扭曲型酰胺
——结构与功能
2024-03-04史雷詹梓烨余志友
史雷,詹梓烨,余志友
哈尔滨工业大学(深圳)理学院,广东 深圳 518055
由氨基酸通过肽键(即酰胺键)相连而组成的蛋白质是生物体细胞、组织的重要组成部分。蛋白质分子中每个酰胺键的六个原子同处于一个平面,此平面被称为肽键平面。蛋白质要发挥生物学功能,就必须折叠为一个特定构型,而肽键平面就是蛋白质中肽链盘曲折叠的基本单位。酰胺键的平面性则决定了肽键平面的性质,因此其在调节蛋白质的生物活性方面起着举足轻重的作用。
传统酰胺分子中的氮原子采取sp2杂化,其孤对电子所在的p轨道会与羰基发生p–π共轭(酰胺键共振能为15–20 kcal·mol−1)[1]。这种共轭作用不但使酰胺分子中的电子云密度和键长趋于平均化,也阻碍了C(O)―N键旋转,进而使得C、N以及与C、N相连的四个原子均处于在同一平面上。此外,正是由于p–π共轭效应的存在,酰胺可以与其他化合物发生π–π堆积、疏水等作用,从而发挥相应的生物功能。例如在药物设计中,研究人员通常会引入酰胺结构来促进药物的吸收并同时提升药物的传输、代谢效率。事实上,酰胺结构的引入也早已被证实是改变小分子药物生理活性最有效的手段之一。目前约25%的已注册药物中含有酰胺结构,同时约55%的潜在药物中也存在酰胺官能团,图1所示为部分含有酰胺结构的药物分子[2–4]。
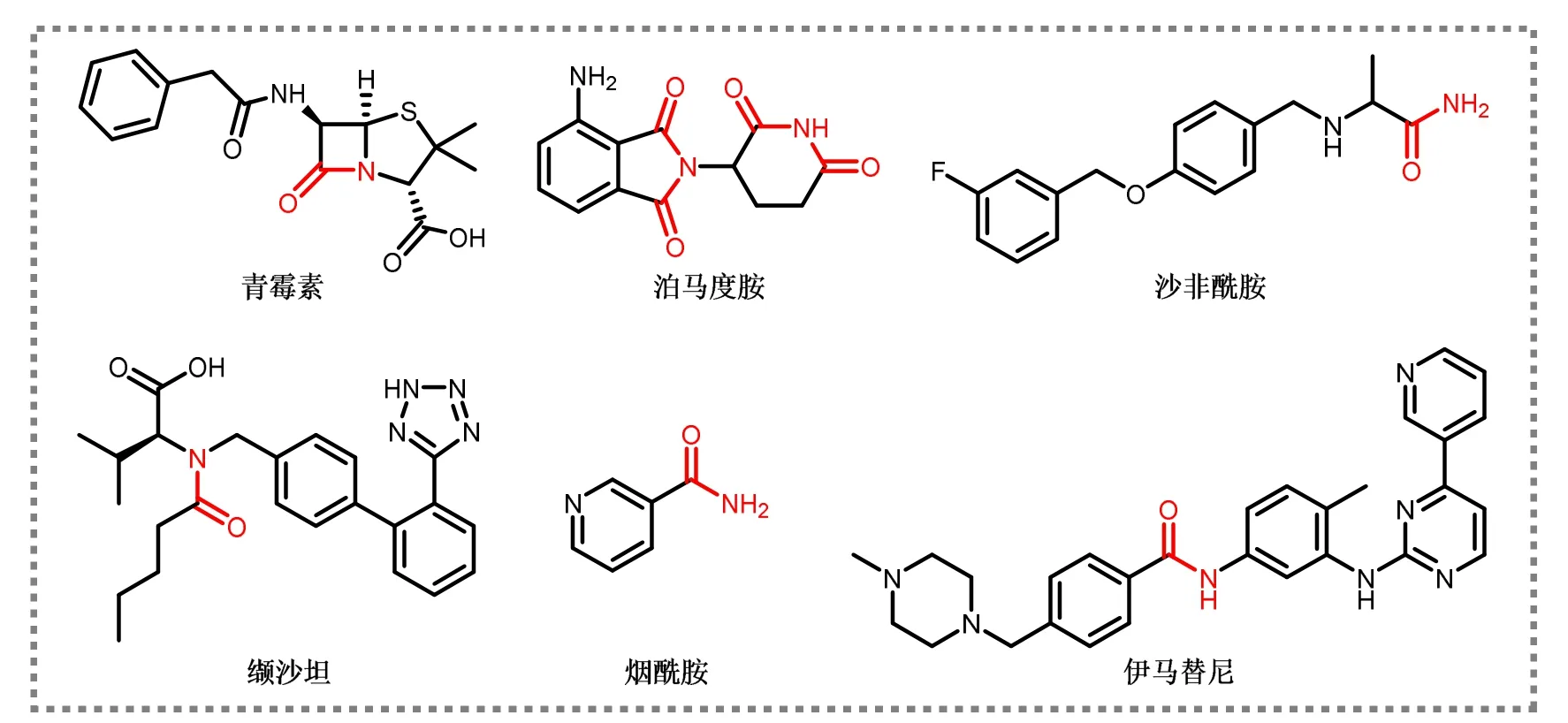
图1 部分含酰胺结构的药物分子
当外力作用使酰胺键的平面发生扭曲时,其p–π共轭作用会遭到一定程度的破坏,传统酰胺因此变成了被扭曲的酰胺,即扭曲型酰胺。扭曲型酰胺的发展一般认为始于1945年Dorothy对青霉素单晶结构的确定[5]。在图2中三种非共价相互作用的存在下,三级酰胺会更容易发生平面扭曲,而类似的几何构型的扭曲在一级和二级酰胺中却不容易实现,因此扭曲型酰胺大多为三级酰胺。与传统酰胺相比,扭曲型酰胺的N―C(O)键更长,但短于一般的胺。另外,其羰基的伸缩振动以及碳谱的化学位移也介于传统酰胺与酮之间。由于p–π共轭被不同程度地破坏,酰胺键的旋转势垒与化学惰性会降低,这使得扭曲型酰胺相比传统平面酰胺而言更容易发生水解、亲核取代、氧化等化学转化。

图2 酰胺键扭曲类型
扭曲型酰胺的物理化学性质会随着酰胺键扭曲程度的不同而发生改变。其扭曲程度通常使用Winkler-Dunitz扭曲参数[6]——扭曲角(τ)、锥状角(pyramidalization)参数(χN和χC)来衡量,图3所示为扭曲角、锥状角参数和键角(ω)之间的关系。扭曲角(τ)描述了N―C(O)键的扭曲程度,锥状角参数(χN和χC)分别描述氮原子的和碳原子的角锥化程度(传统平面酰胺的τ= 0°、χN= 0°、χC= 0°)。扭曲型酰胺中的χC通常为0°或接近0°,所以扭曲酰胺键的扭曲程度可以使用扭曲角(τ)和氮原子的角锥化参数(χN)来表示。实验研究表明τ= 40°和χN= 40°可以被看作是扭曲型酰胺在反应性上区别平面酰胺的阈值[7]。Greenberg首次量化出当扭曲型酰胺的τ值接近40°时,其会更多地呈现氨基酮的反应性而非酰胺的反应性。本文主要聚焦于部分τ> 40°,χN> 40°的扭曲型酰胺,并将其分为环状扭曲型酰胺和无环扭曲型酰胺两部分展开介绍。

图3 Winkler-Dunitz扭曲参数
桥连内酰胺(如图4 1.1–1.5)是环状扭曲型酰胺的典型代表,其主要是通过将酰胺键的氮原子置于双环结构的桥头位置时造成的几何构型限制来达到构建扭曲型酰胺的目的。这是由Lukeš于1938年提出的设想[8],且在此之后,Szostak和Aubé[9,10]、Brown[11]、Stoltz[12,13]、Kirby[14,15]等人证实此猜想并开发出一系列新型的桥连内酰胺。与其他类型的扭曲型酰胺相比,桥连内酰胺更容易修饰和调控,这也使得其种类和数量在扭曲型酰胺中独树一帜。而且,桥连内酰胺的扭曲角和角锥化参数一般线性相关,因此,也可以使用附加扭曲参数(τ+χN)[16,17](additive distortion parameter)来表示此类酰胺的扭曲程度。这一参数在评估桥连内酰胺特殊的反应性上具有重要意义。含有三环桥连结构单元(1.3)或高刚性金刚烷酮骨架(1.4、1.5)的内酰胺可以最有效地实现酰胺键的高度扭转,其扭曲角可以达到90°。除了桥连内酰胺以外,环状扭曲型酰胺还可以分为:(1)N-酰基活化环酰胺,(2)N-磺酰活化环酰胺,(3)N-季铵化环酰胺,(4) 其他环酰胺。这些酰胺的扭曲角和角锥化参数间并无直接联系,因此,后续将从扭曲角和角锥化参数分别介绍这几类环状扭曲型酰胺。N-酰基活化环酰胺(1.6,1.7)中共轭则通过另一个环外羰基来完成,这使得环内酰胺中的共轭被破环,从而实现扭曲。而N-磺酰活化环酰胺(1.16)的扭曲则是由于N-磺酰基和酰胺键两侧相邻的碳的取代基之间发生了显著的非共价相互作用。此外,通过成盐的方式活化酰胺键中的氮,也可以实现酰胺键的扭曲,即N-季铵化环酰胺(1.17–1.18)。在其他环酰胺中,酰亚胺大环结构(1.8–1.15)中具有三组和四组非平面酰胺键,酰胺键的扭曲则通过酰亚胺构象限制来实现。

图4 扭曲角τ > 40°的环状酰胺
另一方面,环状酰胺的几何扭曲也可以通过氮原子的角锥化来实现。在极端情况下,高度角锥化的酰胺会呈现出胺的化学性质,酰胺的N原子由sp2杂化转变为sp3杂化。从氮原子的角锥化来说(图5),环状扭曲型酰胺也可以分为以下几类:(1) 稠环酰胺,(2) 杂环酰胺。一般情况下,依据环系大小不同,可以将稠环类扭曲酰胺分为:(1) 四元环扭曲酰胺,(2) 五元环扭曲酰胺,(3) 六元环扭曲酰胺。其中,β-内酰胺是四元稠环扭曲酰胺的典型代表。其通过酰胺键的扭曲以增强酰胺键的反应性,这对β-内酰胺类抗生素的作用机制至关重要。一般来说,靠近氮原子和羰基的取代更密集的稠环(特别是α位),其N-角锥化的程度更高。五元稠环内酰胺作为重要的中间体在杂环化学和合成吲哚利嗪、吡咯利嗪及相关生物碱方面起着不可忽视的作用。在这些体系中酰胺羰基的还原可以在温和的反应条件下进行,这是酰胺键的角锥化削弱了共振的结果[18,19]。六元稠环内酰胺类似于五元稠环内酰胺,N-角锥化破坏了酰胺共振,从而导致了这些体系中的酰胺羰基更容易发生亲电加成。
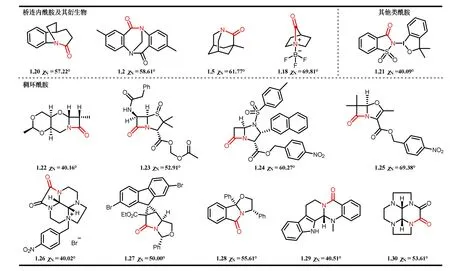
图5 锥状角参数χN > 40°的环状酰胺
在无环扭曲酰胺中,酰胺键上的取代基间的空间排斥力会破坏共振,从而导致N―C(O)键旋转扭曲[20]。Yamada[21]首次认识到这种排斥可以实现无环酰胺的扭转,并于1993年提出了N-酰基-1,3-噻唑烷-2-硫酮类的模型,由于噻唑烷骨架中硫羰基的尺寸较大,使得该类化合物具有非常显著的τ值(τ= 74.3°)[22]。一般情况下,依据无环酰胺中活化基团的类型,可将其分为以下几类:(1)N-酰基活化的扭曲酰胺,(2)N-磺酰基活化的扭曲酰胺,(3)N-杂环活化的扭曲酰胺(图6)。目前,N-酰基活化是构建无环扭曲酰胺最常用的方法。在此类酰胺中,酰基上的羰基也可以参与酰胺键中氮原子的共轭从而降低酰胺键内的p–π共轭效应,实现酰胺的几何扭曲,其扭曲角最高可达90°。在N,N-二酰基活化的扭曲酰胺中,的共轭是通过离域到两个外环羰基上来满足的,这就导致了键的扭曲主要依赖于空间位阻。一般来说,α-碳取代基的空间位阻越大,酰胺键的扭曲越高(3°烷基 > 芳基 > 2°烷基 > 1°烷基)[23]。N-酰基−戊二酰亚胺和N-酰基−琥珀酰亚胺这两类无环扭曲酰胺在金属催化中是非常有利的,因为它们比相应的酰卤化物和酸酐具有更高的稳定性。将酰胺氮原子连接到杂环系统有两种情况:芳香性杂环中,Nlp离域到芳环体系上,导致酰胺键的扭曲;不具有芳香性的杂环中,在没有额外的Nlp离域的情况下,空间斥力会导致酰胺键的扭曲。N-酰基杂环扭曲型酰胺在药物化学中作为杂环结构模块和靶活性化合物具有重要意义。N-酰基咪唑2.13是有效的FabH抑菌剂,而雷米普利的羟甲基氨基甲烷盐2.14是一种抗高血压药物。N-酰基无环季铵盐(2.10,τ= 85.11°),由于缺乏环结构会导致这类N−酰基季铵盐的水解稳定性较低。
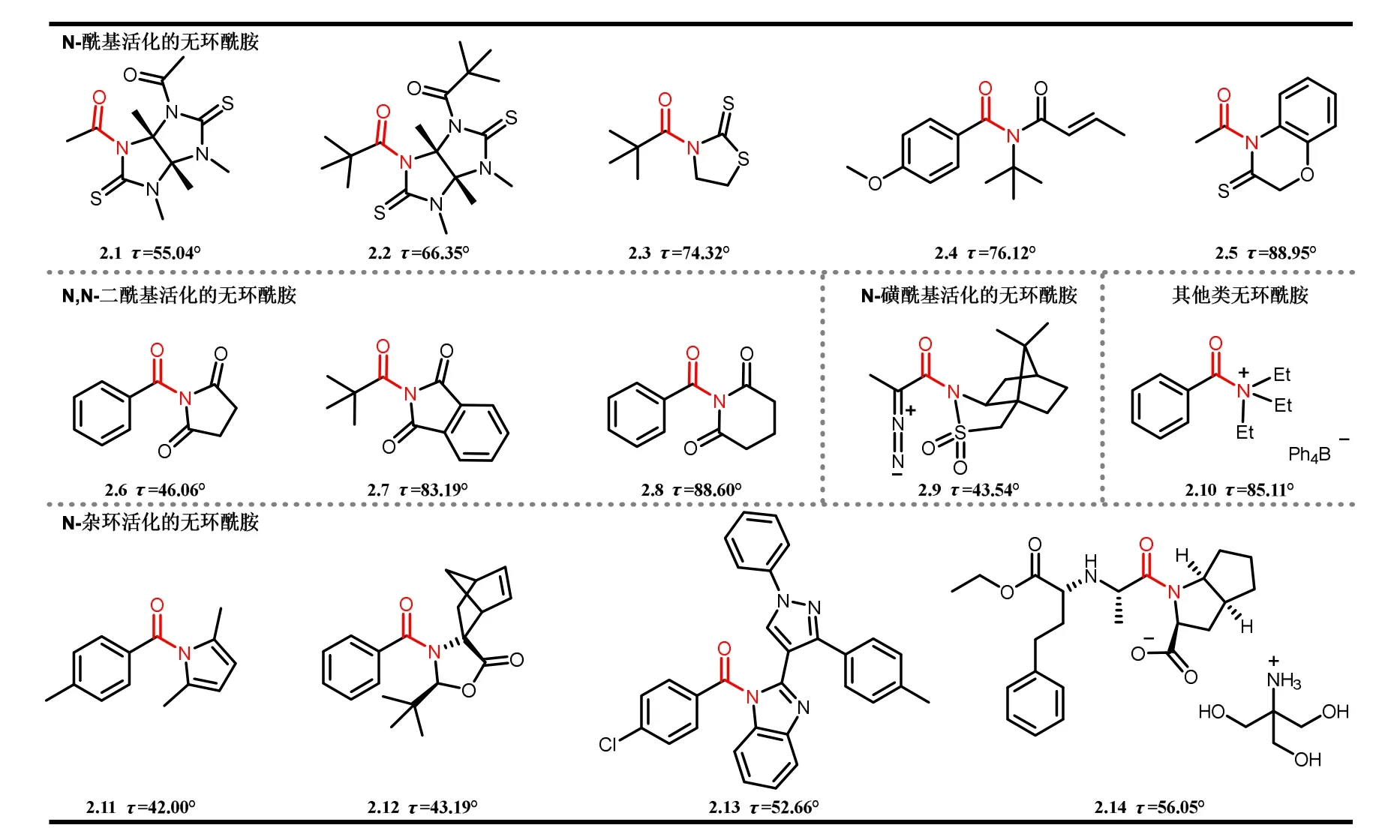
图6 扭曲角τ > 40°的无环酰胺
无环酰胺中产生N-角锥化的主要方法有:(1)N-杂环活化,(2)N-磺酰基活化,(3)脂肪族酰胺的N-角锥化(如图7所示)。在杂环活化的无环酰胺中,由于酰胺取代基与桥头氢原子之间的张力以及较小的C―N―C角[24,25](2.16–2.17)或酰胺键取代基与吡咯环之间的空间相互作用(2.15),实现酰胺的N-角锥化。对于N-磺酰基活化的N-角锥酰胺,一般随着α-碳取代的增加,氮的角锥化会随之增加。在N-角锥脂肪族酰胺中,值得让人注意的是,N-酰基无环季铵盐(2.10),含有完全角锥化的酰胺键。

图7 锥状角参数χN > 40°的无环酰胺
除了上述方式外,将酰胺装入分子笼中也可以实现酰胺扭曲(如图8所示)。2020年,Hiroki Takezawa和Makoto Fujita课题组将酰胺装入自组装分子笼中[26],通过机械扭曲且不发生化学过程的操作将稳定的平面酰胺转换为反应性的非平面酰胺。当芳香族二级酰胺被包含Td对称的配位笼中的内腔时,实现了cis-扭曲构型的非共价捕获,其酰胺扭曲度可达34°。
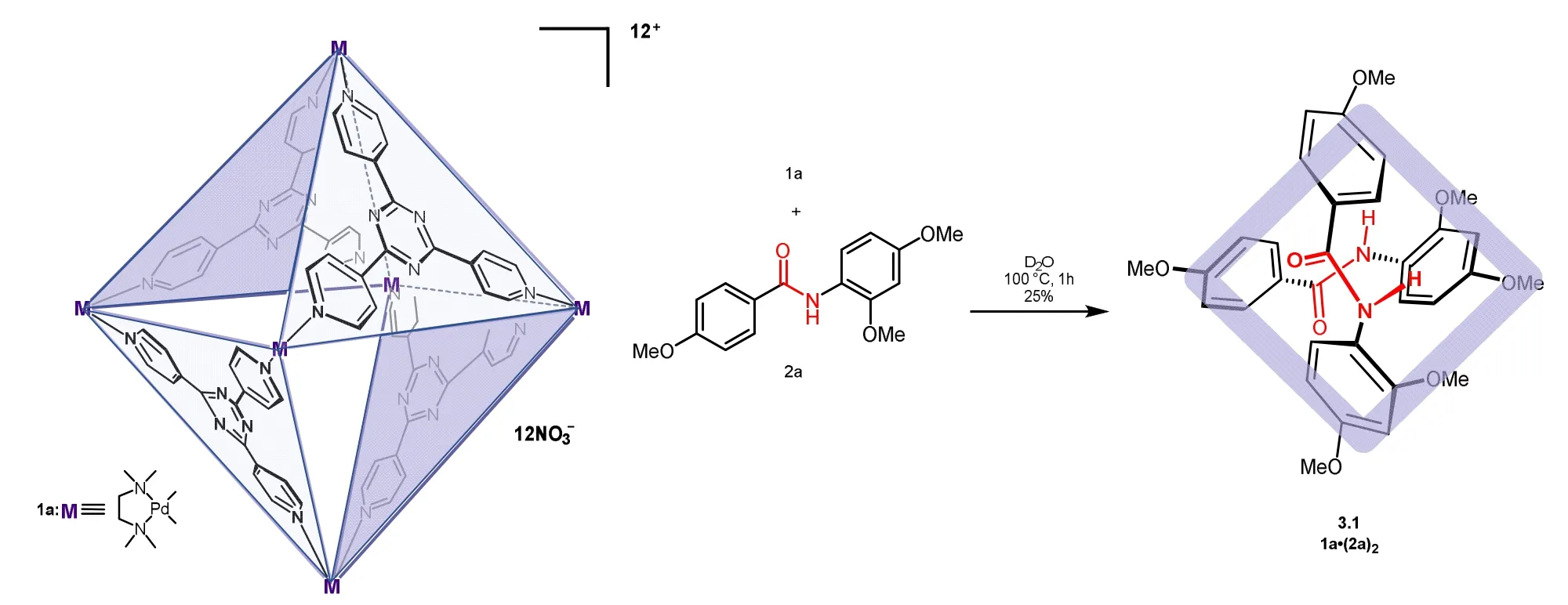
图8 包含在分子笼中的扭曲型酰胺
扭曲型酰胺结构的特殊性使其具有特别的反应性。例如,环状扭曲型酰胺尤其是桥连内酰胺拥有更高的亲电性,其在常温下就可以发生水解反应(图9a)[27,28],而平面型酰胺则一般都需要在酸或碱的存在下加热时才能水解。另外,在酸性条件下,平面酰胺中的氧原子会比氮原子更容易质子化,而扭曲型酰胺由于酰胺键的p–π共轭被破坏,其氮原子的碱性会提升,其孤对电子会更倾向与外源路易斯酸结合,从而使得扭曲型酰胺更容易生成N-质子化和N-甲基化产物(图9b)[29,30]。同时,环状扭曲型酰胺这些独特的反应性使其在天然产物全合成中展现出明显的优势。例如图10中可以治疗重症肌无力和中轻度阿尔茨海默症的福西丁(2.26,(+)-fawcettidine)可以通过合成2.25这样一个桥连内酰胺,然后再经多步转化得到[31]。
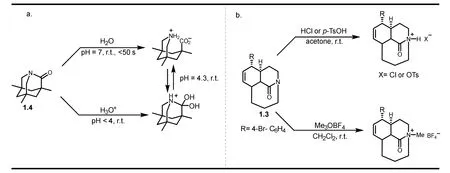
图9 扭曲型酰胺的水解、N-质子化、N-甲基化反应
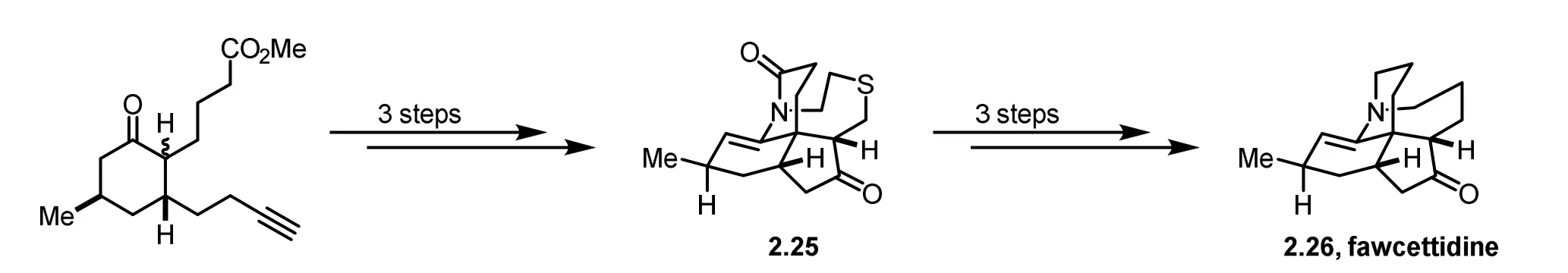
图10 fawcettidine的合成路径
最近,无环扭曲型酰胺的应用潜力也在不断被发掘。例如,传统的Suzuki偶联反应一般都是在碱存在下有机硼试剂和芳香或烯基卤代物(或芳香三氟甲磺酸酯)在钯催化下实现相应的交叉偶联。而无环扭曲型酰胺的存在突破了此反应需要卤代物参与的限制(图11)[32]。其也可以在钯催化下完成与有机硼试剂的交叉偶联。值得注意的是,无环扭曲型酰胺的Suzuki偶联反应在卑金属镍催化下也能进行[33]。另外,合成化学中常用的Heck反应和Negishi偶联反应也可以在过渡金属催化下使用无环扭曲型酰胺来完成[34,35],这些极大地丰富了合成人员的底物选择范围。

图11 无环扭曲型酰胺参与的Suzuki偶联反应
扭曲型酰胺的种类及其应用性正在被不断地开发和拓展。我们有理由相信在不远的未来,扭曲型酰胺不仅能在现有的医药和材料领域继续发光发热,其也定会在更多领域崭露头角,得到更多研究人员的关注,并终将造福于广大人民群众。
