长牡蛎弧菌抗性选育家系生长和存活性状遗传参数评估及基因型与环境互作效应分析
2024-03-02鲁林基李鹏飞徐成勋刘士凯
李 寅 鲁林基 杨 奔 李鹏飞 徐成勋 李 琪 刘士凯
(中国海洋大学海水养殖教育部重点实验室, 青岛 266003)
长牡蛎(Crassostrea gigas)又称太平洋牡蛎, 是中国北方重要的水产养殖物种, 也是世界上重要的海产经济贝类[1,2]。近年来, 长牡蛎在世界不同养殖地都经历不同程度的夏季大规模死亡(Mass summer mortality), 严重地影响了牡蛎产业的健康发展。相关研究表明细菌、病毒等病原体感染,与长牡蛎夏季大规模死亡事件密切相关[3,4]。在团队先前开展的研究工作中, Yang等[5]从我国暴发大规模死亡的牡蛎体内分离出一株高致病性的菌株,经鉴定为溶藻弧菌(Vibrio alginolyticus) Cg5菌株,由此推断溶藻弧菌可能是导致长牡蛎夏季死亡的关键菌株。溶藻弧菌是一种革兰氏阴性细菌, 广泛分布于海洋和河口等自然水域中, 特别是在温暖地区的海水中较为常见[6]。该弧菌已报道可在日本对虾等多个海洋生物中引起疾病[7—9], 并且能够引起人类的耳炎和伤口感染[10], 具有较强的危害性。
由于牡蛎自身缺乏适应性免疫系统, 加上养殖水体等人为无法控制的自然环境因素, 导致无法通过药物或疫苗等人为干预的手段进行疾病的预防和治疗[11], 较为有效的方法是通过遗传改良手段选育具有弧菌抗性的长牡蛎, 以此降低弧菌感染造成的经济损失。目前国内外针对长牡蛎遗传改良已开展了多个选择育种项目, 主要集中在生长[12—15]、壳色[16—18]等经济性状的遗传改良。一些聚焦于提高牡蛎抗病能力和存活率的选择育种方案也相继开展并取得显著效果, 例如牡蛎疱疹病毒Ostreid herpesvirus1 (OsHV-1)的抗性改良[19,20]、河口弧菌(Vibrio aestuarianus)的抗病性选育[21]。在溶藻弧菌的抗性选育方面, Yang等[22]于2019年以溶藻弧菌为病原, 对52个长牡蛎家系(n=1402)进行攻毒, 采用简化基因组测序分型技术解析了抗弧菌性状的遗传基础, 并通过家系选育结合全基因组选育的方法开展了长牡蛎抗弧菌家系的育种工作。Zhai等[23]评估了长牡蛎抗弧菌家系的弧菌抗性性状遗传参数,并指出弧菌抗性性状遗传力表现为中低等水平, 同时其研究还指出弧菌抗性性状与生长性状之间较低的遗传和表型相关性, 表明生长性状和抗性性状同时遗传改良的可行性。长牡蛎的生长和存活等性状是重要的经济性状, 通过研究其遗传参数, 制定合理的选育路线, 可以提高长牡蛎的产量, 获得更高的经济效益。目前已在多个品系开展工作, 例如, Dégremont等[24]和Chi等[25]报道了长牡蛎不同生长阶段的生长、存活的遗传参数。陈雨露等[26]、方佳峰等[27]和赵宗武等[28]报道了长牡蛎壳橙、壳白品系生长性状的遗传参数。然而, 目前尚未在长牡蛎弧菌抗性品系中开展有关生长和存活性状的遗传参数评估工作。
育种计划的有效性不仅取决于目标性状的遗传基础及育种策略, 还取决于基因型与环境的相互作 用(Genotype × Environment interaction, GEI)[37]。不同养殖海域, 水体环境条件等存在差别, 造成牡蛎在生长或存活率等方面会产生显著差异, 不可避免地产生GEI效应, 即基因型在不同环境中具有不同的表现型[28]。GEI等遗传参数值的准确估计是实施良好育种计划的先决条件, 因为显著的GEI可能会减少遗传增益, 所以在设计育种方案时, 确定影响这些不同养殖区域下的选育性状间的GEI具有重要意义。有关长牡蛎GEI的研究也有较多的报道。例如, Evans等[29]报道了长牡蛎生长和存活性状在俄勒冈州和华盛顿州两个不同养殖环境下的互作情况。Dégremont等[30]则报道了法国3个不同养殖地点长牡蛎的存活率和产量情况。Chi等[31]报道了长牡蛎收获性状在乳山、黄岛、荣成3个养殖地点的GEI效应。邢德等[32]报道了长牡蛎壳白品系的生长和壳色性状在乳山、荣成两地的GEI效应。目前还没有关于弧菌抗性长牡蛎生长及存活性状的基因型与环境互作的相关报道。
本研究以前期筛选出的弧菌抗性家系为亲本,采用单对单交配方案, 构建了40个全同胞家系, 以单变量动物模型和父本母本阈值动物模型评估了长牡蛎抗弧菌选育G2代家系在不同日龄下生长和存活性状的遗传参数, 同时针对不同养殖区域的环境, 评估了长牡蛎弧菌抗性家系生长和存活性状在多环境下的基因型与环境互作效应。本研究旨在为长牡蛎弧菌抗性的遗传改良提供参考资料。
1 材料与方法
1.1 亲本来源和家系构建
2019年, 收集不同遗传背景(野生品系、中日韩选育系、美国壳型选育系、橙黑相关选育系)的52个长牡蛎家系作为基础群体G0[23]。随机选取基础群体G0中的1402只长牡蛎进行溶藻弧菌的人工侵染, 以筛选抗病性家系, 同时对溶藻弧菌感染的抗性性状遗传力进行了估算[23]。根据应用阈值动物模型, 计算G0中各家系抗性性状的育种值(即亲本育种值的平均值), 2020年选择家系育种值排名前20%的G0家系以单对单的交配设计构建了长牡蛎抗溶藻弧菌选育家系(G1)。
本实验所使用的亲本来自2020年构建的G1家系。2021年3月选择经过人工筛选的30个G1家系,转移至室内进行人工促熟。2021年5月, 待亲本性腺发育成熟, 对长牡蛎进行雌雄辨别, 挑选性腺发育良好的父母本各40个, 按照雌雄比1∶1的比例进行人工授精, 共构建40个全同胞家。
1.2 孵化、幼虫培育和养成
在授精完成后, 所有家系转移至独立的100 L聚乙烯桶内进行孵化, 孵化时受精卵密度控制在30个/mL, 海水温度控制在23℃左右。在孵化24h后, 受精卵发育至D型幼虫, 并用300目筛绢进行选优。幼虫的密度前期控制在8—10个/mL, 临近投附着基时调整至2—3个/mL。整个幼虫培育期间保持持续充气, 定期检查沉淀池的水质情况, 每日换水,换水量约为1/3, 在幼虫的整个生长期间以等鞭金藻(Isochrysis galbana)为主, 后期加入适量的扁藻(Platymonassp.)进行投喂。当桶内有超过30%的幼虫到达眼点幼虫阶段时, 投放扇贝壳作为附着基以供幼虫附着。附着期间加大换水量、投饵量和充气量, 待幼虫完成附着后, 转移至室外沉淀池暂养以适应海洋环境。
当暂养个体达到3 mm左右时, 从40个家系中随机选取90个个体分成3个重复, 每个重复30个个体, 放在20网目0.3 m×1.5 m×0.3 m规格的网笼中并转移至荣成桑沟湾海区。为了评估抗弧菌家系在不同海区的基因环境互作, 从剩余的40个家系中挑选个体数目较多的30个家系, 同样随机选取90个个体设置3个重复, 存放在20网目0.3 m×1.5 m×0.3 m规格的网笼中并转移至乳山海区(同时对每个家系做好标记方便与荣成海区的家系对应)。即荣成养殖海区含40个家系, 每个家系90只牡蛎, 共3600只牡蛎; 乳山海区含30个家系, 每个家系90只牡蛎, 共2700只牡蛎。乳山和荣成养殖海区的基本情况如表1所示。
1.3 取样观测
在稚贝附着后的120、180、300、400和460日龄前往荣成海域记录40个牡蛎家系的生长和存活率数据。同时, 在稚贝附着后的300、400和460日龄统计乳山海域30个牡蛎家系的生长和存活率数据, 并与荣成海区对应的家系形成对比, 用作基因型与环境互作分析。
生长性状的测量是通过电子游标卡尺(精确度0.01 mm)从各个家系的90个个体中随机选取30个个体测量牡蛎的壳高(Shell height, SH)和壳长(Shell length, SL), 当存活的牡蛎个数不足30只时, 全部测量。存活性状则通过计算吊笼里各家系三层牡蛎死亡个数的均值, 然后计算出该家系死亡个数均值占起始牡蛎总个数的比例即为该家系的存活率(Survival rate, SR)。
1.4 遗传力估计
采用SPSS软件(22.0)对生长和存活率数据进行单因素方差分析和多重比较来分析不同家系间生长和存活率的差异, 将P<0.05设为差异显著。使用ASREML3.0运行动物模型进行遗传参数的评估[33],采用单性状动物模型的限制最大似然法(REML)计算不同生长阶段的壳高和壳长的遗传力, 公式如下:
采用单变量动物模型计算壳高和壳长的遗传力, 计算公式:
采用父本母本阈值logit模型计算存活性状的遗传力, 模型:
对于父本母本阈值模型来说, 存活性状遗传力计算公式:
1.5 生长与存活性状的相关性分析
用双变量动物模型来估计生长性状间的遗传相关和表型相关, 计算公式:
1.6 基因型与环境互作分析
评估荣成与乳山海区间的基因型与环境的相互作用(GEI)情况可以通过计算2个不同养殖地点间的遗传相关来处理[34]。将2个环境中的同一性状视为2个不同性状。通过单变量动物模型预测壳高、壳长数据的育种值; 通过父本母本阈值模型估计存活性状的育种值。然后通过使用SPSS22.0软件进行Pearson相关性分析, 计算得出2个环境同一性状间的遗传相关。不同环境中的同一性状的遗传相关性为0.5、0.7和0.9, 分别代表了不同程度的GEI效应(严重、中等和不显著)[34]。
2 结果
2.1 长牡蛎弧菌抗性家系生长和存活性状的表型参数
如表2所示, 在不同日龄下存活性状的变异系数范围最大, 荣成海区的变异系数为14.79% (120d)—60.73% (460d), 在乳山海区的变异系数为21.74%(300d)—40.19% (400d)。壳高和壳长变异范围较小且较为接近, 荣成海区的壳高变异系数为13.68%(400d)—16.97% (180d), 壳长的变异系数为13.83%(460d)—20.67% (300d); 乳山海区的壳高变异系数为10.62% (460d)—14.44% (300d), 壳长的变异系数为13.12% (460d)—17.02% (300d)。

表2 长牡蛎弧菌抗性家系不同日龄下生长和存活性状的表型参数Tab. 2 Phenotypic parameters of growth and survival traits in Vibrio resistant families of C. gigas at different ages
2.2 长牡蛎弧菌抗性家系生长和存活性状的遗传参数估计
如表3所示, 在荣成海区, 壳高的遗传力估计为(0.46±0.10) (460d)—(0.53±0.11) (120d), 不同日龄下的遗传力均为中高等遗传力; 壳长的遗传力估计为0(.30±0.08) (120d)—(0.56±0.11) (180d), 均为中高等遗传力。在乳山海区, 壳高的遗传力估计为(0.55±0.14) (460d)—(0.59±0.13) (300d), 不同日龄下的遗传力均为高等遗传力; 壳长的遗传力估计为(0.50±0.12) (300d)—(0.59±0.13) (400d), 均为高等遗传力。在荣成海区, 存活性状的遗传力估计为(0.25±0.06) (180d)—(0.41±0.09) (460d), 存活性状除在460日龄遗传力为中等遗传力外, 其余阶段均为低等遗传力; 而在乳山海区, 存活性状的遗传力估计为(0.27±0.07) (300d)—(0.41±0.11) (460d), 存活性状除在300日龄遗传力为低等遗传力外, 其余两阶段均为中等遗传力。
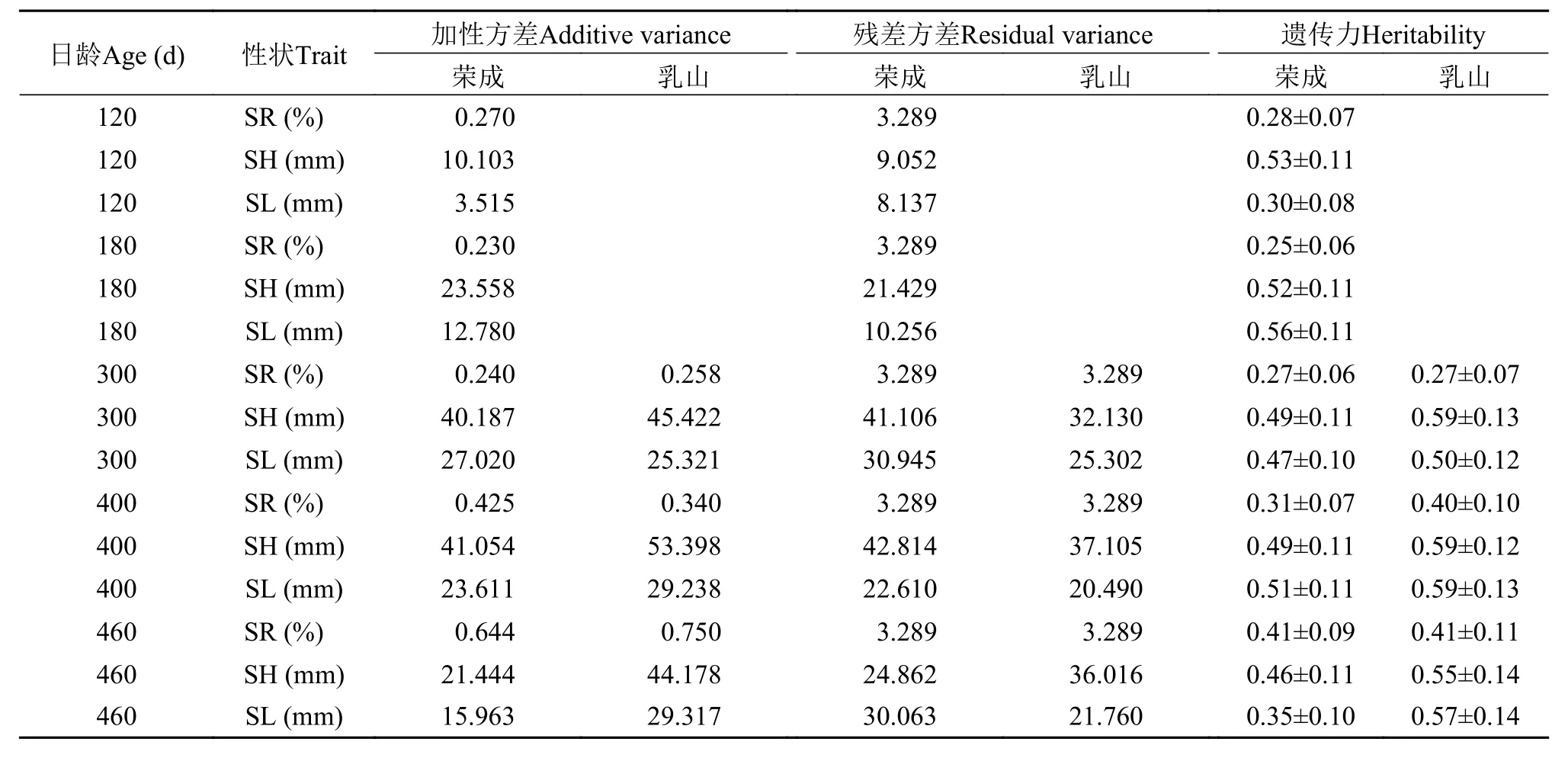
表3 不同生长阶段生长性状和存活性状的遗传力估计Tab. 3 Estimates of heritability of growth and survival traits at different growth stages
2.3 长牡蛎弧菌抗性家系生长和存活性状的表型相关与遗传相关
如表4所示, 除在荣成海区180日龄时, 壳高和壳长的表型相关为低度正相关, 其余各阶段壳高和壳长之间的遗传相关和表型相关均为中高度正相关。且不同日龄的生长性状的遗传相关(0.429—0.828)均高于表型相关(0.192—0.611)。在不同日龄下, 生长和存活性状的遗传相关范围为-0.138—0.380, 表型相关范围为-0.073—0.512, 除120日龄时, 生长和存活性状之间的遗传相关和表型相关为负相关外, 其余日龄下遗传相关和表型相关均为正相关。荣成海区除300日龄时, 生长性状和存活性状之间的表型相关为中度正相关外, 其余各阶段均为低度的正相关, 而乳山海区各阶段生长性状和存活性状之间的表型相关均为低度正相关。

表4 长牡蛎抗弧菌家系不同日龄下生长性状和存活性状的遗传相关(对角线上方)和表型相关(对角线下方)Tab. 4 Genetic correlation (above the diagonal) and phenotypic correlation (below the diagonal) of growth and survival traits in Vibrio resistant families of C. gigas at different ages
2.4 基因型与环境互作效应
长牡蛎弧菌抗性选育家系在荣成和乳山两个养殖地点的生长和存活性状的遗传相关如表5所示, 对于各个时间段来说, 荣成和乳山海域牡蛎的壳高遗传相关范围为(0.34±0.07)—(0.68±0.01); 而对于壳长指标, 在不同日龄下, 荣成和乳山海域壳长遗传相关范围为(0.35±0.06)—(0.63±0.03)。对于存活率指标, 荣成和乳山海域存活性状遗传相关范围为(0.32±0.08)—(0.50±0.03)。同一性状在不同环境下遗传相关为0.5、0.7和0.9, 代表严重、中等和不显著的基因型与环境互作。不同日龄的弧菌抗性长牡蛎的生长和存活性状的遗传相关均小于0.7,这说明不同时间段乳山和荣成养殖海区存在非常显著的基因型与环境互作效应。
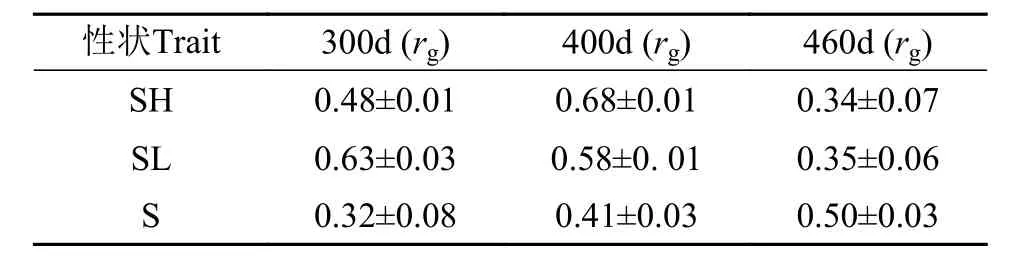
表5 两个环境下的长牡蛎抗弧菌家系生长和存活性状的遗传相关Tab. 5 Genetic correlation of growth and survival traits of Vibrio resistant families of C. gigas in two environments
3 讨论
3.1 生长和存活性状的表型变异
变异系数(CV)是用于衡量数据集相对于均值的离散程度, 在选择育种中CV常被用于量化和比较表型性状变异的程度[35]。在本研究中, 通过对长牡蛎弧菌抗性家系生长和存活率的表型数据观测发现, 长牡蛎弧菌抗性家系存活性状的变异系数最大, 而壳高和壳长性状的变异范围较小且较为接近。这说明对于存活性状而言, 生长性状在选育过程中能够稳定的遗传。先前也有研究报道长牡蛎存活性状表现出较大的遗传变异, 例如Chi等[36]对长牡蛎幼虫和稚贝阶段的壳高和壳长性状进行测量并对存活率进行了统计, 发现存活率的变异系数为最大, 为6.68%—47.42%, 而壳高和壳长性状的变异系数较小且较为接近, 分别为8.21%—23.03%、8.12%—24.58%。结合上述的研究结果不难发现,以存活性状作为长牡蛎的选育指标具有较大的遗传改良的潜力和优势。
3.2 生长和存活性状的遗传参数
遗传力大小是决定选择育种方案的主要根据之一, 目标性状的遗传参数的准确估计对设计育种方案具有重大的指导意义[37]。本研究对长牡蛎弧菌抗性家系生长性状的遗传力进行估计发现在不同日龄下壳高和壳长性状的遗传力均为中高等遗传力。这说明对于本研究中的弧菌抗性家系来说, 开展生长性状的选育是有效的。此外, 对于长牡蛎生长性状的遗传力估计先前也有不少报道, 例如,Kong等[38]采用全因子交配设计方法估计了来自双岛湾长牡蛎一龄个体的壳高、壳长等生长性状的遗传力, 发现各性状遗传力介于0.35—0.49, 属于中高等遗传力, 这与我们结果类似。Li等[12]利用群体选育方法在相同养殖环境下估测中国、日本和韩国3个群体的壳高在不同生长阶段的遗传力分别为0.334、0.402和0.149, 遗传力介于中低遗传力之间。王庆志等[39]采用二因素系统分组的方差、协方差分析估计长牡蛎5—25日龄壳高的遗传力为0.161—0.387, 壳长的遗传力为0.139—0.398, 遗传力范围均为中低等遗传力。综合上述分析发现, 各研究中有关长牡蛎生长性状的遗传力不尽相同, 这可能是由于养殖区域、日龄及年份的差异导致的,因此在开展遗传力选育时要综合考虑因素以制定合理计划。
牡蛎的存活率是与牡蛎产量直接相关联的, 存活性状在遗传学上被定义为阈值性状, 如患病或正常、存活或死亡, 都可被视为阈值性状[40]。本研究通过父本母本阈值模型估计了长牡蛎弧菌抗性家系存活性状的遗传力, 结果显示为中低水平遗传力,这与Chi等[25]采用相同的数据分析模型估计的长牡蛎存活性状的遗传力相似。Evans等[29]在4个养殖地点估计3个不同日龄下长牡蛎存活性状的遗传力,显示在360日龄, 华盛顿州达博湾潮间带的长牡蛎存活性状遗传力范围为0.36—0.49, 属于中等遗传力, 而其他3个地点则展现出较高的遗传力水平, 范围为0.50—0.71, 遗传力略为高于本研究结果。Dégremont等[30]报道了法国海岸3个不同地点长牡蛎存活性状的遗传力分别为1.08、0.89和0.47, 均处于高等遗传力水平, 高于本研究的结果。在以上研究中, 各存活性状的遗传力各有差异, 这可能与环境等外部因素有关, 也可能是评估方法的差异导致。当某一性状的遗传力较高时可以采用群体选育方法进行选育, 而当遗传力较低时则可以通过家系选育等方法进行选育, 本研究所估计的存活性状处于中低遗传力水平, 表明进行家系选育的方法是合理的。另外本研究的遗传参数评估还显示, 在前期养殖过程中存活性状的遗传力估计为低等水平,这表明在前期选择的准确性比较低, 不过随着牡蛎的不断生长, 遗传力水平也由前期的低等转为后期的中等, 因此在养殖阶段的后期进行存活性状的筛选, 具有较高的选择潜力。
3.3 生长和存活性状的表型相关与遗传相关
了解性状间遗传相关性是在选择育种过程中至关重要的一步。生长性状间的遗传相关和表型相关在之前的研究中已有大量报道。例如, Zhang等[14]报道了“海大1号”第八代和第九代选育群体壳高和壳长之间的表型相关和遗传相关均处于高度的正相关。孔宁等[41]研究发现长牡蛎一龄下的壳高和壳长遗传相关性为高度的正相关。在本研究中不同日龄下, 壳高和壳长的遗传相关均大于表型相关, 这说明对壳高进行选育的同时也可以对壳长进行选育。另外, 除荣成海区180日龄时壳高和壳长的表型相关为低度正相关外, 其余各阶段壳高和壳长间的遗传相关和表型相关为中高度正相关。对于180日龄表现出低度正相关的现象, 这里推测可能是受到环境因素的影响。例如, 180日龄在2月取样, 冬季低温环境影响牡蛎生长[42]。此外, 近年来海区养殖密度的不断加大, 随着牡蛎的不断发育,密度可能成为影响壳型的重要因素[43], 不过要深入了解这个现象, 需要进行更多的研究和数据分析。综合以上研究表明, 壳高性状和壳长性状具有较高的正相关性, 这说明控制壳高和壳长的基因可能是紧密连锁的且具有多效性。因此在选育壳高的同时, 也会对壳长起到间接选育的效果。生长和存活性状间的遗传相关研究也被多次报道, 如Chi等[25]报道长牡蛎幼虫和稚贝期生长和存活性状遗传相关范围为-0.21—0.35, 属于低遗传相关性。在日本囊对虾中, 郑静静等[44]发现在285日龄下各生长与存活性状间的遗传相关表现出中低度正相关。在本研究的生长和存活性状的相关性分析中, 生长和存活性状间的遗传和表型相关均较低。除荣成海区300日龄外, 生长和存活性状之间的表型相关为中度相关, 其余各发育阶段均为低度相关性, 而乳山海区300日龄生长和存活性状之间的表型相关仍呈现低度相关性。这可能是受到各自海区环境和生态因素的影响, 导致了不同的表型表现和相关性强度。综上, 结合本研究结果发现控制长牡蛎生长和存活性状的基因可能在不同的基因座上, 因此可分别对生长和存活性状进行改良, 即对存活性状的选择性育种不会对长牡蛎的生长性产生负面影响,反之亦然。
3.4 基因型与环境互作
一般来说, 随着养殖环境(水温、盐度、饵料和管理方式)的变化, 选择的目标性状在不同养殖环境会存在基因型与环境互作(GEI)效应[45]。较大的GEI效应会导致长牡蛎的生长和存活性能得不到充分的发挥, 从而导致养殖产能的下降, 造成经济损失, 因此了解不同养殖环境下的GEI是至关重要的。对于长牡蛎GEI效应的研究已有很多报道,Mallet等[46]报道了5个不同遗传背景的美洲牡蛎群体在2个不同养殖环境下的生长性状存在显著GEI效应。Dégremont等[30]对法国3个不同养殖地点长牡蛎的存活和产量情况进行研究, 同样发现显著的GEI效应。以上研究结果都说明有必要开展牡蛎的GEI效应研究, 用以科学合理地指导遗传育种工作。在本研究中, 300日龄、400日龄和460日龄时乳山和荣成养殖海区长牡蛎的存活性状存在明显的重排效应, 且不同日龄的长牡蛎在两海域间生长性状的GEI达到中度和重度水平。这可能是由于乳山海域比荣成海域年平均水温高, 风浪大所导致。当两个养殖海域养殖生物存在GEI, 单一的选择育种方案会大大降低遗传增益, 因此, 为了提高长牡蛎在多种养殖环境下的存活率, 需要针对不同养殖环境制定不同的选育方案。
4 结论
本研究分析了不同日龄长牡蛎弧菌抗性家系的表型参数、遗传力及生长和存活性状的关联性,确定了以存活性状作为选育目标的可行性; 同时发现生长性状的遗传为中高遗传力, 而存活性状遗传力为中低遗传力, 并且生长和存活性状之间的相关性较低, 这说明无法通过单一的存活性状选育实现对生长性状的改良, 而同时将生长和存活性状进行协同选育是可行的。本研究还发现弧菌抗性长牡蛎在乳山和荣成2个养殖海区存在显著的基因型与环境互作效应。因此在实际育种过程中要结合具体养殖环境制定特定的育种方案。本研究为长牡蛎抗弧菌品系的选育提供基础资料和科学依据。
