鲇楚克拉虫的地理新记录及不同地理株系的比较研究
2024-03-02袁采莉唐发辉杨雨婷彭建军谭禄奇张雕雕杨承忠赵元莙
袁采莉 唐发辉 杨雨婷 彭建军 谭禄奇, 张雕雕 杨承忠 赵元莙
(1. 重庆师范大学生命科学学院, 动物生物学重庆市高校重点实验室, 重庆 401331; 2. 重庆师范大学, 动物生物学重庆市重点实验室, 重庆 401331; 3. 湖南科技大学生命科学与健康学院, 湘潭 411201; 4. 铜仁学院, 贵州省梵净山地区生物多样性保护与利用重点实验室, 铜仁 554300)
黏孢子虫(Myxosporea Bütschli, 1881)是一大类个体微小、形态多样且分布广泛的后生动物(Metozoa)寄生虫, 其生活史涉及无脊椎动物终末宿主和脊椎动物中间宿主两个阶段[1—4]。迄今为止, 已记录的黏孢子虫超过2600种[5—7]。其中, 两极虫科(Myxidiidae Thélohan, 1892)是黏孢子虫中宿主范围最广的类群, 也是典型的腔寄生类群, 极少行组织寄生[8,9]。楚克拉虫属(ZschokkllaAuerbach, 1910)是该科中物种丰富度第二的类群[第一为两极虫属(MyxidiumBütschli, 1882)], 迄今记述的有效种超过100种[10]。
鲇楚克拉虫Zschokkella parasiluri是Fujita[11]于1927年在日本琵琶湖采集的鲇(Silurus asotus)胆囊中检获并命名的。后来有学者在浙江、辽宁和四川等地采集的鲇、怀头鲇(Silurus soldatovi)和黄颡鱼(Pelteobagrus fulvidraco)的胆囊中发现该种, 并补充描述了其极囊直径、极囊间距和条纹数等形态学量度数据[12—14]。因受当时技术条件限制, 之前样本均未获得分子数据。直到2006年, Fiala[15]从湖北检获的鲇楚克拉虫[(下文统一称为湖北株系(S1)]中获得了18S rDNA分子序列(GenBank登录号:DQ377689), 但该研究却未提供鲇楚克拉虫成熟孢子的形态学量度数据。继后, 又有学者在重庆渝北检获该种(下文统一称为重庆渝北株系(S2))并提供了其形态学和18S rDNA数据(GenBank登录号:MH517584)[16]。本研究在我国重庆、贵州和河南采集的黄颡鱼胆囊中共检获5个鲇楚克拉虫株系[重庆沙坪坝株系(S3)、重庆渝北株系(S4)、重庆秀山株系(S5)、贵州铜仁株系(S6)和河南信阳株系(S7)], 并获得了相应的形态学及分子生物学数据。
对于自由生活的动物, 地理隔离在其种群分化中起着非常重要的作用, 然而对于营寄生生活的动物而言, 其种群分化却受到多种因素的影响[17—19]。对此, 黏孢子虫类群的研究却很少[20—23]。为探索地理隔离对鲇楚克拉虫株系分化的影响规律, 本研究基于形态与分子数据对鲇楚克拉虫各地理株系进行了比较研究, 以期更深入地了解该物种的进化规律。
1 材料与方法
1.1 样本采集与物种鉴定
本实验于2018—2021年分别在重庆沙坪坝区、重庆渝北区、重庆秀山县、贵州铜仁碧江区和河南信阳市等5地共采集到宿主黄颡鱼34尾(表1)。活体用适量的MS-222麻醉剂(350 mg/L)进行安乐死, 然后剖检, 检查体表、鳃、肌肉、肝胰脏、肠、胆囊、肾脏和膀胱等部位是否有黏孢子虫孢囊存在。同时, 取各部位的部分组织进行涂片并镜检是否有离散孢子存在。检查到孢囊或离散孢子后, 参考赵元莙等[24]的方法对获取的黏孢子虫新鲜样本进行图像采集及基因组DNA提取等工作。基于形态学方法对其进行物种鉴定, 结果为鲇楚克拉虫, 这与后续分子鉴定结果一致。
1.2 孢子形态差异性分析
利用Leica DM6000B显微镜对检获的鲇楚克拉虫(S3—S7株系)进行图像采集及形态测量, 基于成熟孢子的孢子长、孢子宽、极囊直径和极囊间距的测量值, 利用PAST3进行主成分分析(PCA), 以分析鲇楚克拉虫各株系间的形态差异, 使用变量协变矩阵生成具有95%置信区间的散点图。利用SPSS 16.0非参数Mann-Whitney U检验对5株系间形态量度进行显著性差异分析。
1.3 DNA 提取与 PCR 扩增
DNA提取镜检后剩余胆汁保存于1.5 mL离心管中, 从离心管中吸取10 μL含有孢子的胆汁,离心富集, 采用灭菌水悬浮清洗2—3次以除去杂质。基 因 组DNA的 提 取 采 用Dneasy Tissue Kit(QIAGEN, Germany)试剂盒, 按生产厂家提供的说明书步骤进行操作; 再将成功提取的基因组DNA保存于-20℃冰箱中备用。
PCR扩增用于扩增18S rDNA的引物为18E (5′-CTGGTTGATCCTGCCAGT-3′)[25]和18R (5′-CTACGGAAACCTTGTTACG-3′)[26]。PCR反 应 体系: Mix (北京擎科生物科技有限公司)12.5 μL, 引物各1 μL (10 μmol/L), 模板DNA 1 μL, 最后用灭菌超纯水补足至终体积25 μL。PCR反应程序: 98℃预变性5min; 98℃变性90s, 58℃退火30s, 72℃延伸2min, 35个循环; 最后72℃延伸5min, 反应完成后于PCR仪12℃条件下保存。取获得的PCR产物于1.5%的琼脂糖凝胶电泳检测, 然后将有目的条带的PCR产物用DNA凝胶回收试剂盒(Omega Bio-Tek,Norcross City, GA)进行纯化回收, 再将回收产物插进pMD18-T载体(TaKaRa, Japan)中, 随后导入大肠杆菌进行单克隆培养, 每株系送3个克隆子至北京擎科生物科技有限公司测序, 测序返回的每株系的3条18S rDNA序列均一致。
1.4 序列与系统发育分析
序列的选取将本实验获得的鲇楚克拉虫的5条18S rDNA序列上传至GenBank, 并用在线BLAST工具进行序列同源性比对。根据比对结果,选取同源性较高的30条有效序列, 包含鲇楚克拉虫序列S1—S7 (因S3、S4和S6共享同一基因型, 因此,仅选用S3株系的序列为代表), 楚克拉虫属Zschokkella13条、两极虫属Myxidium11条、囊盘虫属Cystodiscus2条、弧形虫属Sphaeromyxa2条、碘泡虫属Myxobolus1条和四极虫属Chloromyxum1条。另外, 选用Tetracapsuloides bryosalmonaeisolate(GenBank登录号: KF731712)和Buddenbrockia plumatellae(GenBank登录号: AY074915)为外群构建系统发育树。
18S rDNA序列分析通过Clustal W程序按照缺省参数进行序列多重比对, 序列相似度的计算用在线序列双重比对工具( https://www.ebi.ac.uk/Tools/psa/ )计算获得。所选序列进行两两之间的遗传距离利用MEGA 6.0[27]选择K2P模型计算完成。
系统发育树的构建利用MrBayes 3.1.2软件构建BI树, 通过Modeltest 3.7[28]计算获得最佳进化模型为GTR+I+G, 共运行10000000代, 每200代抽样1次, 在舍弃25%的老化样本后, 再依据剩余样本构建一致树。利用在线软件CIPRES Science Gateway V. 3.1 (htlp://www.phylo.org/sub_sections/portal)构建ML树, 选用模式为RAxML-HPC2 XSEDE (8.2.12)。然后用FigTree v 1.4.0及Photoshop 2021编辑系统发育树。
1.5 18S rRNA二级结构预测
二级结构模型从欧洲核糖体RNA数据库(http://bioinformatics.Psb.ugent.Be/webtools/rRNA/secmodel/index.html)[29,30]获得。利用MEGA 6.0对所选18S rRNA基因进行比对以获得可变序列区域,基于18S rRNA二级结构对鲇楚克拉虫各株系进行比较。RNA二级结构的预测是使用RNA structure 5.2[31,32]软件依据最小或次小自由能原理完成, 所有的参数设置均为默认值, 最后通过 Rnaviz 2.0[33]软件对已构建的二级结构构型进行手动调整。
2 结果
本研究检获的鲇楚克拉虫均寄生于黄颡鱼胆囊, 孢子游离于胆汁中, 未形成孢囊。如前所述, 依据地理分布, 将鲇楚克拉虫分为5个株系, 其中重庆沙坪坝株系(S3)感染率为20.0%、重庆渝北株系(S4)感染率为16.7%、重庆秀山株系(S5)感染率为50.0%、贵州铜仁株系(S6)感染率为50.0%, 河南信阳株系(S7)感染率为12.5% (表1)。
2.1 鲇楚克拉虫Zschokkella parasiluri Fujita,1927 形态学描述
本研究新获的鲇楚克拉虫各株系(S3—S7)孢子形态与原始描述基本一致(表1), 其成熟孢子壳面观呈椭圆形, 末端钝圆, 壳瓣表面有7—9条明显的条纹; 缝脊“S”形, 从一端绕至另一端; 两个极囊等大、近球形, 位于孢子两端, 开口相反, 极丝缠绕5—7圈(图1)。鲇楚克拉虫重庆沙坪坝株系(S3)的成熟孢子形态学量度(n=30 )为孢子长(11.92±0.38) μm(11.15—12.60 μm); 孢子宽(6.28±0.50) μm (5.41—7.30 μm); 极囊直径(4.34±0.29) μm (3.76—4.84 μm);两极囊最小间距(2.22±0.52) μm (1.38—3.27 μm);极丝缠绕6—7圈; 壳面条纹数7—9。其余株系形态量度与重庆沙坪坝株系(S3)接近(表1)。基于孢子形态量度的主成分分析结果显示, 本研究获得的鲇楚克拉虫各株系(S3—S7)形态对应散点聚集(图2),说明各株系间形态非常相似。通过非参数 Mann-Whitney U检验结果进一步表明, 5株系间孢子形态量度无显著差异(P>0.05)。
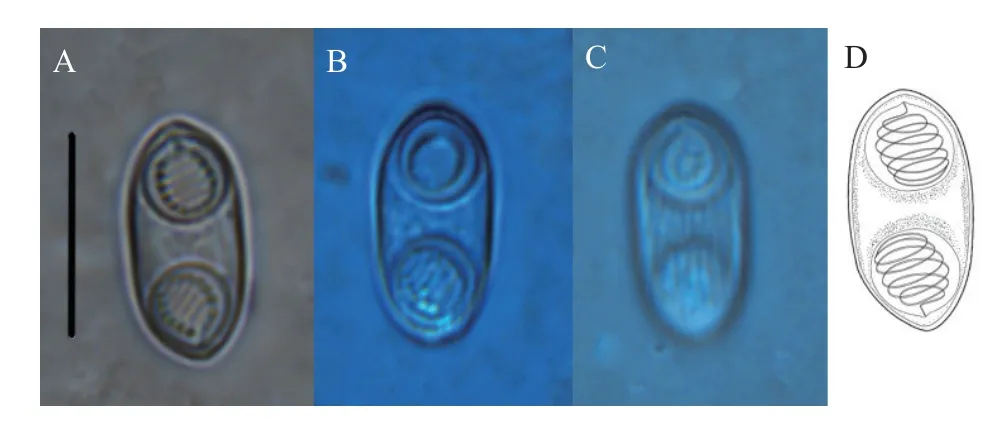
图1 鲇楚克拉虫孢子形态Fig. 1 Morphology of Zschokkella parasikuri
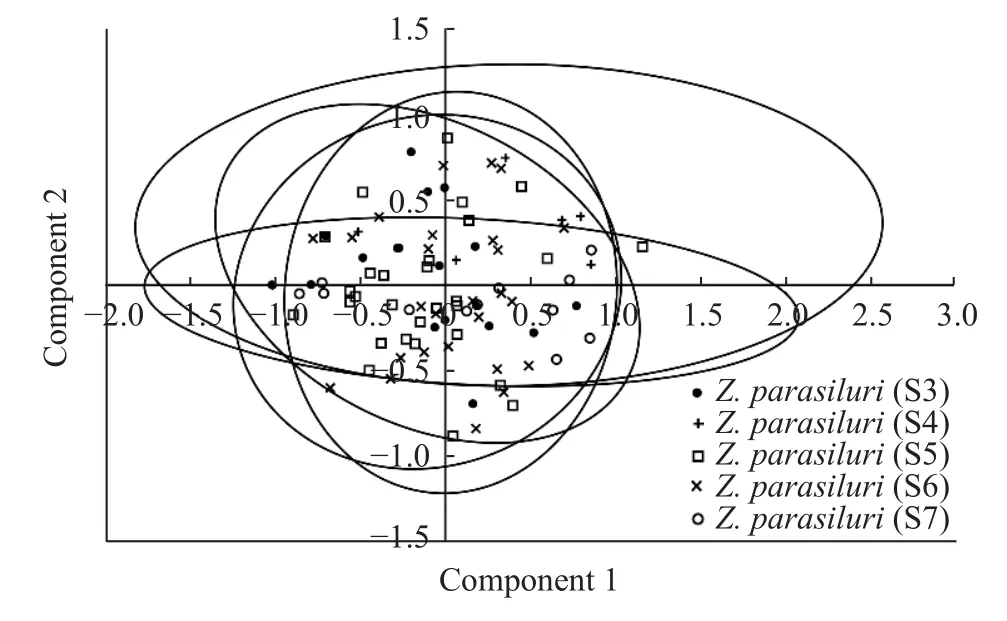
图2 鲇楚克拉虫5株系(S3—S7)主成分分析Fig. 2 Principal component analysis (PCA) of five strains(S3—S7) of Zschokkella parasiluri
2.2 鲇楚克拉虫18S rDNA分子特征
获得鲇楚克拉虫S3—S7株系18S rDNA序列片段长度分别为1919 nt (GenBank登录号为: OP592188)、1792 nt (GenBank登 录号 为: OP592198)、1878 nt(GenBank登录号为: OP592203)、1891 nt (GenBank登录号为: OP445242)和1976 nt (GenBank登录号为: OP906307)。序列分析结果显示: 鲇楚克拉虫各株系间(S1—S7)序列相似度为98.7%—100%, 遗传距离为0—0.006 (表2)。其中S3、S4和S6株系间18S r DNA序列相似度为100%, 且遗传距离为0, 故3株系共享同一基因型。
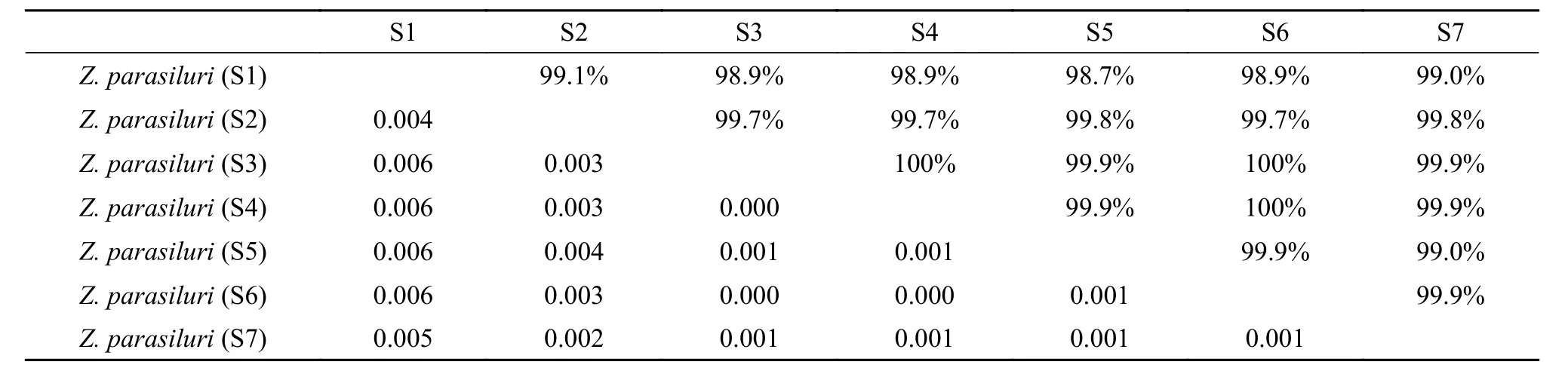
表2 鲇楚克拉虫各株系间18S rDNA序列相似度 (右上) 与遗传距离 (左下)Tab. 2 Similarities (upper right diagonal) and genetic distances (lower left diagonal) of strains of Zschokkella parasiluri based on 18S rDNA sequences
对鲇楚克拉虫S1—S7各株系18S rRNA共有区段的高变区V2、V3、V4、V5、V6、V7、V8 等7个可变区二级结构进行了预测和分析(V1和V9区不 完 整, 故 未 分 析)。结 果 显 示, V5、V6 (37)及V8区的相关构型可将鲇楚克拉虫湖北株系(S1)与其余株系进行有效区分: 湖北株系(S1)V5区二级结构构型多一个由11个碱基构成的内部环, 而其余株系无内部环; 湖北株系(S1) V6 (37)含由11个碱基构成的内部环、无发夹环, 而其他6个株系均含有由12个碱基构成的发夹环; 湖北株系(S1)V8区靠近发夹环的内部环大于其余6个株系对应位置内部环(10 bpvs. 8 bp), 而远离发夹环的内部环小于其余6个株系的对应位置内部环(8 bpvs. 9 bp), 同时, 湖北株系(S1)与其余株系相比, 多两个侧凸(AA; 图3)。
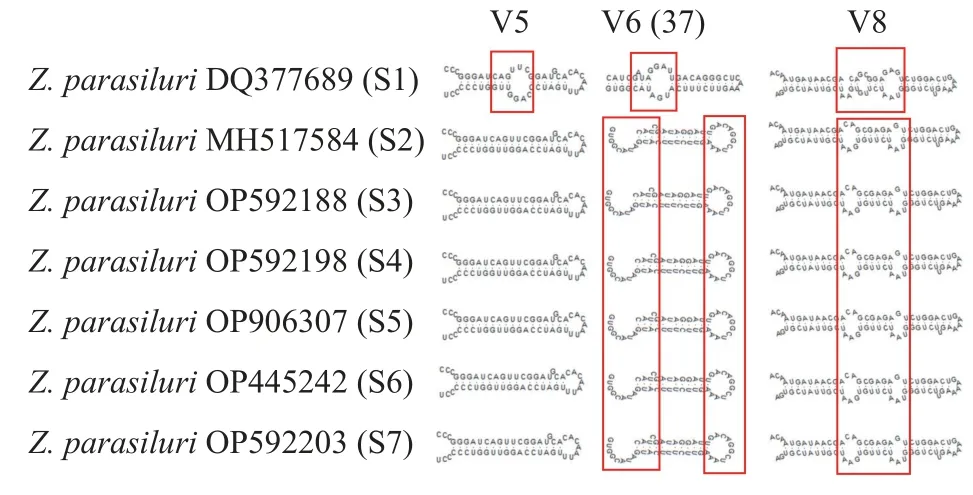
图3 鲇楚克拉虫各株系18S rRNA 部分高变区二级结构Fig. 3 Secondary structure of partial hypervariable regions of 18S rRNA among strains of Zschokkella parasiluri
2.3 系统发育
以18S rDNA为分子标记构建的ML树和BI树,呈现一致的拓扑结构(图4)。系统发育分析显示:鲇楚克拉虫所有株系聚为一支, 其中共享同一基因型的株系(重庆沙坪坝株系S3、重庆渝北株系S4和贵州铜仁株系S6)与重庆秀山株系S5先聚支, 其构成的进化支再与湖北株系S1聚支, 以上共同形成的一大支与河南信阳株系S7和重庆渝北株系S2构成的进化支形成姐妹群关系(图4)。
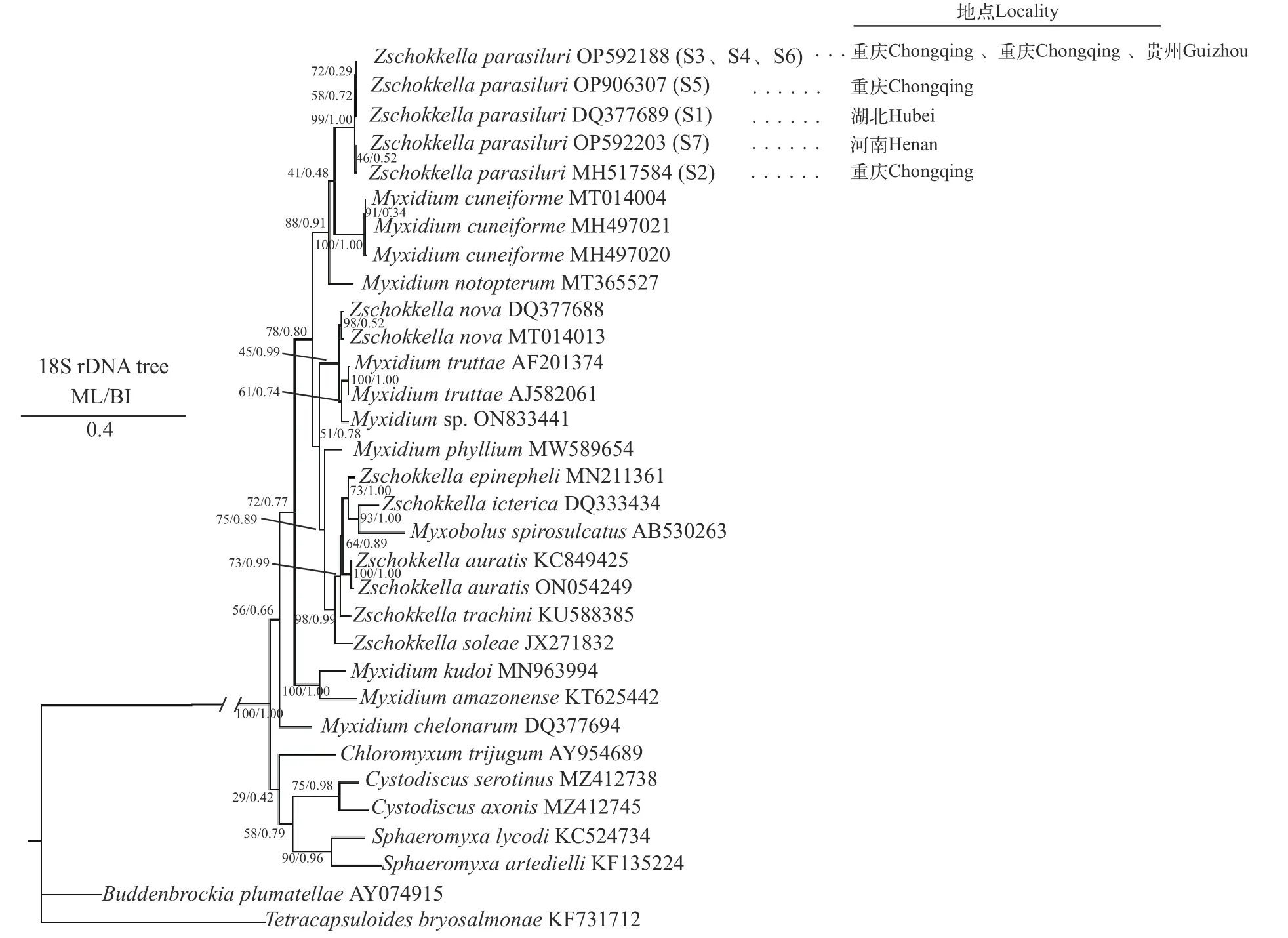
图4 基于18S rDNA序列构建的ML/BI树Fig. 4 ML/BI phylogenetic tree based on 18S rDNA sequences
3 讨论
本研究从重庆、贵州及河南等地的黄颡鱼胆囊中检获鲇楚克拉虫5个株系, 并进行了形态与分子的综合描述, 重庆秀山、河南信阳、贵州铜仁为该物种的地理新记录。虽然本研究获得的5株系孢子整体量度比原始记录略小, 但整体形态特征与原始记录基本一致(表1), 其微小的形态差异可能与宿主种类以及地理分布有关。通过对S3、S4、S5、S6和S7之间形态学量度的主成分及显著性差异分析结果显示, 各株系间无显著差异, 这表明地理分布差异对鲇楚克拉虫的形态变异无明显影响, 推测本研究鲇楚克拉虫与原始记录之间的微小差异, 可能主要与宿主种类不同有关。
虽然物种之间并不存在绝对的界限, 但以往诸多基于18S rDNA为分子标记的黏孢子虫物种鉴定方面的研究表明, 绝大多数黏孢子虫的种内相似度为98.6%—100%, 遗传距离为0—0.007[34—37]。本研究鲇楚克拉虫各株系间(S1—S7)序列相似度为98.7%—100%; 遗传距离为0—0.006 (表2), 进一步说明这7株系应为同一物种。序列分析的结果表明,鲇楚克拉虫7株系间已经形成了不同程度的遗传分化, 其中最明显的是湖北株系S1与其他6株系间存在较大程度的遗传差异, 如S2—S7的遗传距离为0—0.004 (相似度99.0%—100%), 而S1与其余株系的遗传距离为0.004—0.006 (相似度98.7%—99.1%)。同时, 在18S rRNA的二级结构上, 湖北株系与其余6株系在V5、V6 (37)和V8构型上存在明显的差异。这表明, 虽然鲇楚克拉虫7株系处在种内的遗传差异水平, 但湖北株系S1表现的巨大差异暗示其可能有着不同的遗传来源。由于该株系无形态学数据可供比较, 其隐种的可能性不能被排除, 或者该株系可能正处在形成新种的进化阶段。
一般而言, 宿主种类、地理隔离及寄生部位差异在寄生虫种群分化过程中起着非常重要的作用[17,18,38]。然而, 对于黏孢子虫类群并无一致结论。如有关透镜碘泡虫(Myxobolus lentisuturalis)的研究结果表明, 宿主种类差异是透镜碘泡虫种群分化的主要因素, 地理隔离对透镜碘泡虫种群分化的影响不大[21]。又如吉陶单极虫(Thelohanellus kitauei)不同地理株系之间的遗传变异与宿主种类、地理隔离和寄生部位均无明显相关性[22]。再如蛇鲭库道虫(Kudoa thyrsites)不同地理区域间存在显著的基因流阻碍, 而单个区域内基因交流频率较高, 这表明地理隔离是蛇鲭库道虫种群分化的主要影响因素[39]。本研究鲇楚克拉虫7株系均寄生于黄颡鱼胆囊, 不同的是地理分布, 推测地理隔离可能是7株系间遗传分化的主要影响因素。然而, 系统发育分析却显示, 鲇楚克拉虫重庆株系并未聚成一支, 而是分散在几个进化支中, 甚至出现与其他地理株系混合聚支的情况(图4), 即鲇楚克拉虫各株系间并未形成地理种群特有的单系。同时, 7株系间遗传分析的结果也表明, 地理隔离可能并非鲇楚克拉虫株系分化的决定性因素。鲇楚克拉虫的遗传分化可能涉及一些更复杂的问题, 如人为干扰因素(鱼类宿主的引种或交易等)和终末宿主(环节动物)的分布及行为等, 这些均有待于今后基于更多样本和数据进一步研究。
