饲料中添加N-氨甲酰谷氨酸或牛磺酸对杂交鳢生长性能、肠道黏膜形态及肠道菌群的影响
2024-03-02李培佳侯冬强曹俊明赵红霞
李培佳 闫 辰 2 侯冬强 李 敏 彭 凯 黄 文 曹俊明 赵红霞
(1. 广东省农业科学院动物科学研究所, 广东省农业科学院水产研究中心, 广东省畜禽育种与营养研究重点实验室,广州 510640; 2. 华中农业大学水产学院, 武汉 430070; 3. 广州飞禧特生物科技有限公司, 广州 510640)
肠道是水生动物消化系统中的重要部位, 在机体营养代谢、免疫调节和营养物质消化吸收过程中发挥重要作用[1]。肠道致病菌及外源性致病性物质会对宿主肠道健康造成影响, 在此过程中, 肠道黏膜可对其进行清除, 以保护肠道健康[2]。机体正常的生长性能与肠道的健康密切相关, 当肠道结构受到有害物质及寄生虫侵入, 肠道会发生炎症及一系列的病理反应, 严重者会直接影响到肠道的生长发育甚至死亡[3]。水生动物肠道结构及功能的完整性不仅反映肠道正常的消化吸收能力, 同时可以衡量肠道免疫功能的强弱[4]。水生动物肠道内存在大量微生物群落, 微生物与宿主肠道形成一个动态平衡的生态系统, 其中, 肠道菌群的动态平衡与宿主健康密切相关[5]。肠道微生物群可以促进肠道蠕动和营养物质消化, 一旦肠道微生物群失衡, 机体会发生疾病, 如肠炎[6]、腹泻[7]和肠道应激[8]等。感染肠炎会增加肠道的通透性, 更利于有害物质进入到机体, 因此增强鱼类肠道健康是保证鱼类正常生长的重要保障。
水生动物生长性能与肠道健康密切相关。近年来, 由于集约化的养殖模式导致养殖密度大和水质环境污染等现象, 引起水生动物肠道疾病, 从而造成生长性能下降[9]。研究表明, 饲料补充牛磺酸(Taurine)可以显著增强斑点叉尾鮰(Ictalurus punctatus)生长性能和肠道健康[10]、显著缓解欧洲鲈(Dicentrarchus labrax)肠道炎症[11]和显著增强了鲤(Cyprinus carpio)生长性能、肠道形态结构和消化活性[12]。同时先前本实验室研究表明, 在杂交鳢饲料中添加N-氨甲酰谷氨酸(N-carbamylglutamic, NCG)可以显著改善杂交鳢肠道形态结构与肠道菌群丰度[13]。但是, 目前牛磺酸在水生动物肠道菌群方面的研究较少, 关于饲料补充NCG和牛磺酸对鱼类肠道结构及肠道微生物群落的影响研究不深入, 开展此方面的研究很有必要。
杂交鳢(Channa maculata♀ ×C.argus♂), 是乌鳢和斑鳢的杂交子一代, 其在生长性能、抗病性和抗逆性方面均优于亲本[14]。目前珠三角主要鳢科养殖品种为杂交鳢, 据统计, 2021年珠三角杂交鳢养殖产量达到28.30万吨[15]。NCG和牛磺酸在水产动物促生长、提高抗氧化能力和免疫能力方面有大量研究, 但截至目前, 仍没有关于牛磺酸对杂交鳢的研究, 牛磺酸对水生动物肠道形态结构及肠道菌群的影响少之又少。NCG和牛磺酸都具有增强生长性能、改善肠道结构的功能, 但二者的作用机制是否相似尚不清楚。综上所述, 本文结合饲料补充NCG和牛磺酸对杂交鳢生长性能影响的基础上, 进一步研究NCG和牛磺酸对杂交鳢肠道形态结构、消化酶活性、抗氧化能力及肠道微生物群落的影响及作用机制, 旨在发现二者作用的异同, 为后续研究提供一定的参考, 本研究对杂交鳢的健康养殖及提高水生动物肠道保护机制方面具有重要的理论价值。
1 材料与方法
1.1 实验饲料
以玉米蛋白粉、豆粕和鱼粉等配制蛋白为44%, 大豆油、磷脂油和鱼油等配制脂肪为8%的基础饲料。分别设计3个实验组别: 对照组、N-氨甲酰谷氨酸组及牛磺酸组。NCG纯度≥98%, 购自亚太兴牧(北京)科技有限公司(北京, 中国)。牛磺酸纯度≥98%, 购自希杰(沈阳)生物科技有限公司沈阳。本实验室前期试验确定杂交鳢饲料精氨酸适宜添加水平为0.03%左右[16], 因此本次试验饲料NCG添加量为0.03%。研究显示, 饲料添加1%牛磺酸能显著提高翘嘴鲌(Culter alburnus)生长性能[17],饲料在不同阶段添加1%—1.2%牛磺酸能显著提高斜带石斑鱼(Epinephelus coioides)增重率[18], 饲料添加1.15%牛磺酸能显著提高大菱鲆(Scophthalmus maximusL.)增重率[19], 因此本次试验牛磺酸添加水平为1%。将不同的原料按照配方进行称量, 并粉碎过60目筛, 逐级混合后拌水, 采用B20强力搅拌机进行混合, 混合后采用T52型膨化机制成膨化饲料,继而将磷脂油、豆油和鱼油进行混合并喷洒到膨化饲料上, 喷洒均匀后自然风干, 风干后阴凉保存备用。饲料配方如表1所示。

表1 实验饲料配方及营养成分(干重)Tab. 1 Experimental feed formula and nutrient composition (dry matter, %)
1.2 养殖管理
在广东省农业科学院动物科学研究所白云实验基地进行8周养殖实验, 养殖用水曝气后使用。从广州市锦龙渔业有限公司购买杂交鳢鱼苗。第一周在2.5 m×2.5 m×1.5 m的暂养网箱中暂养, 每天08:00和16:00饱食投喂基础饲料2次。暂养结束后禁食24h, 随机挑选体格均匀(22.02±0.02) g, 活力旺盛的杂交鳢鱼苗450尾。5个实验组, 每个实验组包含3个重复(50尾), 在1.5 m×1.5 m×1.5 m网箱中进行8周养殖实验, 每天08:00和16:00饱食投喂实验饲料2次。实验期间溶氧浓度8 mg/L左右,pH 8.0左右, 氨氮浓度小于0.1 mg/L, 水温为25—32℃。
1.3 样品采集与指标测定生长指标计算公式
式中,F初为初始尾数,F末为终末尾数, CP初为初始鱼体蛋白含量, CP末为终末鱼体蛋白含量,W为体重,W初为初始鱼重量,W末为终末鱼重量, CP饲料为饲料蛋白含量,D总为摄入饲料总重,D为饲料摄入量,T为养殖时间。
实验鱼样品采集与体成分测定在8周实验结束后, 禁食24h。对每个网箱实验鱼进行测量, 将体重、体长等数据进行汇总, 并统计存活率及消耗饲料量。生长性能计算随机挑取6尾鱼, 放置于冰上迅速进行解剖, 3尾鱼全肠进行消化酶和抗氧化指标的测定, 3尾鱼后肠进行肠道菌群的测定。10%福尔马林溶液固定3尾鱼的肠道进行肠道切片的制作。饲料及鱼体水分采用GB/T 6435-2014法测定、粗蛋白质采用GB/T 6432-2018法测定、粗灰分采用GB/T 6438-2007法测定、粗脂肪采用GB/T 6433-2006法测定、鱼体精氨酸采用GB/T 18246-2019法测定。
肠道消化酶和抗氧化酶活性测定淀粉酶(Amylase, AMS)、胰蛋白酶(Tryosim, TPS)、脂肪酶(Lipase, LPS)、γ-谷氨酰基转移酶(γ-glutamyltransferase, γ-GT) 、Na+/K+ATP酶(Na+/K+ATPase) 、肌酸激酶(Creatine, CK) 、过氧化物酶(Peroxidase, POD)活性、超氧化物歧化酶(Superoxide dismutase, SOD)活性、过氧化氢酶(Catalase, CAT)活性、总抗氧化(Total antioxidant capacity, T-AOC)能 力、丙 二 醛(Malondialdehyd, MDA)含量及谷胱甘肽过氧化物酶(Glutathione peroxidase , GSH-Px)活性。酶活试剂盒购自南京建成生物工程研究所, 测定步骤、原理和计算公式等参考试剂盒说明书。
肠道切片分析提取固定的肠道, 进行修剪和脱水处理, 采用石蜡包埋, 继而进行组织切片和染色, 最后封片和镜检。镜检使用成像显微镜并且使用Case Viewer 2.2进行拍摄, 挑选不同的放大倍数中合格的切片并拍摄切片中的肠道病理变化。
肠道菌群采集每个重复组随机取3尾鱼肠道, 立即装入2 mL冻存管中液氮速冻4h, 放置于-80℃保存, 用于检测肠道菌群。
生物信息分析以16S DNA“V3+V4”设计引物序列, 引物序列为338F (5′-ACTCCTACGGGA GGCAGCAG-3′) and 806R (5′-GGACTACHVGGGT WTCTAAT-3′), PCR 正式试验采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase, 20 μL反应体系。采用分类单元(OTU)进行聚类和物种分析,基于OTU进行alpha多样性分析, 对Coverage指数(Coverage index)测定其物种覆盖度, 对Chao 指数(Chao index), Ace 指数(Ace index)测定肠道菌群丰度, 对Shannon 指数(Shannon index), Simpson 指数(Simpson index)测定肠道菌群多样性。Illnmina肠道测序产生净序列2177059, 平均序列长度450 bp。
1.4 数据分析
使用GraphPad Prism 5 (美国)软件对数据进行t检验和绘制该实验的结果图(GraphPad Software U.S.A)。*表示组间差异显著(P<0.05),**表示组间差异极显著(P<0.001)。所有实验均独立重复3次,n=3。
2 结果
2.1 生长性能和体成分分析
与对照组相比, 0.03%NCG组和1%Taurine组PPV显著升高, FCR和FI显著下降(P<0.05), IBW、WGR、FW、SGR、PE和鱼体精氨酸含量无显著性差异(P>0.05); 与对照组相比, 0.03%NCG 组SR显著升高(P<0.05; 图1)。

图1 不同实验组饲粮对杂交鳢生长性能的影响Fig. 1 Effect of different experimental groups of diet on the growth performance of Channa maculate ♀× C. argus ♂
2.2 肠道消化酶活性
与对照组相比, 0.03%NCG组和1%Taurine组杂交鳢肠道淀粉酶和肌酸激酶显著升高(P<0.05); 与对照组相比, 1%Taurine组杂交鳢肠道胰蛋白酶、脂肪酶、γ-谷氨酰转移酶和钠钾ATP酶显著升高(P<0.05); 与0.03%NCG组相比, 1%Taurine组杂交鳢肠道淀粉酶和钠钾ATP酶显著升高(P<0.05; 图2)。

图2 不同实验组饲粮对杂交鳢肠道消化酶活性的影响Fig. 2 Effect of different experimental groups of diet on intestinal digestive enzyme activities of Channa maculata ♀× C. argus ♂
2.3 肠道抗氧化酶活性
与对照组相比, 0.03%NCG组杂交鳢肠道总抗氧化能力、过氧化物酶和谷胱甘肽过氧化物酶显著升高, 丙二醛含量显著下降(P<0.05); 与对照组相比, 1%Taurine组杂交鳢肠道胰丙二醛含量显著下降(P<0.05); 与0.03%NCG组相比, 1%Taurine组杂交鳢肠道丙二醛含量显著升高(P<0.05; 图3)。

图3 不同实验组饲粮对杂交鳢肠道抗氧化指标的影响Fig. 3 Effect of different experimental groups of diet on intestinal antioxidant index of Channa maculata ♀× C. argus ♂
2.4 肠道黏膜病理状态
各实验组杂交鳢肠道黏膜层、肌层结构清晰、紧密, 黏膜层绒毛丰富, 较多绒毛上皮与固有层间隙增宽(黑色箭头), 少量绒毛上皮断裂(红色箭头), 肠腔亦见脱落的上皮细胞团块(黄色箭头), 未见其他明显异常(图4)。
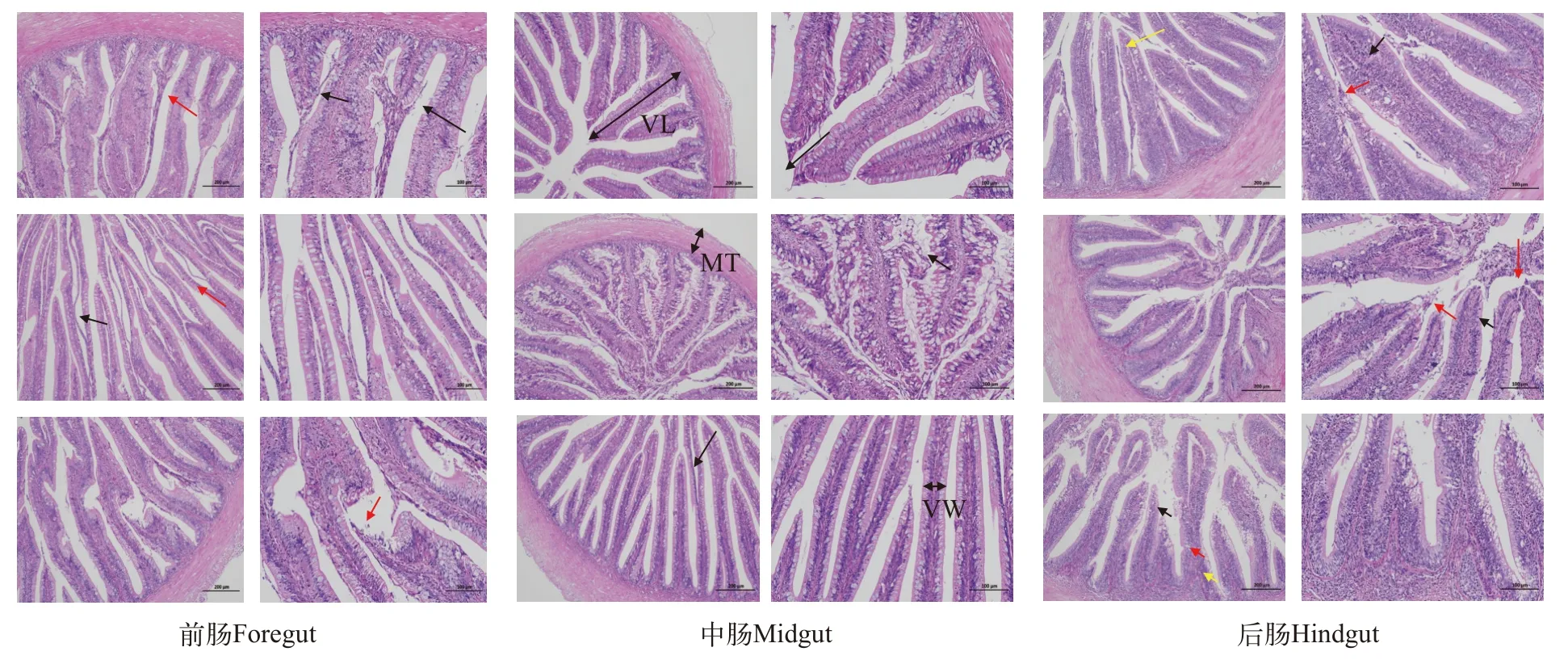
图4 不同实验组饲粮对杂交鳢肠道病理切片的影响(左图. 原始放大100×; 右图. 原始放大200×)Fig. 4 Effect of different experimental groups of diet on the expression of intestinal pathological sections in Channa maculata ♀× C. argus♂ (left figure. original magnification 100×; right figure. original magnification 200×)
2.5 肠道结构分析
与对照组相比, 0.03%NCG组杂交鳢前肠肌层厚度、中肠绒毛宽度、中肠肌层厚度和后肠肌层厚度显著升高(P<0.05); 与对照组相比, 1%Taurine组杂交鳢前肠绒毛长度、前肠绒毛宽度、前肠肌层厚度、中肠绒毛宽度、中肠肌层厚度、后肠绒毛宽度和后肠肌层厚度显著升高(P<0.05); 与0.03%NCG组相比, 1%Taurine组杂交鳢中肠肌层厚度和后肠肌层厚度显著升高(P<0.05; 图5)。

图5 不同实验组饲粮对杂交鳢肠道结构的影响Fig. 5 Effect of different experimental groups on intestinal morphology and structure of Channa maculata ♀× C. argus ♂
2.6 肠道alpha多样性分析
各实验组Coverage指数均为1.00, 表明测序深度已经完成肠道所有微生物物种检测, 与对照组和相比, 1% Taurine组杂交鳢肠道Ace指数和Chao指数显著升高(P<0.05), 0.03% NCG组无显著差异性(P>0.05; 表2)。

表2 不同实验组饲粮对杂交鳢肠道alpha多样性的影响Tab. 2 Effect of different experimental groups on the expression of genes related to sugar metabolism in Channa maculata ♀× C.argus ♂
2.7 肠道微生物物种组成分析
杂交鳢肠道微生物在3个实验组共鉴别出1454个OTU。对照组、0.03% NCG组和1% Taurine组OTU分别有289、332和833, 分别占总OTU的19.88%、22.83%和57.29%。其中1% Taurine组OTU显著高于对照组和0.03% NCG组(P<0.05; 图6)。

图6 不同实验组饲粮对杂交鳢肠道微生物物种丰度占比的影响Fig. 6 Effect of different experimental groups on the abundance proportion of intestinal microbial species in Channa maculata ♀×C. argus ♂
如图7和图8所示, 在门水平上与对照组相比,0.03%NCG组和1% Taurine组厚壁菌群(Firmicutes)显著升高, 梭杆菌群(Fusobacteriota)显著降低(P<0.05)。在属水平上与对照组相比, 0.03%NCG组和1% Taurine组支原体属(Mycoplasmataceae)显著升高, 梭菌属(Clostridium)显著降低(P<0.05)。
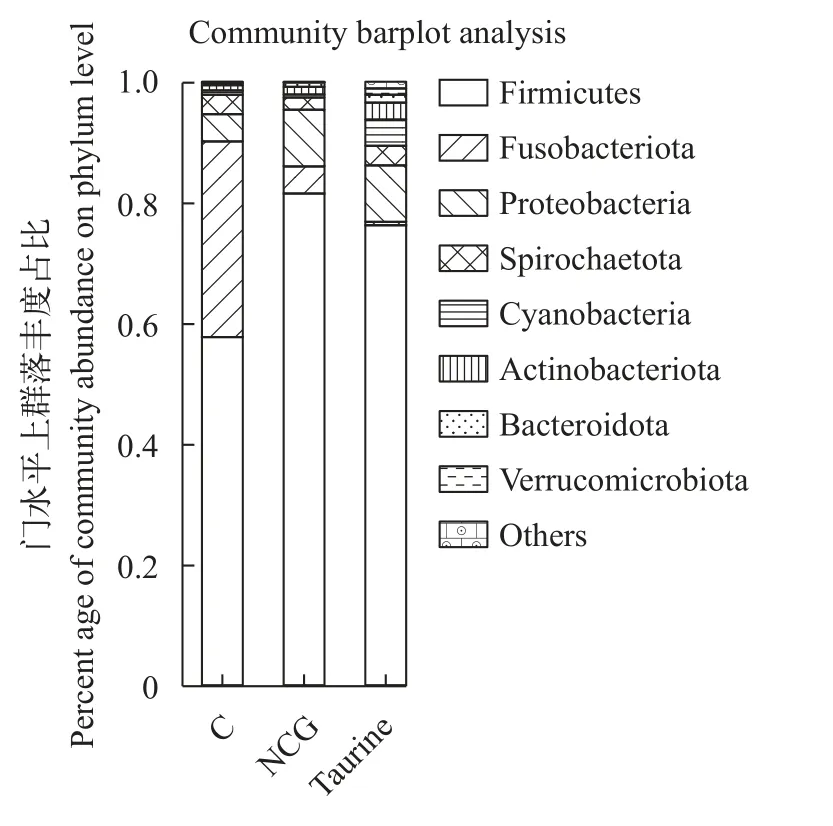
图7 门水平上的群落丰度占比Fig. 7 Community abundance ratio at phylum level

图8 属水平上的群落丰度占比Fig. 8 Community abundance ratio at genus level
杂交鳢肠道微生物在门水平上选取前40个丰度高的菌群进行占比分析, 结果表明, 对照组和0.03%NCG组物种同源性及丰度占比相似, 与1%Taurine组成显著差异(P<0.05)。同时观察到1%Taurine组在厚壁菌群丰度占比最高, 并显著高于对照组和0.03%NCG组(P<0.05; 图9)。

图9 门水平上前40个肠道微生物热图分析Fig. 9 Heat map analysis of the top 40 intestinal microorganisms at the phylum level
选取杂交鳢肠道微生物门水平上前40个菌落对比在线数据库, 并通过KEGG途径对每个微生物物种进行功能注释。结果表明, 杂交鳢肠道微生物的功能主要用于氨基酸的转运与代谢、糖类及能量的代谢与转化等(图10)。
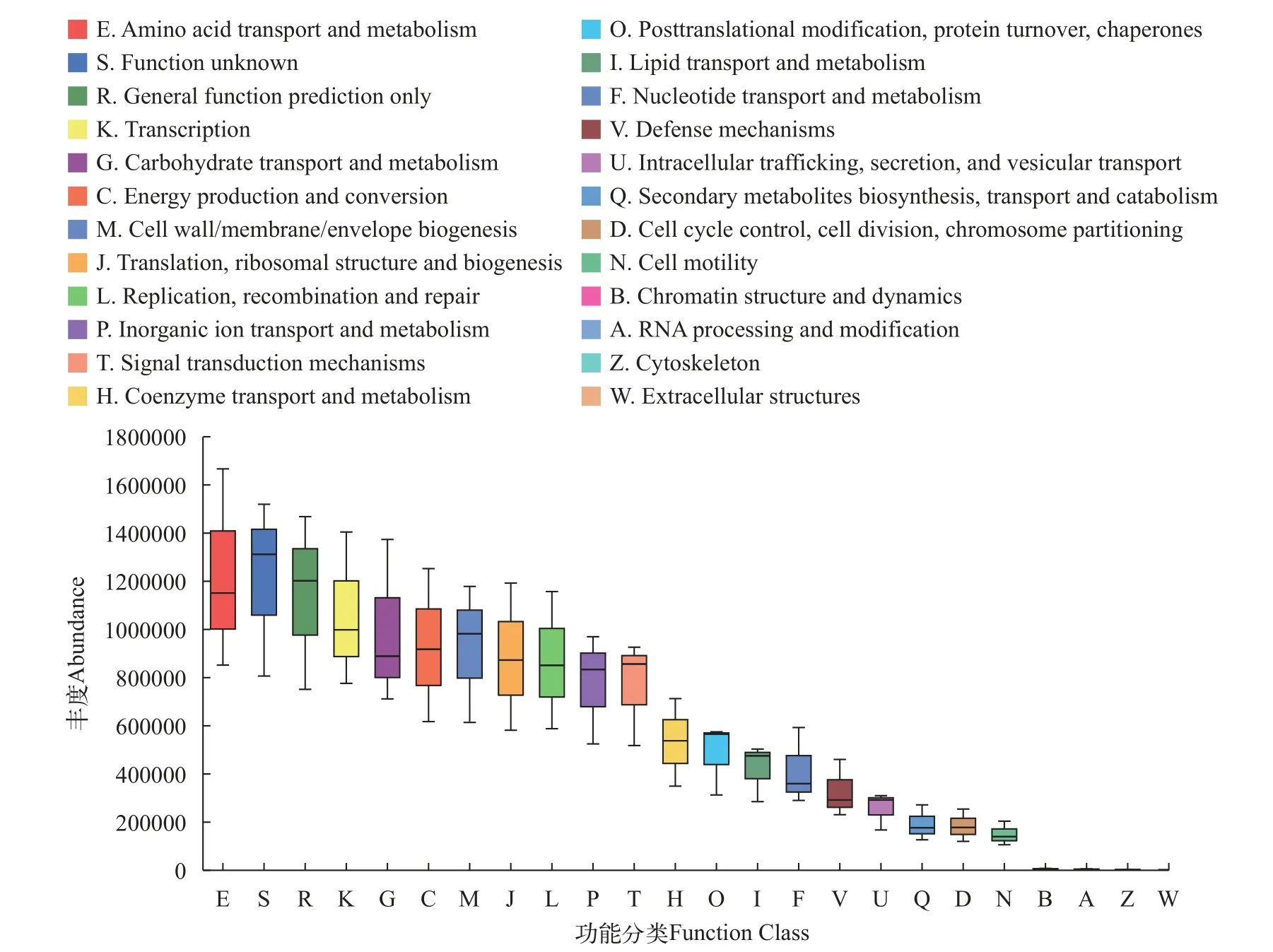
图10 基于KEGG途径分析杂交鳢肠道微生物功能预测Fig. 10 Prediction of intestinal microbial function of Snakehead hybrid based on KEGG approach
3 讨论
NCG在水生动物体内可有效合成精氨酸、精氨酸作为水生动物必需氨基酸, 对水生动物的生长和维持氮平衡有重要作用[20]。而牛磺酸作为水生动物体内条件性必需氨基酸, 是水产养殖动物不可缺少的营养素[21]。在本实验条件下, 饲料补充0.03%NCG和1%Taurine杂交鳢PPV显著升高, FCR显著下降, NCG组与Taurine组相比, FCR、FI和PPV无显著差异, 这表明杂交鳢饲料补充NCG或牛磺酸可以显著增强蛋白沉积, 提高饲料利用效率, 降低养殖成本。这可能由于外源性补充NCG在水产动物体内内源性合成精氨酸代谢产生一氧化氮和多胺等物质, 一氧化氮促使杂交鳢吸收更多的营养物质,多胺在杂交鳢体内直接促进蛋白质的合成[20]。值得注意的是, 牛磺酸早在先前的研究中被证明可以作诱食剂, 这也很好地解释了杂交鳢饲料中补充了牛磺酸, 促使杂交鳢表现出较高的饲料利用效率和蛋白质沉积率[22]。同时牛磺酸作为含硫氨基酸, 在水生动物体内可以促进多胺的合成, 有效合成体蛋白[23]。当然, 这也归因于牛磺酸可以通过增强肠道消化酶的活性, 从而促进营养物质的消化吸收, 并以最佳的生长性能做出反馈[24]。综上所述, NCG和牛磺酸在促进杂交鳢生长性能方面作用结果相似,原因可能与NCG和牛磺酸在杂交鳢体内合成多胺有关, 具体作用机制需进一步研究。
肠道消化酶包括蛋白酶、脂肪酶和淀粉酶, 消化酶与肠道的生长发育相关[25]。Na-K+-ATP酶可调节细胞内外的渗透压, 促进葡萄糖、氨基酸等物质进入细胞内代谢[26]。γ-GT在主要作用于多肽转运, 为机体蛋白合成提供原料[27]。肌酸激酶主要与细胞内能量转运、ATP再生有直接关系[28]。在本实验条件下, 杂交鳢饲料补充NCG可以显著提高肠道淀粉酶和肌酸激酶活性, 表明内源性合成精氨酸可以增强杂交鳢肠道消化酶活性, 促进肠道内能量转运。这与建鲤(Cyprinus carpio var. Jian)[29]研究结果相同。同时观察到, 杂交鳢饲料补充牛磺酸可以显著增高肠道胰蛋白酶、脂肪酶、γ-谷氨酰转移酶和钠钾ATP酶活性, 表明牛磺酸可以显著增强杂交鳢肠道消化酶活性, 提高肠道营养物质交换和能量转化效率, 促进营养物质在消化道内的吸收和代谢,这与黄河鲤[24]的研究结果相同, 同时可以有效地解释了牛磺酸显著增强杂交鳢生长性能的原因。综上, NCG和牛磺酸可通过提高不同消化酶活性提高肠道能量转化效率, 促进杂交鳢生长。
水生动物组织结构会受到氧化损伤, 进而影响到水生动物的免疫机能[30]。水生动物在氧化应激损伤过程中, 会释放氧自由基, 主要包括超氧阴离子和羟自由基, 其能够导致水生动物组织上皮细胞脂质氧化损伤, 进而产生丙二醛[30]。研究表明, 饲料补充NCG可以显著增强黄颡鱼(Pelteobagrus fulvidraco)血清[31]和团头鲂(Megalobrama amblycephala)[32]肠道抗氧化活性。在本实验条件下, 饲料补充NCG可以显著提高杂交鳢肠道总抗氧化能力、过氧化物酶和谷胱甘肽过氧化物酶活性。这可能由于饲料补充NCG内源性合成精氨酸, 进而使机体内谷氨酰胺活性升高, 谷氨酰胺可以作为氧化物质的能量来源, 从细胞中去除氧化化合物, 防止氧化损伤细胞组分[33]。值得注意的是, 饲料补充NCG杂交鳢肠道丙二醛含量显著下降。丙二醛是脂质过氧化的产物之一, 可导致细胞损伤和功能障碍, 因此, 它被认为是氧化应激的一个强有力的生物标志物[34]。本实验结果表明, 饲料补充NCG可以有效降低杂交鳢肠道MDA含量, 并有效缓解肠道过氧化造成的细胞损伤, 本实验结果在团头鲂中也得到证实[32]。同时观察到, 杂交鳢饲料补充牛磺酸肠道丙二醛含量显著下降。这一点与黄颡鱼[35]研究结果相同, 鱼类可通过自身酶系统清除氧自由基, 缓解氧化损伤[36]。研究表明, 饲料补充牛磺酸可以提高中华绒螯蟹(Eriocheir sinensis)[37]血清抗氧化活性、显著提高欧洲鲈[38]肠道抗氧化活性。截至目前, 关于牛磺酸与鱼类肠道中抗氧化酶关系研究较少, 更未涉及到抗氧化酶mRNA水平方面的研究, 牛磺酸可能会通过影响鱼类肠道抗氧化信号分子表达调控机体抗氧化进程, 因此, 在未来的研究中, 开展相关的研究很有必要。
肠道作为水生动物重要的营养物质消化器官,是保证水生动物健康生长的保障[39]。外界环境中的细菌会对肠道结构造成损坏, 引发肠炎及肠道相应部位的损伤[40]。肠炎是水生动物养殖过程中的三大疾病之一, 严重危害鱼的生长健康[41]。因此,增强鱼类肠道健康是保证鱼类生长性能的重要保障性因素。肠道绒毛和肌层厚度是保证肠道结构完整发关键指标, 完整的肠道绒毛不仅可以促进消化物质的吸收, 更有利于防止有毒物质的入侵[42]。研究表明, 饲料补充精氨酸可显著增强水生动物肠道绒毛宽度、改善肠道萎缩状态[43], 饲料补充牛磺酸可显著增强水生动物肠道消化酶和抗氧化酶活性、缓解肠道氧化损伤[44]。在本实验条件下, 饲料补充NCG显著增强杂交鳢前肠肌层厚度、中肠绒毛宽度、中肠肌层厚度和后肠肌层厚度, 饲料补充牛磺酸显著增强杂交鳢前肠绒毛长度、前肠绒毛宽度、前肠肌层厚度、中肠绒毛宽度、中肠肌层厚度、后肠绒毛宽度和后肠肌层厚度。本实验结果很好地证明了NCG和牛磺酸在水生动物肠道形态结构方面发挥的重要作用。同时观察到各实验组杂交鳢肠道黏膜层、肌层结构清晰、紧密, 黏膜层绒毛丰富, 对照组有较多绒毛上皮与固有层间隙增宽, 少量绒毛上皮断裂, 肠腔亦见脱落的上皮细胞团块, NCG组这些现象得到缓解, 表明饲料补充NCG内源性合成精氨酸途径可保护杂交鳢肠道结构完整, 缓解病理损伤。这一原因可能是精氨酸可以促进多胺和生长激素的合成, 多胺对肠道修复起重要作用, 而生长激素能够显著减少肠黏膜萎缩,加速受损肠道修复[45]。
水生动物肠道微生物群落从动物出生就在肠道内存在, 是机体内最大的生态系统[46]。肠道微生物群落在肠道内处于动态平衡状态, 这种平衡对于机体正常生理活动如营养物质消化、代谢和抵御外来病原物质入侵起关键作用[47]。肠道微生物群落平衡被打破、其正常的消化功能也会受损甚至引发肠道炎症等一系列疾病[48]。在本实验条件下,杂交鳢肠道菌群各实验组Coverage指数均为1.00,表明测序深度已经完成肠道所有微生物物种检测。杂交鳢饲料补充牛磺酸肠道Ace和Chao指数显著升高, 表明牛磺酸的补充显著增加了肠道菌群的丰富度, 改善了肠道菌群的稳定性。同时观察到,饲料补充牛磺酸杂交鳢肠道菌群OUT占比为57.29%,显著高于对照组和NCG组, 这表明牛磺酸不仅可以增强杂交鳢肠道菌群的丰富度, 更有效地增多了杂交鳢肠道微生物的数量, 保护肠道健康。
本实验通过在门水平上选取前40个丰度高的菌群进行占比分析, 结果表明, 牛磺酸组与对照组间的微生物组成存在显著差异性, 并显著高于对照组, NCG组和对照组间肠道微生物物种同源性及丰度占比相似。值得注意的是, 饲料补充NCG和牛磺酸杂交鳢肠道厚壁菌门显著升高, 梭杆菌门显著降低。厚壁菌门是肠道中存在的主要细菌, 也是杂交鳢肠道微生物的优势菌群, 厚壁菌群的升高对肠道健康至关重要[49]。梭杆菌门可以从膳食纤维或淀粉中释放能量, 但在分解蛋白过程中也会致使有毒产物的释放[50]。同时观察到, 饲料补充NCG和牛磺酸组肠道微生物群支原体属显著升高, 梭菌属显著降低。结果表明, 饲料补充NCG或牛磺酸可以显著增强肠道微生物的多样性和丰富度, 促进肠道生长,维持肠道微生物群落动态平衡, 保护肠道健康。同时选取杂交鳢肠道微生物门水平上前40个菌落对比在线数据库, 并通过KEGG途径对每个微生物物种进行功能注释。结果表明, 杂交鳢肠道微生物的功能主要用于氨基酸的转运与代谢、糖类及能量的代谢与转化等, 这些预测结果与NCG和牛磺酸对水生动物的促生长、增强消化酶和抗氧化酶活性和改善免疫调节能力相同。
4 结论
饲料中添加0.03% NCG或1% Taurine可显著提高杂交鳢蛋白质沉积率、提高肠道消化酶活性(淀粉酶和肌酸激酶)、改善肠道结构(前肠肌层厚度、中肠绒毛宽度、中肠肌层厚度和后肠肌层厚度)、增强肠道菌群丰度(厚壁菌群和支原体属), 显著降低饲料系数和肠道丙二醛含量、显著降低肠道梭杆菌群和梭菌属丰度。此外, 饲料中添加0.03% NCG可显著提高杂交鳢肠道总抗氧化能力(过氧化物酶和谷胱甘肽过氧化物酶)并显著缓解肠道病理状态,饲料中添加1%Taurine可显著提高杂交鳢肠道消化酶活性(胰蛋白酶、脂肪酶、γ-谷氨酰转移酶和钠钾ATP酶)、改善肠道结构(前肠绒毛长度、前肠绒毛宽度和后肠肌层厚度)并显著增强肠道菌群丰度。结果表明饲料中添加NCG在增强肠道抗氧化活性, 缓解肠道氧化损伤方面优于添加牛磺酸, 但饲料添加牛磺酸可以增强肠道消化酶活性, 促进肠道生长, 其作用效果优于补充NCG。
