白及叶斑病病原菌的鉴定与室内杀菌剂筛选
2024-03-02侯秀明林思雨王晗怡郭静怡廖宏泽
侯秀明,林思雨,王晗怡,郭静怡,刘 泽,廖宏泽,周 浩,2**
(1.广西民族大学 广西多糖材料与改性重点实验室,广西 南宁 530007;2.广西民族大学 海洋生物资源保护与利用重点实验室,广西 南宁 530007)
白及[Bletillastriata(Thunb)Reichb.f.(Orchidaceae)]又名地螺丝、良姜、紫兰,是兰科白及属多年生药用植物.白及块茎味苦、涩,性偏凉,化学成分主要有联苄类、菲类化合物和多糖,具有消肿、生肌、敛疮、止血的功效,被美容行业广泛使用[1].此外,白及可治痈疽肿毒,肺伤咳血,灼伤溃疡,肛裂,乳头裂和手足皲裂,对肠道疾病胃溃疡、结肠炎也具有疗效[2].
野生白及产于贵州、四川、云南、广西、湖南、湖北、浙江、江西等省(自治区),生长于山谷潮湿处[3].由于白及具有重要药用价值,近年来市场需求急剧增长,野生资源挖掘殆尽,导致物种濒临灭绝,目前已被《中国植物红皮书——稀有濒危植物》第一册收录[4].为满足市场需求,人工种植产业兴起,而病害问题已成为影响白及产量的重要因素,制约白及种植业发展.白及病害的发生集中于雨季前,据研究报道,Phytophthoranicotianae[5]和RhizoctoniasolaniAG-2-2 IIIB[6]引起白及叶枯病,Fusariumfujikuroi[7]引起白及黑腐病、F.asiaticum[8]、F.solani[9]和Epicoccumsorghinum[10]能引起白及叶斑病.这些病害后期可导致叶片掉落,植株死亡,严重影响产量.本研究在广西南宁市白及种植基地发现一种白及叶斑病.为了鉴定该病的病原菌种类,筛选出高效的防治药剂,通过采集白及发病叶片,从病害组织中分离纯化病原菌,结合形态学特征与多基因系统发育分析,明确病害病原种类,并在室内开展该病原的防治药剂筛选.研究结果可为白及叶斑病的病原真菌鉴定以及防治提供理论依据.
1 材料与方法
1.1 供试植株供试植物来自广西南宁市白及种植基地.病症植株置于无菌袋中保存并编号;健康植株移栽到温室培养.
1.2 供试培养基及试剂马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g、水1 L.燕麦培养基(OA):燕麦片30 g、琼脂20 g、水1 L.麦芽汁培养基(MEA):麦芽浸提物34 g、琼脂20 g、水1 L.水琼脂培养基(WA):15 g,水1 L.
主要试剂有EasyTaq®DNA 聚合酶、10× EasyTaq®Buffer、dNTP、氯仿、异丙醇、1% CTAB、15 mg/mL 氯霉素.
1.3 田间病害观察与样品采集2020 年5 月在广西南宁市白及种植基地观察并采集患病植株,拍照记录发病情况后将患病植株带回实验室.
1.4 病原菌分离、纯化及保存采取组织分离法[11]与单孢纯化法[12]分离病原菌.剪取0.5 cm×0.5 cm病健交界处的植物组织,放入0.1% HgCl2溶液浸泡1 min,无菌水冲洗3 次后放入PDA 培养基,28 ℃恒温倒置培养.从新长出的菌落边缘挑取菌丝块,置于PDA 平板上,依据菌落形态和显微特征进行初步分类.待菌落长满平板,制备分生孢子悬浮液(106个/ mL),利用平板稀释画线法纯化病原菌.纯培养物用PDA 斜面保存于4 ℃冰箱.
1.5 致病性测定采用分离菌株的PDA 菌饼和孢子悬浮液测定致病性.将纯化的菌株接种于含有氯霉素(25 μg/mL)的PDA 平板上,28 ℃培养7 d,制备0.5 cm×0.5 cm 菌饼,挑选生长状态一致的健康白及叶片,用无菌水清洗晾干,针头刺伤后接种菌饼,无菌水浸润棉花保湿,以刺伤的白及叶片作为空白对照[13].在刺伤的活体植株叶片上滴加孢子悬液,无菌水做空白对照.实验重复3 次,所有处理植株在室温下培养6 d,定期记录发病情况,待植株发病后,依据柯赫氏法则验证病原.
1.6 形态学观察把纯化的分离菌株分别接种于PDA、MEA 和OA 平板,28 ℃培养,待菌丝长满后,记录菌株菌落形态.在PDA 平板上接种直径为5 cm的菌饼,利用十字交叉法间隔12 h 测量菌落直径,统计菌株平均生长速度.将菌株接种于WA 培养基,待菌丝长满后,显微镜下观察并拍照,利用ImageJ[14]测量分生孢子大小.
1.7 分子生物学鉴定接种纯培养物于PDA 上,菌丝长满后,挑取菌丝,使用CTAB 法[15]提取真菌基因组DNA.用引物(表1)分别扩增核糖体DNA(nrDNA)内转录间隔区(ITS)、28S nrDNA(LSU)、18S nrDNA(SSU)、转录延伸因子基因(TEF1)、编码RNA 聚合酶Ⅱ的基因(RPB2)、甘油-3-磷酸脱氢酶基因(GAPDH)的序列,引物均由武汉奥科鼎盛生物科技有限公司合成.25 μL PCR 反应体系:DNA 模板1 μL,10×EasyTaq®buffer 2.5 μL,dNTP与上下游引物各0.5 μL,DNA 聚合酶 0.1 μL,无菌去离子水20.9 μL.扩增程序设置为:94 ℃预变性3 min,94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸45 s,循环35 次,72 ℃延伸10 min,4 ℃保温.

表1 PCR 扩增所用引物Tab.1 Primers for PCR amplification
选取预期大小的DNA 片段在武汉奥科鼎盛生物科技有限公司测序,使用Vector NTI 对测序结果进行检查校准,在NCBI 中进行同源性分析,并将序列上传至NCBI 数据库获得序列登录号(表2).依据Woudenberg 等[16]的方法选取29 株近缘菌株,以A.alternantherea作为外类群,下载相应ITS、LSU、SSU、TEF1、RPB2、GAPDH序列(表2),使用Phylosuite1.2.2 进行多重序列比对,串联序列,以最大似然法(ML)构建系统发育树,设置自检值为20 000.
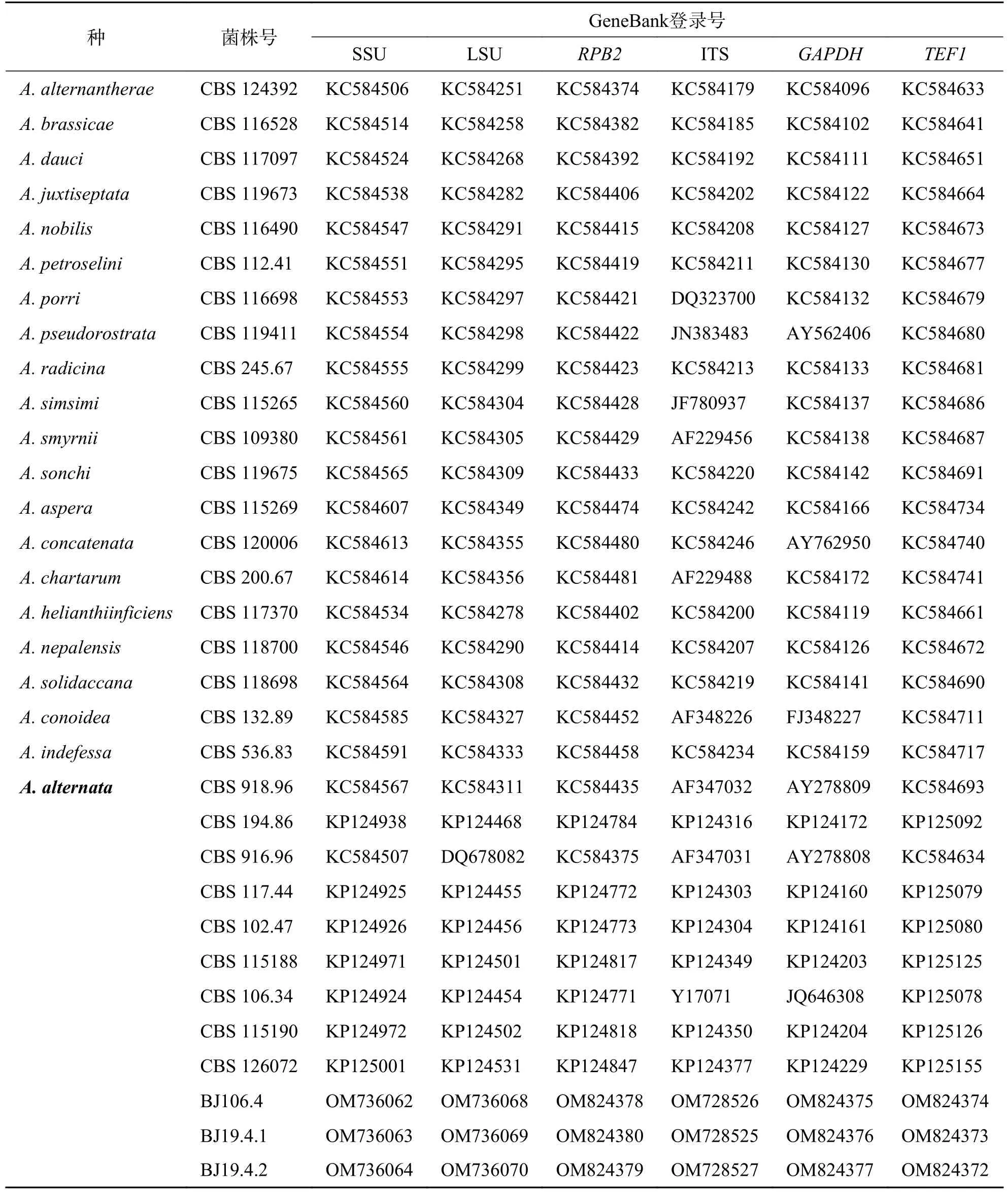
表2 系统发育分析所用链格孢属菌株相关信息和GeneBank 登录号Tab.2 Collection details and GeneBank accession numbers of the Alternaria used in phylogenetic analysis
1.8 不同杀菌剂的室内毒力测定采用菌丝生长速率法测定杀菌剂对致病菌的毒力,依据张晓勇等[24]、李文等[25]的文献,选取10 种杀菌剂进行测定,供试杀菌剂种类及质量浓度见表3.以无菌水作为空白对照,每个处理重复2 次,72 h 后采用十字交叉法统计不同处理的菌落直径,计算抑制率.

表3 供试杀菌剂名称及用量Tab.3 Names and dosages of test agents.
抑制率=(空白对照菌落纯生长量-处理菌落纯生长量)/空白对照纯生长量×100%,
纯生长量=菌落平均直径-菌饼直径.
利用Excel 2010 计算不同质量浓度杀菌剂对病原菌生长的抑制率,采用GraphPad Prism 8.0 绘制杀菌剂抑制效果曲线图,以杀菌剂质量浓度的对数值为横坐标,抑制率作为纵坐标,计半数有效质量浓度(EC50),判断不同杀菌剂的药效.
2 结果
2.1 白及叶斑病田间症状本研究在广西南宁种植基地的白及叶片上观察到一种叶斑病,呈黑色不规则状.随着病害的发展,叶面斑点不断增多,密集覆盖整个叶片或者植株(图1),危害面积约0.2 hm2(3 亩).田间五点取样法随机统计200 株,发病率约15%.在其中3 个取样点选取了3 株患病植株(每个取样点选取了1 株),病斑边缘剪下18 块植物叶片(~5 mm2)组织用于病原分离.在PDA 上一共分离到了15 株真菌,11 株形态一致,都能在植物叶片上引起病斑.其余4 株菌落形态差别很大,且不能在植物上引起病害.ITS 序列分析表明,11 株菌都属于链格孢属(Alternaria),随机挑选了其中3 个菌株BJ19.4.1、BJ19.4.2、BJ106.4 进行下游实验.

图1 白及田间病害症状Fig.1 Symptoms of leaf spot on Bletilla striata
2.2 病原菌致病性测定将菌株BJ19.4.1、BJ19.4.2、BJ106.4 的PDA 菌饼接种于健康白及叶片,3 d 后叶片出现黑色斑点,3 株菌在白及上产生的病斑形状一致,发病时间无差异(图2B~D).用孢子悬液(106个/ mL)接种活体植株,植株6 d 后出现黑色病斑(图2E~G),滴加蒸馏水的对照组不发病.2种接种方式中,用菌饼接种的叶片发病更明显,病斑出现时间较早.从叶片的病健交接处都再次分离到与接种菌株一致的病原菌.依据柯赫式法则,确定病原菌BJ19.4.1、BJ19.4.2、BJ106.4 为白及叶斑病致病菌株.

图2 白及叶斑病病原菌致病性测定Fig.2 Pathogenicity test of the isolates on Bletilla striata plants
2.3 病原菌形态学特征在PDA 平板上28 ℃培养,6 d 菌落长满直径9 cm 培养基,菌株BJ19.4.1与BJ19.4.2 的平均生长速度为0.44 cm/d,BJ106.4的平均生长速度为0.43 cm/d.菌落正面为白色,细绒毛状,菌落厚,边缘整齐,后期呈现褐色,边缘为灰白色,气生菌丝丰富,菌落背面呈现深褐色,出现同心轮纹,边缘灰白色.在OA 培养基上,菌落由白色变为灰绿色,菌丝比PDA 平板上少,菌落背面呈现灰绿色,未见同心轮纹.在MEA 培养基中,菌落由白色变为棕色,菌落背面呈现棕褐色,有明显的同心轮,边缘浅黄色(图3A~C).

图3 病原菌的形态特征Fig.3 Morphological characteristics of the pathogens
显微观测,分生孢子梗单生或簇生,直立或弯曲,分支少,具有一个或几个顶端分生孢子位点.分生孢子呈棕色或深褐色,形状有棒状、梨形、长椭球形,具有横纵隔膜.分生孢子逐渐缩小为锥形,在分隔处缢缩,大小为(19~34)μm×(3.5~12.5)μm(图3D~H).依据Woudenberg 等[16]的报告,初步鉴定菌株为链格孢属真菌.
2.4 系统发育学分析将所得的基因序列在NCBI 上进行BLAST 比对,结果表明,以ITS 序列进行比对,BJ19.4.1、BJ19.4.2 与AlternariaalternataCBS 918.96(登录号:AF347032)的相似度为99.81%(530/531),BJ106.4 与A.alternataCBS 916.96(登录号:AF347031)的相似度为99.81%(531/532).以SSU 序列进行比对,BJ19.4.1、BJ19.4.2 与A.alternataCBS 918.96(登录号:KC584567)的相似度为100%(1 020/1 020),BJ106.4 与A.alternataCBS 916.96(登录号:KC584507)的相似度为99.90%(1 019/1 020).以LSU 序列进行比对,BJ19.4.1、BJ19.4.2 与A.alternataCBS 918.96(登录号:KC584311)的相似度为100%(849/849),BJ106.4 与A.alternataCBS 916.96(登录号:DQ678082)的相似度为99.90%(1 019/1 020).以RPB2序列进行比对,BJ19.4.1、BJ19.4.2与A.alternataCBS 918.96(登录号:KC584435)的相似度分别为100%(860/860)、99.88%(862/863),BJ106.4 与A.alternataCBS 916.96(登录号:KC584375)的相似度为100%(865/865).以GAPDH序列进行比对,BJ19.4.1、BJ19.4.2 与A.alternataCBS 918.96(登录号:AY278809)的相似度为100%(580/580),BJ106.4 与A.alternataCBS 916.96(登录号:AY278808)的相似度为99.83%(579/580).以TEF1序列进行比对,BJ19.4.1、BJ19.4.2 与A.alternataCBS 918.96(登录号:KC584693)的相似度为100%(240/240),BJ106.4 与A.alternataCBS 916.96(登录号:KC584634)的相似度为100%(255/255).
依据菌株基因测序结果,参考已报道的29 株菌,通过Phylosuite 构建ML 系统发育树(图4).结果显示BJ19.4.1、BJ19.4.2、BJ106.4 与A.alternata聚为一类,自举值为98,结合形态学鉴定结果,将白及叶斑病病原菌鉴定为A.alternata.

图4 基于ITS、LSU、SSU、TEF1、RPB2、GAPDH 序列构建的ML 系统发育树Fig.4 ML phylogenetic tree based on ITS、LSU、SSU、TEF1、RPB2、GAPDH gene sequences
2.5 不同杀菌剂的室内毒力测定通过菌丝生长速率法测定了10 种杀菌剂对病原菌的抑制效果(图5、6).结果表明,在PDA 平板上,候选杀菌剂都不能完全抑制病原菌生长,但肟菌戊唑醇、苯醚甲环唑、代森锰锌抑制效果较好.在杀菌剂质量浓度为100 μg/mL 时,抑制率分别为83%、76%、85%,其中肟菌戊唑醇效果最好,EC50值为1.25 μg/mL,表明白及叶斑病病原菌对这种药剂十分敏感.病原菌对代森锰锌虽然敏感,但在低浓度时,未有明显的抑制作用.其余7 种杀菌剂抑制率低于60%,对病原菌的防治没有指导意义.综上所述,在测试的候选药剂中,肟菌戊唑醇对白及叶斑病病原的抑制效果最强.

图6 不同杀菌剂对白及叶斑病病原菌BJ19.4.1 的抑制效果曲线图Fig.6 Graph of inhibitory effect of different fungicides on the pathogenic fungi BJ19.4.1
3 讨论
Alternariaalternata属于真菌界(Fungi),子囊菌门(Ascomycota),座囊菌纲(Dothideomycetes),格孢腔菌目(Pleosporales),格孢腔菌科(Pleosporaceae),链格孢属(Alternaria),是常见的真菌之一.因链格孢属种类繁多、适应性强,广泛分布在世界各地,给全球农业生产造成重大损失.有相关研究表明,链格孢侵染植物引起病害与附着胞有关,也与其分泌的细胞壁降解酶有关[26].此外,链格孢产生的链格孢毒素也能干扰寄主的生理代谢功能,表现为叶片病斑、植株枯萎[27].链格孢引起植物病害主要与寄主类别、气候、土壤有关.近年来,有报道A.mycotoxins在田间能侵染小麦[28],A.alternata能使洋葱[29]、高粱[30]染病,A.aborescens能引起石榴果实心腐病[31],在菊科观赏植物中也发现不同类型链格孢寄生[32].本研究通过致病性实验,结合形态学与分子生物学研究,首次确定白及是A.alternata的新寄主.研究报道,镰刀菌属和茎点霉属真菌也能引起白及叶斑病,然而它们与链格孢属真菌引起的叶病斑有明显差异.前两种病原真菌前期在叶片上引起圆形或不规则的浅棕色斑点,随机散布在叶片边缘或表面,后期病斑扩大融合形成更大的病斑,最终导致叶片脱落[7-10].链格孢属真菌病斑呈现星点状,近圆形或不规则,直径一般小于10 mm,后期病斑无明显扩大趋势,密集分布整张叶片.白及链格孢属真菌叶斑病首次在南宁发现,在其他白及种植区是否有这类病害发生有待进一步研究.
化学防治是白及田间病害防控的重要措施,杀菌剂室内毒力测定实验表明,在测试的药剂中,肟菌戊唑醇对病原的抑菌效果最好,在使用质量浓度为100 μg/mL 时,在PDA 平板上抑制率高达83%,EC50为1.25 μg/mL.肟菌戊唑醇使用范围广泛,是肟菌酯和戊唑醇混合剂,通过抑制呼吸作用以及阻碍菌丝生长达到抑菌效果,预计在种植基地喷撒肟菌戊唑醇可以达到良好的防治效果.
本研究首次报道A.alternata能在中药植物白及上引起叶斑病,并对其进行了常用药剂室内筛选,为该病害的识别和防治提供理论基础.
