金属基吸附剂及其复合材料吸附除氟研究进展
2024-03-01张自恒李林波梁李斯马洪月
张自恒,李林波,梁李斯,弥 晗,马洪月
(1.西安建筑科技大学 冶金工程学院,西安 710055;2.陕西省黄金与资源重点实验室,西安 710055)
由于自然和人为活动所造成的氟污染已被世界卫生组织认为是主要环境问题之一。虽然适量的氟化物对人体有益,但摄入过量的氟化物不仅会引起氟斑牙及氟骨病,还会对人体的神经系统、心血管系统、生殖系统、肝肾等器官造成严重的危害[1-3]。水体氟化物的主要来源为化工、冶炼、玻璃、化学肥料、光伏、电池等行业[4](图1),我国严格规定工业废水中F-的含量不能超过10 mg/L。因此,如何有效的去除水中过量的氟化物成为了目前亟待解决的问题。

图1 氟化物的来源和常见的处理方法Fig.1 Sources and common treatment methods of fluoride
目前,研究者们提出并使用了多种方法来处理含氟废水,包括化学沉淀法[5]、膜处理法[6]、离子交换法[7-8]和吸附法[9]等。化学沉淀法原理、操作都比较简单,是目前工业应用最多的除氟方法,但在除氟同时会产生大量污泥且不能够深度除氟(小于1 mg/L);膜处理法去除效率高还能同时去除其他杂质,不需要加入额外的化学药品,但运行能耗高,膜容易受到污染导致堵塞;离子交换法处理效果稳定、操作灵活,但树脂的生产以及再生成本较高,且易受其它离子干扰;吸附法相比较其他方法而言,具有材料来源广泛、成本低、处理效果好、具有再利用的潜力[10-11]等优点,被认为是最有前途的氟处理方法。
一般而言,吸附技术的发展在很大程度上取决于吸附材料的发展,因为材料的结构及表面特征决定其吸附性能。近年来科学家们一直致力于开发低成本、高效率的吸附材料,如活性炭[12]、方解石[13]、无定形氧化铝[14]、活性氧化铝[15]、粘土[16]、生物质材料[17]和稀土氧化物[18]等。其中金属氧化物因具有比表面大、活性强、活性位点多等特点,受到相关研究者的广泛关注。金属氧化物能够通过表面羟基的配体交换作用与氟离子形成稳定的M-F内核配位结构,实现污水中氟离子的选择性吸附去除[19]。目前,利用单一或多种金属氧化物/氢氧化物从水中去除氟化物的合成吸附剂已被开发。本文综述了近年来国内外利用金属材料吸附除氟的研究现状及发展趋势,总结了现有金属吸附材料的吸附特性、吸附容量以及提高吸附容量的方法,以期为除氟吸附剂的发展和应用提供参考。
1 金属基吸附剂的类型
1.1 铝基吸附剂及其改性材料
活性氧化铝具有比表面积大、孔径结构丰富、吸附性能好、吸附效率高等优点,在氟化物吸附方面受到广泛关注[20]。并且大多数铝氧化物及氢氧化物的等电点都在8以上,因此在中性以及酸性条件下这些吸附剂表面都会带正电荷,更容易吸附带负电荷的氟离子[21-22]。目前,世界卫生组织将活性氧化铝确定为除氟最佳可用材料之一[23]。我国早在2005年就建成了处理规模为20 000 m3/d的活性氧化铝水厂,实际运行一年期间,出厂水氟离子平均含量为0.43 mg/L,符合生活饮用水卫生标准[24]。目前常见的吸附剂包括一元、二元和三元铝基材料。
1.1.1 单金属铝基吸附剂
一元铝基脱氟材料的制备和性能研究已比较成熟,目前主要研究工作是介孔材料的制备、性能以及吸附机制的研究。Yang等[25]利用控制变量法通过采用不同的模板、铝前驱体、煅烧温度合成了一系列介孔氧化铝样品,来比较其除氟性能,寻找合成吸附材料的最佳实验条件。研究发现,以Pluronic P123为模板,异丙醇铝为铝前驱体,在600 ℃下制备的介孔氧化铝吸附剂(MA)具有较大的比表面积和更多的表面羟基离子。吸附剂的pHzpc高达11.6,最大吸附容量达513.9 mg/g,这主要是由于高Zeta电位增强了氟离子的静电相互作用以及铝羟基和氟化物之间的配体相互作用。此外,孔结构的有序程度也对吸附性能有一定影响。Yang等[26]报告了在不同温度下高度有序介孔氧化铝(OMA)和无序介孔氧化铝(MA)的制备和除氟性能比较,根据吸附剂结构特性的物理表征得出结论,在400 ℃下煅烧OMA制得的吸附剂(OMA-400)的吸附能力优于MA,归因于其较大的比表面积和更多的羟基。与MA相比,OMA-400更大的比表面积提供了更多的表面活性位点。同时,有序互连的孔结构降低了传质阻力,使其更容易吸附氟离子。除了上述影响因素之外,不同pH处理的氧化铝在吸附性能上也表现出显著差异,与碱性氧化铝相比,酸性氧化铝具有更高的离子交换容量、带更多正电荷的表面、更高的吸附容量和更快的脱氟速度[27],但在酸性条件下处理氧化铝或用氧化铝吸附时要考虑铝溶解问题[28]。
1.1.2 双金属铝基吸附剂
活性氧化铝由于吸附速率较慢,吸附pH范围较窄,因此研究人员对其进行改性,通过掺杂或者负载其他材料制成二元材料来达到提高吸附容量、吸附速率以及pH适用范围的目的。Zr(IV)、La(III)、Ce(IV)等氧化物对氟离子具有很高的吸附性能及吸附速率,因此,常被用作铝的改性材料[29]。例如,Zhu等[30]通过沉淀结合煅烧方法制备了Al-Zr二元氧化物(Al2O3-ZrO2),合成的吸附剂结合了Al2O3和ZrO2的优点。线性Langmuir模型很好地描述了吸附等温线,最大吸附容量为114.54 mg/g,最佳吸附pH为2,这表明了吸附剂即使在酸度较高条件下,仍然具有不俗的吸附性能。同样地,Cheng等[31]采用浸渍法制备了La(OH)3改性的氧化铝吸附剂(La-Al2O3)用于饮用水除氟,并深入研究了其除氟性能。结果显示改性后材料的等电点提高了0.63 mV,说明在相同pH的条件下,改性后的材料对F-的亲和力更强。同时吸附动力学实验表明在相同条件下Al2O3达到平衡需要6 h,而La-Al2O3只需要1 h。吸附等温线实验表明改性后理论吸附容量提升了2.5倍,吸附柱过滤实验结果表明,在实际动态吸附过程中,La-Al2O3处理的水量是Al2O3的1.7倍,说明改性大大提升了F-的吸附速率和吸附容量。
1.1.3 三金属铝基吸附剂
三元铝基复合材料主要是一些叠层纳米复合材料或层状双金属氢氧化物。通过掺杂不同金属在吸附氟离子时发挥复合协同作用,完成对氟离子的高效去除。Jiang等[32]通过共沉淀法成功合成了叠层Y-Zr-Al纳米复合材料并应用于水中氟离子的去除,结果表明,该复合材料具有优异的吸附性能,尤其是在低F-浓度条件下,去除效率可以达到97.91%,处理后F-含量为0.209 mg/L,可以达到饮用水要求。并且抗干扰能力极强,表现出了对F-的高选择性,其除氟机制分析如图2所示,主要有介孔扩散、离子交换以及静电吸附。

图2 Y-Zr-Al纳米复合材料的除氟机理[32]Fig.2 Defluorination mechanism of Y-Zr-Al nanocomposite[32]
1.2 铁基吸附剂及其改性材料
在众多金属材料中,铁在地壳中的丰度仅次于铝,具有来源广泛,易于获取,价格低廉等优点[33],在元素周期表中属于过渡金属。据相关文献报道,与碱金属和碱土金属相比,过渡金属对氟化物的吸附作用更强,因为它们具有更高的价态和更多的氟离子作用位点[34]。此外,铁不具有生物毒性,因此,也是最受关注的除氟吸附剂之一。
1.2.1 单金属铁基吸附剂
单金属铁基吸附材料包括铁(氢)氧化物和纳米铁。龙伟等[35]通过剪切强化法制备高比表面积针铁矿去除硫酸锌电解液中的氟离子,来探究制备方法对吸附效率的影响。与传统搅拌方法相比,剪切强化法制得的吸附剂结晶核心数量更多,得到的晶粒更细小且分散更加均匀。正因于此,剪切强化法制得的吸附剂比表面积远远高于传统制备方法,吸附容量更是传统搅拌方法的两倍。除了制备方法对吸附效率有影响以外,制备过程中分散剂的使用也大大影响脱氟效率。Zhang等[36]以氧化铁为原料,用共沉淀法制备了一种新型吸附剂用于饮用水除氟,并研究了乙醇处理对吸附剂的影响,吸附结果如图3所示。

图3 氧化铁吸附剂的SEM图:(a)乙醇处理;(b)未乙醇处理[36]Fig.3 SEM images of iron oxide adsorbent : ( a ) ethanol treatment ; ( b ) non-ethanol treatment [36]
由图3可知,与非乙醇处理的氧化铁吸附剂相比,乙醇处理的氧化铁具有更大的比表面积和多孔结构,从而产生更多的吸附活性位点,Langmuir的最大吸附容量可达62.8 mg/g。在吸附机制的研究过程中发现,在较高氟离子浓度条件下,吸附剂会释放出更多的羟基来与氟离子进行离子交换,从而提高了吸附剂的吸附能力。Ali等[37]采用绿色技术开发了纳米铁吸附剂,结果表明,该吸附剂对氟的去除具有选择性。在最佳吸附条件时,可将水中的氟化物从4 mg/L降低至0.4 mg/L,氟离子去除率可达90%。此外,所开发的吸附剂用于从天然地下水中去除氟,氟离子去除率在90%到100%之间,远远高于普通铁基吸附剂的脱氟效率,可以考虑用于饮用水中除氟。
1.2.2 铁基复合材料吸附剂
由于铁吸附性能较好且具有磁性,易于回收处理,因此也常被用来掺杂其他材料制作磁性复合材料[38]。Zhao等[39]报告了一种新型磁性纳米复合吸附剂(Fe3O4@Al(OH)3),通过将磁性Fe3O4纳米离子与氢氧化铝结合以去除氟化物。在真实水样条件下,该吸附剂可将水中F-质量浓度从20 mg/L降低到0.7 mg/L,符合世界卫生组织(WHO)饮用水水质标准。该方法分离效果好,在外加磁场作用下,样品溶液易于分离。初步探讨Fe3O4@Al(OH)3的吸附机制是静电吸引和表面络合。Wu等[40]利用共沉淀法将等电点较高的Al2O3掺杂进Ce-Fe双金属氧化物中,在未加入氧化铝之前,对氟的最佳去除pH值为3,且随着pH增高,吸附容量显著下降;掺杂氧化铝后最佳吸附pH值区间为6.0~6.5,且在较宽的pH范围内(5.5~7.0)都表现出了相当高的吸附容量,吸附剂的等电点由5.8提升到7.5。吸附等温线拟合结果符合Langmuir模型,理论最大吸附容量高达229 mg/g。共存离子实验结果表明吸附过程不受氯离子及硫酸根离子的干扰,轻微受磷酸盐及砷酸盐影响,表现出了对F-的高度选择性。
1.3 稀土类吸附剂
稀土金属具有较大的离子半径,稀土类金属氧化物对羟基氧的极化作用较小,表面羟基易于解离,具有独特的亲氟性,可有效去除水体中过量的氟,成为除氟吸附剂的研究热点。常见的稀土类吸附剂包括镧基吸附剂和铈基吸附剂。
1.3.1 镧基吸附剂
王莉莉等[41]研究了不同粒径对水合氧化镧吸附速率以及吸附容量的影响,并与活性氧化铝的吸附性能进行对比。结果发现随着粒径的减小,La2O3·nH2O吸附容量及吸附速率均会提高。当粒径为0.038~0.050 mm,初始氟离子质量浓度为5 mg/L,pH值为6.5时,吸附效果最好。吸附等温线符合Langmuir模型,理论最大吸附容量高达273.36 mg/g,且只要粒径在0.074 mm以下,以1 mg/L氟离子质量浓度为吸附终点,在5 min内就可达到吸附平衡。在同等条件下,吸附容量最高可为活性氧化铝的13.88倍。霍亚坤等[42]利用海藻酸钠和LaCl3制备出来了一种球形海藻酸镧颗粒(LAB)。对其进行吸附实验研究发现,在pH=4的条件下吸附效果最好,吸附等温线符合Langmuir模型,理论最大吸附容量可达197.2 mg/g。通过对吸附前后吸附剂及溶液组分进行分析得出,吸附机制主要是吸附剂的Cl-和OH-与F-发生离子交换,因此,在碱性条件下由于OH-浓度升高会影响吸附反应的进行
1.3.2 铈基吸附剂
由于Ce(IV)体积小且具有高正电荷,因此与氟化物有很强的结合能力,但Ce的成本较高,因此经常通过掺杂一些其它材料来降低成本。Mukhopadhyay等[43]制备出了一种掺杂铈的水合铁氧化物(CIHFO)吸附材料,在研究元素掺杂比例时,发现当铁与铈摩尔比为2∶1时,吸附效果最好,尽管仍然低于纯铈材料,但从经济成本角度考虑是更可行的。CIHFO的pHzpc为5.2,这意味着当在酸性条件下,吸附剂会拥有更好的吸附性能,吸附等温线符合Freundlich模型,表明这种混合金属氧化物的吸附位点是不均匀的。在初始氟离子质量浓度为15 mg/L,pH=7的条件下,吸附容量可达24.8 mg/g。将其用于地下水除氟时,可以将地下水中F-质量浓度从9.05 mg/L降低到1 mg/L以下,符合饮用水水质要求。纳米氧化铈(NCO)具有优异的抗酸碱溶出性能,并且对氟离子具有高度选择性,在除氟领域有广阔的前景,但由于粒径太小导致易团聚从而限制了其应用范围。唐欢等[44]通过将NCO负载到大孔聚合物阴离子交换树脂D21上制备出了纳米复合吸附剂NCO@201,可对酸性废水进行深度除氟。在氟离子初始质量浓度为10 mg/L,pH为3的条件下,实验吸附性能为17.67 mg/g,并且表现出了对F-的高度选择性以及抗酸溶出性能,在pH=2时只有少量溶出(0.53%)。
1.4 金属有机骨架材料
金属有机骨架材料(MOFs)是由金属中心与有机配体通过相互连接形成的一类具有周期性网络结构的晶态多孔材料,具有比表面积大、孔隙率可调、吸附容量大及可功能修饰等特点。能与多种金属配位形成各种形状,在吸附领域具有极大的应用前景。但大部分MOFs材料的稳定性较差,水溶液会破坏晶体结构,所以一些研究者通过控制合成过程或者添加一些物质来增强其稳定性。据文献报道[45],在吸附剂中加入Ce可以提高吸附容量和吸附速率。武鑫霞等[46]通过“一锅法”合成了一种Ce/MOF-5材料,成功的将Ce负载到MOF表面,提高了吸附剂表面所带正电荷数目。吸附过程符合准二阶动力学模型以及Freundlich模型,理论最大吸附容量为110 mg/g,当反应平衡质量浓度为1 mg/L时,吸附容量为16.75 mg/g,吸附机制主要为表面羟基与氟离子发生离子交换。La与Ce同属镧系元素,化学性质相近,因此用La负载MOFs也可以强化对氟离子的吸附过程。比如赵瑨云等[47]采用水热合成法将La(III)负载到MOFs上制成了一种毛线团状球形结构材料。等温线拟合符合Freundlich模型,最大吸附容量为43.1 mg/g。但通过对吸附前后材料表面进行分析发现在吸附氟离子后,材料表面生成了氟化镧晶体,破坏了原有的结构,而这会导致再生困难及氟污染物难以分离回收等问题。
针对MOFs材料再生困难及氟污染物难以回收等问题,Xie等[48]制备了锆基金属有机框架/泡沫碳复合材料(UiO-66(Zr)/CF),实现了吸附剂的循环利用以及氟离子的分离回收。合成过程见图4,其中UiO-66(Zr)颗粒可以较好地锚定在三维多孔结构的泡沫碳上,有助于氟污染物的高效去除。由于该材料能暴露大量的活性位点,分级孔径结构便于有效的传质,使得UiO-66(Zr)/CF复合材料具有较高的除氟效率和速率,饱和吸附容量高达295 mg/g。而且,该材料经过4次循环实验后,依然保持较高的氟去除率(70%),并具有易分离、较好的水稳定性等优点。在进行吸附柱动态除氟实验中,0.36 g的吸附剂在突破点出现前可以连续处理初始质量浓度为6.2 mg/L的含氟溶液400 mL,表现出了在实际除氟运用中的可行性。Mohamadreza等[49]采用中心复合设计对制得的UiO-66进行最佳吸附条件的优化,发现pH是影响该材料除氟效果的最大因素。Li等[50]以偏苯三甲酸和硫酸亚铁为原料,在室温下合成了一种铁基有机骨架(R-MIL-100(Fe))材料,与传统的水热合成法相比,不仅降低了制备成本,制备的材料还具有更小的晶体尺寸。图5为R-MIL-100(Fe)材料的除氟机理,吸附等温线符合Langmuir模型,这归因于材料本身表面活性中心的均匀分布,最大吸附容量为25.53 mg/g,且材料对于pH的适用范围极广,在4~10范围内都表现出优异的吸附性能,而在此范围内的氧化铝吸附剂,吸附容量均小于其本身最大吸附容量的一半[51]。
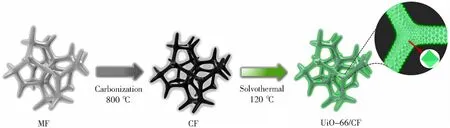
图4 UiO-66/CF合成示意图[48]Fig.4 Schematic illustration of the fabrication process of the UiO-66/CF hybrid[48]

图5 R-MIL-100(Fe)的除氟机理[50]Fig.5 Mechanism of fluoride removal by R-MIL-100(Fe) [50]
1.5 其他金属基材料

综上所述,活性氧化铝具有大的比表面积以及优异的孔结构,但吸附速率较慢以及适用范围窄,可以用Zr或者稀土金属等对其进行改性,来提高吸附动力学性能及适用范围,获得更好的除氟效果。铁基材料近年来改性集中在纳米材料或与其他材料复合协同去除水中氟离子,具有价格便宜、吸附性能好、易于回收等优点。稀土金属吸附剂吸附效果好且对氟离子的选择性高,但价格昂贵,可以与其他金属掺杂,在保证吸附容量的同时降低成本。金属有机骨架一般具有较大的比表面积和可调节的孔径结构,这样可以提供大量的活性位点,有利于氟离子的吸附,但在吸附过程中容易受pH影响,经改性后具有良好的稳定性以及较高的除氟效率。目前,金属基吸附材料的研究主要集中在复合材料方面,不同金属互相掺杂可以利用各自的优点来提高除氟性能,但复合材料的除氟机理往往比较复杂,大多数金属材料的除氟机制一般为静电吸附、离子交换、氢键作用以及可能存在的介孔扩散和络合作用[62-63]。本文统计了一些金属基吸附剂在一定条件下的最大吸附容量,见表1,由表1可以看出,吸附法拥有较广的适用范围,无论是在酸性还是中性环境下,都有不错的去除效果。表2比较了几种金属基吸附剂的优缺点,对比分析可以发现,改性铝基及铁基材料具有吸附效果好、价格相对便宜、来源广泛、合成简单和可以再生利用等优点,更具有工业应用前景。
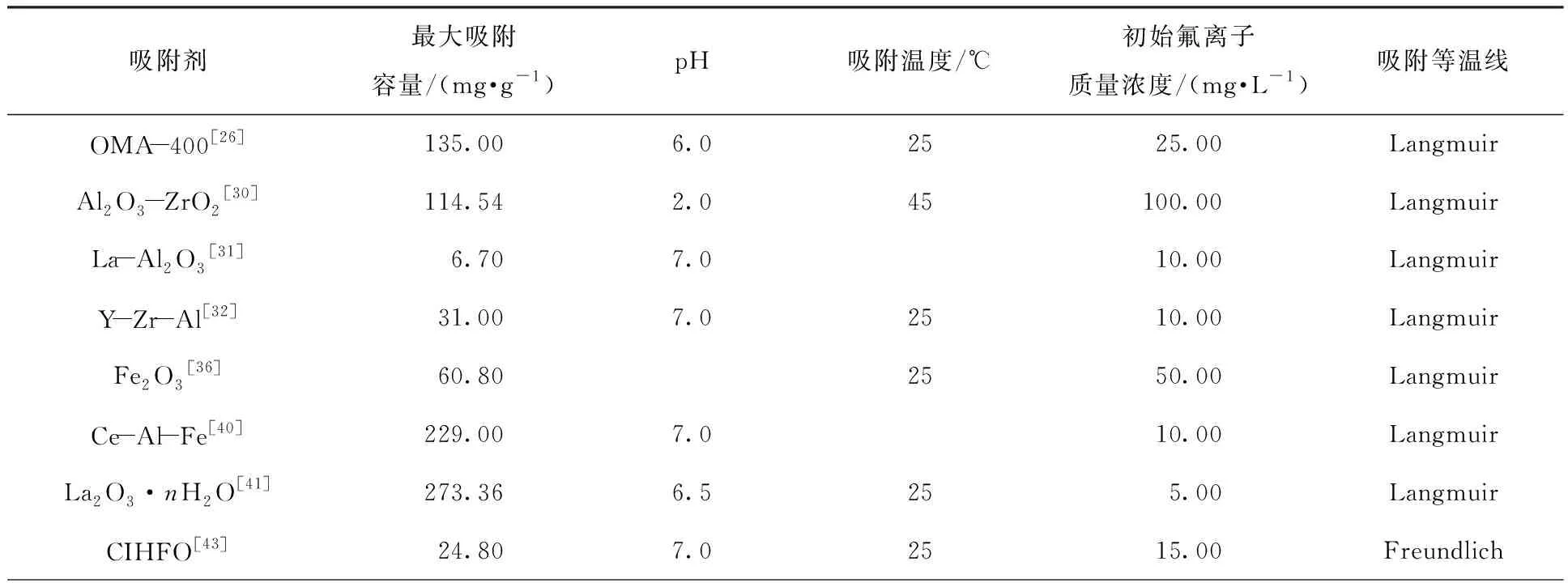
表1 一些金属基吸附剂的除氟性能Table 1 Fluoride removal performance of some metal-based adsorbents

表2 不同金属基吸附剂的优缺点Table 2 Advantages and disadvantages of different metal-based adsorbents
2 提高吸附容量的方法
吸附容量是衡量吸附剂吸附性能的重要指标之一,因此如何提高吸附容量成为了研究者们亟待解决的问题。根据目前的研究结果,可将提高吸附容量的方法归纳为以下4类[67]。
2.1 晶型的控制
在实验过程中,研究人员发现同一材料不同的晶型对于吸附效率也有很大的影响。以活性氧化铝为例,在吸附过程中发现,γ相的氧化铝对F-的吸附效率远高于α和β相的同种材料[68]。同时,Guan等[69]通过DFT计算研究了α、γ、θ相的氧化铝对水中氟离子的吸附能,结果表明,F-在氧化铝表面的吸附顺序为θ-Al2O3>γ-Al2O3>α-Al2O3,但由于氧化铝表面是亲水的,当暴露在大气中时,会被水分子部分羟基化[70],这会降低F-在氧化铝表面的吸附稳定性,这点在θ-Al2O3上的表现最为明显。Markeb等[64]制备出一种Ce-Ti@Fe3O4纳米复合材料,图6为该材料的改性以及用于饮用水除氟的示意图。与Ce-Ti氧化物吸附材料相比,在引入Fe3O4后,尽管颗粒尺寸从1~2 nm增加到了10~15 nm,比表面积减少,但吸附容量由44.37 mg/g增加到91.04 mg/g。这是因为在加入Fe3O4后,吸附剂由原来的非晶态转变为多聚纳米晶型材料,发达的晶面提高了吸附剂的吸附容量以及吸附速率。

图6 Ce-Ti@Fe3O4纳米复合材料的改性以及用于饮用水除氟示意图[64]Fig.6 Modification of Ce-Ti @ Fe3O4 nanocomposites and fluoride removal for drinking water[64]
2.2 表面形态及结构控制
吸附剂的表面形态及结构在吸附过程中起着至关重要的作用,可以直接决定吸附剂的脱氟速率和效率。一般来说,吸附效果良好的吸附剂都拥有大的比表面积以及优异的孔结构,包括分级多孔结构及空心微球结构,因为它们可以产生较多的活性位点,增强吸附剂的吸附能力。此外,孔结构的有序程度也会对吸附性能产生影响,有序互连的孔结构可以在吸附时降低传质阻力,提高吸附性能。因此,表面形态及结构控制是提高吸附剂吸附性能的关键因素。
羟基磷灰石由于其成本低廉且易于获得成为常用的吸附材料,Poinern等[71]将超声波和微波工艺结合起来,制备出羟基磷灰石纳米颗粒,通过改变调节颗粒成核和生长的实验条件,可以控制颗粒的大小和形态。Gao等[72]的研究结果表明,羟基磷灰石的脱氟性能依赖于其尺寸,粒径越小,脱氟效果越好。这是因为随着粒径的减小,比表面积逐渐增大,并且在低pH值条件下除氟效率更高。但除了比表面积之外,其它因素在吸附过程中也有很大的影响,Sergey等[73]在对Al2O3改性过程中发现,虽然改性后Al2O3的比表面积减小但是吸附性能反而增加了,这是因为改性后平均孔径减小了,这种改变抵消了比表面积减小带来的不良影响,并提高了脱氟效率。
2.3 官能团修饰
随着研究的不断深入,研究者们发现氨基[74]、羟基[75]、氯离子、碳酸盐[76]等阴离子官能团可有效地与氟离子进行配体交换,同时,当环境的pH值小于材料的等电点时,这些基团也可能被质子化从而带上正电荷,如质子化羟基、氨基等,可以依靠静电引力或氢键作用来吸附氟离子。因此,利用这些官能团对吸附剂进行改性也是一种提高吸附容量的有效途径。Thakre等[77]采用将膨润土加入到氯化镁溶液中搅拌并煅烧的方法制备出了一种新型吸附剂除氟,在初始F-质量浓度为5 g/L条件下,吸附容量为2.66 mg/g,吸附效率可达95.47%。吸附机制主要是氧化镁在水溶液中生成了Mg(OH)2,Mg(OH)2中的羟基官能团进一步与溶液中的F-发生离子交换反应生成MgF2,XRD谱图以及吸附后溶液pH略微升高都可以进一步证实这一结果。Lin等[65]合成了含有氨基集团的金属有机框架(UiO-66-NH2)与常规材料(UiO-66)进行对比,探究官能团对MOFs吸附效果的影响,改性及除氟过程如图7所示。结果发现,UiO-66-NH2的平衡吸附容量可达55.7 mg/g,与UiO-66相比提高了10.78 mg/g。分析吸附机制发现,在吸附过程中,氨基通过静电作用进一步加强了对氟化物的吸附。
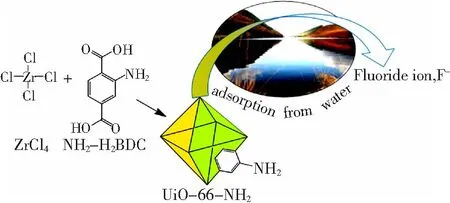
图7 UiO-66-NH2的改性以及除氟示意图[65]Fig.7 Modification of UiO-66-NH2 and fluoride removal[65]
2.4 复合材料的协同作用
随着吸附材料的不断发展,越来越多的研究者开始利用复合材料如二元及多元金属氧化物、掺杂稀土金属的金属有机骨架材料、金属纳米复合材料等来去除水中的氟化物。这些材料在吸附过程中表现出了优异的吸附性能。
Chen等[66]通过氨水滴定共沉淀法合成了一种Fe-Ti双金属氧化物吸附剂用于饮用水除氟,通过对Fe/Ti摩尔比、煅烧温度、洗涤及干燥方法进行调控获得最佳制备条件,最大吸附容量可达47.0 mg/g。为了证实Fe-Ti存在复合协同作用,他又在相同条件下制备了摩尔比1∶1的Fe-Ti复合材料、纯氧化铁、纯氧化钛以及铁钛的物理混合物进行对比,结果仍然是Fe-Ti复合材料的吸附容量远远高于其它几种材料。这是因为在材料合成过程中,抑制了Fe的成核过程,形成了一种纳米球状结构,增大了材料的比表面积。表面羟基以及Fe—O—Ti键为吸附提供了吸附位点。巩勤学等[78]采用废旧锂离子电池回收过程中,去除硫酸浸出液铁铝时所产生的含Fe、Al、Ca的副产物作为复合除氟剂来去除氟离子,在初始氟离子质量浓度为2.94 g/L,吸附剂用量为20 g/L条件下,30 min就能达到吸附平衡,除氟效率可以达到98%,吸附容量为144 mg/g。SEM结果显示,除氟剂主要是由柱状分层的硫酸钙和无定形态的铁铝水解产物组成,这种结构使得其表面积大大提高,提升了除氟能力。
晶型的改变包括非晶态物质与晶态物质之间以及同一物质不同晶型之间的转变,但值得注意的是晶型的转变往往伴随着其它条件(如比表面积)的改变,因此在实际应用中要考虑综合因素对于吸附性能的影响。吸附剂的表面形态和孔隙结构是影响吸附性能的重要因素,在目前的研究中发现,反应物料的种类、比例、反应温度以及合成方法等都会对表面形态和孔隙结构造成重大影响,因此对于研究者们而言,需要通过多次实验改变以上因素才能获得满意的结构或比表面积。在材料表面负载官能团可以通过静电吸附、配体交换和氢键等作用来增强对氟离子的吸附,同时也可以提高对吸附质的选择性。复合协同作用是通过利用某些金属不同特性的复合作用来提高材料的吸附性能,但并不是任意几种金属的加入都可以提高吸附剂的性能,而是根据吸附质的性质决定的。根据吸附质的种类选择合适的材料,再通过合适的改性方法来提高吸附剂的吸附性能将会是以后研究重点。
3 结 语
水体中氟离子的污染严重危害生态环境和人体健康,吸附法作为一种操作简单、经济、处理效果稳定的方法被广泛用于水体除氟,而吸附法的除氟性能与吸附剂的特性密切相关。本文综述了几种不同类型的吸附材料在除氟过程的表现,氧化铝在未改性前存在吸附速率慢、适用范围窄等问题,掺杂稀土金属后其吸附动力学性能显著提高。铁基材料的成本较低,对氟离子的吸附作用稍弱,经改性后其吸附量大大提高,且可与其它金属掺杂制成磁性复合材料。稀土金属对氟离子选择性强、吸附容量大、但成本较高,可以与其它金属掺杂使用来降低成本。金属有机骨架材料比表面积大、多孔且孔径结构可调,缺点在于稳定性不强,掺杂La、Ce等金属可以显著提高其稳定性及吸附容量。在脱氟过程中可以根据实际水质情况选用合适的吸附剂来去除氟离子,起到事半功倍的效果。吸附法也可以与其他工艺联用,如过滤[79]、混凝沉淀法[80]等来减少吸附过程的干扰,同时,延长吸附剂的使用寿命。
尽管金属基吸附剂取得了较为满意的除氟效果,但目前仍存在诸多问题:1)对于上述所提到的大多数吸附剂的制备和使用还停留在实验室阶段,并未对其制备的难易程度及成本进行工业化考量,并且所做的吸附实验大都为静态吸附,而工业吸附法大多为填充吸附柱进行动态除氟;2)在使用金属吸附剂时,某些金属离子(如Al3+)的析出会对人体造成危害,因此研究吸附剂的溶解限度以及毒理性有重大意义;3)当前的吸附实验大多是用模拟溶液完成,在真实溶液中的除氟效果可能会受pH、共存离子等因素的干扰而下降,还要进一步提升材料的稳定性以及选择性,此外,对于复合吸附剂不同金属协同除氟机理研究不够深入;4)目前所使用的吸附剂为了增大比表面积多以粉末态的形式存在,这类材料在使用过程中还要考虑团聚作用以及后续回收的问题,因此,还要对其结构特征进行改进及优化;5)大多数吸附剂的再生性能不好,并且再生过程还都要用到一些化学药剂,如氢氧化钠等,这无疑会增加成本,同时再生药剂的处理也是一个大的问题。因此,在未来还需要加强对吸附除氟机制的研究,探索绿色、经济的制备方法,简化回收、再生流程,为除氟工业化奠定基础。
