基于普鲁士蓝纳米粒子的免疫层析法检测小麦中的呕吐毒素
2024-03-01章铜沈央红张雯朱军莉陆海霞刘兴泉
章铜,沈央红,张雯,朱军莉*,陆海霞*,刘兴泉
1(浙江工商大学 食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州,310018) 2(浙江农林大学 食品与健康学院,浙江 杭州,311300)
呕吐毒素(deoxynivalenol,DON),即脱氧雪腐镰刀菌烯醇,主要污染小麦、大麦、玉米等谷类作物,人和动物误食被该毒素污染的粮谷类后会产生各种急慢性中毒反应[1]。近年来发现呕吐毒素可能与人类食管癌和肾病有关,已被国际癌症研究机构列为第三类致癌物[2],引起了各国的普遍重视,世界上超过37个国家和组织制定了谷物中DON的限量标准,我国GB 2761—2017《食品安全国家标准 食品中真菌霉素限量》规定谷物及其制品(玉米、小麦、小麦制品)中呕吐毒素含量不超过1 000 μg/kg[3]。尽管已有高灵敏度检测DON的方法,如高效液相色谱法[4]和气相色谱法[5],但是这些方法存在仪器昂贵、操作繁琐、耗时长且要求专业人员操作等限制,因此开发一种高灵敏度、低成本的DON快速、现场检测方法具有重大意义。
侧向流免疫检测法(lateral flow immunoassay,LFIA)又称免疫层析检测法(immunochromatographic assay,ICA)[6],具有成本低、检测快、分析过程简便等独特优势,已作为一种有效的现场分析方法广泛应用于不同领域。LFIA的灵敏度受到多方面的影响,其中抗体标记量以及信号标签的影响最为显著[7-10]。因此,抗体标记量优化后提高检测性能最有效的方法是寻找理想的标记材料,不仅可以用较少数量的标记抗体显示出强信号,同时也不需要复杂的合成过程。
普鲁士蓝纳米粒子(Prussian blue nanoparticles,PBNPs),通式为Fe4[Fe(CN)6]3nH2O,由于其尺寸可控、环境友好、成本低和易于合成等特性而日益受到关注[11-12]。其具有优异的物理化学功能,用于电化学免疫传感器[13]和催化比色检测[14]等食品分析方法中。并且,PBNPs具有独特的立方体结构,尺寸从几纳米到几百纳米不等,由于大尺寸PBNPs的参与,即使只有少数抗体分子被标记在每个PBNP上,在LFIA中也会看到明显的色带,成为硝酸纤维素膜(nitrocellulose filter membrane,NC)上的明亮信号标记物。ZHAO等[15]将PBNPs作为信号标签应用于免疫层析试纸条中检测盐酸克伦特罗,发现比胶体金所需要的抗体标记量更少,灵敏度更高。LU等[16]在磁性纳米颗粒上原位生成PBNPs结合纳米酶联免疫吸附试验检测黄曲霉毒素B1,实现超灵敏荧光检测,比光热分析和比色分析的灵敏度分别提高6 333倍和28倍。聚多巴胺(polydopamine,PDA)是一种新兴的仿生黏附聚合物,具有制备工艺简单、生物相容性好、黏附性强、易功能化等特性而受到广泛关注。利用PDA结构中的类儿茶酚胺基团,PDA可以很容易地通过静电相互作用或共价键附着在纳米粒子表面,常被用于表面修饰。YE等[17]和XU等[18]用PDA包裹AuNPs形成AuNP@PDA,均提高了对检测物的灵敏度。
目前谷物和饲料中呕吐毒素等真菌毒素污染仍较严重,有效控制DON危害的前提是能快速、准确地检测该毒素。鉴于此,本研究通过合成PBNPs和聚多巴胺包裹普鲁士蓝纳米粒子(polydopamine coated Prussian blue nanoparticles,PB@PDA),并以其作为信号标签建立了一种信号放大的免疫层析模型,优化和比较2种标记物的检测结果,评价了PBNPs和PB@PDA标记的LFIA对小麦样品中呕吐毒素的快速检测性能。
1 材料与方法
1.1 试剂
聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP K30,优级纯)、铁氰化钾[K3Fe(CN)6,纯度99.0%]、盐酸多巴胺(dopamine hydrochloride,纯度98.0%),上海麦克林生化有限公司;牛血清白蛋白(bovine serum albumin,BSA,优级纯)、吐温20(Tween-20,纯度99.0%),上海国药集团化学试剂有限公司;DON-BSA抗原、DON单克隆抗体(DON-mAb)、羊抗鼠IgG,北京厚生正德科技有限公司;黄曲霉毒素M1(aflatoxin M1,AFM1)、黄曲霉毒素B1(aflatoxin B1,AFB1)、DON、玉米赤霉烯酮(zearalenone,ZEN)、赭曲霉毒素(ochratoxinA,OTA)、T-2标准品,青岛普瑞邦生物工程有限公司;呕吐毒素胶体金试纸条,深圳芬德生物技术有限公司。本实验所用试剂未经说明者均为优级纯,所用水均为超纯水。
1.2 仪器与设备
TGL-15B高速冷冻离心机,上海安亭科学仪器公司;Mastersizer 3000激光粒度仪,英国马尔文仪器有限公司;KQ3200超声波清洗机,昆山市超声仪器有限公司;RO-MB-T台式超纯水器,杭州永杰达净化科技有限公司;HGS510台式划膜喷金标机,杭州峰航科技有限公司;ZNCL-GS磁力搅拌器,河南爱博特科技发展有限公司。
1.3 实验方法
1.3.1 PBNPs和PB@PDA的制备
PBNPs合成方法参考文献[15],在磁力搅拌下将PVP K30 (6 g)和K3[Fe(CN)6] (264 mg)加到80 mL HCl溶液(0.01 mol/L)中。搅拌溶解后,将混合物放入80 ℃真空干燥箱中加热20 h。室温冷却后离心收集沉淀物,并用乙醇和超纯水洗涤数次。最后在60 ℃烘箱中干燥24 h后获得PBNPs,4 ℃保存备用。
参照文献[19]方法合成PB@PDA,取10 mL (1 mg/mL)普鲁士蓝溶液添加到含有1 mg/mL的盐酸多巴胺(pH 8.5)的Tris溶液中,超声反应20 min,边搅拌边用碳酸钾调节pH,反应6 h后所得溶液在10 000 r/min离心25 min,沉淀物重悬在2 mL超纯水中,所得溶液即为PB@PDA溶液。
1.3.2 PB-mAb和PB@PDA-mAb的制备
两者都是采用经典的静电吸附方法将呕吐毒素单克隆抗体连接在颗粒表面。以PB@PDA为例:取1 mL制备的PB@PDA置于蒸馏水中,超声并涡旋后加入DON的抗体溶液,涡旋混合;在室温下孵育1 h后,加入200 μL BSA(0.1 g/mL)溶液并再反应1 h以封闭颗粒表面多余的结合位点;将该混合物置于10 000 r/min离心25 min以除去未结合的抗体和 BSA,重复一次后,将PB@PDA-mAb 探针沉淀物重悬在100 μL PBS中,在 4 ℃冰箱中保存备用。
1.3.3 表征方法
为观察PBNPs和PB@PDA形貌特征,采用透射电子显微镜(transmission electron microscope,TEM)进行观察。通过X射线衍射(X-ray diffraction,XRD)表征来获得PBNPs和PB@PDA的相对纯度,结果与标准卡片进行比较。为验证抗体是否成功结合到材料上,通过Zeta电位分析仪和紫外扫描光谱进行表征,来观察材料和探针之间的电势和吸收峰是否有变化。
1.3.4 免疫层析试纸条的组装及封闭液的选择
试纸条由吸收垫、NC膜、结合垫和样品垫四部分组成(图1-a)。将质量浓度总共1 mg/mL的DON Ag (DON-BSA生物缀合物)和0.5 mg/mL的山羊抗小鼠IgG沉积在NC膜上,分别以0.8 μL/cm的分配速率形成T线和C线(约4 mm距离)。然后,将处理过的膜在室温下干燥2 h。样品结合垫浸泡在封闭缓冲液(含2%(体积分数)BSA的0.01 mol/L PBS)中,37 ℃干燥过夜后,吸收垫按原样使用。将样品垫、NC膜、吸水垫依次搭粘到衬板上进行组装。最后,用切条机切成3 mm宽的试纸条,并贮存在干燥器中备用。

a-聚多巴胺包裹普鲁士蓝形成原理;b-免疫层析试纸条的检测原理图1 基于PB@PDA免疫层析试纸条竞争检测DON
以DON-BSA偶联物和PBNPs探针分别作为捕获试剂和检测试剂。样品垫用不同的封闭缓冲液处理,37 ℃干燥过夜后,组装试纸条。将试纸条插入到含有等量PBNPs探针的100 μL PBS 溶液中,15 min 后观察显色结果,确定最优封闭液组成。
1.3.5 待测和加标样品的制备
DON标准溶液用0.01 mol/L PBS (pH 7.4)缓冲液中稀释至一系列不同浓度。将100 μL指定浓度的DON标准溶液与2 μL PB-mAb和2 μL PB@PDA-mAb探针滴加到试纸条上用于检测。同时,选择PBS (pH 7.4)作为空白对照。反应15 min后观察T线和C线测试结果(图1-b)。当存在较高浓度的DON 时,形成 PB@PDA-mAb-DON,T 线无色,C 线有色;在没有DON的情况下,T线和C线都显色。DON的浓度可用Image J判断,T 线的颜色强度随着DON的浓度升高而减弱。
为验证试纸条实用性,购买了市售小麦样本,所选小麦样本均为DON阴性。称取5.0 g碾碎的小麦样品,向其中加入 DON 标准品分别获得 0.25~100 ng/g和0.1~100 ng/g的最终浓度,根据文献[20]进行预处理,具体步骤如下:取上述加标样品1 g置于10 mL离心管中,用3 mL 60%(体积分数)的甲醇水溶液进行提取。然后将混合物振荡混匀5 min,于8 000 r/min离心10 min。收集上清液用0.01 mol/L PBS稀释5倍后,用制备的试纸条进行样品分析,重复3遍,结果与市场上现有的胶体金试纸条相比较。
1.4 数据处理
每组样品均设置3个平行,采用 Adobe Illustrator作图并分析,通过 SPSS Statistics 26进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 表征结果
用TEM观察合成的PBNPs和PB@PDA形貌(图2),如图2-a和图2-e所示,PBNPs和PB@PDA粒径均一,PBNPs的平均粒径在100 nm左右,而PB@PDA的平均粒径稳定在130 nm左右,且分散性良好。如图2-b和图2-f所示,对比普鲁士蓝标准卡片(JCPDS No.73—0687)可以看出2种纳米材料的 XRD 吸收峰位置和强度与标准卡片一致,可以得出纳米材料为纯度较高的普鲁士蓝纳米颗粒,而聚多巴胺包裹的普鲁士蓝纳米粒子虽然吸收峰与普鲁士蓝一致,其吸收峰强度明显比普鲁士蓝高,与其包裹一层多巴胺有关。进一步比较2种离子PBNPs、PB@PDA以及连接抗体PB-mAb、PB@PDA-mAb后的 Zeta电位(图2-c和图2-g),PBNPs溶液的电位值为-24.9 mV,而连接抗体后的电位值为-19.8 mV,表明添加带有正电的呕吐毒素单克隆抗体后,抗体与带有负电荷的 PBNPs发生静电吸附,使其电位值发生变化,提示抗体与PBNPs成功结合, PB@PDA表现相似的现象。如图2-d和图2-h所示,PBNPs和PB-mAb在400~800 nm波长的紫外扫描光谱中均出现了强烈吸收峰,在标记完抗体后都发生了吸收峰的偏移,而PB@PDA和PB@PDA-mAb紫外峰完全不一样,这可能是因为包裹在普鲁士蓝表面的聚多巴胺外壳改变了吸收波长和吸光强度导致的。
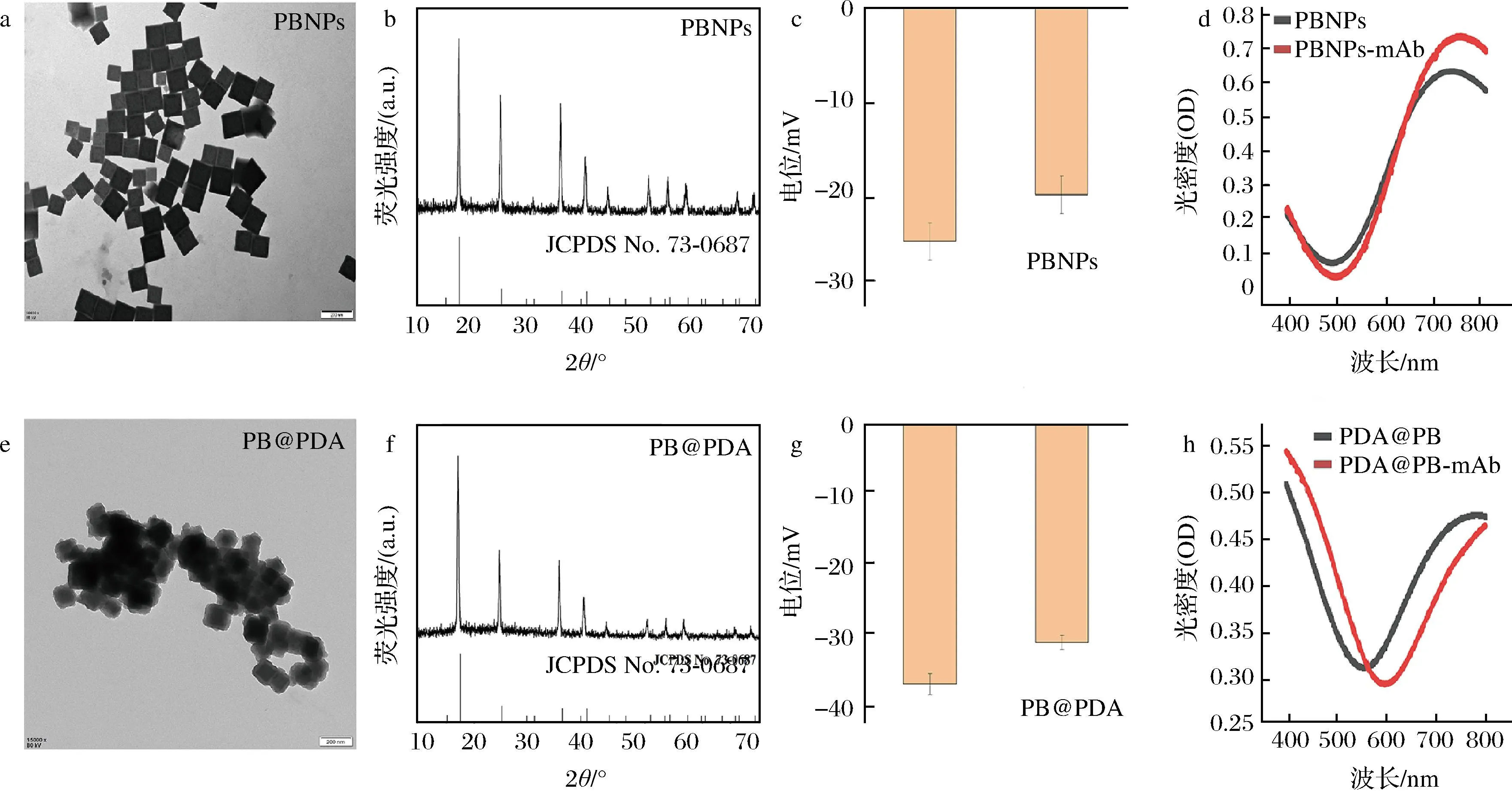
a-PBNPs TEM表征图;b-PBNPS的XRD图;c-PBNPs Zeta电位;d-PBNPs紫外扫描光谱;e-PB@PDA TEM电镜图;f-PB@PDA的XRD图;g-PB@PDA Zeta电位;h-PB@PDA紫外扫描光谱图2 PBNPs和PB@PDA的表征图
2.2 样品垫封闭液组成的优化
用5种不同的封闭液对样品垫浸泡处理,其中稀释液均为 PBS 溶液(0.01 mol/L,pH 7.4),之后组装试纸条并进行空白样品检测,结果如表1所示。可以看到样品垫封闭液2% BSA+0.05%吐温+1% PVP可以使试纸条的T线和C线显色效果最好。
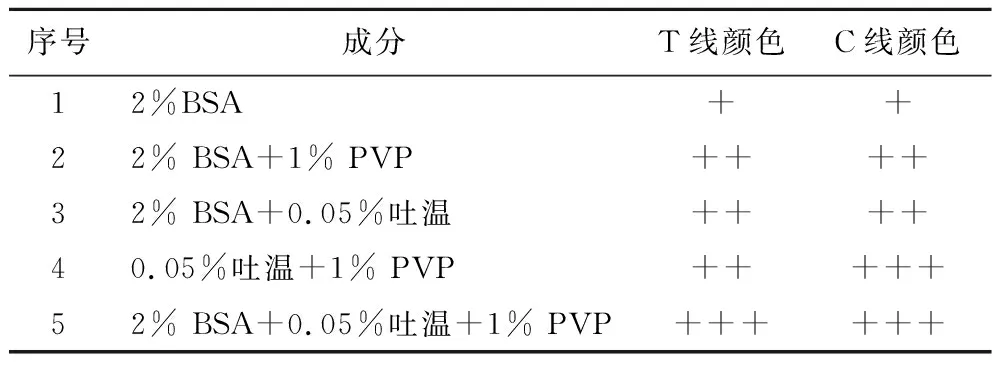
表1 样品垫的最佳封闭液选择Table 1 Selection of the best sealing solution for the sample pad
2.3 反应条件的优化
2.3.1 抗体标记量的影响
如图3-a所示,两者都会随着抗体标记量的增加颜色发生改变,当PBNPs-mAb在抗体标记量达到12 μg时T线强度最佳,PB@PDA在抗体标记量为9 μg时T线强度最佳。在基于竞争检测原理的免疫层析试纸条中,当 T 线与 C 线明显时,抗体的用量越少,T 线上包被的抗原与待检测物质竞争越激烈,试纸条的检测灵敏度就越高。此外,抗体的用量减少还可以大大降低免疫层析检测成本。因此,选用 12 μg 呕吐毒素单克隆抗体作为 1 mL PBNPs-mAb中抗体的最终标记量,选用9 μg呕吐毒素单克隆抗体作为 1 mL PB@PDA的最终标记量。
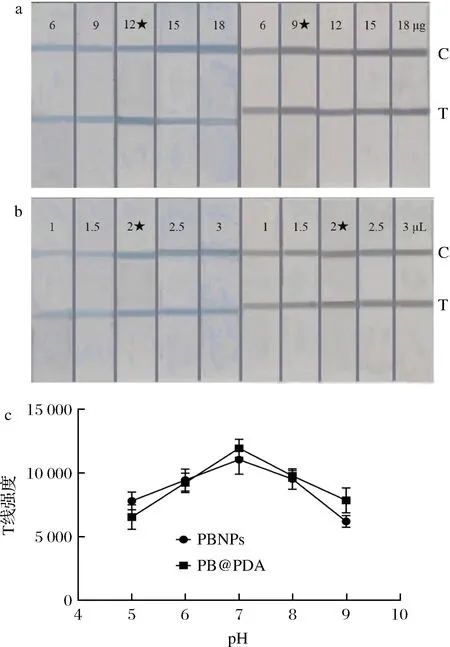
a-2种试纸条抗体标记量的优化;b-2种试纸条探针用量的优化;c-2种试纸条pH的优化图3 两种试纸条带的3种参数优化结果
2.3.2 探针用量的影响
在测试溶液中添加2种探针量也影响试纸条的灵敏度和信号强度。如图3-b所示,当PBNP-mAb和 PB@PDA-mAb 探针体积从 1 μL 增加至 2 μL时,试纸条 T 线与 C 线的颜色强度逐渐加深,当探针浓度为 2、2.5、3 μL时,T 线与 C 线的颜色强度几乎保持一致。基于最少探针量获得最佳信号响应的原则,选用2 μL PBNPs和PB@PDA-mAb 作为该试纸条中最优探针添加量。
2.3.3 pH的影响
试纸条的检测线和质控线强度在一定程度上取决于探针溶液中pH的大小,如图3-c所示,当探针溶液的pH从酸性变为中性时试纸条T 线与 C 线的颜色强度逐渐增高,而当pH由中性逐渐变为酸性时T线与 C 线的颜色强度会逐渐降低。当pH值达到7时2种条带颜色都达到最高强度。这可能是因为在酸性条件下探针粒子聚集成团块导致在结合垫前造成了太多滞留使得聚集在检测区的探针数量变少,从而导致颜色强度变低[21]。而在碱性条件下普鲁士蓝纳米粒子的分解导致颜色褪色,从而降低 T线与 C线的颜色强度。
2.4 试纸条的灵敏度分析
在最优检测条件下,通过检测不同浓度的DON标准溶液来确定2种免疫层析试纸条对DON的检测灵敏度。如图4所示,随着检测样品中DON的浓度逐渐增加,PBNPs免疫层析试纸条T线上颜色条带也逐渐减弱。当DON质量浓度达到1 ng/mL时,T线上颜色明显浅于阴性对照的T线颜色,而DON质量浓度达到7 ng/mL时,T线颜色完全消失。而PB@PDA的试纸条在DON质量浓度达到0.2 ng/mL时T线上颜色明显浅于阴性对照的T线颜色,当DON质量浓度达到1 ng/mL时,T线颜色完全消失。因此,基于PBNPs的免疫层析试纸条对DON的可视化检出限和消线质量浓度分别为1 ng/mL和7 ng/mL。PB@PDA免疫层析试纸条对DON的可视化检出限和消线质量浓度分别为0.2 ng/mL和1 ng/mL。

a-PB-LFIA检测呕吐毒素灵敏度结果;b-PB-LFIA对呕吐毒素的线性方程分析;c-PB@PDA-LFIA检测呕吐毒素灵敏度结果;d-PB@PDA-LFIA对呕吐毒素的线性方程分析图4 PBNPs和PB@PDA的检测灵敏度评估结果
此外,采用Image J软件分析计算T线条带的强度值,并分析其与DON浓度的关系。由图4-b显示,T线强度值与DON浓度呈负相关,并且DON质量浓度为0.5~3.0 ng/mL时,T线强度值与DON质量浓度呈现出良好的线性关系,相关系数R2为0.992。而PB@PDA的试纸条的检出限和消线质量浓度分别为0.2 ng/mL和1 ng/mL(图4-d),比PBNPs试纸条灵敏度提高了5倍,此外,PB@PDA在DON质量浓度为0.1~0.5 ng/mL时呈现出良好的线性关系,相关系数R2为0.990。
2.5 试纸条的特异性
选取 FB1、AFB1、OTA、T-2和 ZEN 5 种常见的真菌毒素进行特异性实验,质量浓度均为 10 ng/mL。肉眼观察后结合 Image J 软件分析检测线的强度值。如图5所示,含有FB1、AFB1、OTA、T-2、ZEN的检测试纸条均在T线上显示清晰的颜色,只有样品中含有DON时,在试纸条T线处观察不到明显的颜色,表明2种方法的特异性良好,不受其他真菌毒素干扰。
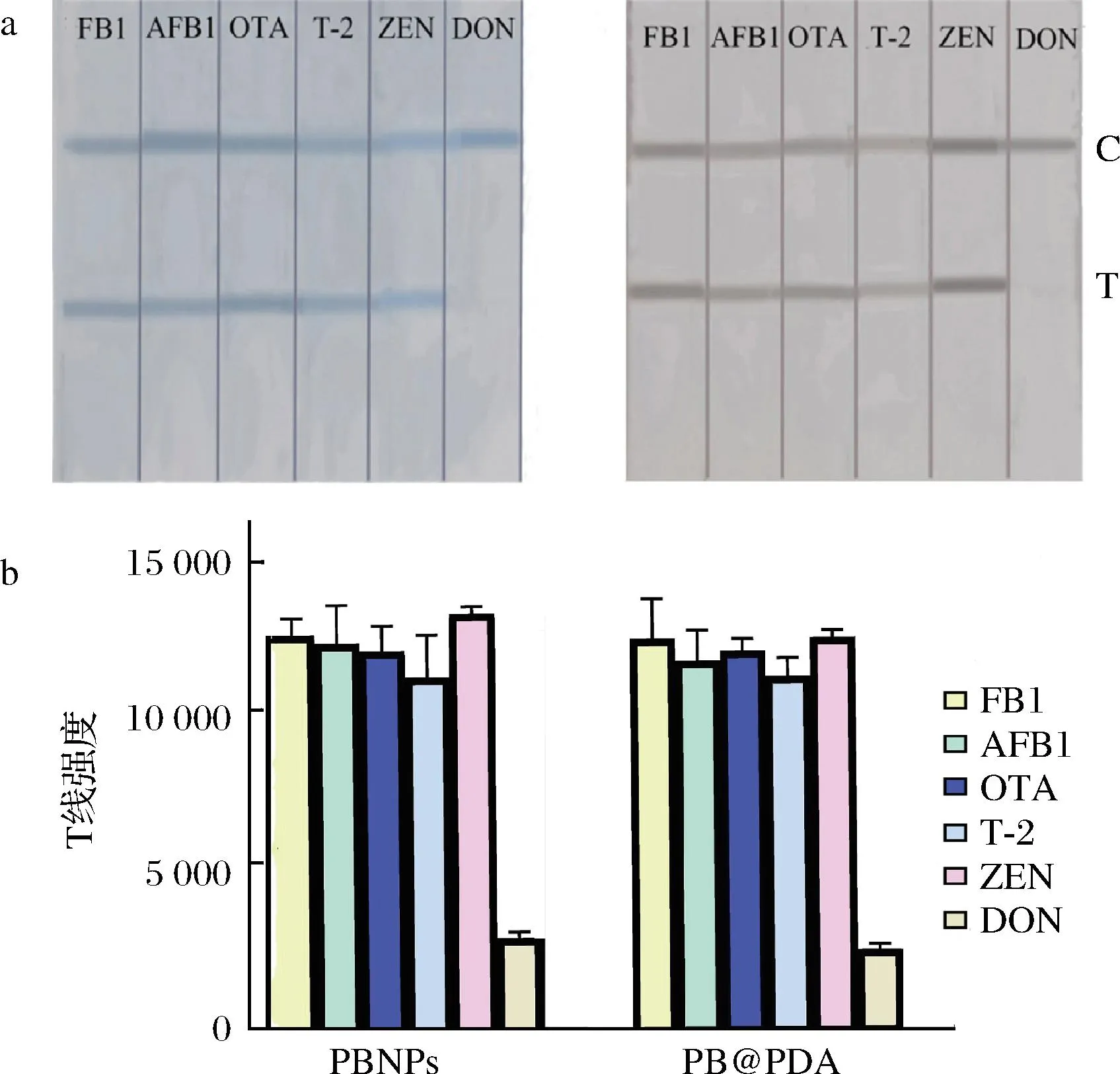
a-2种试纸条检测特异性结果;b-2种试纸条特异性结果分析图图5 基于PBNPs和PB@PDA的免疫层析试纸条的特异性检测结果
2.6 实际样品中的应用
为验证该方法的实用性,将不同浓度DON添加到小麦中进行检测。如图6-a所示,PB-LFIA对小麦DON的视觉检出限和消线浓度分别为20、60 ng/g,而PB@PDA-LFIA对小麦DON的视觉检测限和消线浓度分别为5 ng/g和20 ng/g(图6-b)。进一步与商品化胶体金检测试纸条比较,如图6-c可以发现胶体金的视觉检测限和消线浓度分别为10 ng/g和50 ng/g,略高于PBNPs的灵敏度,但低于PB@PDA的灵敏度,3种试纸条的检测限均低于我国对小麦中DON残留限量1 000 μg/kg。PB@PDA-LDFIA与胶体金免疫层析法相比优点有:a)普鲁士蓝和盐酸多巴胺等材料价格低廉,合成只需简单的离心便可获得,制备过程省时省力;b)PBNPs稳定性良好,具有更好的应用前景;c)PBNPs能够实现量产化,能够减少工艺损耗和生产时间。

a-PB-LFIA对小麦样品中呕吐毒素的检测;b-PB@PDA-LFIA对小麦样品中呕吐毒素的检测;c-胶体金对小麦样品中呕吐毒素的检测图6 三种免疫层析法对小麦样品中呕吐毒素的检测
3 结论
本文以 PB@PDA为标记物,通过竞争抑制模式建立了一种新型的 PB@PDA -LFIA,实现了对小麦中DON 的快速灵敏检测。与传统的PBNPs相比,合成的 PB@PDA 颜色亮度更强,消线效果更好,显著提高免疫层析的灵敏度。在最优参数下,对 DON 检测的定性裸眼判断阈值为 1.0 ng/mL,定量检测限为 0.2 ng/mL。对小麦样品的定量检测限为5 ng/g。相比于商品化的胶体金和PB-LFIA,PB@PDA检测灵敏度更高,对食品基质有良好的抗干扰性,为快速、灵敏地检测农产品和食品中的真菌毒素提供了良好的应用前景。
