泡椒汁中耐受辣椒素乳酸菌的筛选及其耐受性研究
2024-03-01李宏洋张通化罗丽蓉李升
李宏洋,张通化,罗丽蓉,李升
1(贵州大学 生命科学学院,贵州 贵阳,550025)2(贵州大学 农业生物工程研究院,贵州 贵阳,550025)
泡椒是我国一种传统的发酵食品,由于其独特的风味和营养益生作用而深受人们的喜爱[1]。泡椒口感辛辣中带酸,具有增进食欲、促进血液循环、调理肠胃和促进消化等作用。泡椒的辣味和酸味是其最基本的味道,同时也是泡椒特有的风味之一,辣味和酸味相互作用,形成了独特的口感和滋味[2]。乳酸菌是发酵辣椒的主要菌群,发酵过程中产生的乳酸和乙酸贡献了泡椒的主要酸味[3],并降低食物基质的pH值,从而创造出一种抑制腐败菌和致病菌生长的环境,这种作用有助于延长食品的保质期并提高其安全性。辣椒素是引起辣椒辛辣的主要成分,属于香草类化合物家族中的一种极度辛辣的生物碱,化学式为C18H27NO3[4-5]。由于强烈的刺激性和生物活性,辣椒素具有广泛抗菌作用[6],可以有效地抑制如金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌等多种病原微生物的生长代谢[7-8],当辣椒素浓度超过一定质量浓度(0.133 g/L)时,也会对乳酸菌细胞产生伤害作用[9]。研究表明,不同品种的辣椒对发酵辣椒制品的品质及风味具有较大影响[10],不同批次的泡椒质量与风味不同,品质不稳定[11],这可能与辣椒的辣度以及自然发酵过程参与的菌株种类有关。筛选出耐受辣椒素的乳酸菌,作为强化发酵候选菌株应用于泡椒工业生产,取代传统自然发酵,可为更好利用辣椒和乳酸菌资源提供理论基础。
1 材料与方法
1.1 材料与试剂
试验菌株来自于四川绵阳市和德阳广汉市农家自制泡椒卤水,年限分别为6年和5年;商用菌株CICC 6239购于中国工业微生物菌种保藏管理中心;MRS肉汤及琼脂培养基培养基,杭州百思生物技术有限公司;CaCO3、NaCl、NaOH,国药集团化学试剂有限公司;辣椒素标准品,索莱宝科技有限公司;乳酸菌成套生化鉴定管,上海抚生实业有限公司;细菌基因组DNA 提取试剂盒、RNA 提取试剂盒、反转录试剂盒、革兰氏染色液,塞维尔生物科技有限公司。
辣椒素母液制备:用无水乙醇溶解配制30 g/L的辣椒素母液溶液,0.22 μm滤器过滤除菌,4 ℃贮存备用。
1.2 仪器与设备
辣度快速检测仪,北京盈盛恒泰科技有限责任公司;恒温水平摇床,塞维尔生物科技有限公司;酶标仪、高速冷冻离心机、全自动高压灭菌锅,美国 Thermo公司;便携式电导率仪,上海雷磁仪器厂;S-3400 N扫描电子显微镜;HITACHI(日立)公司;PCR仪、荧光定量PCR仪,美国伯乐。
1.3 试验方法
1.3.1 泡椒汁的辣度测定
参照GB/T 21266—2007中辣椒素类物质总量计算方法,测定的泡椒汁的斯科维尔指数并换算其辣椒素含量。
1.3.2 菌株的分离纯化
将1 mL泡椒老卤水用生理盐水倍比稀释后取100 μL样液涂布至含0.7 g/L辣椒素、15 g/L CaCO3的MRS琼脂平板上,37 ℃培养 48 h,根据溶钙圈和形态特征挑选菌落并进行革兰染色和过氧化氢酶试验。
1.3.3 耐受辣椒素菌株的筛选
高浓度辣椒素极易从培养基析出,且溶剂乙醇体积分数较高会抑制菌株的生长,因此根据菌株在较低浓度辣椒素胁迫下的相对生长率进行筛选。将1.3.2节保存的菌株活化2代后,用生理盐水稀释至1.0×108CFU/mL制成菌悬液(下同)。根据辣椒素对乳酸菌的最低抑菌浓度(minimum inhibitory concentration, MIC)为0.133 g/L,将Y-6的菌悬液以1%比例接种到0.2 g/L辣椒素MRS液体培养基中,37 ℃, 160 r/min摇床培养,测定0和24 h的OD600nm值,空白培养基作为对照组,将生长状况好的菌株在0.3、0.4和0.5 g/L辣椒素MRS培养基中复筛,3次重复试验。通过公式(1)计算相对生长率。
(1)
式中:R,相对生长率,%;a和b为无辣椒素培养基中24和0 h的OD600nm值;c和d为加有辣椒素培养基中24和0 h的OD600nm值。
1.3.4 菌种鉴定
使用pH计和GB 12456—2021 中的酸碱滴定法每2 h测定菌株pH和酸度变化;生理生化鉴定:乳酸菌成套生化鉴定管;16S rDNA 序列分析:提取菌株的基因组DNA[12],以27 F和1492 R为引物进行PCR扩增,PCR产物送上海生工测序,MEGA 7.0 绘制系统进化树,确定菌株种属。
1.3.5 辣椒素对乳酸菌的生长抑制作用
将Y-6菌悬液以1%接种量接入0.5、0.6、0.7、0.8和0.9 g/L辣椒素MRS培养基中,37 ℃,160 r/min培养24 h,测定其OD600 nm值,以未接菌培养基为空白对照,抑菌率按式(2)计算,并用GraphPad Prism 9软件计算辣椒素的 IC50值,3次重复。
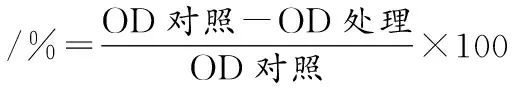
(2)
式中:OD对照,空白处理组OD600nm值;OD处理,辣椒素处理组OD600nm值。
1.3.6 辣椒素对乳酸菌细胞膜通透性的影响
将Y-6菌悬液以1%的比例接入MRS液体培养基中,160 r/min,37 ℃振荡培养至菌浓度达到1.0×108CFU/mL时,加入辣椒素使其终浓度为IC50值。取3 mL菌液4 000 r/min离心10 min吸取上清液,分别测定0、1、2、3、4 和5 h上清液的电导率;测量0、2、4、6、8和10 h上清液OD260nm与OD280nm值[13],商用菌株6239为对照,无菌水为空白对照。
1.3.7 扫描电子显微镜(scanning electron microscope, SEM)分析
将Y-6悬液以1%的比例分别接入空白培养基和0.57 g/L辣椒素MRS液体培养基中,37 ℃,160 r/min培养12 h,5 000 r/min离心10 min,弃上清液,沉淀用磷酸盐缓冲液洗涤2次后用2.5%的戊二醛4 ℃固定过夜。0.1 mol/L磷酸盐缓冲液洗涤样品3次后使用30%、50%、70%、90%、100%(体积分数)乙醇溶液依次进行梯度脱水处理,最后将所有样品放在真空蒸发器中。镀一层金属膜,使用S-3400 N扫描电镜观察菌体细胞的变化,以商用菌株6239为对照。
1.3.8 荧光定量PCR
将Y-6菌悬液以1%的比例接入空白培养基和0.57 g/L辣椒素MRS培养基中,37 ℃,160 r/min培养,收集对数生长期(空白对照组8 h和处理组12 h)的菌体,Trizol法提取细菌总RNA后进行反转录[14]。以16SrRNA为内参基因,检测通用应激蛋白usp、ABC转运蛋白渗透酶、渗透保护剂转运系统-ATP结合蛋白(opuA)、渗透保护剂转运系统-透性酶蛋白(opuB)和渗透保护剂转运系统-底物结合蛋白(opuC)、乳酸脱氢酶(L-lactate dehydrogenase):ldh和磷酸甘油酸激酶(phosphoglycerate kinase):pgk等7个与辣椒素耐受性相关的基因在辣椒素处理前后的表达量变化,每个处理3次重复。
1.4 数据处理
本试验数据以3 次重复的平均值±标准差表示,Excel 2010进行数据分析,Graph Pad Prism9.0作图并计算辣椒素的 IC50值。用IBM SPSS Statistics 26软件Duncan 法对各数据进行显著性检验(P<0.05)。
2 结果与分析
2.1 耐受辣椒素乳酸菌的筛选
2.1.1 初筛
通过测定泡椒汁的辣椒素含量为(0.685±0.016) g/L,在此基础之上以0.7 g/L辣椒素浓度对耐受菌株进行初筛,得到30株生长良好、溶钙圈明显、革兰氏染色阳性以及过氧化氢酶测定为阴性的菌株,并分离纯化后保存。
2.1.2 复筛
在0.2 g/L辣椒素处理下,30株乳酸菌对辣椒素均有一定的耐受能力,选择相对生长率在90%以上的8株菌株(表1),进一步复筛(0.3、0.4和0.5 g/L),结果表明菌株Y-6在0.5 g/L辣椒素下的生长率仍在70%以上,其余菌株虽有生长,但其长势较差(表2)。基于此,我们选择菌株Y-6为后续的试验材料。
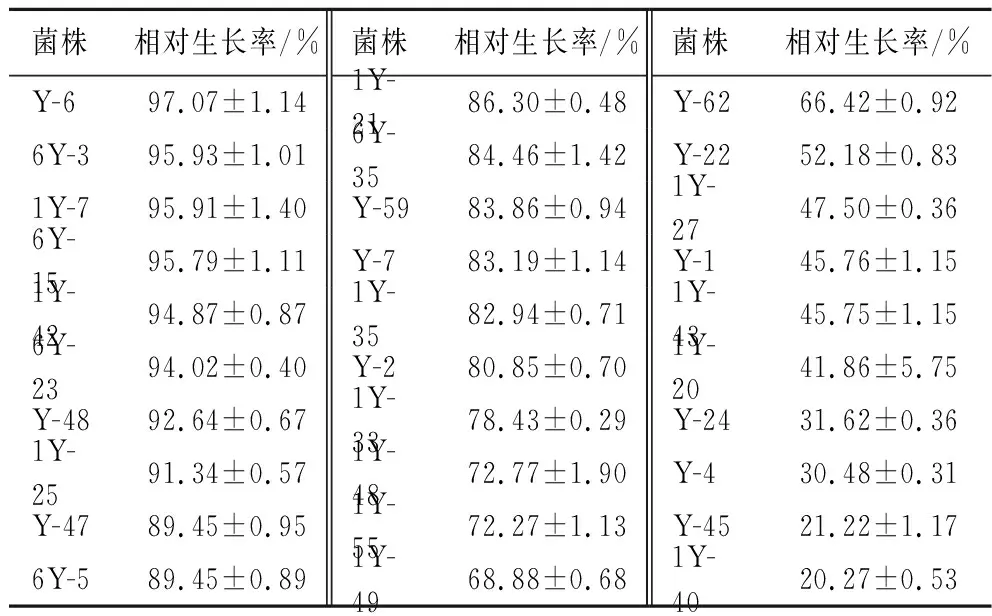
表1 乳酸菌在0.2 g/L辣椒素培养基中的生长情况Table 1 The growth of lactobacillus in contained 0.2 g/L capsaicin medium
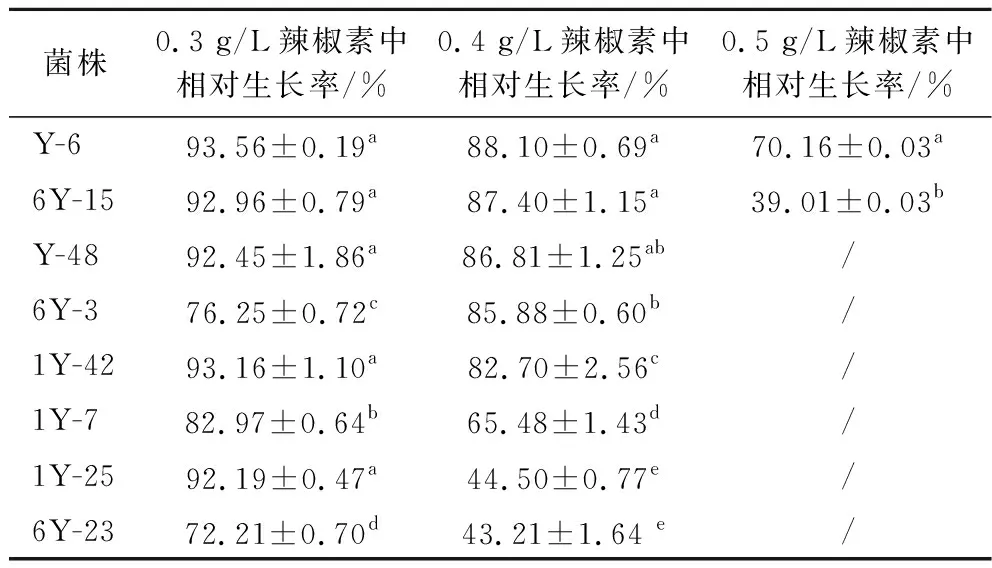
表2乳酸菌在含有不同辣椒素浓度培养基中的生长情况Table 2 The growth of lactobacillus in contained different concentration capsaicin medium
2.2 耐受辣椒素乳酸菌的鉴定
2.2.1 形态观察
通过形态学鉴定发现菌株Y-6的菌落为乳白色,形状呈凸起,圆形,湿润、表面光滑细密,不透明但有光泽,无芽孢(图1-a),革兰氏染色结果表明,菌株Y-6菌体呈紫色、杆状(图1-b)的革兰氏阳性菌。
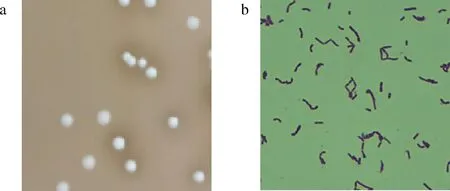
a-菌落形态;b-光学显微镜下细胞形态图1 菌落形态学特征
2.2.2 生理生化鉴定
对菌株Y-6的产酸测定结果表明,其菌液pH值随着时间的推移而逐渐降低,酸度增加,在20 h趋于稳定,pH值为3.93±0.01,24 h其酸度值达到140 °T(图2);过氧化氢酶试验、VP试验、靛基质试验结果均为阴性,甲基红(M.R)试验为阳性;糖酵解试验结果表明,菌株Y-6可利用七叶苷、纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、乳糖、木糖和阿拉伯糖(表3)。
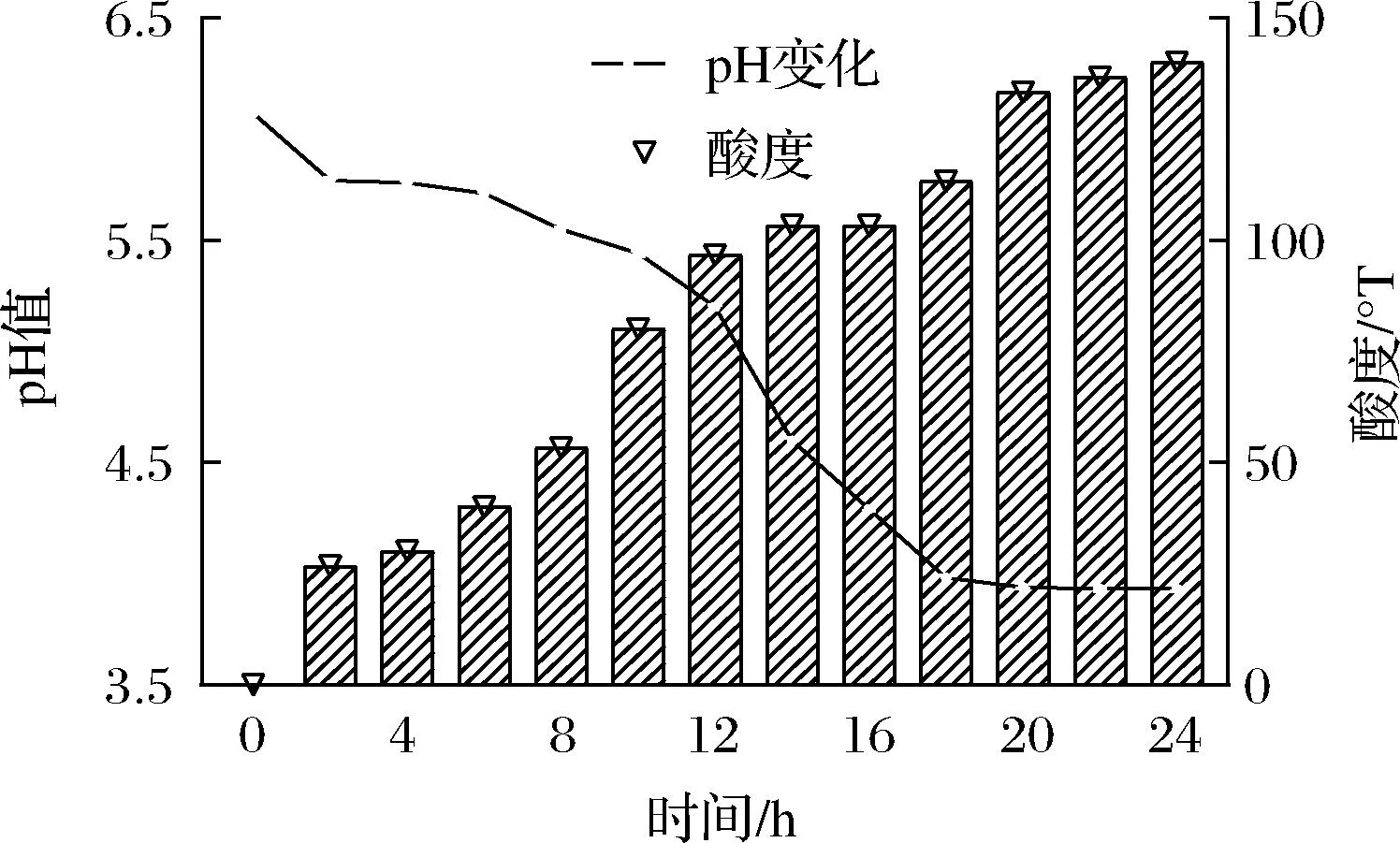
图2 菌株Y-6 24 h下的pH和酸度变化

表3 菌株Y-6的生理生化鉴定结果Table 3 Physiological and biochemical identification results of strain Y-6
2.2.3 16S rDNA 序列分析
对菌株Y-6进行16S rDNA 扩增测序并与GenBank 数据库进行 BLAST 同源性序列比对,使用Megalign程序的邻接法绘制系统发育树(图3),菌株Y-6与植物乳杆菌3596 (登录号:MT538471.1)的序列以100%的置信度聚在一起,亲缘关系最近。
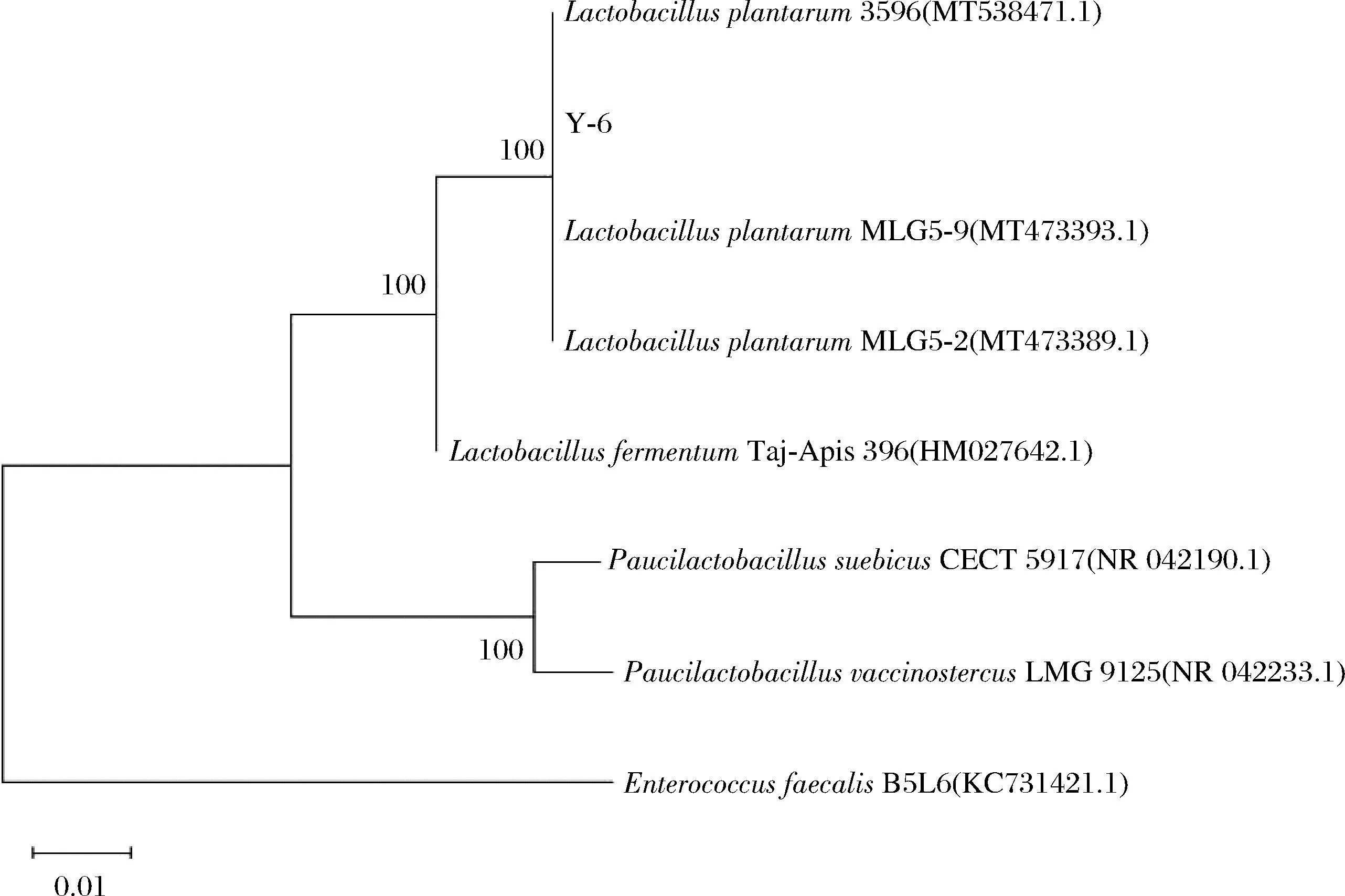
图3 菌株Y-6和相关菌株的系统发育树
2.3 耐受辣椒素乳酸菌的耐受性研究
2.3.1 辣椒素对乳酸菌的生长抑制作用
通过对菌株Y-6生长率的测定发现,在0.25 g/L辣椒素处理下,对数期时间点为8 h,稳定期时间点为16 h,作用效果小,与空白对照组一致;在0.5 g/L辣椒素处理下,对数期时间点为12 h,稳定期时间点为28 h。无论是在0.25 还是0.5 g/L辣椒素的胁迫下,并未显著地降低稳定期(32 h)的OD600nm值,而在高浓度(≥1.0 g/L)辣椒素处理下,菌株不生长或生长缓慢,相对生长率仅10%左右(图4)。
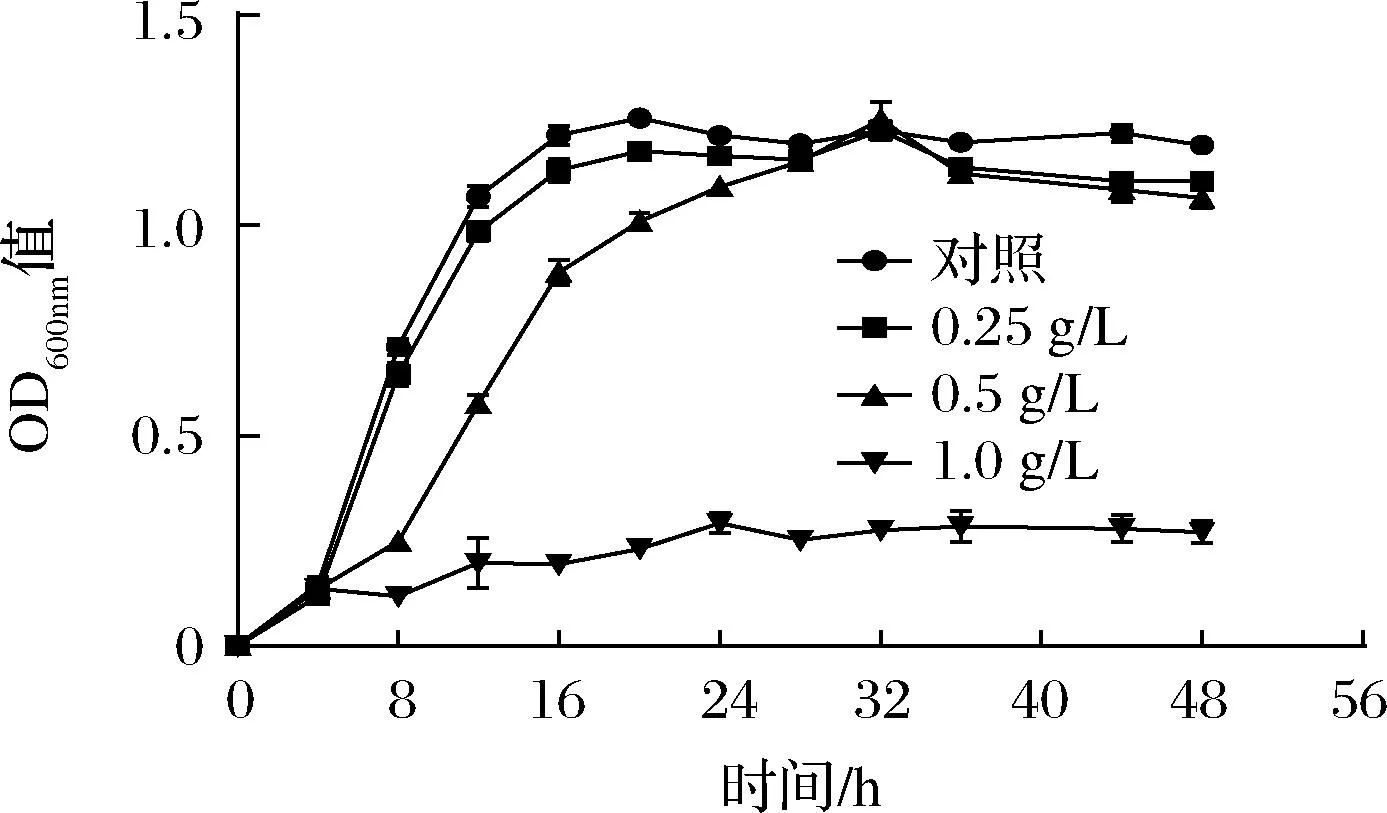
图4 不同浓度辣椒素对菌株Y-6的生长的影响
对菌株Y-6和6239在不同浓度辣椒素处理下的生长比较发现,在0.1 g/L的辣椒素处理下2株菌的生长无差异性,辣椒素的作用低;随着辣椒素浓度的升高,菌体受到的抑制程度随之增加,但相比于6239,菌株Y-6均保持较高的活性(图5)。
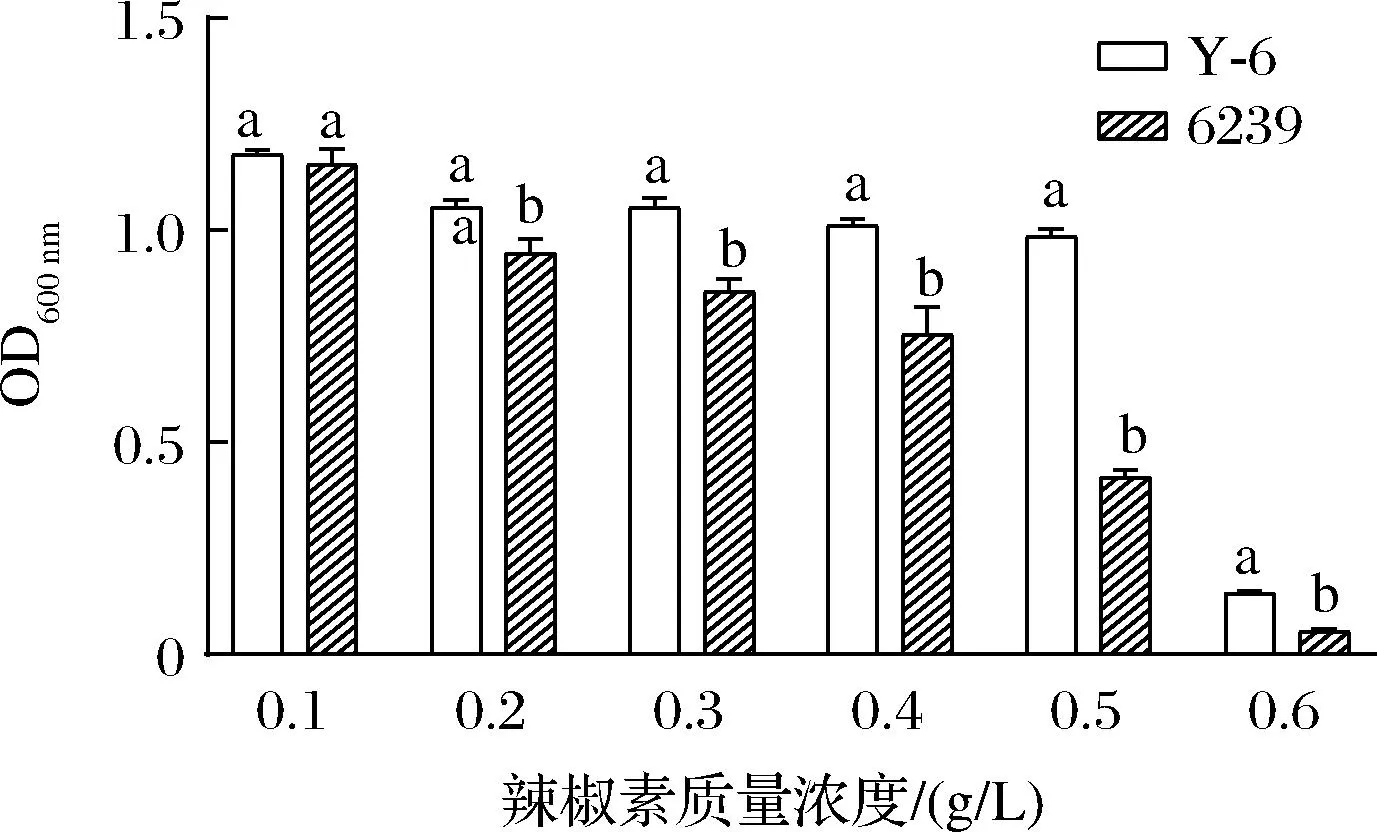
图5 不同菌株的辣椒素耐受性比较
通过对菌株Y-6进行辣椒素IC50的测定发现,辣椒素质量浓度为0.5 g/L时,抑菌率(28.53±0.04)%;在辣椒素质量浓度为0.6 g/L时,抑菌效果显著性升高,抑菌率为(54.38±0.01)%,已超过辣椒素的半抑制浓度;在辣椒素质量浓度为0.7 g/L时,抑菌率为(76.42±0.01)%,与0.8 g/L的抑菌率无显著差异(P<0.05),选择IC50(0.571 g/L)进行后续实验(图6)。

图6 菌株Y-6在不同浓度辣椒素处理下24 h的存活率
综上,高浓度辣椒素可以致死乳酸菌,使其不生长或生长缓慢,低浓度辣椒素增长了菌株的滞后期,且随浓度的增大抑制效果更明显;菌株Y-6的IC50为0.571 g/L;相较于菌株6239,Y-6受辣椒素生长抑制作用更低。
2.3.2 辣椒素对乳酸菌细胞膜完整性的影响
相对电导率可反映菌体细胞膜通透性变化,0.57 g/L辣椒素处理下菌株Y-6和6239在0~1 h的胞外电导率呈现出上升的趋势,1 h均达到最大值,分别为6.36±0.31和7.69±0.008;在2~5 h出现缓慢的下降趋势,但仍高于空白处理组(图7);菌株Y-6与6239在2~10 h的OD260nm和OD280nm值均高于空白对照组,结果表明在辣椒素作用下乳酸菌细胞膜的通透性增加,促进了胞内核酸和蛋白等内容物的释放,导致电导率、OD260nm和OD280nm值升高;但辣椒素处理下Y-6的胞外电导率均低于6239,且核酸OD260nm值和蛋白OD280nm值在2 h后趋于恒定,比6239所需的时间(4 h)更短,表明菌株Y-6相较于菌株6239对辣椒素能更快适应(图8)。为进一步研究Y-6对辣椒素的耐受性,通过SEM对菌株Y-6和6239的细胞形态观察。未加辣椒素组下的菌株6239和Y-6的细胞形态完整、轮廓清晰呈杆状,表面光滑,无颗粒物无膨胀皱缩现象,未见细胞破损,表明细胞膜完整,细胞处于正常状况;辣椒素处理下菌株6239细胞变形严重,失去光泽,细胞出现皱缩和扭曲等形态,发生粘连,界限模糊,细胞发生破损,有明显的损伤;菌株Y-6在辣椒素处理下部分细胞出现和扭曲和皱缩等形态,但仍能保持细胞膜完整(图9)。
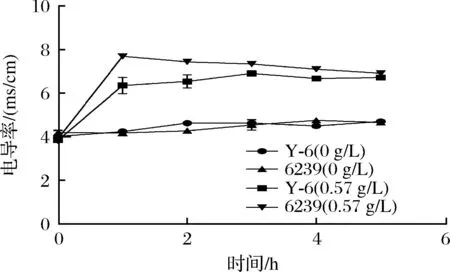
图7 辣椒素处理下菌株Y-6和6239的电导率
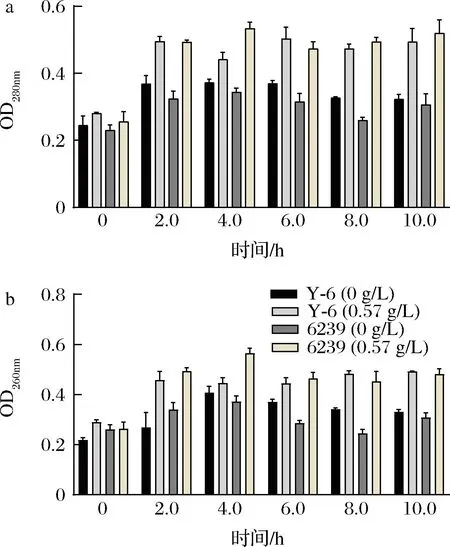
a-菌株Y-6和6239的蛋白泄露;b-菌株Y-6和6239的核酸泄露图8 辣椒素处理下菌株Y-6和6239的蛋白和核酸泄漏
综上,辣椒素通过破环乳酸菌的壁膜结构从而抑制菌体的生长,而Y-6在辣椒素胁迫下可能存在一定的应激反应机制使得其适应环境,相较于商用菌株6239对辣椒素有更高的耐受性。
2.3.3 乳酸菌对辣椒素的耐受调节
选取的7个基因在辣椒素处理下均显著上调,与空白对照组的表达有显著性差异(P<0.01),菌株Y-6对辣椒素有一定的耐受性,揭示表明菌株通过提高通用应激蛋白基因usp(3.37±0.04)等热激蛋白基因的表达应对辣椒素引起的胁迫,保证细胞壁膜的完整性而维持生长;菌株通过自身抑制分裂周期,以求在这种不利条件下存活,所以增加了其生长的滞后期(图4),通过opuA(4.06±0.05)、opuB(6.39±0.38)和opuC(7.32±0.53)等相容性溶质调控系统基因以及ABC转运蛋白渗透酶基因(23.24±0.43)的表达上调维持菌体渗透压的平衡,使其能在辣椒素的环境中适应耐受;最后通过提高与生长代谢相关的如ldh(3.85±0.05)和pgk(3.49±0.06)等糖酵解相关基因的表达,逐渐恢复自身的生长代谢以耐受较高浓度的辣椒素(图10)。
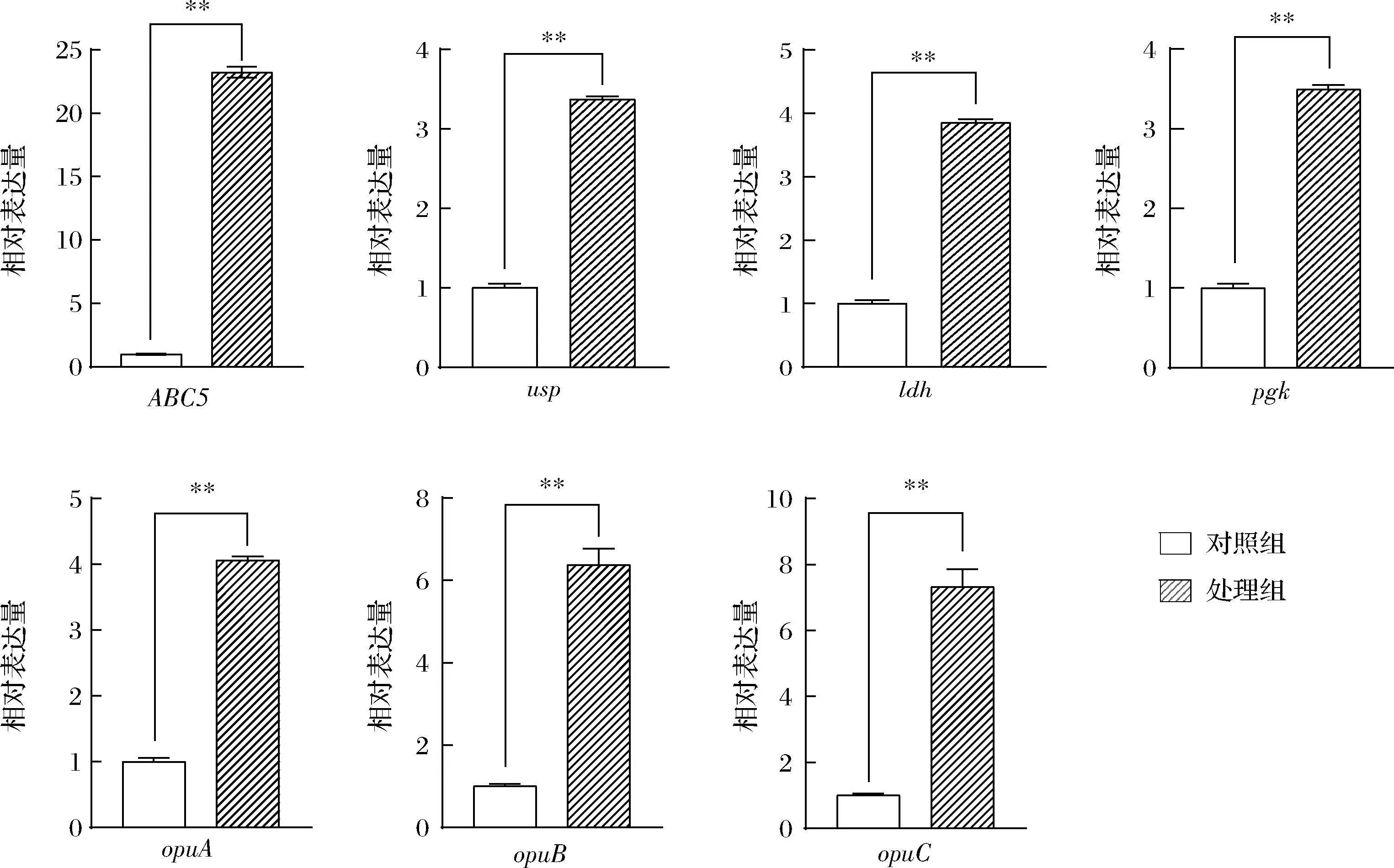
图10 选取基因在对数生长期受辣椒素诱导表达情况
3 讨论与结论
辣椒素是引起辣椒辛辣的主要成分,具有较好的抗菌活性,通过诱导渗透胁迫元件以及膜生物合成和转运体网络的关键基因的表达,抑制核糖体成分和生长相关基因等抑制细菌生长[15],大多数革兰氏阴性菌(包括大肠杆菌、铜绿假单胞菌、肺炎克雷伯菌和变形杆菌)的MIC为0.512 g/L,而对革兰氏阳性菌(如甲氧西林金黄色葡萄球菌(MRSA)的MIC为0.256 g/L;枯草芽孢杆菌MIC为0.128 g/L[16],测定的泡椒汁辣椒素含量为(0.685±0.016) g/L,可有效地抑制病原菌的生长,是筛选耐受辣椒素乳酸菌的主要来源之一,筛选到的菌株Y-6对辣椒素有一定的耐受性,在0.5 g/L下的生长率仍在70%以上,经形态学观察、生理生化试验和16S rDNA 序列分析[17]鉴定为植物乳杆菌。
细胞壁膜是多种抗菌剂的直接作用靶标[18],辣椒素破环了菌株Y-6和6239细胞膜的完整性,导致其电导率、OD260nm和OD280nm值均升高,细胞出现一定的皱缩变形等。研究表明辣椒素能破坏肽聚糖结构[19],致使病原菌的细胞膜破坏成孔而达到抑菌作用[20]。辣椒素的酚羟基会改变致病菌的疏水性和细胞质膜中负表面电荷的减少;导致局部破裂和孔形成,在细胞膜中形成孔,产生结构损伤和抑制作用[21],作为一类生物碱,辣椒素可抑制细菌的外排泵活性[22-23]和增加胞外渗透压[24]致使细胞膜受损而坏死。菌株Y-6在0.57 g/L辣椒素处理下仍能保持细胞形态的相对完整,相关研究表明乳酸菌可诱导专门的修复机制适应不良环境[25],菌株通过上调表达usp等热激蛋白相关基因维持细胞膜流动性和蛋白质稳定,另一方面,调节opuA、opuB和opuC等相容性溶质调控系统基因以平衡细胞内和细胞外渗透压之间的差异[26],ABC转运蛋白渗透酶基因的表达上调可降低药物对菌株的细胞毒性,提高了菌株的耐受性[27]。辣椒素增长了菌株的滞后期,且浓度越大抑制效果越明显。0.5 g/L辣椒素下乳酸菌的对数生长期时间点从8 h延滞到12 h,稳定期时间点从16 h延滞到28 h,这是因为菌体可系统调节影响菌体细胞的活性和抑制分裂周期以求在不利条件下存活[28],在适应一段时间后(对数生长期)又提高通过乳酸脱氢酶ldh基因和和磷酸甘油酸激酶基因pgk基因等糖酵解相关的酶活性恢复自身的生长和代谢,最终也能达到最高的生长数量。
植物乳杆菌Y-6对辣椒素有一定的耐受性,可作为高辣度辣椒的发酵剂,为发酵辣椒的工业化生产提供一定理论依据。
