干燥方式对绿碎茶多酚提取物体外抗氧化和抗糖尿病及乙酰胆碱酯酶抑制活性的影响
2024-03-01张倜培李青包鸿慧沈正兴石娟唐前勇程一方周睿
张倜培,李青,包鸿慧*,沈正兴,石娟,唐前勇,程一方,周睿*
1(湖北文理学院,传统药食同源产品研究与开发国际科技合作基地,湖北 襄阳,441053) 2(襄阳市农业科学院,湖北 襄阳,441607)
糖尿病是一类严重威胁人类健康的代谢紊乱性慢性疾病,常伴有糖尿病肾病、神经病变等并发症[1]。α-淀粉酶和α-葡萄糖苷酶抑制剂可有效减缓葡萄糖通过肠壁吸收参与机体的血液循环,控制餐后血糖水平,是临床治疗糖尿病常用一线药物[2-3]。乙酰胆碱脂酶抑制剂可通过抑制乙酰胆碱脂酶活力而提高乙酰胆碱水平和神经元兴奋性,广泛应用于阿尔茨海默症的治疗[4]。目前,临床常用酶抑制剂主要有阿卡波糖和伏米格列醇、多奈哌齐和他克林等,但长期服用易产生胃肠道疾病、头晕恶心等副作用且价格昂贵[2,4]。此外,高血糖机体内血清和血红蛋白等的非酶糖基化终产物(advanced glycation end products,AGEs)是糖尿病并发症如阿尔茨海默病、动脉粥样硬化、白内障等慢性疾病发生的重要诱因,抑制蛋白糖基化和AGEs的形成能有效缓解糖尿病并发症[5]。而机体内活性氧自由基大量累积,易导致蛋白质、DNA等生物大分子功能损伤,且氧化应激与认知功能障碍等糖尿病并发症密切相关[4,6]。因此,清除自由基、抑制α-淀粉酶、α-葡萄糖苷酶和乙酰胆碱脂酶活性以及抑制AGEs常作为安全高效型天然植物源抗糖尿病和抗痴呆活性成分的重要评价指标[6-10]。
绿碎茶一般选用中低档机采老嫩混杂的茶鲜叶为原料,通过杀青、揉切、初烘、足火及筛分等工艺制成的颗粒形绿茶,富含儿茶素类天然多酚物质,主要用于热销国内外的袋泡茶和窨制花茶产品基料,但绿碎茶较红碎茶产业发展相对滞后,其研究仅限于加工工艺、理化品质、滋气味等方面[11-12]。此外,植物多酚可通过抑制自由基通路、脂质抗氧化、抑制肠道消化酶和葡萄糖转运、促进胰岛素合成与分泌、调节肠道菌群以及改善氧化应激状态和神经元线粒体功能等机制发挥降血糖和认知保护功效[3,10,13-14],而干燥方式与加热温度均显著影响多酚抗氧化及α-淀粉酶和α-葡萄糖苷酶抑制活性[7,15]。同时,前期研究已发现绿碎茶水提物具有较强的α-葡萄糖苷酶抑制活性以及一定的抗氧化和乙酰胆碱酯酶抑制能力[16],然而干燥方式对绿碎茶多酚提取物抗氧化和抗糖尿病及抗痴呆活性的影响未见研究报道。
因此,本研究通过蒸干结合真空干燥与真空冷冻干燥2种方式干燥绿碎茶乙酸乙酯萃取相,测定提取物的DPPH自由基、ABTS阳离子自由基、羟自由基(·OH)清除能力,铁离子还原能力(ferric ion reducing power,FRAP)、α-淀粉酶、α-葡萄糖苷酶和乙酰胆碱酯酶抑制能力以及AGEs形成抑制能力,评价2种干燥方式对多酚提取物体外抗氧化和抗糖尿病及抗痴呆活性潜力的影响,为绿碎茶资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
绿碎茶,湖北天艺茶业有限责任公司;DPPH、ABTS、福林酚、2,4,6-三吡啶三吖嗪,上海阿拉丁有限公司;α-淀粉酶、α-葡萄糖苷酶、乙酰胆碱酯酶(acetylcholin esterase,AChE)、阿卡波糖,美国Sigma-Aldrich公司;L-抗坏血酸(维生素C)、氨基胍(aminoguanidine,AG)、石杉碱甲(huperzine A,HupA)、5,5′-二硫代双(2-硝基苯甲酸)(5,5′-dithiobide (2-nitrobenzoic acid),DTTB)、4-硝基酚-α-D-呋喃葡萄糖苷(4-nitrophenol-α-D-glucofuran,pNPG)、碘化硫代乙酰胆碱,上海源叶生物科技公司;其他所有试剂均为分析纯。
1.2 仪器与设备
Ultra Scan PRO型色度仪,美国Hunter Lab公司;LC-LX-L6OD型高速离心机,上海力辰邦西仪器科技有限公司;SY-2000A型旋转蒸发仪,上海贤德实验仪器有限公司;L5S型紫外可见分光光度计,上海精密仪器仪表有限公司;DZF-6050型真空干燥箱,上海一恒科学仪器有限公司;DNM-9602型酶标仪,北京普朗新技术有限公司;SP Virtis BenchTop Pro型真空冷冻干燥机,美国SP Scientific仪器公司;F-7000型荧光分光光度计,日本日立公司。
1.3 实验方法
1.3.1 样品制备
将绿碎茶粉碎并过60目筛,称取150 g用1 500 mL 80%(体积分数)乙醇溶液于30 ℃恒温水浴下搅拌浸提12 h,4层纱布过滤,将滤液离心取上清液,浓缩,用等体积氯仿萃取3次,收集上层水相,再用等体积乙酸乙酯萃取3次,收集上层乙酸乙酯相,然后均匀等量分为2份。其中1份萃取液减压浓缩,将残液置于蒸发皿,水蒸气浴挥干至膏状,真空干燥(0.09 MPa,60 ℃,6 h),样品标记为BGTE-SVD。另1份萃取液减压浓缩至膏状,冷冻干燥,样品标记为BGTE-FD。采用福林酚法[17]测定样品BGTE-SVD与BGTE-FD的总酚含量分别为(759.89±14.28) mg GAE/g和(820.11±20.37)mg GAE/g。采用苯酚硫酸法[17]测定样品BGTE-SVD与BGTE-FD的总糖含量分别为(6.71±0.21)%和(7.55±0.28)%。
1.3.2 绿碎茶多酚提取物的色泽测定
将样品置于洁净的比色皿中,采用色差仪测定色度值:L*值(亮度)、a*值(红度)、b*值(黄度),并根据公式(1)计算色差值ΔE。测定前用标准白板校正色差仪。
(1)
式中:ΔL*表示提取物与原绿碎茶粉的亮度差值;Δa*表示提取物与原绿碎茶粉的红度差值;Δb*表示提取物与原绿碎茶粉的黄度差值。
1.3.3 绿碎茶多酚提取物体外抗氧化活性测定
DPPH自由基和ABTS阳离子自由基清除能力测定参照张露等[10]方法。·OH清除能力(hydroxyl radical scavenging activity,HRSA)测定参照龙晓珊等[14]方法。FRAP测定参照陈涛林等[18]方法。维生素C为阳性对照,测定结果用IC50值表示。
1.3.4 绿碎茶多酚提取物体外抗糖尿病活性测定
1.3.4.1α-淀粉酶抑制活性测定
采用张宏图等[13]的测定方法并略作修改。取0.5 mL的样品与0.5 mL的α-淀粉酶溶液充分混合,于37 ℃条件下孵育10 min后,添加0.5 mL的淀粉溶液,继续反应10 min。然后,添加1.0 mL的DNS试剂,并置于沸水浴5 min灭酶。冰浴快速冷却至室温后,加入10 mL的蒸馏水充分混匀,最后准确量取200 μL溶液加入96平板,并置于酶标仪,于540 nm下测定吸光值。选择阿卡波糖为阳性对照。结果用样品的α-淀粉酶活性抑制率和半抑制浓度值(IC50)表示,α-淀粉酶活性抑制率的计算如公式(2)所示:
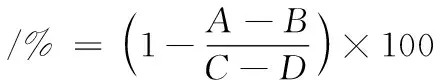
(2)
式中:A为添加样品和酶的反应体系为抑制组;B为不含酶的反应体系为对照组;C为不加样品的反应体系为非抑制组;D为不加样品和酶的反应体系为空白对照组。
1.3.4.2α-葡萄糖苷酶抑制活性测定
采用张露等[10]测定方法并略作修改。用磷酸缓冲液(0.1 mol/L,pH 6.9)配制α-葡萄糖苷酶溶液(0.25 U/mL)和pNPG溶液(5 mmol/L)。然后,准确量取50 μL的样品以及100 μL的α-葡萄糖苷酶溶液于96孔平板中,置于酶标仪25 ℃下反应10 min。再加入50 μL的pNPG溶液,25 ℃下继续反应5 min,用酶标仪测定405 nm处的吸光值。阿卡波糖为阳性对照。结果用样品的α-葡萄糖苷酶活性抑制率和IC50表示。α-葡萄糖苷酶活性抑制率的计算如公式(3)所示:
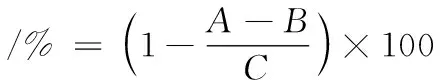
(3)
式中:A是样品测试组吸光值;B是样品背景测试组(磷酸盐缓冲液代替样品测试组中的α-葡萄糖苷酶溶液)吸光值;C是空白对照测试组(磷酸盐缓冲液代替样品测试组中的样品)吸光值。
1.3.4.3 抗糖基化活性测定
参照杨生辉等[9]的测定方法并略作修改。准确配制20 mg/mL牛血清白蛋白(bovine serum albumin,BSA)溶液、0.5 mol/L葡萄糖溶液(glucose,Glu)。准确量取BSA、Glu各1.5 mL,分别加入1 mL样品溶液(0.2 mg/mL)与6.0 mL 0.2 mol/L磷酸缓冲溶液(pH 7.4),摇匀后避光37 ℃恒温孵育1~6 d。采用荧光分光光度计,测定AGEs在激发波长370 nm,发射波长440 nm处的荧光值。相同浓度的AG为阳性对照。样品对BSA/Glu模拟体系AGEs的相对抑制率按公式(4)计算:
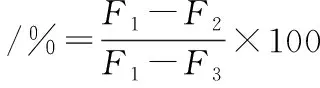
(4)
式中:F1为不添加样品但水浴的BSA/Glu模拟体系的荧光值;F2为添加样品且水浴的BSA/Glu模拟体系的荧光值;F3为不添加样品也不水浴的BSA/Glu模拟体系的荧光值。
1.3.5 AChE抑制活性测定
参照ELLMAN等[19]的测定方法并略作修改。在96孔板上依次加入50 μL PBS(pH 7.4)、25 μL不同质量浓度样品溶液以及25 μL质量浓度为1.0 μg/mL AChE溶液。在4 ℃条件下静置20 min。然后加入25 μL质量浓度为0.3 mg/mL ATCI和125 μL质量浓度为0.59 mg/mL DTNB,在37 ℃恒温条件下反应20 min后,用酶标仪在405 nm处快速测定吸光值。以HupA作为阳性对照。AChE酶活性抑制率按公式(5)计算:
(5)
式中:A1为PBS代替样品的吸光值;A2为PBS代替空白测试组中的AChE溶液的吸光值;A3为样品组测试吸光值;A4为PBS代替样品测试组中的AChE溶液的吸光值。
1.4 数据处理
所有试验平行测定3次,结果表示以平均值±标准差表示。采用Excel 2019软件进行基本数据统计;采用SPSS 26.0软件进行Duncan多重比较及分析;采用ANOVA算法进行单因素方差分析;采用Origin 2019软件绘制图形。显著性水平选定P<0.05。
2 结果与分析
2.1 绿碎茶多酚提取物的色泽
由图1和表1可知,原绿碎茶粉呈暗绿色,而BGTE-SVD和BGTE-FD分别呈现橙黄色和暗黄色,其L*、a*、b*值均显著升高(P<0.05),ΔE分别为8.68和11.59,差异显著(P<0.05)。BGTE-FD的L*、b*及ΔE值均明显高于BGTE-SVD,而其a*值却低于BGTE-SVD,表明真空冷冻干燥提取物色泽偏亮偏黄,而蒸干结合真空干燥提取物色泽偏红,这可能与多酚类物质在高热条件下易发生氧化、聚合或分解等反应有关[15]。
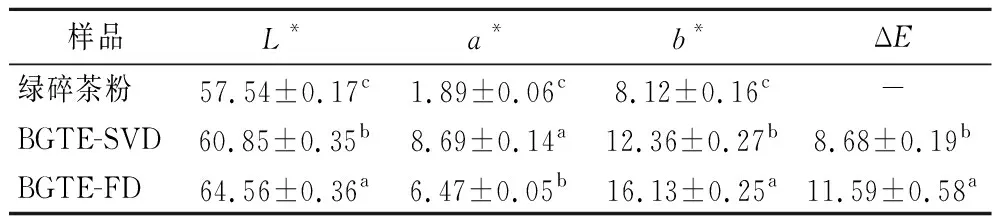
表1 绿碎茶多酚提取物的色泽测定Table 1 The color measurements of polyphenol extracts of broken green tea

a-绿碎茶粉;b-BGTE-SVD;c-BGTE-FD图1 绿碎茶粉和绿碎茶多酚提取物的外观
2.2 绿碎茶多酚提取物体外抗氧化活性
由图2和表2可知,各样品对DPPH自由基清除能力随质量浓度的提高而不断增强,剂量依耐性明显。
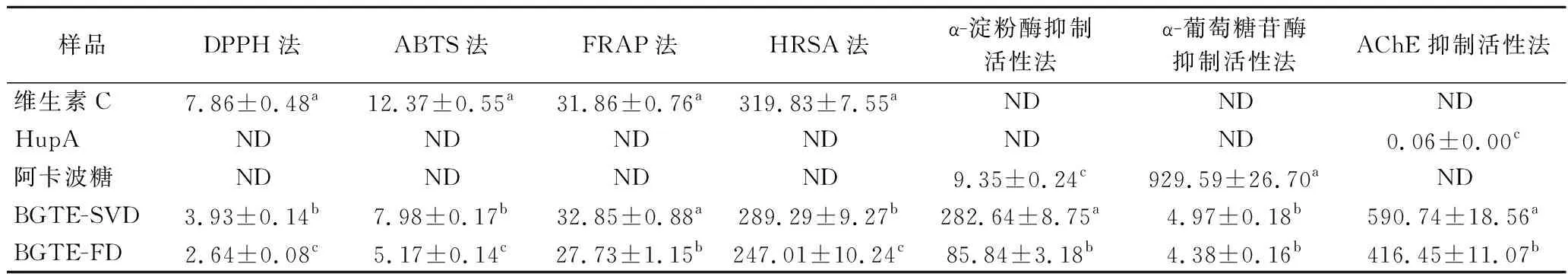
表2 绿碎茶多酚提取物体外抗氧化和酶抑制活性的IC50值 单位:mg/L
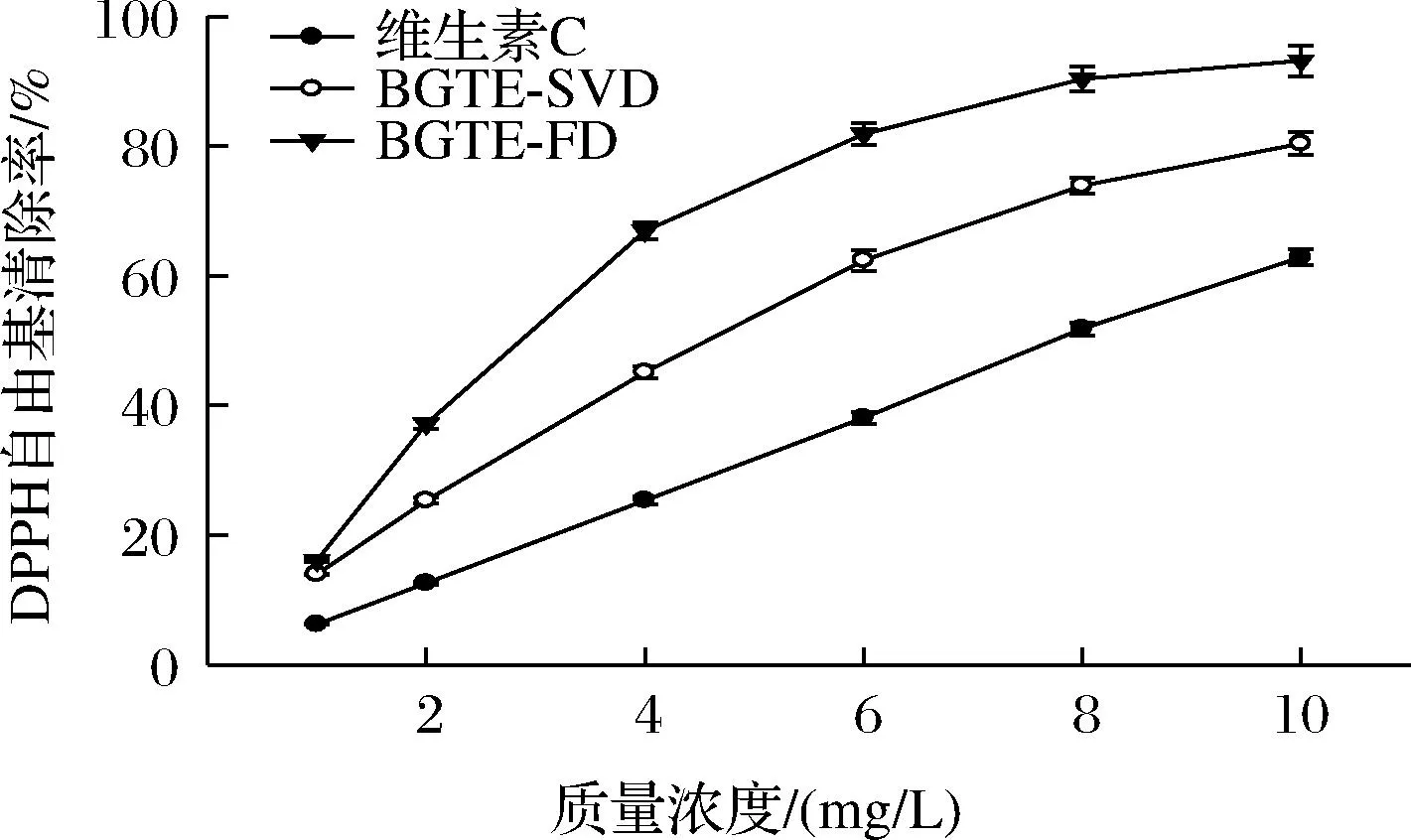
图2 绿碎茶多酚提取物的DPPH自由基清除能力
BGTE-FD和BGTE-SVD的IC50值分别为2.64 mg/L和3.93 mg/L,其清除DPPH自由基能力约为维生素C(IC50=7.86 mg/L)的3倍和2倍,表明绿碎茶多酚提取物具有较强的DPPH自由基清除能力,且BGTE-FD活性明显强于BGTE-SVD(P<0.05)。这可能是由于低温和低氧分压环境有利于提取物抗氧化活性物质的保留[20]。袁晓擘等[21]与张轶斌等[22]研究发现五峰绿茶水提物和绿茶多糖对DPPH自由基清除能力的IC50值分别为50.56 mg/L及300 mg/L以上,远大于本研究样品测定值,表明多酚是绿碎茶中最主要的抗氧化物质。
由图3和表2可知,随着质量浓度的提升,各样品对ABTS阳离子自由基的清除能力不断增强,剂量效应显著。BGTE-FD和BGTE-SVD对ABTS阳离子自由基清除能力的IC50值分别为5.17 mg/L和7.98 mg/L,明显低于前期绿碎茶水提物的研究结果(IC50=22.16 mg/L)[16]以及五峰绿茶水提物的测定值(IC50=8.81 mg/L)[21],且BGTE-FD和BGTE-SVD抗氧化活性相当于维生素C(IC50=12.37 mg/L)的2.39倍和1.55倍,这与DPPH自由基清除活性测定结论相一致。这可归因于高含量的多酚类物质有利于自由基清除能力增强[6]。

图3 绿碎茶多酚提取物的ABTS阳离子自由基清除能力
由图4和表2可知,绿碎茶多酚提取物具有较强的羟自由基清除活性,各样品对羟自由基清除能力随质量浓度的提高而不断增强,且相互之间存在显著性差异(P<0.05),量效关系明显。各样品清除·OH能力大小顺序为BGTE-FD(IC50=247.01 mg/L)>BGTE-SVD(IC50=289.29 mg/L)>维生素C(IC50=319.83 mg/L),BGTE-FD和BGTE-SVD的·OH清除能力相当于维生素C的1.30倍和1.11倍,且显著强于前期绿碎茶水提物的测定值[16](IC50=2 952.57 mg/L)(P<0.05)。李晓强等[23]同样研究发现余甘子提取物中多酚含量与羟自由基清除能力呈显著性正相关。由图5和表2可知,各样品的FRAP与质量浓度呈显著正相关性,且彼此间差异显著(P<0.05),剂量依赖性明显。BGTE-FD的FRAP最强,IC50值为27.73 mg/L,其活性约为维生素C的1.15倍,而BGTE-SVD与维生素C的总还原能力次之,IC50值分别为32.85 mg/L和31.86 mg/L,差异不显著(P>0.05)。
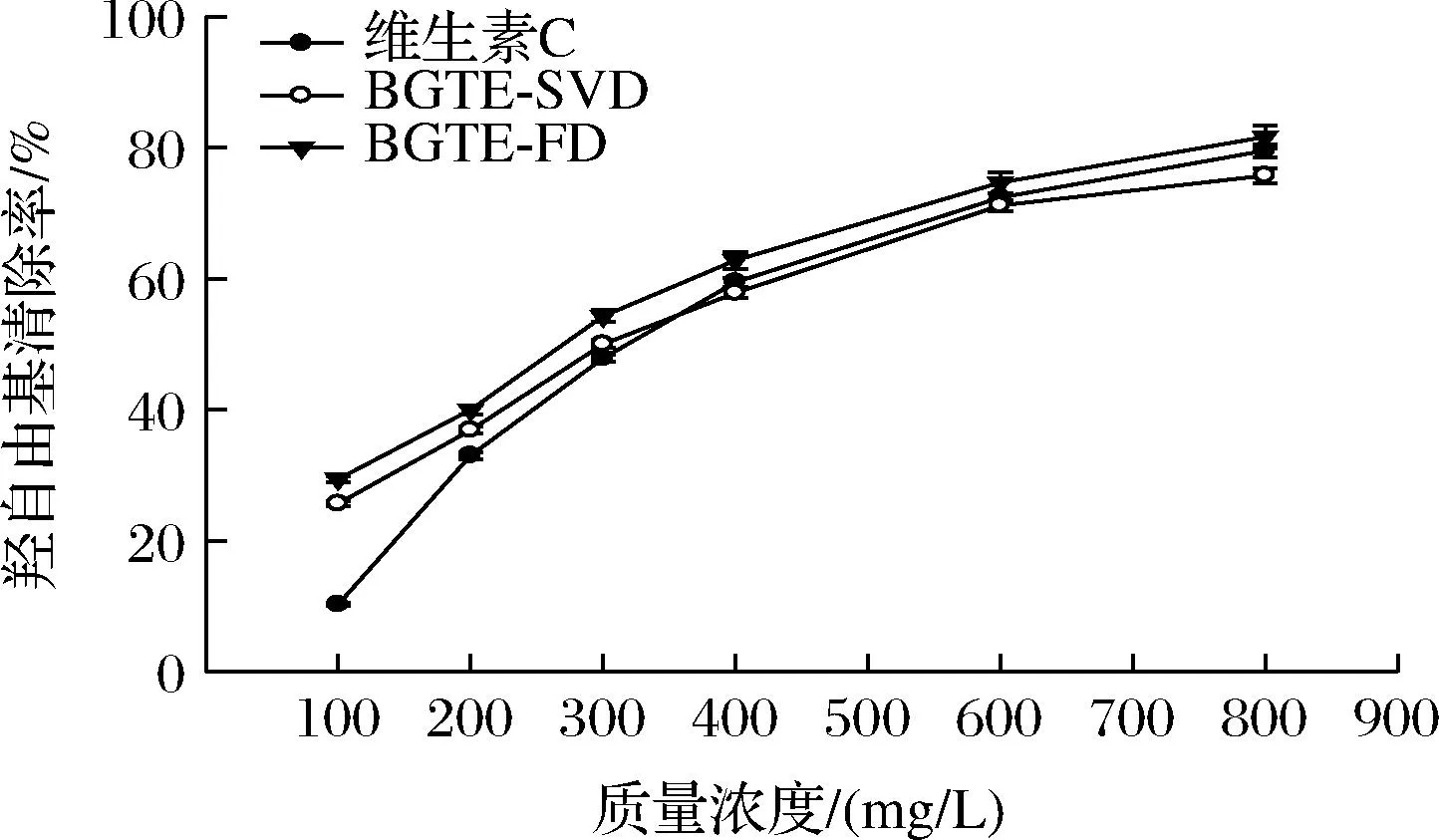
图4 绿碎茶多酚提取物的羟自由基清除能力
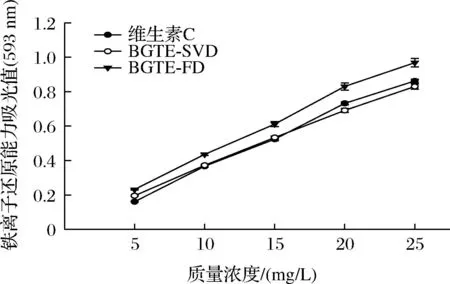
图5 绿碎茶多酚提取物的铁离子还原能力
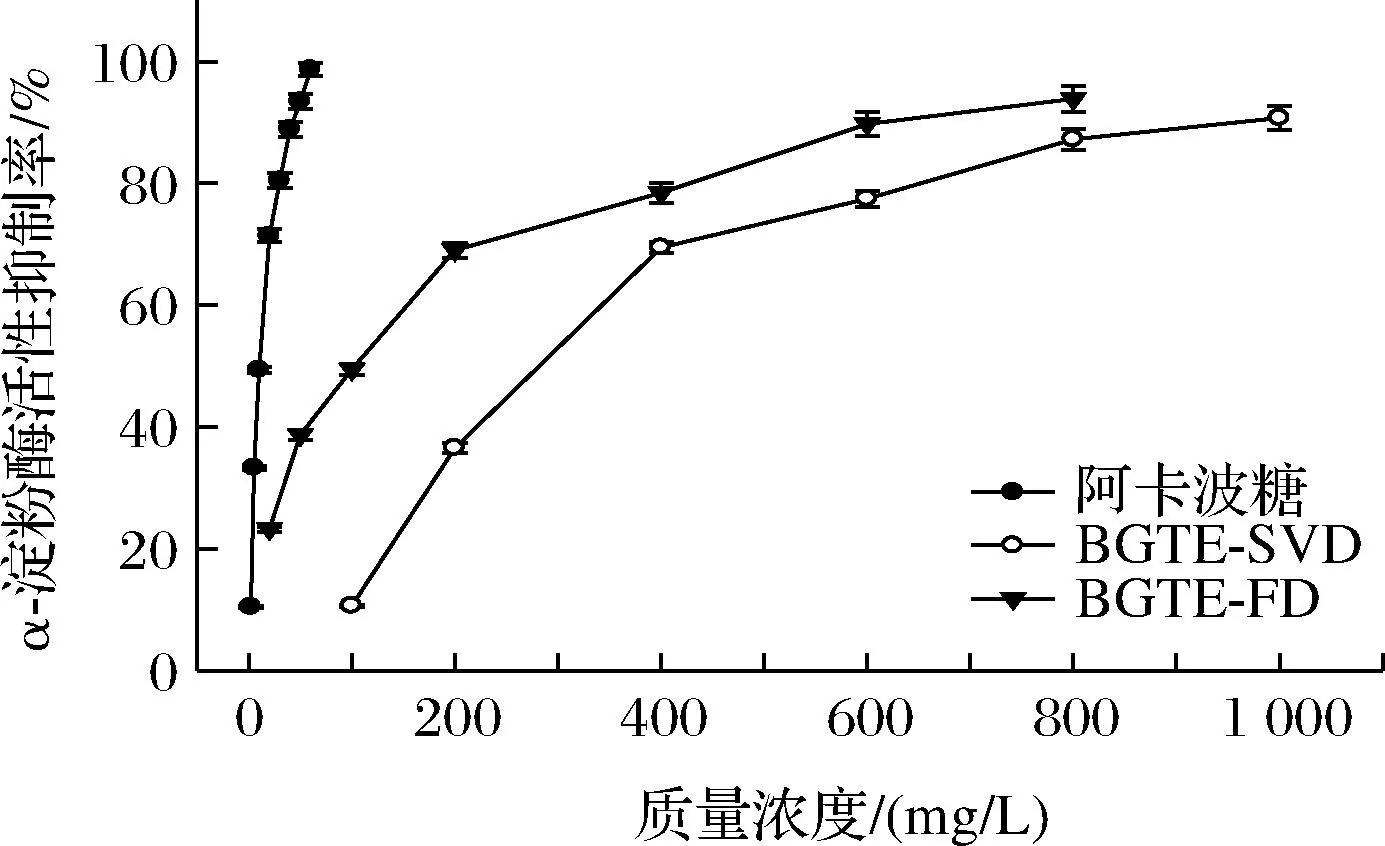
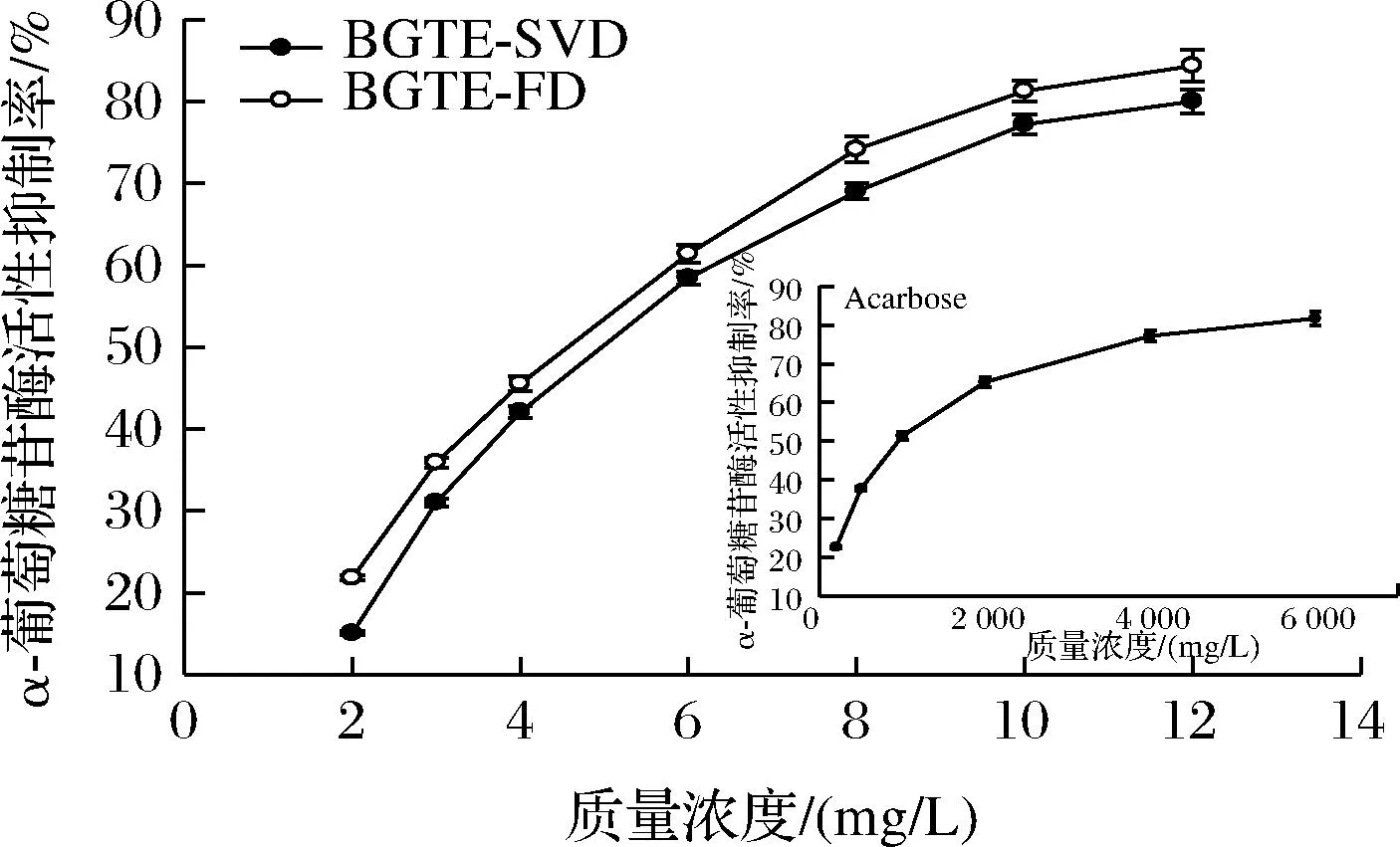
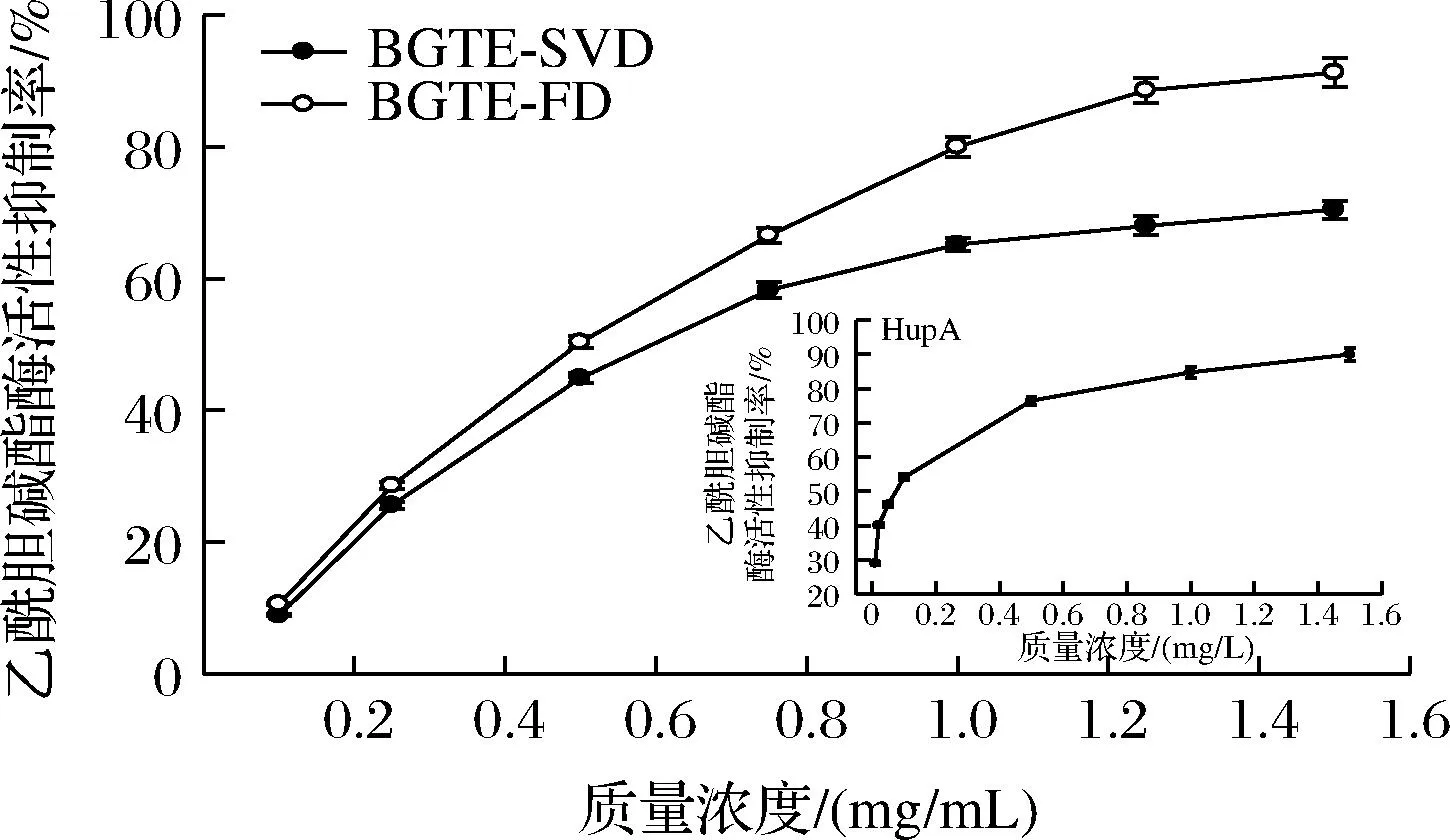
综上所述,绿碎茶多酚提取物的4个抗氧化指标IC50值大小顺序依次为IC50(DPPH) 由图6和表2可知,各样品对α-淀粉酶具有良好的抑制能力,剂量依赖效应显著。BGTE-FD与BGTE-SVD对α-淀粉酶的抑制活性显著低于阿卡波糖(IC50=9.35 mg/L),这与王静等[24]对苹果多酚的研究结论相一致。BGTE-FD抑制α-淀粉酶的能力明显高于BGTE-SVD(P<0.05),两者的IC50值分别为85.84 mg/L和282.64 mg/L,约为阿卡波糖的α-淀粉酶抑制能力的10.89%和3.31%。此外,张宏图等[13]研究发现茶多酚可通过疏水相互作用和氢键与α-淀粉酶结合形成稳定复合物,产生非竞争性抑制作用。 图6 绿碎茶多酚提取物的α-淀粉酶活性抑制能力 由图7和表2可知,绿碎茶多酚提取物具有较强的α-葡萄糖苷酶抑制活性,剂量依赖效应良好。质量浓度为12 mg/L时,BGTE-FD和BGTE-SVD对α-葡萄糖苷酶抑制率分别高达84.56%和80.03%,IC50值分别为4.38 mg/L和4.97 mg/L,差异不显著(P>0.05),其活性显著强于阿卡波糖(IC50=929.59 mg/L),约为阿卡波糖活性的187倍以上,且远高于前期绿碎茶水提物(IC50=390 mg/L)[16]、桑黄醇提物(IC50=430 mg/L)[25]、肉桂多酚(IC50=48 mg/L)[14]及海蒿子多酚(IC50=27.09 mg/L)[8],低于覆盆子多酚提取物(IC50=1.65 mg/L)[10],表明绿碎茶多酚提取物具有天然医药α-葡萄糖苷酶抑制剂的开发潜力。 图7 绿碎茶多酚提取物对α-葡萄糖苷酶活性抑制能力 由图8可知,绿茶碎多酚提取物对荧光性AGEs形成具有良好的抑制作用。反应1 d时,各样品AGEs抑制率均较低。反应3 d时,BGTE-FD和BGTE-SVD的AGEs抑制率快增至35.35%和31.67%(P<0.05),但明显低于AG(67.03%),约为AG抑制能力的52.74%和47.25%。反应6 d时,AG的AGEs抑制率增速变缓,而BGTE-FD和BGTE-SVD的ACEs抑制率继续呈线性增长,其抑制率接近于AG(71.81%),分别高达65.28%和63.66%,远高于玉米须黄酮(IC50=467.9 mg/L)[9],表明绿茶碎多酚提取物具有天然植物源AGEs抑制剂的开发潜力。刘玲等[26]研究表明,茶多酚抗糖基化作用机制主要在于保护蛋白质的巯基、抗氧化作用以及抑制蛋白质的交联反应。 图8 绿碎茶多酚提取物对AGEs形成的抑制能力 天然植物源乙AChE抑制剂是阿尔茨海默病治疗药物的研发热点[27]。由图9和表2可知,绿碎茶多酚提取物对AChE活性具有一定的抑制作用,其抑制能力随着质量浓度的增大而增强,呈现良好的剂量依耐性。BGTE-FD抑制AChE的能力(IC50值416.45 mg/L)显著低于HupA(IC50=0.06 mg/L)(P<0.05),而高于BGTE-SVD(IC50值590.74 mg/L),且远大于云台山毛尖绿茶提取物(质量浓度1 mg/mL的抑制率为56.27%)[28]、丹参乙酸乙酯提取物(IC50值为1.2 mg/mL)[29]以及大果榕果实多酚提取物(IC50值为4.9 mg/mL)[30]。 图9 绿碎茶多酚提取物对乙酰胆碱酯酶活性抑制能力 本文首次采用蒸干结合真空干燥以及真空冷冻干燥2种干燥方式处理绿碎茶乙酸乙酯萃取相,比较研究了两种提取物的色泽、体外抗氧化和抗糖尿病以及乙酰胆碱酯酶抑制活性。结果表明,干燥方式对绿碎茶多酚提取物的色泽及体外生物活性具有显著影响。真空冷冻干燥提取物具有较高的总酚含量及较强的酶抑制能力和AGEs形成抑制能力,其清除DPPH自由基、ABTS阳离子自由基、·OH、铁离子还原及抑制α-葡萄糖苷酶的能力均高于相应的阳性对照抗坏血酸和阿卡波糖,同时对荧光性非酶糖基化终产物抑制率高达65.28%,接近于阳性对照氨基胍,且抑制乙酰胆碱酯酶能力的IC50值仅为416.45 mg/L。因此,真空冷冻干燥的绿碎茶多酚提取物具有良好的天然植物源抗氧化剂以及抗糖尿病和防治老年痴呆药物或保健食品的开发潜力。后续拟对绿碎茶多酚提取物的单体活性组分进行分离纯化、结构鉴定及功效机制探究等工作,并通过细胞模型和动物实验对其体内外生物活性进行综合评价。2.3 绿碎茶多酚提取物的体外抗糖尿病活性

2.4 绿碎茶多酚提取物的AChE抑制活性
3 结论
