布瓦西坦片在健康受试者中的生物等效性研究
2024-03-01徐满秦月雯赖健明曾洁萍程玲
徐满,秦月雯,赖健明,曾洁萍,程玲*
1.江西青峰药业有限公司,江西 赣州 341000
2.成都中医药大学附属医院,四川 成都 610000
流行性病学调查显示,我国约有900 万以上的癫痫患者,并且每年有65~70 万新发癫痫患者[1]。布瓦西坦是第2 代抗癫痫药左乙拉西坦吡咯烷烃的4 位碳原子连接正丙基衍生物,由比利时优时比制药公司研发,用于治疗成人、青少年和2 岁以上儿童部分性癫痫发作[2]。布瓦西坦对突触囊泡蛋白2A具有高亲和力,是左乙拉西坦的15~30 倍,且易透过血脑屏障,显著提高了其抗癫痫活性[3]。布瓦西坦口服吸收迅速,绝对生物利用度约为100%,具有良好的安全性和药动学特征,特别是中枢神经系统的良好耐受性是其优于其他抗癫痫药物的主要原因[2]。空腹服用布瓦西坦片,达峰时间(tmax)0.25~3 h,中位数为1 h,进食高脂餐后布瓦西坦的吸收减缓,tmax中位数为3 h,最大血浆浓度降低37%,但吸收总量不变[4]。布瓦西坦与血清蛋白质结合率较低(≤20%)。布瓦西坦主要通过乙酰胺基团的水解和丙基侧链羟基化,在体外,布瓦西坦羟基化主要由CYP2C19 介导,代谢无药理活性[5]。超过95%的剂量(包括代谢物)在72 h 内通过肾脏排泄,终末血浆半衰期(t1/2)约为9 h[4]。瓦西坦尚未在我国批准进口,2019 年6 月国家卫生健康委员会公布《关于第一批鼓励仿制药品目录建议清单的公示》,涉及34 个品种,布立西坦名列其中,因此仿制该药对于我国癫痫患者的治疗具有重要意义。本研究建立了快速、灵敏、准确的UPLC-MS/MS 法测定布瓦西坦的血药浓度,评价自制布瓦西坦片与原研布瓦西坦片在健康受试者中的生物等效性。
1 材料与对象
1.1 仪器
LC-20ADXR 高效液相色谱仪(日本岛津公司),包括CBM-20A Lite 系统控制器,LC-20ADXR液相泵,DGU-20A5R 脱气机,CTO-20AC 柱温箱;Turbo Spray 离子源(Applied Biosystems/Sciex);API4000 质谱仪(Applied Biosystems/Sciex)配有电喷雾离子化源(ESI)、Analyst 1.6.3 数据采集系统。
1.2 药品与试剂
布瓦西坦片受试制剂(T),规格50 mg/片,江西青峰药业有限公司生产,批号20 181114;布瓦西坦片参比制剂(R),规格50 mg/片,UCB Pharma S.A.公司生产,批号224103。布瓦西坦对照品,质量分数98%,TRC 公司,批号1-NYL-116-1;内标布瓦西坦-d7对照品,质量分数98%,TLC 公司,批号3263-001A5。甲醇、乙腈为色谱纯(Merck KgaA 公司),醋酸铵、甲酸为ACS 级(Sigma-Aldrich 公司)。
1.3 研究对象
空腹试验共筛选58 例18 岁以上健康成年受试者,最终入组28 例,其中男性18 例,女性10 例,年龄(24.43±4.22)岁,身高(165.75±8.23)cm,体质量(58.79±8.72)kg,身体质量指数(21.26±1.93)kg/m2。餐后试验共筛选53 例受试者,最终入组28 例,其中男性19 例,女性9 例,年龄(25.93±5.29)岁,身高(165.04±8.43)cm,体质量(59.45±8.09)kg,身体质量指数(21.70±1.81)kg/m2。入组的受试者均完成试验,均纳入全分析集、安全性分析集、药动学浓度集。所有受试者均自愿签订知情同意书。编号C003 受试者因方案违背,剔除参数数据进行分析;编号C005 受试者在第2周期发生呕吐,剔除其数据进行分析。本研究经成都中医药大学附属医院医学伦理委员会的审查同意,伦理批件号2018ZL-016。
2 方法与结果
2.1 给药方案
空腹和餐后试验均采用单中心、单剂量、随机、开放、两周期、交叉试验设计。采用区组随机法将受试者分配至2 个给药顺序组,每组14 人。每个周期给药1 次,清洗期为7 d。空腹试验给药前禁食至少10 h,餐后试验服用高脂餐前禁食至少10 h,于给药前30 min 依次进食高脂高热餐,随后按照随机表分别单次给予布瓦西坦片受试制剂或参比制剂50 mg 即1 片,用240 mL 温水送服。服药前后1 h 内禁止饮水。
2.2 样本采集
受试者于给药当天早晨埋留置针。空腹试验时每个周期采集18 管静脉血,分别在给药0 min(给药前60 min 内)及给药后10、20、30、45 min 以及1、1.25、1.5、2、2.5、3、4、6、8、12、24、36、48 h 由外周静脉采血约4 mL;餐后试验时每个周期采集19 管静脉血,分别在给药0 min(给药前60 min 内)及给药后0.25、0.5、1、1.5、2、2.5、2.75、3、3.25、3.5、4、5、6、9、12、24、36、48 h 由外周静脉采血约4 mL。各时间点采集的血样置于K2EDTA 真空采血管中,4 ℃下2 500×g离心10 min,取上层血浆置冻存管中,置−20 ℃冰箱,备用。
2.3 LC-MS/MS 法测定布瓦西坦
2.3.1 色谱条件 Kinetex 2.6 μm XB-C18100Å 色谱柱(50 mm×2.1 mm,2.6 μm);流动相:含0.1%甲酸和5 mmol/L 醋酸铵的水溶液(A)–100%甲醇(B),梯度洗脱(0~0.40 min 43% B,0.40~1.90 min 43%~50% B,1.90~3.00 min 100% B,3.00~4.00 min 100%~43% B);体积流量:0.350 mL/min;柱温:40 ℃;进样室温度:8 ℃;进样量:5.00 μL。
2.3.2 质谱条件 电离模式:ESI 电喷雾离子化源(正离子方式);扫描模式:多反应监测模式;离子源喷雾电压:3 500 V;离子源温度:600 ℃;气帘气:35 psi(1 psi=6 895 Pa);雾化气:30 psi;辅助气:50 psi;接口加热:ON;碰撞气:6 Unit;Q1、Q3 分辨率均为Unit。用于定量分析的反应离子对:布瓦西坦m/z213.1→168.1,布瓦西坦-d7220.1→175.2,去簇电压分别为50、60 V,射入电压均为9 V,碰撞电压分别为19、20 V,碰撞室射出电压分别为15、14 V,扫描时间为0.2 s。
2.3.3 溶液的配制
(1)标准曲线储备液的配制:取适量布瓦西坦对照品,质量校正系数校正后溶于甲醇,制得1.00 mg/mL 储备液,于透明玻璃瓶、−20 ℃条件下保存。
(2)标准曲线工作液的配制:用50%甲醇溶液稀释储备液配制成质量浓度为5.00(LLOQ)、10.00、50.00、200.00、600.00、1 500.00、2 400.00、3 000.00 ng/mL(ULOQ)标准曲线工作溶液,贮存于透明聚丙烯管中,于−20 ℃条件下保存。
(3)内标储备液和工作溶液的配制:取1 支布瓦西坦-d7对照品,经质量校正系数校正后,将其溶于甲醇中,得到1.00 mg/mL 内标储备液,于棕色玻璃瓶、−20 ℃条件下保存。用50%甲醇溶液稀释内标储备液以配制内标工作溶液,并将其贮存于透明聚丙烯管中,于−20 ℃条件下保存。
(4)质控(QC)样品的配制:以人血浆(以K2EDTA 作为抗凝剂)作为空白基质配制质控样品,用50%甲醇溶液稀释布瓦西坦储备液,配制成12.00(LQC)、500.00(MQC)、2 250.00(HQC)、6 000.00(DQC)ng/mL 的质控样品溶液,并将其贮存于透明聚丙烯管中,于−20 ℃条件下保存。
2.3.4 血浆样本处理 待测样品(待测生物样品、标准曲线样品、质控样品)室温融化涡旋混匀后,向96 孔板中加入50.0 μL 样品(待测生物样品、标准曲线样品、质控样品);对于双空白样品和零点样品,加入50.0 μL 空白人血浆。向除双空白样品和不含内标的定量上限样品外的所有样品中加入30.0 μL 500 ng/mL 内标工作溶液;对于双空白样品和不含内标的定量上限样品中,加30.0 μL 50%甲醇溶液。将96 孔板充分振摇1 min 后向所有样品孔中加入400 μL 乙腈,密封振摇10 min 后将96 孔板在室温条件下以4 000 r/min 离心10 min。转移30.0 μL上清液至干净的96 孔板中,将所有的样品上清液用270 μL 50%甲醇溶液稀释,充分振摇10 min 后置于自动进样器中,进行HPLC-MS/MS 分析。
2.3.5 选择性试验 在6 个不同来源的单个空白基质中,待测物、内标干扰峰的平均响应(峰面积)不超出定量下限标准曲线样品平均响应的0.0%。制备3 个重复的零点样品以考察内标对分析物测定的干扰,在空白样品中加入定量上限浓度的分析物而不加内标,配制不含内标的定量上限样品考察分析物对内标测定的干扰,不加内标的定量上限样品、零点样品中待测物干扰峰的平均响应均不超出定量下限标准曲线样品平均响应的0.0%。取20.0 μL冷冻全血加入980 μL 空白血浆得溶血基质,将20%英脱利匹特加入941 μL 空白血浆,制得高脂基质,在高脂、溶血基质配制的双空白样品中,在待测物或内标保留时间附近没有显著干扰。见图1。

图1 布瓦西坦的HPLC-MS/MS 典型色谱图Fig.1 Typical HPLC-MS/MS chromatograms of brivaracetam
2.3.6 标准曲线和定量下限 根据2.3.3(1)项下加入到人空白血浆中配制5.00、10.00、50.00、200.00、600.00、1 500.00、2 400.00、3 000.00 ng/mL标准曲线样本溶液。通过使用权重因子1/x2,采用Watson LIMS 7.5 SP1 软件回归,线性回归得到理论质量浓度与响应之间的线性关系进行定量,得标准曲线方程Y=5.614×10−3X-2.621×10−4(R2=0.998 7),线性范围为5.00~3 000.00 ng/mL。最低定量下限为5.00 ng/mL。
2.3.7 准确度和精密度试验 5.00 ng/mL(LLOQ QC)、12.00 ng/mL(LQC)、500.00 ng/mL(MQC)、2 250.00 ng/mL(HQC)质控样每个质量浓度重复6次评估准确度和精密度,4 个质量浓度水平的质控样品检测结果的批内、批间精密度RSD 值均小于5.8%,准确度偏差为−3.2%~12.8%。见表1。
表1 准确度和精密度试验结果(,n=6)Table 1 Results of accuracy and precision tests (,n=6)

表1 准确度和精密度试验结果(,n=6)Table 1 Results of accuracy and precision tests (,n=6)
2.3.8 稀释可靠性试验 配制一个质量浓度超过定量上限的稀释质控样品DQC(6 000.00 ng/mL)和高质量浓度质控样品HQC(2 250.00 ng/mL),然后用空白人血浆将质控样品稀释,使其质量浓度落在标准曲线线性范围内。在2 250.00~6 000.00 ng/mL,质控样品待测物平均测定准确度偏差为2.7%(HQC:2 250.00 ng/mL)、−5.2%(DQC:6 000.00 ng/mL),测定精密度RSD 值小于2.4%。因此,稀释因子为1∶5 时具有良好的稀释可靠性。
2.3.9 稳定性试验 布瓦西坦血浆样品在室温下放置20.2 h 稳定性良好,在−20、−70 ℃条件下5 次冻融循环稳定性良好,在−20、−70 ℃条件下长期冰冻56 d 稳定性良好,血浆样品处理后的上清液在8 ℃自动进样器中放置7 d 稳定性良好,见表2。
表2 稳定性试验结果(,n=3)Table 2 Results of stability test (,n=3)
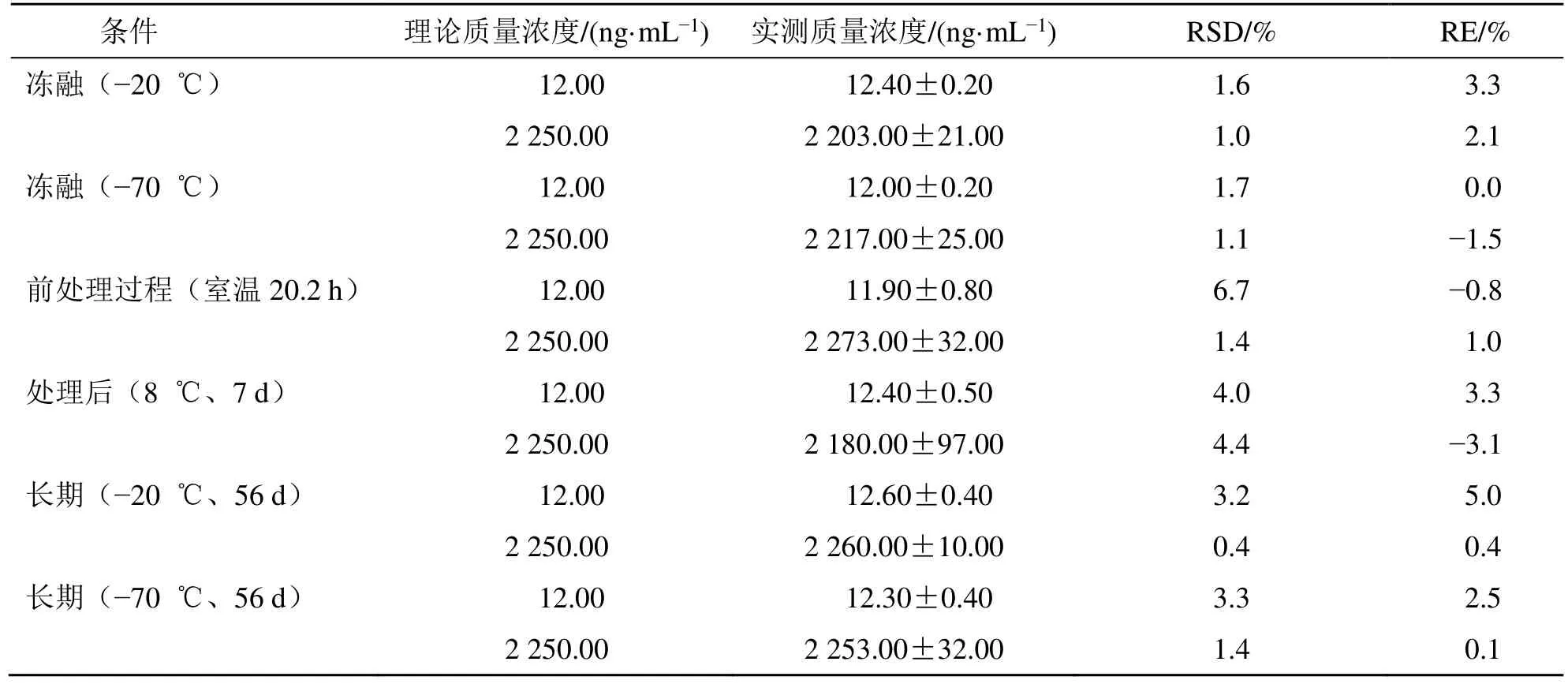
表2 稳定性试验结果(,n=3)Table 2 Results of stability test (,n=3)
2.3.10 基质效应 以6 个不同来源的空白人血浆制备的双空白样品,提取之后加入待测物和内标,以使其最终质量浓度分别与12.00、500.00、2 250.00 ng/mL 质控样品的进样质量浓度一致,同时配制含有一定量待测物和内标的纯溶液,其最终质量浓度分别与12.00、500.00、2 250.00 ng/mL 质控样品的进样质量浓度一致。通过计算基质存在下的峰面积与不含基质的峰面积的比值,计算每一个待测物和内标的基质因子。进一步通过待测物的基质因子除以内标的基质因子,计算经内标归一化的基质因子(基质效应因子=基质样品峰面积平均值/对照溶液峰面积平均值)。6 个不同来源的单个基质在12.00、500.00、2 250.00 ng/mL 水平下,内标归一化的基质因子均值为98.6%~101.9%,精密度RSD 值≤0.7%,3 个质量浓度水平内标归一化的基质因子平均值为100.6%,精密度RSD 值为1.7%。高脂基质12.00、2 250.00 ng/mL 水平的质控样品准确度偏差均值分别为3.3%、−2.8%,精密度≤4.8%。溶血基质12.00、2 250.00 ng/mL 水平的质控样品准确度偏差均值分别为1.7%、−4.1%,精密度RSD 值≤2.7%。上述结果表明,各类基质对血浆中的布瓦西坦无显著影响,不影响定量分析。
2.3.11 提取回收率试验 内标测定质量浓度为500.00 ng/mL,待测物测定质量浓度为定量范围内3个质量浓度水平12.00、500.00、2 250.00 ng/mL。6个重复的12.00、500.00、2 250.00 ng/mL 质控样品(LQC、MQC、HQC)与18 个双空白样品一同处理。处理后,将含有待测物和内标的溶液加入空白人血浆制备的双空白样品中,以使其最终质量浓度与12.00、500.00、2 250.00 ng/mL 质控样品的进样质量浓度一致。通过比较单个质控样品中待测物或内标响应值与提取后加入待测物、内标的双空白样品的响应值,计算回收率(回收率=提取后样品峰面积/未经提取峰面积平均值)。血浆样品中布瓦西坦的提取回收率为96.3%~99.6%,在12.00、500.00、2 250.00 ng/mL 下的平均提取回收率分别为97.1%、96.3%、99.6%。内标布瓦西坦-d7的回收率为95.5%。
2.3.12 残留 在批量样品检测过程中的残留结果为待测物残留0~6.8%,内标残留0~0.1%,不影响定量分析。
残留=双空白样品中待测物或内标的最大峰面积/该分析批LLOQ(5.00 ng/mL)标准曲线样品最小峰面积值
2.4 药动和生物等效性研究
2.4.1 血药浓度–时间曲线 根据测定的血药浓度绘制血药浓度–时间曲线,空腹和餐后试验中受试者口服受试试剂、参比制剂的血药浓度–时间曲线见图2。

图2 空腹(A)和餐后(B)受试者口服受试制剂、参比制剂后布瓦西坦的平均血药浓度-时间曲线Fig.2 Mean concentration-time curves of brivaracetam in subjects after po administered with test and reference preparation under fasting (A) and fed (B) condition
2.4.2 药动学参数和统计分析 使用 Phoenix WinNonlin 8.1 软件,按照非房室模型并基于实际采血时间点计算每位受试者的药动学参数,包括Cmax、AUC0-t、AUC0-∞、tmax、t1/2、λz和AUC%Extrap,主要药动学参数为Cmax、AUC0-t、AUC0-∞。空腹和餐后状态下口服布瓦西坦片的主要药动学参数见表3。

表3 空腹和餐后口服布瓦西坦片的主要药动学参数Table 3 Main pharmacokinetic parameters after po Brivaracetam Tablets under fasting or fed condition
2.4.3 生物等效性评价 基于生物等效性分析集(BES),采用SAS 9.4 软件进行两个制剂药动学参数的推断性统计分析。对受试制剂、参比制剂的主要药动学参数Cmax、AUC0-t、AUC0-∞进行自然对数转换,进行线性混合效应模型分析,基于主要药动学参数(AUC0-∞、AUC0-t和Cmax)的线性混合效应模型分析,计算两个制剂主要药动学参数(AUC0-∞、AUC0-t和Cmax)几何均数比值及其90%置信区间,并采用双单侧t检验进行生物等效性判定。受试制剂相对参比制剂的AUC0-∞、AUC0-t和Cmax几何均数比值的90%置信区间在80.00%~125.00%则认为两制剂生物等效。空腹、餐后生物等效性评价结果见表4。结果表明,在空腹和餐后状态下口服布瓦西坦受试制剂、参比制剂的几何均值比、90%置信区间均在等效区间范围内,二者具有生物等效性。
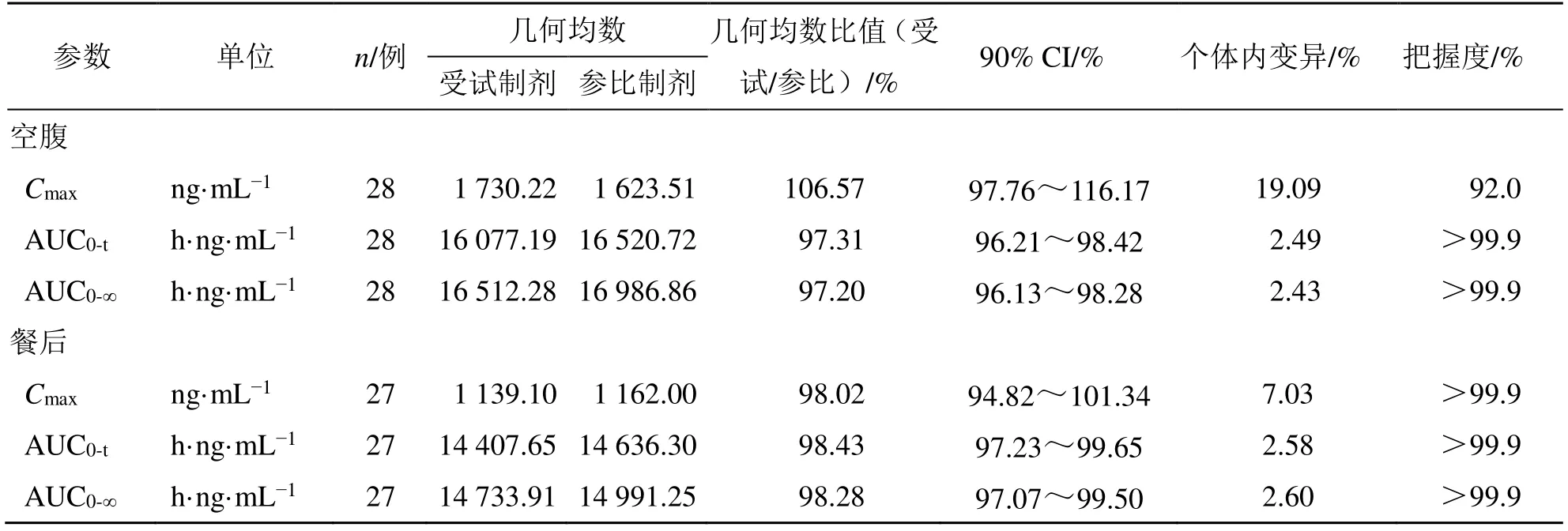
表4 空腹和餐后状态下布瓦西坦片主要药动学参数的生物等效性分析Table 4 Bioequivalence analysis of main pharmacokinetic parameters of Brivaracetam Tablets under fasting condition and fed condition
3 讨论
布瓦西坦作用机制独特,主要通过突触囊泡蛋白2A 高亲和作用和钠离子通道抑制作用,具有较好的抗癫痫活性。布瓦西坦在体内吸收迅速,空腹给药受试制剂在0.34 h 即可达峰,较参比制剂和既往文献报道更迅速[6],其半衰期约为9 h。
餐后试验中,受试试剂、参比制剂的吸收较空腹试验均延迟了约2 h,这可能与食物能降低胃排空速率有关[7],进食后吸收程度无显著差异,这与文献报道的结果一致[4]。空腹给药相对餐后给药的疗效更快,生物利用度更高,在充分考虑药物安全性的情况下为了提高药物临床疗效,可优先选择空腹服药。
本研究进行的餐后和空腹试验中,布瓦西坦片的Cmax、AUC0-t、AUC0-∞、tmax和t1/2与既往试验中的药动学参数基本一致,与原研进行的试验中得到的药动学参数无明显差别[3,6,8]。
本研究建立了LC-MS/MS 法测定人血浆中布瓦西坦,方法快速、准确、选择性高、稳定性好,适用于布瓦西坦的药动学研究。健康受试者空腹口服试验结果表明布瓦西坦受试制剂与参比制剂具有类似的药动学特性、生物等效。
利益冲突所有作者均声明不存在利益冲突
