耐盐菌生物强化耦合催化臭氧氧化处理渗滤液RO 浓液及微生物特性分析*
2024-03-01袁春波朱宇楠楼紫阳
袁春波 朱宇楠 张 楚 刘 伟 楼紫阳,3 张 千
(1.重庆理工大学化学化工学院,重庆,400054;2.上海交通大学重庆研究院,重庆,401147;3.上海交通大学环境科学与工程学院,上海,200240)
目前国内对渗滤液处理大多采用“预处理+生物处理+膜深度处理”的主流工艺.其中,采用纳滤或反渗透滤等膜分离系统不可避免会产生占渗滤液处理总量约20%—30%的浓缩液[1].其中反渗透膜滤浓缩液中COD 的浓度范围在500—1500 mg·L−1,其中腐殖质含量较高,占总TOC 的27.4%—52.3%,总氮100—200 mg·L−1,其中有机氮含量较高,占总氮的50%—60%,同时浓缩液含盐量较高,电导率为7.53—20.05 ms·cm−1,处理难度极大,是众多垃圾填埋场面临的难题之一.
目前,对于浓缩液中有机物的处理已形成比较成熟的技术,如两级物料膜技术,臭氧高级氧化技术可以对有机物中腐殖质进行有效的分离和降解[2−3],而总氮的去除依然是处理的重点和难点.对于总氮的去除,目前普遍采用的是生物处理技术,如A2/O 技术[4],由于浓缩液可生化性差、有机氮含量高且盐度极高,导致传统脱氮微生物难以在极端环境下有效脱氮[5−7];耐盐微生物和嗜盐微生物在处理高含盐废水中发挥积极作用,通过耐盐菌或嗜盐菌接种强化活性污泥是处理含盐废水的最佳方法.利用耐盐菌强化活性污泥处理硫酸钠质量分数为38%的精细化工行业产生的废水,其对COD 的去除率大于95%[8];郭立[9]分离筛选出针对高含盐垃圾渗滤液中COD 的降解菌种.大多数的研究只关注COD 的去除,对脱氮的关注较少,仅有的强化耐盐菌,也是传统的强化硝化菌和反硝化菌,由于渗滤液浓缩液水质差异较大,本研究处理的RO 浓液有机氮含量较高,而对于强化有机氮氨化和好氧反硝化强化菌研究鲜有报道.此外,目前对于高级氧化处理前后有机物变化研究较多,厌氧/好氧生物处理过程中有机物的去除效果研究较多,而对于处理过程中有机物成分的变化研究较少[8−10].因此,如何脱除渗滤液浓缩液中有机物和总氮,使渗滤液浓缩液达标排放仍是迫切需要解决的问题.
团队前期研究中开发了在高盐条件下仍具有良好的生长态势和污染物降解效果的厌氧耐盐菌TN-YN 和好氧耐盐菌TP-HN,将耐盐菌与活性污泥法相结合耦合催化臭氧氧化,构建一种垃圾渗滤液反渗透膜滤浓缩液的处理方法.在高盐条件下,通过厌氧耐盐菌的氨化作用先将浓缩液中有机氮转化为氨氮,再通过具有好氧反硝化功能的好氧耐盐菌强化好氧活性污泥,在好氧条件下实现NH4+-N、TN 的同步去除[11],解决传统A2/O 技术在高盐条件下反硝化受到抑制的问题,再通过催化臭氧氧化对难降解有机物的去除,确保出水中COD、TN 达标排放.同时,对比活性污泥、耐盐菌剂、活性污泥+耐盐菌剂3 个体系的污染物去除效果、有机物去除效果和生物多样性变化,进一步探讨体系的脱氮机理,为揭示耐盐菌强化机理提供科学依据.
1 材料与方法(Materials and methods)
1.1 实验装置
本实验采用A/O+催化臭氧氧化处理垃圾渗滤液RO 浓液,实验装置如图1 所示.图1(a)为厌氧实验装置,3 组500 mL 锥形瓶,磁力搅拌水浴锅进行加热搅拌.图1(b)为好氧实验装置,3 组500 mL 锥形瓶,磁力搅拌水浴锅进行加热搅拌,曝气泵提供曝气.图1(c)为催化臭氧氧化实验装置,包括纯氧钢瓶(浓度为99.999%)、臭氧发生器(广州创环,CH-ZTWSG)、催化臭氧氧化反应主体及尾气处理装置,反应器主体为有效容积500 mL 的锥形瓶,尾气采用30% KI 溶液吸收后排入空气.

图1 实验装置图Fig.1 Experimental device diagram
1.2 实验材料
1.2.1 实验水质
实验用水为某垃圾填埋场垃圾渗滤液RO 浓液,水质情况见下表1.

表1 实验用水水质Table 1 Water quality for experimental use
1.2.2 实验菌剂
本实验中的耐盐厌氧菌(产品型号:TN-YN,主要成分含深红红球菌C1、莱比托游动球菌、铜绿假单胞菌、粪产杆菌和不动杆菌,专利申请号: 202110419569.1)和耐盐好氧菌(产品型号: TP-HN,主要成分含醋酸钙-不动杆菌TAJ-1、施氏假单胞菌、反硝化盐单胞菌和贪铜菌SWA1,专利申请号: 201911106185.3)均为团队前期研发,其中耐盐好氧菌剂中含有具有异养硝化-好氧反硝化功能的菌株,可在好氧条件下实现NH4+-N、TN 同步去除.
1.2.3 活性污泥
实验污泥取自巴南区高速公路服务区污水处理设备.厌氧活性污泥体系中污泥浓度4—6 g·L−1,污泥沉降比(SV30)60%—70%;好氧活性污泥体系中污泥浓度2.5—4.0 g·L−1,SV30 范围30%—40%.
1.2.4 催化剂的制备
催化臭氧氧化所用催化剂为制备的粉末活性炭负载金属铈.其制备采用传统的浸渍-低温灼烧法,对粉末活性炭进行改性.活性炭于5%稀盐酸溶液中煮沸1 h,过滤并用去离子水冲洗至中性,110 ℃烘箱中烘干保存备用.将1% wt 的 Ce(NO3)3浸渍液3 mL 均匀的滴在AC 粉末上,风干后制备催化剂.最后将风干的催化剂放入管式炉中,氮气作为保护气,以3 ℃·min−1升温至450 ℃并恒温煅烧2 h,冷却后得到Ce-AC 催化剂(催化剂制备中所使用的粉末活性炭采购自上海泰坦科技,规格为200 目,所使用的负载物 Ce(NO3)3·6H2O 晶体采购自成都科隆).
1.3 实验方法
1.3.1 参数检测方法
研究过程中水质和污泥的检测均参照水和废水监测方法第四版中国标法进行,具体方法如表2所示.

表2 检测项目及方法Table 2 Detection Items and Methods
1.3.2 生物强化对比实验
厌氧生物强化对比实验:首先向3 组锥形瓶中加入垃圾渗滤液浓缩液500 mL(每组试验分别进行3 组平行试验),分别向3 组锥形瓶中加入体积比1%的活化厌氧耐盐菌剂、10%体积的厌氧活性污泥、1%的活化厌氧耐盐菌剂+10%体积的厌氧活性污泥,最后分别向3 组锥形瓶加入1 g 无水亚硫酸钠(创造厌氧环境),用橡胶塞密封,由伸入液面以下的水样采集管向锥形瓶中持续通入氮气30 min 去除水中溶解氧.置于磁力搅拌水浴锅中加热搅拌,在溶解氧<0.1 mg·L−1,温度(30±1)℃,磁力搅拌转速10—20 r·min−1条件下运行,运行处理8 d 后达到稳定状态,每24 小时取样检测.
厌氧耐盐菌的活化的具体步骤如下:称量5 g 的耐盐厌氧菌剂(TN-YN)粉末加入装有100 mL 自来水的锥形瓶中,加入1 mL 菌种激活剂(采购重庆士继生态环境科技有限公司,产品型号:JH-1,主要成分含产甲烷细菌、假单胞菌、乳酸菌、酵母菌、活化剂等,活菌含量≥100 亿·g−1),加入5 g 的葡萄糖(一水,分析纯,采购自成都市科隆化学品有限公司),加0.6 g 的无水亚硫酸钠(分析纯,采购自成都市科隆化学品有限公司),放置在30 ℃的恒温水浴锅静置活化24 h,每隔6—8 h 混匀1 次,最终形成活化好的菌液,菌液浓度OD 值为1.4—1.5.
好氧生物强化对比实验:将厌氧处理稳定后的出水400 mL 倒入锥形瓶中,以无水乙酸钠补加200 mg·L−1碳源,向厌氧耐盐菌体系及厌氧耐盐菌+活性污泥体系中各加入体积比0.2%的活化好氧耐盐菌剂.置于磁力搅拌水浴锅中加热搅拌,在溶解氧2—3 mg·L−1,温度(30±1)℃,磁力搅拌转速600—620 r·min−1条件下运行,运行处理4 d 后达到稳定,每24 小时取样检测.
好氧耐盐菌活化的具体步骤如下:称量5 g 的耐盐好氧菌TP-HN 粉末加入装有100 mL 自来水的锥形瓶中,加入1 mL 菌种激活剂(采购自重庆士继生态环境科技有限公司,产品型号:JH-1,主要成分由能形成芽孢(内生孢子)的杆菌或球菌组成,活菌含量≥100 亿·g−1),加入5 g 的葡萄糖(一水,分析纯,采购自成都市科隆化学品有限公司),放置在30 ℃的恒温摇床进行活化,摇床转速150 r·min−1,活化24 h,最后形成活化好的菌液,菌液浓度OD 值为1.7—1.8.
1.3.3 臭氧催化氧化
臭氧催化氧化反应在图1(c)所示反应装置中进行,取好氧反应出水300 mL 于500 mL 锥形瓶中,加入5 g Ce-AC,进气臭氧浓度为90 mg·L−1,臭氧流量为1 L·min−1[12],在恒定温度30 ℃条件下反应3 h.
1.3.4 高通量测序
获取活性污泥、耐盐菌和活性污泥+耐盐菌体系稳定运行的生物样样品,储存在−80 ℃环境下的0.9%生理盐水中,分别标记为:A1、A2、A3、B1、B2和B3,利用MobioPowerSoil® DNA Isolation Kit 提取固定化菌液总基因组DNA 后采用MiSeq 平台对16S rDNA 基因高变区序列进行测序以进行生物多样性分析,考察不同体系对系统中微生物群落结构的影响.为了确保每个扩增子的长度大于550 bp,使用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)扩增16S rRNA V3/V4 区域.采用Trimmomatic 和FLAH 获得清晰的读取,并使用uparse 方法在usearch 平台上根据97%的相似阈值将序列划分为多个组.
2 结果与讨论(Results and discussion)
2.1 厌氧体系对污染物去除效果的影响
厌氧条件下,如图2(a,b),厌氧耐盐菌、厌氧活性污泥和厌氧耐盐菌+厌氧活性污泥3 个体系的TOC 和COD 去除效果无明显差别.3 个体系出水稳定后,如图2(c)所示,有机氮含量分别为37.7、33.2、2.7 mg·L−1,厌氧耐盐菌+厌氧活性污泥有机氮的转化率最高为97%,较单独厌氧活性污泥和耐盐菌体系有机氮的转化率分别提高了42%和37%,从图2(d)中可以看出,3 个体系的NH4+-N 浓度均出现上升趋势,出水NH4+-N 浓度分别提高了62%、160%和193%,可能是厌氧氨氧化细菌的氨化作用,将有机氮转化为NH4+-N[13];盐度会对体系的氨氧化效率产生影响[14],而厌氧耐盐菌体系+厌氧活性污泥体系对有机氮的转化效果最好,可能是在厌氧环境中,厌氧耐盐菌强化厌氧活性污泥体系,提高体系微生物耐盐耐毒性,使体系中厌氧微生物增多,氨化细菌对有机氮实现氨化作用,将其转化为NH4+-N[15].

图2 厌氧实验结果a.TOC;b.COD;c.有机氮;d.NH4+-N;e.TN;f.NO3−-NFig.2 Anaerobic resultsa.TOC;b.COD;c.organic nitrogen;d.NH4+-N;e.TN;f.NO3−-N
如图2(e,f)所示,厌氧耐盐菌体系、厌氧耐盐菌体系+厌氧活性污泥体系的TN 去除率无显著差别,TN 的去除主要是由于厌氧过程中的反硝化作用去除NO3−-N 使得出水TN 降低.
2.2 好氧体系对污染物去除效果的影响
对厌氧出水进行好氧处理.如图3(a,b)所示,好氧耐盐菌、好氧活性污泥和好氧耐盐菌+好氧活性污泥3 个体系对TOC 和COD 的去除效率无明显差别,均为37%左右.根据图3(c,d,e)所示,3 个体系的NH4+-N 去除率分别为88%、92%、97%,姜海凤等[10]研究表明,当进水盐度从1%增加至5%,其NH4+-N 的去除率由90%降至45%以下,将蜡状芽孢杆菌耐盐菌引入活性污泥中,强化体系对盐度的耐受性,当盐度为5%,其NH4+-N 的去除率高于70%,这一结果说明蜡状芽孢杆菌生物强化能显著提高体系的耐盐特性和污染物去除效果;NO3−-N 最大去除率分别为-169%、49%、61%;好氧耐盐菌+好氧活性污泥体系对TN 去除率最高为85%,较单独好氧活性污泥和耐盐菌体系TN 去除率分别分别提升了37%和77%.其中好氧耐盐菌+好氧活性污泥体系对NH4+-N、NO3−-N、TN 的去除效果明显高于另外两个体系,出水浓度分别为1.4 mg·L−1、5.6 mg·L−1、9.4 mg·L−1.本研究将好氧耐盐菌加入活性污泥体系中,能够显著提高NH4+-N、TN 的去除效果,推测好氧耐盐菌强化活性污泥体系,提高其体系中耐盐硝化、反硝化菌的丰度,在高盐条件下对系统脱氮发挥关键作用,从而显著提高脱氮效果.

图3 好氧实验结果a.TOC;b.COD;c.NH4+-N;d.TN;e NO3−-NFig.3 Aerobic test results
2.3 臭氧催化氧化结果
渗滤液浓缩液经过厌氧/好氧处理后,出水NH4+-N、TN 均满足我国制定的《生活垃圾填埋场污染控制标准》(GB16889—2008)中表2 规定水污染物排放浓度限值,但COD 依然无法达到排放要求,因此,对好氧活性污泥+好氧耐盐菌体系的出水进行催化臭氧氧化实验,臭氧在催化剂的作用下,产生氧化还原电位更高的羟基自由基(·OH),实现COD 和TN 的同步去除.在这一过程中,难降解有机物结构被破坏,有机氮被分解,并对氮素有一定吹脱,实现总氮的去除.如表3 所示,经过耐盐菌生物强化耦合催化臭氧氧化处理渗滤液RO 浓缩液,其出水COD、NH4+-N、TN 均低于排放浓度限值.
本研究所用益气固本胶囊用于哮喘病缓解期的治疗,具有益气养阴、补肺脾肾的功效。诸药合用达到补肺助其宣降以清痰窠,健脾助其运化以绝痰源,补肾壮其元气以充肺根,从而除伏痰,铲夙根,临床运用多年,有巩固疗效、降低哮喘复发率的作用[12-14]。本研究旨在研究益气固本胶囊是否有可能通过调节免疫失衡而发挥治疗哮喘的作用,观察不同剂量益气固本胶囊对哮喘小鼠CD4+CD25+Foxp3+Treg细胞数量及IL-33、TNF-α表达水平的影响,丰富其治疗哮喘的理论依据。
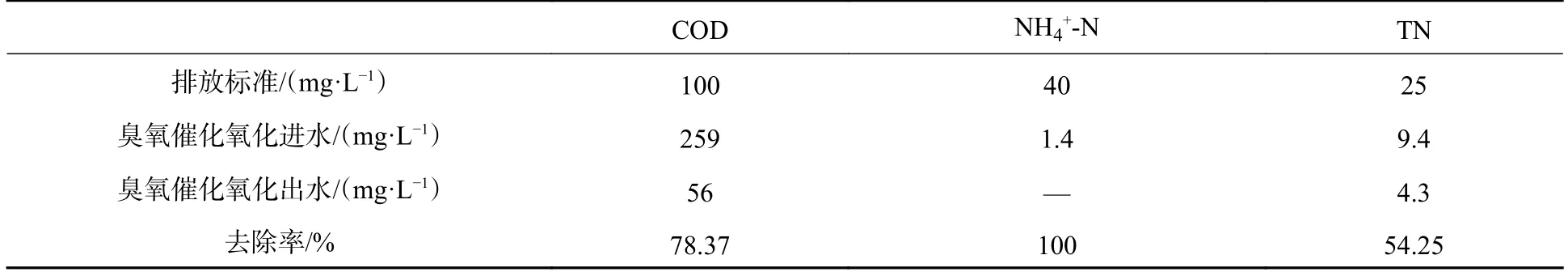
表3 臭氧催化氧化结果与排放标准Table 3 Ozone catalytic oxidation results and emission standards
2.4 废水处理前后有机物GC-MS 分析
由表4 可知原水中含有苯、碳碳双键、碳氧双键等不饱和结构的化合物,其余多为烷烃类物质,这些化学结构的有机污染物属于难生物降解的物质,其中一些有毒有害物质会对微生物产生毒害作用,导致渗滤液RO 浓缩液难生物降解[16].RO 浓液经厌氧、好氧处理后,废水中的直链长烷烃有所减少,好氧出水经催化臭氧氧化后,由于直链长烷烃的不完全氧化,分子量较大,难进一步降解,长链烷烃被氧化为醇类、酮类等物质,水中的一些不饱和键断裂,以及一些含有苯环结构的化合物被转化为苯的同系物,说明废水中的有些物质只能被转化,不能被彻底降解[17];催化臭氧氧化对难降解的大分子物质断裂成小分子化合物,可以提高对有机物的处理效果,从而达到对有机物的降解作用.
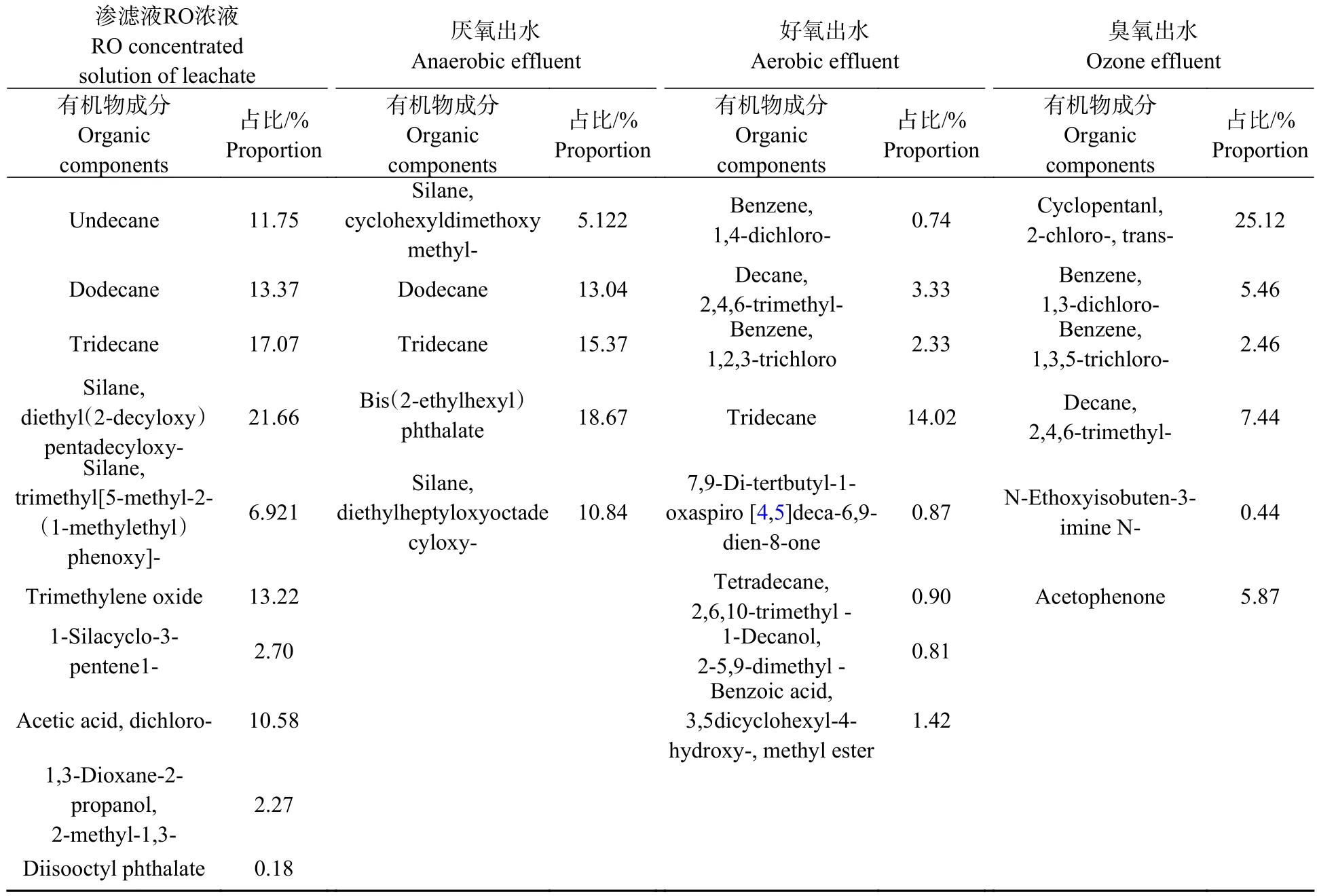
表4 有机物GC-MS 结果分析Table 4 Analysis of organic GC-MS results
2.5 厌氧/好氧体系对系统微生物群落结构的影响
2.5.1 微生物群落分析
多样性指数分析系统中生物群落均匀度和丰富度的多样性特征,微生物α 多样性结果如表5 所示,其中A1、A2、A3、B1、B2、B3分别代表厌氧污泥体系、厌氧耐盐菌体系、厌氧活性污泥+厌氧耐盐菌体系、好氧污泥体系、好氧耐盐菌体系、好氧活性污泥+好氧耐盐菌体系.6 个样品的覆盖率均在99.7%以上,表明所获得的序列可以覆盖大部分微生物,Shannon 指数和Simpson 指数结果表明,在厌氧污泥体系中,微生物种类相对较少,说明厌氧耐盐菌的加入可以提高体系微生物多样性;好氧污泥+好氧耐盐菌体系微生物种类相对较高.Ace 和Chao 指数表明,厌氧活性污泥+厌氧耐盐菌和好氧污泥+好氧耐盐菌体系微生物的丰富度和多样性较高,与污染物的去除规律相一致.
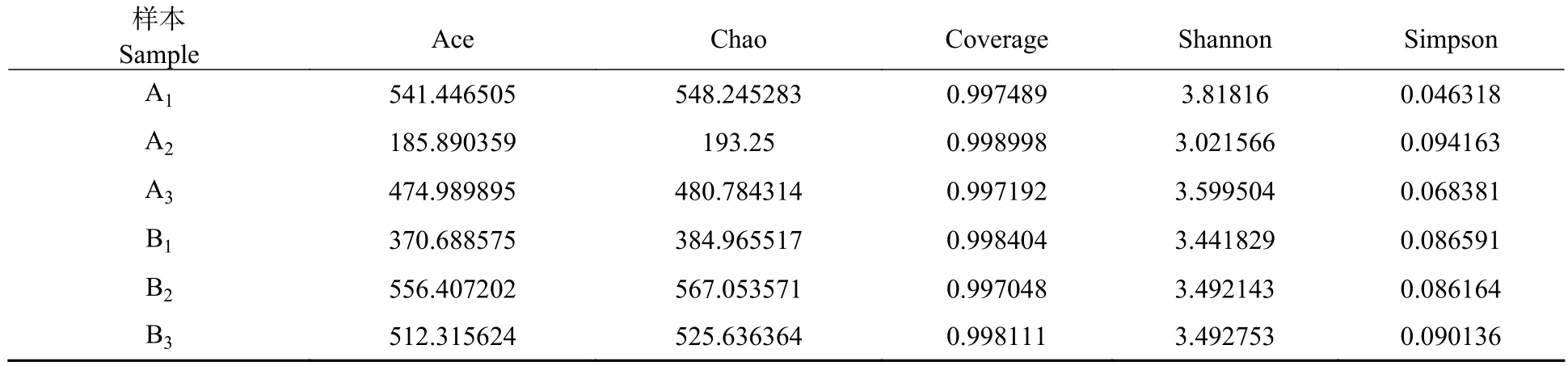
表5 多样性指数表Table 5 Diversity index table
图4 分别为厌氧和好氧条件下,各体系中的微生物多样性结果,如图4(b、e)所示,随着测序深度增加,稀释曲线趋于平坦,表明可以准确地描述各体系的物种多样性.Venn 图结果表明各个体系中共有和独有的OTUs 分布.图4(c)的结果表明,厌氧体系中观察到的OTUs 为581 个,其中,14.28%为各个体系中均存在的,而37.86%的OTUs 是特定体系所独有的.图4(f)的结果表明,好氧系统中共检测到的OTUs 为631 个,各个体系中均存在的占27.73%,不同体系中独有的占比为33.91%.
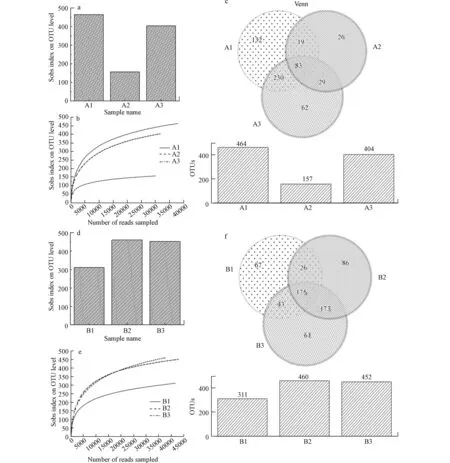
图4 厌氧微生物多样性(a)α 多样性估计,(b)稀释曲线,(c)Veen 图;好氧微生物多样性(d)α 多样性估计,(e)稀释曲线,(f)Veen 图Fig.4 Anaerobic microbial diversities(a)Alpha diversity estimators,(b)Rarefaction curves,(c)Venn diagram;Aerobic microbial diversities(d)Alpha diversity estimators,(e)Rarefaction curves,(f)Venn diagram.
2.5.2 厌氧/好氧体系微生物群落分析
如图5(a)所示,厌氧活性污泥+厌氧耐盐菌体系优势菌门中,Desulfobacterota(12.45%)包含大量反硝化脱硫菌,部分菌属还具有耐盐特性[18−20];Campilobacterota(14.28%)含有大量氨化细菌以实现有机氮的转化[21],Desulfobacterota、Campilobacterota为高盐条件下有机氮转化发挥关键作用.如图5(d)所示,好氧活性污泥+好氧耐盐菌体系优势菌门中,Proteobacteria(27.77%)是反硝化细菌中种类中最多的一类[22],Deinococcota(25.32%)、Actinobacteriota(5.34%)中包含大量具有耐盐能力的异养硝化细菌[23],可以维持体系的高效脱氮.
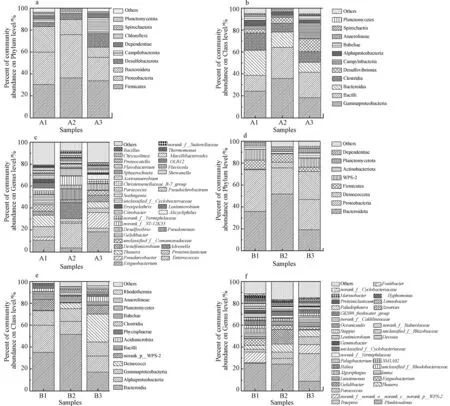
图5 不同厌氧/好氧体系下微生物群落组成分析(厌氧体系: a 门;b 纲;c 属;好氧体系: d 门;e 纲;f 属)Fig.5 The composition of the microbiome under different anaerobic/ aerobic systems Bar diagram(anaerobic: a Phylum;b Class;c Genus;aerobic: d Phylum;e Class;f Genus)
由图5(c)可见,厌氧耐盐菌强化厌氧活性污泥体系后优势菌属丰度增加,Flavobacterium(黄杆菌属)、Desulfovibrio(脱硫弧菌属)相对丰度上升,其相对丰度分别为1.78%和5.77%,其中,Flavobacterium是环境中的主导蛋白水解细菌,可以有效降解环境中的有机氮,同时,也具有一定的耐盐特性[27−28].结合各体系对污染物的去除效果,推测Flavobacterium是高盐条件下有机氮转化过程中发挥关键作用的菌属.如图5(f)所示,好氧活性污泥+好氧耐盐菌体系中Paracoccus(副球菌属)、Truepera(特吕珀菌属)的相对丰度较另外两个体系均有所上升,其相对丰度分别为7.27%和25.32%,且均有耐盐的特性,其中Paracoccus为异养硝化-好氧反硝化菌[29],Truepera是好氧异养菌,能耐受极端环境[30],随着好氧耐盐菌加入好氧活性污泥体系中,系统优势菌属发生显著变化,与系统污染物去除规律相一致,推测Truepera、Paracoccus是高盐条件下高效脱氮的主要菌属.
2.5.3 厌氧/好氧体系功能菌属及功能基因预测
根据京都基因和基因组百科全书(KEGG)数据库(http://www.genome.jp/kegg/),采用PICRUST2 对6 组体系中氮的迁移进行了研究.如图6 所示,有4 种与硝化相关功能基因:羟胺脱氢酶和氨单加氧酶,11 种反硝化相关功能基因,包括硝酸还原酶、一氧化氮还原酶、亚硝酸盐还原酶和一氧化二氮还原酶有关的基因.
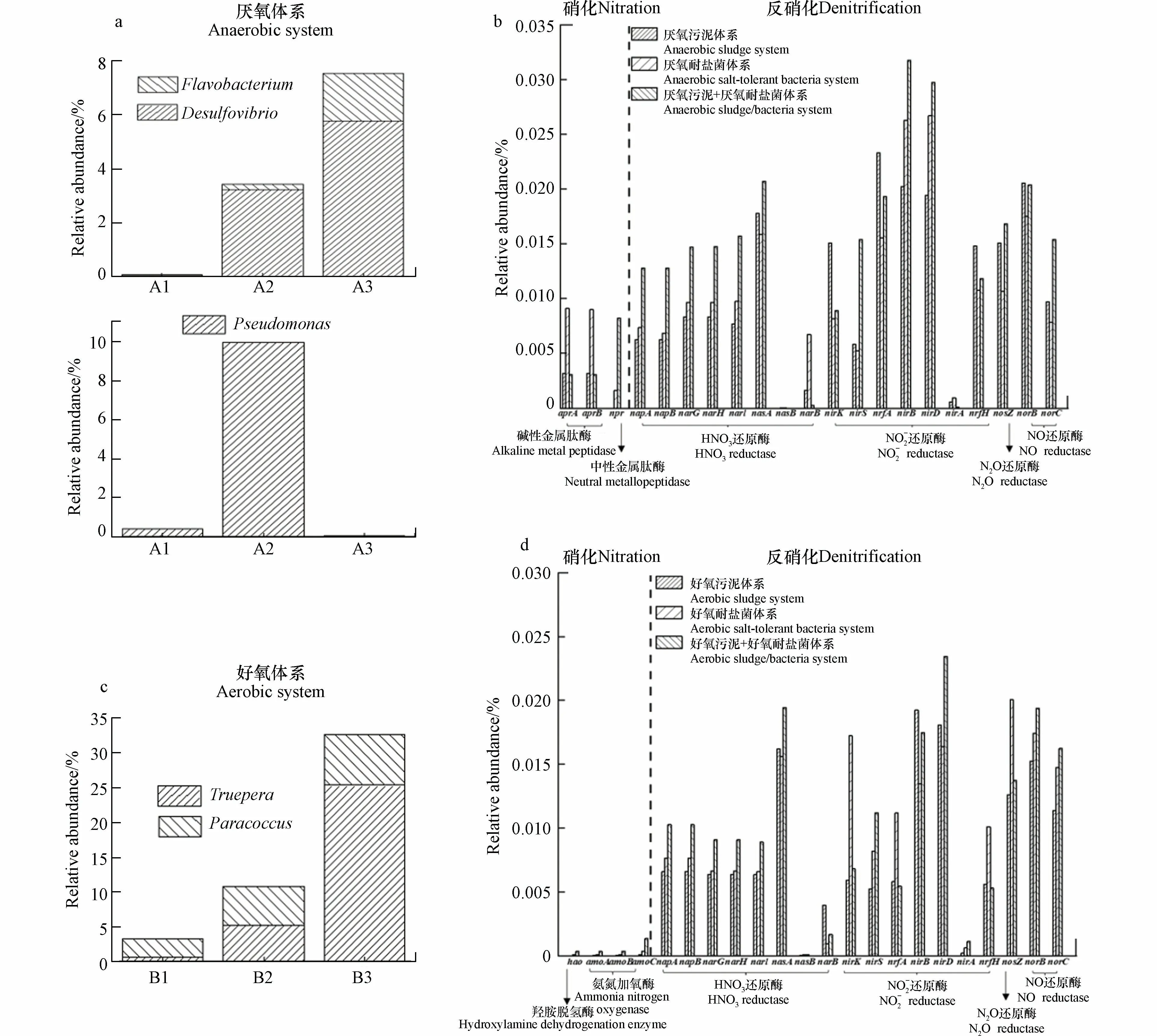
图6 厌氧/好氧条件下各体系功能基因预测(a.厌氧体系功能菌属;b.厌氧体系功能基因;c.好氧体系功能菌属;d.好氧体系功能基因)Fig.6 Functional gene prediction of each system under anaerobic/ aerobic conditions(a.anaerobic conditions functional genus;b.anaerobic conditions functional gene;c.aerobic conditions functional genus;d.aerobic conditions functional gene)
氨化过程最终由微生物功能基因控制,蛋白酶在氨化过程中起重要作用,蛋白酶基因包括apr、npr等基因.由图6(b)可知,厌氧耐盐菌体系中的apr基因(0.0181%)相对丰度最高,而apr存在于Pseudomonas中;Flavobacterium是许多土壤中的主导蛋白水解细菌,可以分泌中性金属蛋白酶[31],而厌氧活性污泥+厌氧耐盐菌体系中npr基因(0.0082%)的相对丰度最高,也在基因水平上进一步证明Flavobacterium是有机氮降解的关键菌属,因此,推测npr基因表达更有利于高盐条件下有机氮的降解.
如图6(c)所示,Truepera、Paracoccus为好氧体系中的优势菌属,其在不同体系下的相对丰度变化情况与污染物去除效果保持一致.氨单加氧酶是氨氮氧化成亚硝酸盐的硝化作用中限制性步骤的关键酶,由amoA,amoB和amoC编码的3 个亚基组成,有研究发现,自养硝化菌中存在amoA基因[32],编码羟胺氧化酶的编码基因hao是硝化过程中关键基因,能将羟胺氧化成亚硝酸盐[33].如图6(d)所示,好氧活性污泥+好氧耐盐菌体系中amo、hao基因,硝酸盐还原基因napA、napB、nasA、narG、narF、narI的相对丰度均高于另外两个体系,其相对总丰度分别为0.0023%和0.0476%,硝酸盐还原酶可将硝酸盐还原为亚硝酸盐[34];好氧耐盐菌强化活性污泥体系后,其亚硝酸盐还原基因nirS、nirA、nirD相对丰度均有显著上升,相对丰度为0.0357%,亚硝酸盐还原酶也是反硝化过程的关键酶,将亚硝态氮还原转化为NO[35].综上所述,好氧耐盐菌强化活性污泥体系后各基因的相对丰度都有明显的优势,脱氮效率显著提高.
3 结论(Conclusion)
(1)厌氧耐盐菌+厌氧活性污泥体系对有机氮转化率可以达到97%,好氧耐盐菌+好氧活性污泥体系出水NH4+-N、TN 浓度分别为1.4 mg·L−1、9.4 mg·L−1,好氧出水经臭氧催化氧化后,最终出水COD 浓度为56 mg·L−1,均满足《生活垃圾填埋场污染控制标准》(GB16889—2008)中表2 规定水污染物排放浓度限值.GC-MS 结果可以进一步得出,臭氧催化氧化可以提高对有机物的处理效果,降低出水有机物的浓度.
(2)微生物群落分析表明,厌氧条件下,Flavobacterium是反应体系在高盐条件下有机氮转化过程中发挥关键作用的菌属;好氧条件下,Truepera、Paracoccus是高盐条件下维持较高的氨氮、总氮去除效果的主要菌属.
(3)厌氧体系中,耐盐菌的强化提高了npr基因的相对丰度,推测该基因表达更有利于高盐条件下有机氮的降解;好氧体系中,耐盐菌强化后,硝化(amo、hao)与反硝化基因(nap、nar、nir、nor)的相对丰度较其他两个体系均有明显上升,更有利于维持NH4+-N、TN 的高效去除效果.
