以NH2-MIL-53(Al)为前驱体制备多孔掺碳Al2O3 吸附剂及其对水中Cr(Ⅵ)的吸附性能
2024-03-01熊明洋邱瑞斯
王 兵 曾 瑶 李 爽 熊明洋 邱瑞斯
(1.西南石油大学化学化工学院,成都,610500;2.四川省环境污染防治与环境安全重点实验室,成都,610500)
铬离子主要是通过铬盐生产行业及相关产业排放的废渣和废水流入环境中而引起污染.其中的Cr(Ⅵ)具有强烈的毒性,可能造成遗传性基因缺陷,吸入可能致癌等,对环境危害极大并具有持久危险性[1].因此,Cr(Ⅵ)的污染治理已经引起研究者广泛关注.对废水重金属铬污染的治理方法一般采用化学沉淀法[2]、氧化还原法[3]、离子交换法[4]和吸附法[5]等.其中吸附法是使用较多的一种方法,而所选用的吸附剂的种类也很多,常用的有活性炭[1]、天然有机吸附剂[6]、无机吸附剂[7]和合成吸附剂[8].工业上最常用的吸附剂是活性氧化铝[9]、硅胶[10]、活性炭[11]和分子筛[12].在这种情况下,活性氧化铝因其对重金属离子的强亲和力而被认为是一种有前途的吸附剂.一般来说,这些材料要么在其框架内提供大量官能团(如石墨烯氧化物和其他活性炭材料),要么晶格空位(如金属氧化物)可以有效去除废水中的污染物[13].废水中污染物富集的适宜材料应满足三个特点:(1)去除率快,对污染物的富集能力强;(2)环保、成本低;(3)结构稳定,可重复使用.金属氧化物可以具备这些特性,各种金属氧化物由于其抗磨损的机械坚固性已被应用于废水中的污染物去除.Drisko 等[14]发现,不同的大孔尺寸和形态的分层结构锆钛氧化物会极大地影响表面可进入性,从而影响扩散速率和U(Ⅵ)离子的空间容量.为了提高材料的吸附速率和吸附容量,新的合成方法有望同时控制微/大孔特性(即孔体积和比表面积).鉴于此,金属有机骨架(metal-organic frameworks,MOFs)合成金属氧化物为以简单、可控的方式合成定制功能材料提供了很大的可能性[15].MOFs 由与有机配体结合的金属离子簇或链组成[16],是一类具有超高比表面积和可调节孔径的新兴材料.MOFs 经热煅烧后可生成孔隙均匀、比表面积高、结构有序的金属氧化物[17].MOFs 衍生的金属氧化物在电催化[18]和能量储存/转换[19]等方面都有很好的应用前景.然而,目前废水中污染物的固定化应用还很少.
本研究针以MOFs 为前驱体,在有氧条件下煅烧制备了多孔掺碳Al2O3材料,使用扫描电极(SEM)、X 射线衍射仪(XRD)和孔隙度分析仪(BET)对该材料煅烧前后的表面形貌进行了表征分析,通过考察吸附剂投加量、初始浓度和共存阴离子等参数的影响分析其对水体中Cr(Ⅵ)的吸附能力,利用等温吸附模型和吸附动力学模型分析,揭示多孔掺碳Al2O3材料对水中Cr(Ⅵ)的去除提供新的途径.
1 材料与方法(Materials and methods)
1.1 试验材料与试剂
九水合硝酸铝(Al(NO3)3•9H2O)、N,N-二甲基甲酰胺(C3H7NO,DMF)、盐酸(HCl)、重铬酸钾(K2Cr2O7)、氯化钠(NaCl)和氢氧化钠(NaOH)由成都科隆化工有限公司提供;迈瑞尔有限公司生产的氨基对苯二甲酸(C8H7NO4),所有的试剂均为分析纯且没有经过纯化处理.
1.2 多孔掺碳Al2O3 吸附剂的制备
a)采用溶剂热法合成了NH2-MIL-53(Al)纳米晶体,将3.751 g 九水合硝酸铝、1.81 g 氨基对苯二甲酸和150 mL DMF 加入到200 mL 聚四氟乙烯内衬反应器中并进行搅拌,在150 ℃下反应24 h,冷却至室温,以10000 r·min−1高速离心分离得到固体产物.将得到的固体产物在150 ℃下加入150 mL DMF 活化12 h,再次高速离心分离得到黄色固体产物,用纯水反复洗涤3 次,在60 ℃下真空干燥,得到黄色固体NH2-MIL-53(Al).
b)将上述得到的NH2-MIL-53(Al)使用马弗炉在600 ℃下煅烧6 h,得到淡黄色多孔掺碳Al2O3粉末材料.
1.3 多孔掺碳Al2O3 吸附剂的表征方法
采用扫描电子显微镜(德国的 ZEISS Sigma 300)观察材料的表面形貌.粉末X 射线衍射图(PXRD)记录在Bruker AXS D8-ADVANCE 衍射仪上,使用经过滤波的CuKα 辐射源,工作在40 kV 和30 mA,扫描速率为5 min−1.使用美国的Micromeritics ASAP 2460 全自动快速比表面与孔隙度分析仪对材料的孔径结构进行表征.
1.4 Cr(Ⅵ)的静态吸附实验
通过吸附平衡法测定多孔掺碳Al2O3对Cr(Ⅵ)的吸附等温线和动力学参数,取一定量的吸附剂加入到100 mL 的不同浓度的重铬酸钾溶液中,振荡一定时间后过滤,通过二苯碳酰二肼分光光度法在波长540 nm 处进行分光光度测定Cr(Ⅵ)的浓度.根据式(1)计算吸附剂对Cr(Ⅵ)的吸附容量Qe(mg·g−1).
式中,C0为Cr(Ⅵ)离子的初始浓度,mg·L−1;Ci为吸附后剩余的Cr(Ⅵ)离子浓度,mg·L−1;V为溶液体积L;m为吸附剂的质量,g.
2 结果与讨论(Results and discussion)
2.1 材料表征与分析
从图1a 中可以观察到,NH2-MIL-53(Al)表面粗糙,同时在其表面上覆盖着不规则的长矩形片状结构,其由聚集的纳米晶体组成,层叠状堆聚,煅烧后的多孔掺碳Al2O3材料(图1b)总体结构与形貌与NH2-MIL-53(Al)类似,呈层叠状堆聚,但很明显看出其表面要较煅烧前的NH2-MIL-53(Al)材料更加粗糙,覆盖表面的片状结构变成絮状结构.

图1 NH2-MIL-53(Al)的扫描电镜图(a);多孔掺碳Al2O3 的扫描电镜图(b)Fig.1 SEM image of NH2-MIL-53(Al)(a);SEM image of Porous carbon-doped Al2O3(b)
通过XRD 测定了制备的NH2-MIL-53(Al)和多孔掺碳Al2O3材料的化学组成和晶体结构(图2).NH2-MIL-53(Al)的XRD 谱图可以看出制备样品有明显衍射峰且特征峰形尖锐,表明结晶度良好.在2θ=8.5°时,存在(110)峰,单峰宽度对应于(211)和(220)的反射,其峰值较高,说明其晶体尺寸大.由图可以看出,NH2-MIL-53(Al)材料的衍射峰与Qin 等[20]研究结果相吻合.
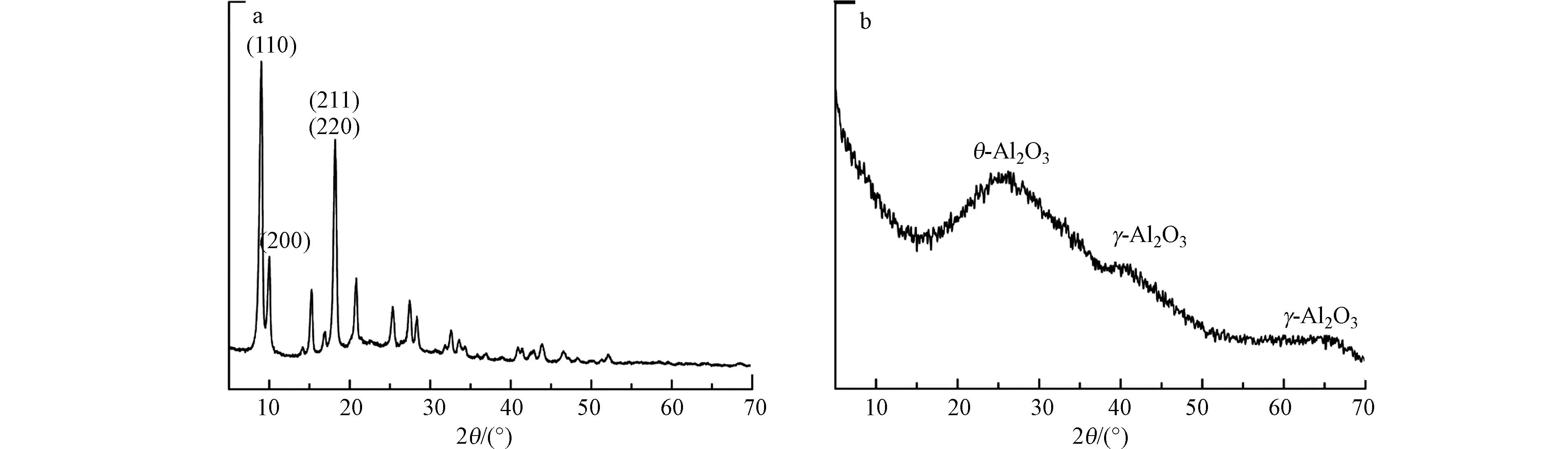
图2 NH2-MIL-53(Al)的X 衍射图(a);多孔掺碳Al2O3 的X 衍射图(b)Fig.2 XRD image of NH2-MIL-53(Al)(a);XRD image of Porous carbon-doped Al2O3(b)
在图2 可以看出,煅烧后的样品没有明显的衍射峰,表明样品以非晶形式存在,在20°和36°附近没有峰,说明不存在对应的α-Al2O3[21].2θ=26.3 处的峰与θ-Al2O3有关,2θ=41.1°和65.2°处的板状峰是γ-Al2O3的特征[22].根据这些峰的位置和形状,可以得出多孔掺碳Al2O3材料由非晶态氧化铝基体中的θ-Al2O3和γ-Al2O3晶粒混合组成.
为了考察NH2-MIL-53(Al)和多孔掺碳Al2O3材料的孔道类型和孔径大小,进行了NH2-MIL-53(Al)和多孔掺碳Al2O3材料的氮气吸脱附测试,如图3a、c 为NH2-MIL-53(Al)和多孔掺碳Al2O3材料的氮气吸脱附曲线,图3b、d 为采用BEJ 模型计算得到的材料孔径分布曲线.图3a 显示NH2-MIL-53(Al)为Ⅰ型吸附等温线,推测为微孔材料.在图3 可以看出,多孔掺碳Al2O3材料在P/P0为0.1—0.4 的范围内没有二次吸收,吸附等温线可归为Ⅴ型,而在高压P/P0为0.7—0.9 的范围内出现H4型迟滞回线,表明多孔掺碳Al2O3材料存在复合孔[23].通过孔径分布曲线可以更详细地验证.NH2-MIL-53(Al)的孔径主要分布在2 nm 以前,大量微孔的存在进一步证明了其为微孔材料,而多孔掺碳Al2O3材料的孔径分布以6.36 nm 为中心,主要以介孔为主.用BET 方程计算出NH2-MIL-53(Al)的比表面积(116.73 m²·g−1)要明显小于多孔掺碳Al2O3材料(180.24 m²·g−1),与预期结果一致.基于上述结果,多孔掺碳Al2O3材料成功合成且其更高的比表面积使其成为污染物富集的高效材料之一.
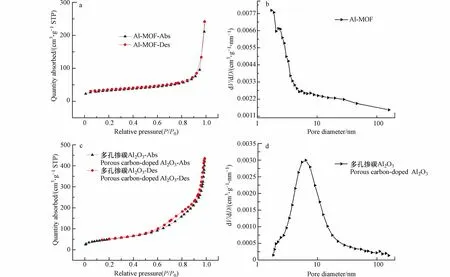
图3 NH2-MIL-53(Al)的氮气吸附脱附等温线图(a),孔径分布图(b);多孔掺碳Al2O3 的的氮气吸附脱附等温线图(c),孔径分布图(d)Fig.3 Nitrogen adsorption and desorption isotherm of NH2-MIL-53(Al)(a),pore size distribution of NH2-MIL-53(Al)(b);Nitrogen adsorption and desorption isotherm of Porous carbon-doped Al2O3(c),pore size distribution of Porous carbon-doped Al2O3(d)
2.2 吸附性能
2.2.1 溶液的初始pH 和Zeta 电位的影响
pH 值是影响吸附剂的吸附效果的主要因素之一,因为pH 通过影响吸附剂的表面电荷和溶液中Cr(Ⅵ)的离子形态来控制吸附剂表面的吸附能力[24],不同溶液pH 条件下多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附效果的影响和材料在不同pH 下的Zeta 电位如图4 所示.数据分析表明,pH 对BPA 吸附容量有显著影响,材料在酸性条件比在碱性条件下对Cr(Ⅵ)的去除效果好,Cr(Ⅵ)在多孔掺碳Al2O3吸附剂上的最大吸附容量在pH=4 左右出现,最大吸附容量为60.71 mg·g−1.pH 较低时,Cr(Ⅵ)主要以HCrO4−存在[25],材料在这个范围内的Zeta 电位显示其时带正电荷,促进了吸附材料与HCrO4−的静电吸引作用.溶液pH 为碱性时,主要以CrO42−形式存在[26],此时吸附材料开始去质子化,表面带负电,与CrO42−存在静电排斥作用,且OH−会与CrO42−竞争吸附剂上的吸附位点[8],因此在碱性环境下吸附剂对Cr(Ⅵ)的吸附能力大幅下降.

图4 pH 对吸附效果的影响Fig.4 The effect of pH on the adsorption effect
2.2.2 Cr(Ⅵ)初始浓度的影响
图5 显示了Cr(Ⅵ)初始浓度对多孔掺碳Al2O3吸附剂的影响.由图5 可见,随着Cr(Ⅵ)初始浓度从100 mg·L−1增加到1400 mg·L−1,Cr(Ⅵ)在多孔掺碳Al2O3吸附剂上的吸附容量也越来越高,低浓度时,Cr(Ⅵ)初始浓度的增加显著提高了平衡吸附容量(qe),这是由于与活性吸附位点接触的Cr(Ⅵ)增加所致.当Cr(Ⅵ)初始浓度超过800 mg·L−1时,qe值仍然可以缓慢增加.这是因为高浓度可以提供更强的驱动力,克服了传质阻力,促进了吸附剂对Cr(Ⅵ)的吸附[27].当Cr(Ⅵ)初始浓度大于1000 mg·L−1时,由于吸附位点饱和,吸附容量保持不变[28].从图得到的Cr(Ⅵ)的qe值为671.56 mg·g−1.
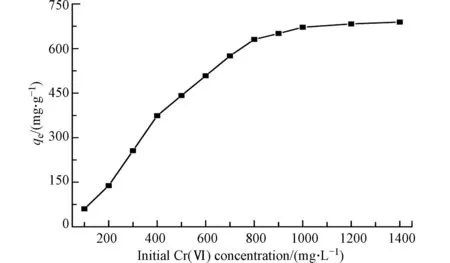
图5 Cr(VI)的起始浓度对吸附效果的影响Fig.5 The effect of Initial concentration on the adsorption effect
2.2.3 共存阴离子的影响
在实际生产中,工业废水的成分非常复杂.因此,实验还应考虑不同离子类型对吸附的影响.在本实验中制备了0、1、5、10 mmol·L−1SO42−、CO32−、C2O42−、CH3COO−、Cl−和Cr(Ⅵ)的混合溶液.研究多孔掺碳Al2O3吸附剂在混合溶液中对Cr(Ⅵ)的吸附效果.实验数据如图6 所示.在CH3COO−和Cl−介质中,Cr(Ⅵ)的吸附量增加.当SO42−存在时,多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附能力降低.这可能是由于SO42−和Cr(Ⅵ)氧阴离子之间具有相似的化学性质,从而导致它们的竞争吸附,降低吸附容量[29],且SO42−与吸附剂竞争溶液中的H+,生成HSO4−,从而降低吸附剂表面的正电荷.
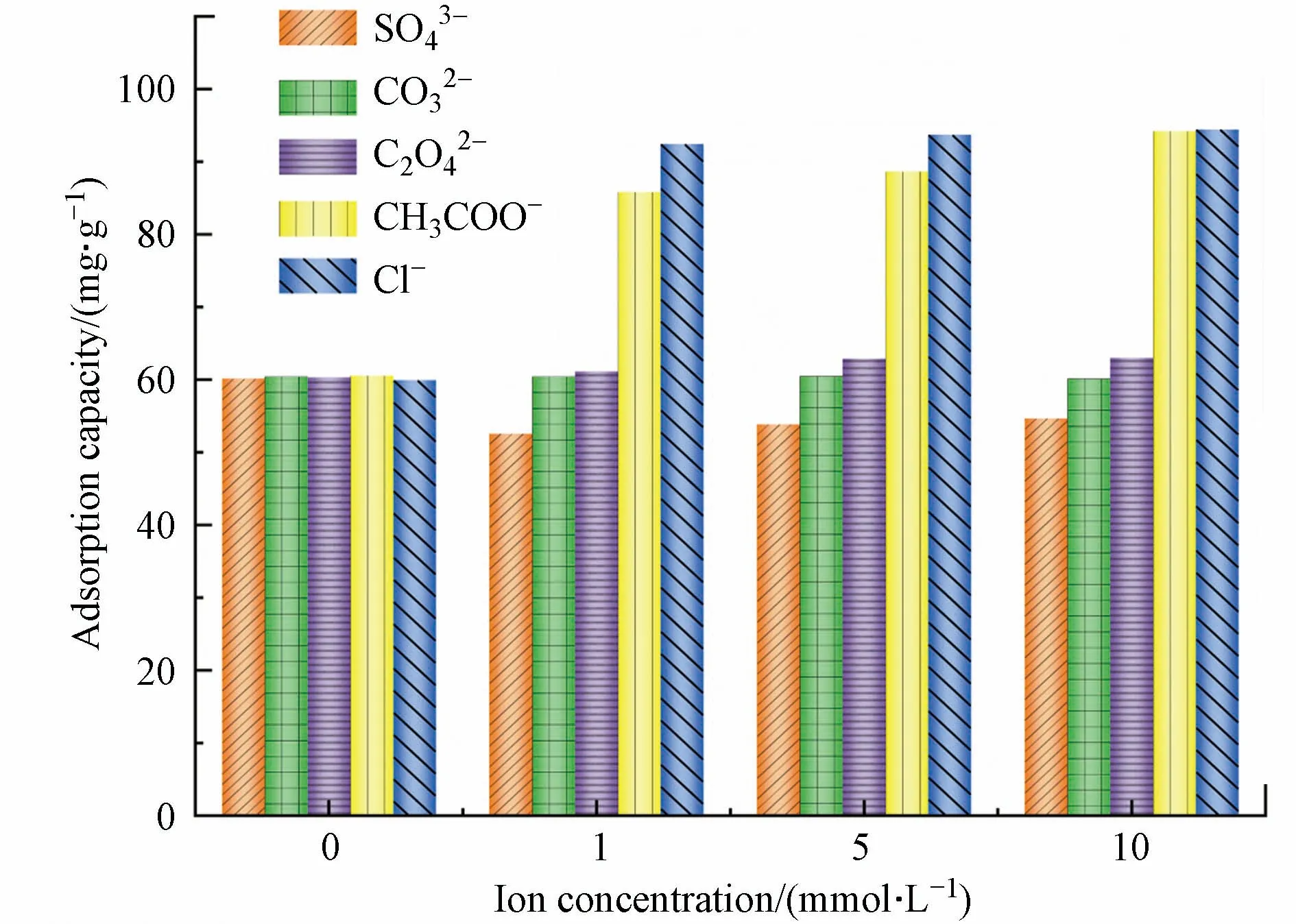
图6 溶液中的阴离子浓度对吸附效果的影响Fig.6 The effect of anion concentration in solution on the adsorption effect
2.3 吸附动力学
图7 为多孔掺碳Al2O3吸附剂对Cr(VI)的吸附容量随时间的变化,可以看出初始浓度为25、50、100 mg·L−1的Cr(Ⅵ)随时间的增加,吸附容量的变化过程都是相似的,均随时间的增加而增加,在前10 h 内吸附速率很快,然后逐渐减慢,在24 h 达到了吸附平衡,最大吸附容量为60.75 mg·g−1.反应前期,多孔掺碳Al2O3吸附剂材料表面的吸附位点较多并且溶液中的Cr(Ⅵ)此时浓度最高,吸附驱动力大,因此吸附速率快.然而随着时间的推移,多孔掺碳Al2O3吸附剂表面的吸附位点逐渐被占据并且Cr(Ⅵ)浓度逐渐降低,因此吸附驱动力减弱.
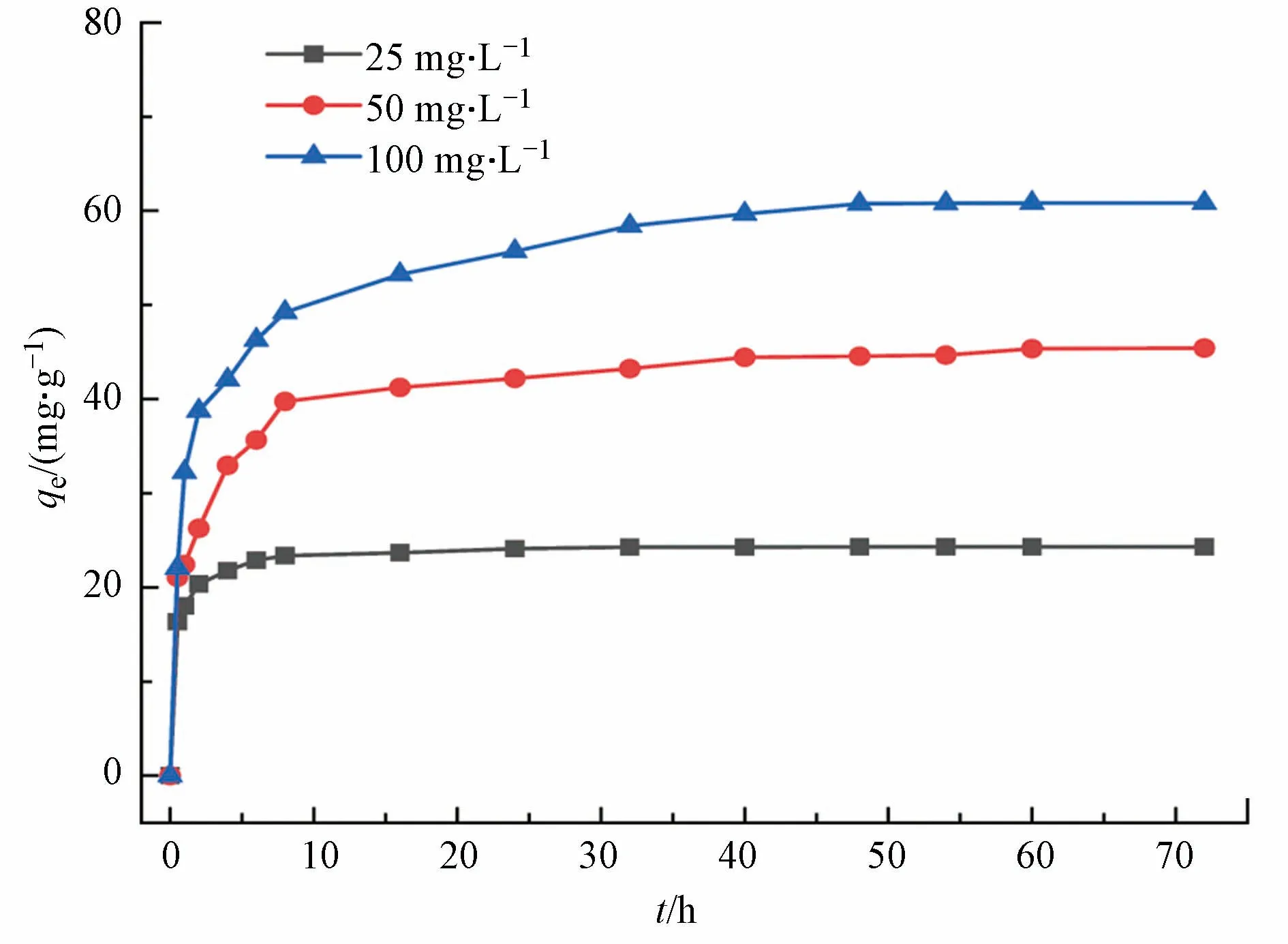
图7 吸附时间对吸附效果的影响Fig.7 The effect of the adsorption time in solution on the adsorption effect
将实验数据拟合在伪一级动力学模型、伪二级动力学模型中,方程见(2)及(3).
其中,K1为伪一阶动力学模型吸附速率常数,min−1;K2为伪二阶动力学模型吸附速率常数,g·(mg·min)−1;qe为平衡时的吸附量,mg·g−1;qt为t时刻的吸附量,mg·g−1.
拟合的图像及相关参数如图8 和表1 所示.由表1 可知,伪二阶动力学模型的回归系数(0.9999、0.9991、0.9997)均高于伪一阶动力学模型的回归系数(0.9685、0.9282、0.9733),且在100 mg·L−1Cr(Ⅵ)下,伪二级动力学模型的吸附容量(60.75 mg·g−1)更接近实验吸附容量值,表明伪二阶动力学模型更适合多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附过程,同时也说明了该吸附过程是化学吸附[30],且化学键取代过程可能是限制该吸附过程的主要机理.
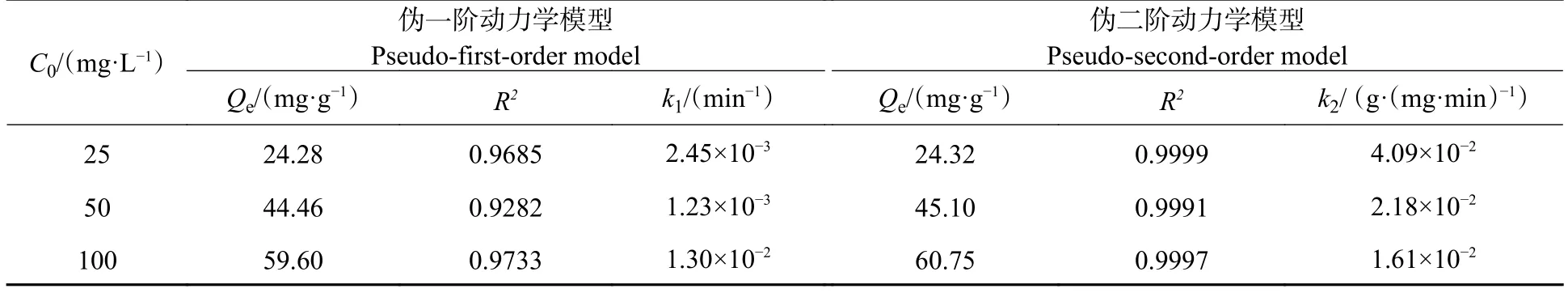
表1 多孔掺碳Al2O3 吸附剂吸附Cr(VI)的动力学模型参数Table 1 Kinetic model parameters of Cr(VI)adsorption on Porous carbon-doped Al2O3
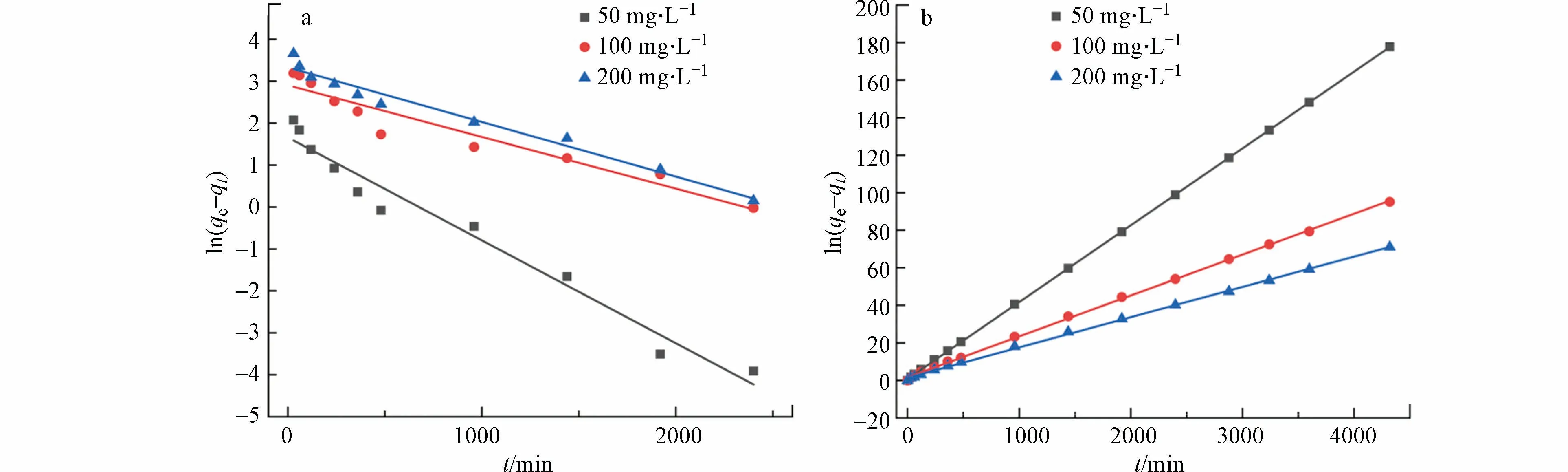
图8 伪一阶动力学模型图(a);伪二阶动力学模型图(b)Fig.8 First-order kinetic model diagram(a);Second-order kinetic model diagram(b)
2.4 吸附等温线
Langmuir 和Freundlich 吸附等温线是经典的等温线模型,用于解释固体中疏水化合物吸附的非线性性质,因此在本研究中使用Langmuir 和Freundlich 吸附模型分析多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附等温线.
Langmuir 吸附等温线表明,吸附剂表面会形成均匀的单分子吸附层,能量均匀,吸附分子之间在不同位置没有相互作用[31].Langmuir 方程的非线性形式用(4)方程表示.而Freundlich 等温线是已知最早描述吸附平衡的关系式,用来描述非均相能量吸附剂表面对多层吸附的非理想可逆吸附过程,非线性形式的Freundlich 等温方程如(5)所示.
式中,qm为最大吸附量,mg·g−1;b为Langmuir 吸附平衡常数,L·mg−1;Kf为Freundlich 吸附容量常数,mg·g−1;n为Freundlich 亲和常数.
不同等温吸附模型的拟合参数如表2 和图9 所示.由表2 可知,使用Langmuir 等温吸附模型拟合R2(0.9963—0.9901)值大于Freundlich 等温吸附模型的R2(0.9912—0.9830)值,说明Langmuir 等温吸附模型更适合描述多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附过程,说明该吸附是单层吸附[32].由Langmuir 等温吸附模型拟合得到的理论最大吸附量与实际测得的吸附量接近,说明其具有可信度.此外,Freundlich 等温吸附模型拟合得到的n值可以很好的反应多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附能力,n<1,说明吸附较难;n>1,说明吸附能力较强.本研究中的Freundlich 等温吸附模型中的n(1.0503—1.2450)值均大于1,说明多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附能力较强.
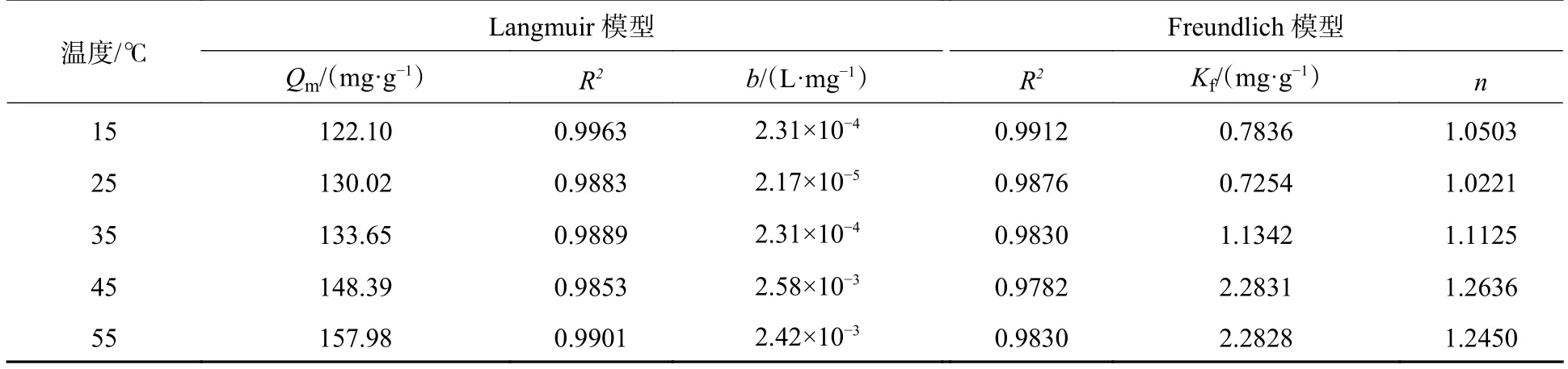
表2 多孔掺碳Al2O3 吸附剂吸附Cr(Ⅵ)的等温吸附模型参数Table 2 Parameters of the isotherm adsorption model for Cr(Ⅵ)adsorption on Porous carbon-doped Al2O3

图9 多孔掺碳Al2O3 吸附剂吸附Cr(VI)的Langmuir 等温吸附模型(a);Freundlich 等温吸附模型(b)Fig.9 The Langmuir(a)and Freundlich(b)isothermal adsorption model of Cr(VI)by Porous carbon-doped Al2O3
2.5 多孔掺碳Al2O3 吸附剂稳定性测试实验
在250 mL 的锥形瓶中配制100 mL 水溶液,加入1 g·L−1的多孔掺碳Al2O3吸附剂和纳米氧化铝吸附剂,并用1 mol·L−1的HCl 或者NaOH 溶液调节pH 为1 和12,溶液振荡反应24 h 后,使用0.22 μm 滤膜分离剩下的吸附剂,取25 mL 分离得到的液体于50 mL 比色管中,利用铬天青s 检测溶液中Al3+的析出量,其反应变化如图10 所示,水样1 为纯水样,水样2、4 分别为多孔掺碳Al2O3在pH 为1 和12 条件下Al3+的析出量,水样3、5 分别为纳米氧化铝在pH 为1 和12 条件下Al3+的析出量.在酸性条件下Al3+和铬天青s 反应生成蓝绿色的四元胶束,碱性条件下生成紫红色.从图10 可以明显看出,多孔掺碳Al2O3在酸碱条件下产生的絮状物要明显少于纳米氧化铝,说明多孔掺碳Al2O3在酸碱条件下的稳定性要明显优于纳米氧化铝.

图10 多孔掺碳Al2O3 吸附剂和纳米氧化铝吸附剂的稳定性对比Fig.10 Comparison of stability of porous carbon-doped Al2O3 adsorbent and nano-alumina adsorbent
2.6 吸附-解吸实验
吸附剂的再生对吸附剂的实用性和可行性至关重要.通过连续5 次吸附脱吸实验,评价多孔掺碳Al2O3吸附剂的重复使用性.将100 mg 多孔掺碳Al2O3吸附剂与100 mL Cr(Ⅵ)(100 mg·L−1)结合,振荡24 h 进行吸附实验,固液分离后测定Cr(Ⅵ)浓度.脱附液100 mL 与吸附剂混合,振荡24 h 得到脱附上清.脱附液由10%的硫脲和2%的盐酸组成.图11a 为5 次循环中Cr(Ⅵ)的吸附速率.各吸附率分别为98.4%、97.6%、96.5%、95.1%和94.5%.多孔掺碳Al2O3吸附剂在5 次循环后仍具有较强的吸附势.值得注意的是,吸附率的轻微下降可能是由于未洗Cr(Ⅵ)的积累或实验过程中不可避免的活性位点的损失.为了确定是否将污染物完全脱附以及脱附后是否有改变吸附剂的结构,使用傅立叶变换红外光谱仪对多孔掺碳Al2O3吸附剂脱附前后的光谱进行分析,如图11b 所示,脱附再生后的多孔掺碳Al2O3与原多孔掺碳Al2O3相似.从图中可以观察到,877 cm−1的峰值代表了吸附Cr(Ⅵ)之后多孔掺碳Al2O3上的C—H 伸缩振动在脱附后的多孔掺碳Al2O3上消失了,说明脱附液洗涤吸附的Cr(Ⅵ)被成功清除.结果验证了多孔掺碳Al2O3的稳定性和可重复使用性.
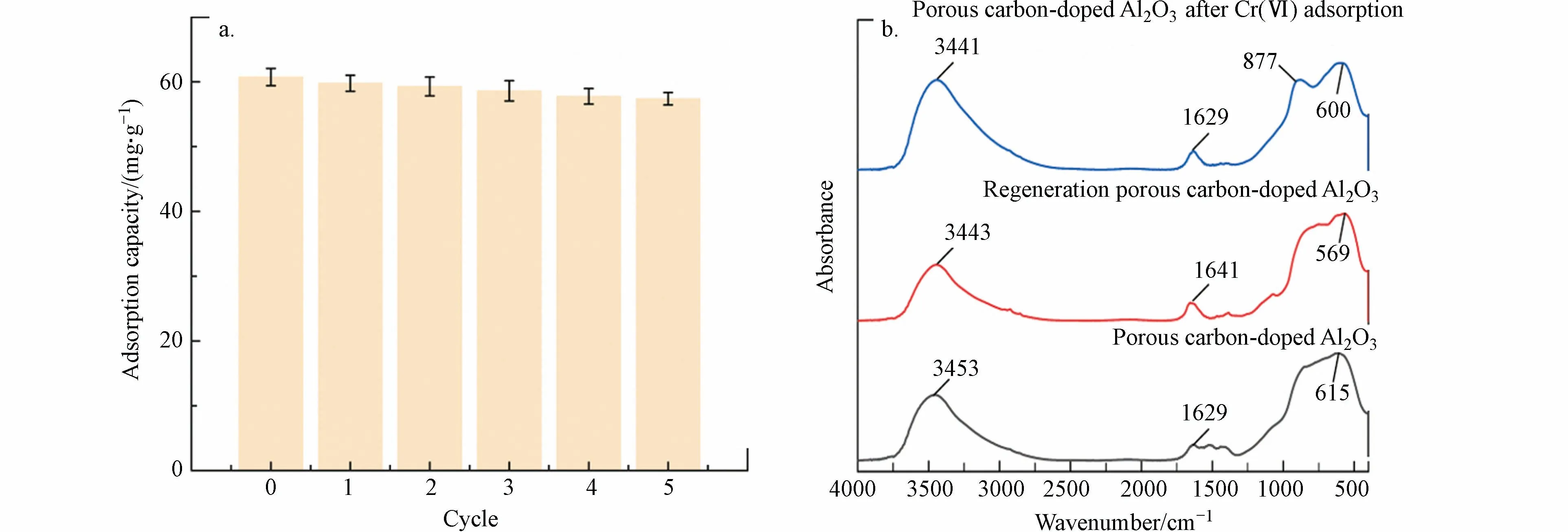
图11 多孔掺碳Al2O3 吸附剂循环吸附率(a)和多孔掺碳Al2O3 的红外光谱(b)Fig.11 Cyclic adsorption rate of porous carbon-doped Al2O3 (a) and FT-IR spectra of porous carbon-doped Al2O3(b)
2.7 吸附机理
吸附Cr(Ⅵ)后的多孔掺碳Al2O3红外光谱如图11b 所示,3453 cm−1处为OH 的伸缩振动,羟基与Cr(Ⅵ)结合后,νOH相对强度减弱,并发生约12 cm−1的位移,表明结合Cr(Ⅵ)后羟基的振动峰强减弱.同样的位于615 cm−1左右处的Al—O 键晶格振动的相对强度减弱,并发生约15 cm−1的位移.红外分析结果表明,多孔掺碳Al2O3具有较高的吸附能力是由于大量羟基的存在,这些羟基能有效地与阳离子结合并形成表面复合物.
3 结论(Conclusion)
(1)本研究将水热法合成的NH2-MIL-53(Al)作为原材料进行碳化,利用碳化开发制备出一种新型制备多孔掺碳Al2O3吸附材料,并将其用于吸附水中的Cr(Ⅵ)污染物.根据经过XRD、SEM、BET 的测试方法分析,XRD、SEM 结果表明多孔掺碳Al2O3成功合成,呈低石墨化状态,晶体结构稳定;SEM 则表明多孔掺碳Al2O3材料表面呈絮状结构,但其结构没有受到破坏;通过BET 测试表明,多孔掺碳Al2O3的比表面积为180.24 m²·g−1,其比表面积要大于煅烧前,其孔径主要为介孔.
(2)探究了吸附过程中各因素对多孔掺碳Al2O3吸附剂吸附Cr(Ⅵ)的影响,结果表明,多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附平衡时间为48 h,平衡吸附量最大可达为671.56 mg·g−1;pH 值为4 时,多孔掺碳Al2O3吸附剂对Cr(Ⅵ)的吸附容量达到最大;同时,SO42−和Cr(Ⅵ)氧阴离子之间具有相似的化学性质,因此增加SO42−会导致它们的竞争吸附,降低吸附容量在吸附剂表面竞争活性位点,抑制吸附过程.
(3)通过吸附模型结果表明,多孔掺碳Al2O3吸附剂对Cr(VI)的吸附过程与Langmuir 等温线模型和伪二阶动力学模型拟合更好,说明吸附是单层的化学吸附.
