早期应用贝利尤单抗治疗系统性红斑狼疮患者的效果及对激素减量的影响分析
2024-03-01欧阳楚君卢瑞荣韦锋梁灼源郭静静冯明亮
欧阳楚君 卢瑞荣 韦锋 梁灼源 郭静静 冯明亮
SLE 是一种侵犯全身多个组织器官的自身免疫性疾病[1]。目前由于临床诊疗技术的进步, SLE 患者的生存率得到大大的提高。目前治疗SLE 的主要药物有糖皮质激素、羟氯喹、免疫抑制剂(环磷酰胺、吗替麦考酚酯、环孢素、他克莫司等)[2-4]。10 年前贝利尤单抗作为第一个获美国食品药品监督管理局(FDA)批准的生物制剂进入了临床, 开启了SLE 生物制剂的治疗时代[5]。此前利妥昔单抗也做了许多研究, 但均未达到研究的终点。2020 年中国系统性红斑狼疮诊疗指南中提出, 对难治性(经常规治疗效果不佳)或复发性SLE 患者可以使用生物制剂[6]。有部分SLE 患者起病时疾病活动度高, 疾病缓解的推迟可造成器官不可逆的损害;另外目前激素及免疫抑制剂所带来的副作用也不容小觑, 特别是激素导致的感染风险, 所以此研究旨在对比早期应用(诱导缓解期3 个月内)贝利尤单抗及诱导缓解期3 个月后应用贝利尤单抗患者的临床特征、激素减量情况。
1 资料与方法
1.1 一般资料 选取2019 年1 月~2022 年12 月江门市中心医院使用贝利尤单抗治疗的SLE 患者83 例, 根据患者诱导缓解期开始使用贝利尤单抗的时间分为早期组(35 例)和对照组(48 例)。两组患者性别、年龄、抗双链脱氧核糖核酸(ds-DNA)滴度、抗核抗体(ANA)滴度和激素用量比较均无统计学差异(P>0.05), 具有可比性。见表1。

表1 两组患者一般资料比较(n, x-±s)
1.2 纳入标准 ①年龄18~75 岁;②符合SLE 的诊断标准[7]。
1.3 排除标准 ①有潜在的结核感染可能, 未规律服用抗结核药物;②人类免疫缺陷病毒(HIV)感染;③乙型肝炎病毒或丙型肝炎病毒感染, 未得到有效控制;④低丙种球蛋白血症(IgG<400 mg/dl)或IgA 缺乏(IgA<10 mg/dl);⑤重要器官移植或造血干细胞/骨髓移植或肾移植史;⑥妊娠;⑦有精神疾病或不能配合研究。
1.4 方法 两组患者均使用甲泼尼龙及吗替麦考酚酯作为背景用药, 其中甲泼尼龙片(PfizerItaliaSrl, 注册证号H20150245)/注射用甲泼尼龙琥珀酸钠(辽宁海思科制药有限公司, 国药准字H20133233)的初始剂量根据SLEDAI-2000 评分[8]进行评估, 轻度活动患者使用<8 mg/d(小剂量)口服, 中度活动患者使用0.5~1 mg/(kg·d)口服, 重度活动患者使用1 mg/(kg·d)口服;病情严重或狼疮危象的患者, 则使用冲击剂量激素, 静脉滴注注射用甲泼尼龙琥珀酸钠500~1000 mg/d,滴注3 d 后减量, 口服甲泼尼龙片1 mg/(kg·d);吗替麦考酚酯胶囊(湖南华纳大药厂股份有限公司, 国药准字H20080016)0.5~0.75 g/次, 2 次/d 口服。
早期组于诱导缓解期≤3 个月时开始使用贝利尤单抗治疗, 注射用贝利尤单抗(GlaxoSmithKline Manufacturing S.P.A., 注册证号S20190032)剂量10 mg/kg,前3 次每2 周给药1 次, 随后每4 周给药1 次, 注射总疗程共24 周。对照组于诱导缓解期>3 个月时开始使用贝利尤单抗治疗, 注射用贝利尤单抗的用法用量与早期组一致, 注射总疗程共24 周。
1.5 观察指标 ①治疗前及治疗12、24 周时进行随访, 检测血常规指标(WBC、Neut、Lym、PLT、Hb)、肝功能指标(ALB)、肾功能指标(SCr)、ESR、免疫功能指标(补体C3、补体C4、IgG、IgA、IgM、球蛋白)水平。②记录治疗前及治疗12 及24 周时激素使用剂量, 计算治疗12、24 周时激素减量值。治疗前及治疗12、24 周时采用SLEDAI-2000 评分评估患者疾病活动度, 轻度活动:SLEDAI-2000 评分≤6 分;中度活动:SLEDAI-2000 评分7~12 分;重度活动:SLEDAI-2000评分>12 分。③主要器官损害情况, 主要包括狼疮性肾炎、狼疮性血液系统损害、神经精神狼疮、弥漫性肺泡出血、间质性肺炎、肺栓塞、肺动脉高压、狼疮性胃肠道损害、心包炎、关节炎、腮腺肿物。
1.6 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 (±s)表示,采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组血常规指标比较 早期组治疗24 周时的Neut 水平明显低于对照组, 治疗12 和24 周时的Lym、Hb水平明显高于对照组, 有统计学差异(P<0.05)。见表2。
表2 两组血常规指标比较( ±s)

表2 两组血常规指标比较( ±s)
注:与对照组同时期比较, aP<0.05
组别例数WBC(×109/L)Neut(×109/L)Lym(×109/L)治疗前治疗12 周 治疗24 周治疗前治疗12 周 治疗24 周治疗前治疗12 周 治疗24 周早期组356.91±3.23 8.45±3.71 8.59±3.81 4.37±1.74 5.14±2.47 4.39±1.59a 1.11±0.42 1.73±0.49a 1.59±0.49a对照组486.99±2.71 7.33±2.63 6.54±2.99 4.88±2.03 5.76±2.72 6.56±3.09 1.09±0.46 1.48±0.42 1.38±0.34 t 0.1221.7111.9291.1991.0653.8000.2032.4962.306 P 0.9030.0910.0570.2340.2900.0000.8400.0150.024组别例数PLT(×109/L)Hb(g/L)治疗前治疗12 周治疗24 周治疗前治疗12 周治疗24 周早期组35185.61±71.04237.63±84.44240.96±64.6095.23±25.80 122.85±15.38a 123.20±16.70a对照组48193.24±61.82209.61±83.61222.13±77.8497.77±24.37105.89±16.91103.42±25.63 t 0.5211.5011.1670.4574.6853.987 P 0.6040.1370.2470.6490.0000.000
2.2 两组肝肾功能指标和ESR水平比较 早期组治疗24 周时的ALB 水平明显高于对照组, 治疗12 和24 周时的SCr 水平明显低于对照组, 治疗12 周时的ESR 水平明显低于对照组, 有统计学差异(P<0.05)。见表3。
表3 两组肝肾功能指标和ESR 水平比较( ±s)
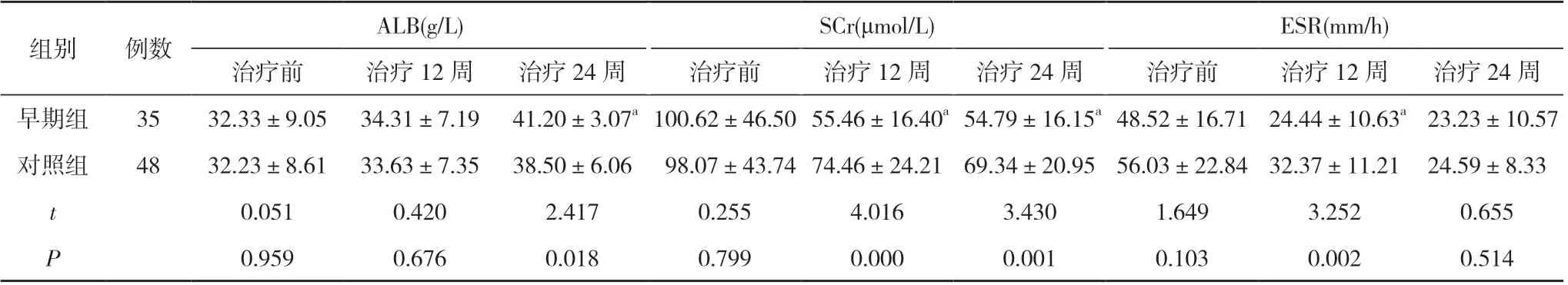
表3 两组肝肾功能指标和ESR 水平比较( ±s)
注:与对照组同时期比较, aP<0.05
ALB(g/L)SCr(μmol/L)ESR(mm/h)治疗前治疗12 周治疗24 周治疗前治疗12 周治疗24 周治疗前治疗12 周治疗24 周早期组3532.33±9.05 34.31±7.19 41.20±3.07a 100.62±46.50 55.46±16.40a 54.79±16.15a 48.52±16.71 24.44±10.63a 23.23±10.57对照组4832.23±8.61 33.63±7.35 38.50±6.06 98.07±43.74 74.46±24.21 69.34±20.95 56.03±22.84 32.37±11.21 24.59±8.33 t 0.0510.4202.4170.2554.0163.4301.6493.2520.655 P 0.9590.6760.0180.7990.0000.0010.1030.0020.514组别例数
2.3 两组免疫功能指标比较 早期组治疗12 和24 周时的IgG 和IgA 水平明显低于对照组, 治疗12 周时的球蛋白水平明显低于对照组, 治疗12 和24 周时的C3水平明显高于对照组, 有统计学差异(P<0.05)。见表4。
表4 两组免疫功能指标比较( ±s, g/L)
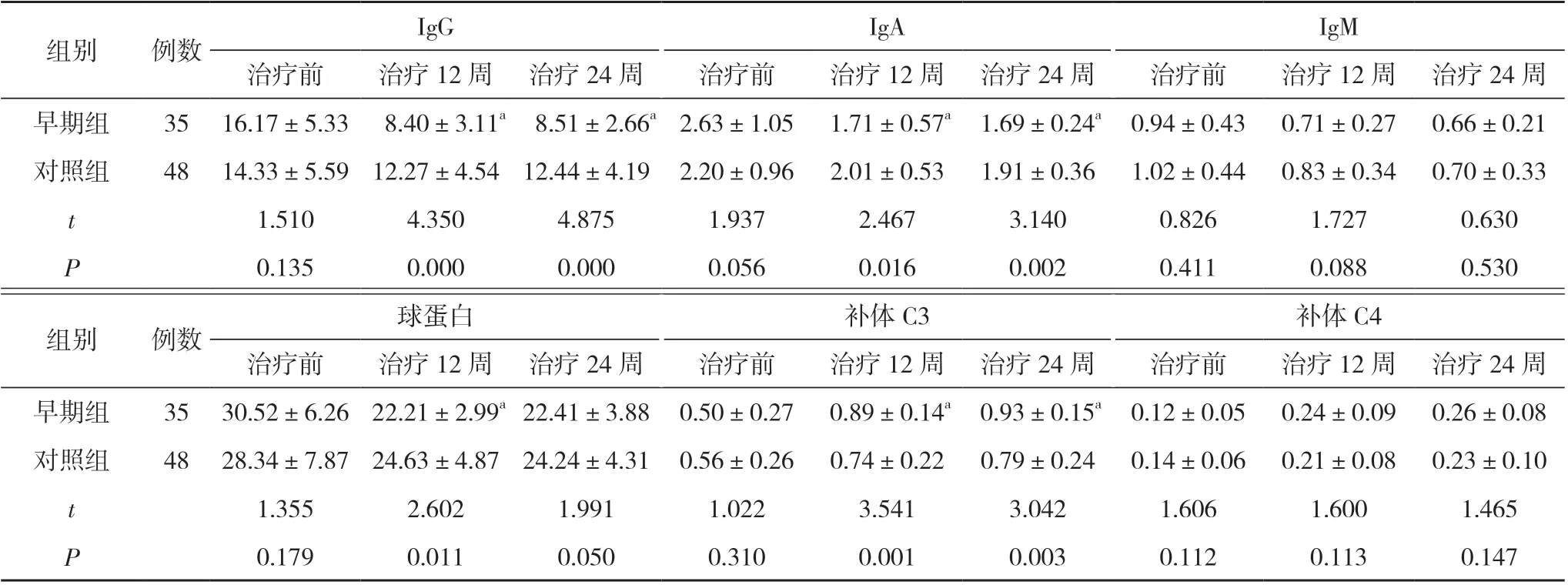
表4 两组免疫功能指标比较( ±s, g/L)
注:与对照组同时期比较, aP<0.05
组别例数IgG IgA IgM治疗前治疗12 周 治疗24 周治疗前治疗12 周 治疗24 周治疗前治疗12 周 治疗24 周早期组35 16.17±5.33 8.40±3.11a 8.51±2.66a 2.63±1.05 1.71±0.57a 1.69±0.24a 0.94±0.43 0.71±0.27 0.66±0.21对照组48 14.33±5.59 12.27±4.54 12.44±4.19 2.20±0.96 2.01±0.53 1.91±0.36 1.02±0.44 0.83±0.34 0.70±0.33 t 1.5104.3504.8751.9372.4673.1400.8261.7270.630 P 0.1350.0000.0000.0560.0160.0020.4110.0880.530组别例数球蛋白补体C3补体C4治疗前治疗12 周 治疗24 周治疗前治疗12 周 治疗24 周治疗前治疗12 周 治疗24 周早期组35 30.52±6.26 22.21±2.99a 22.41±3.88 0.50±0.27 0.89±0.14a 0.93±0.15a 0.12±0.05 0.24±0.09 0.26±0.08对照组48 28.34±7.87 24.63±4.87 24.24±4.31 0.56±0.26 0.74±0.22 0.79±0.24 0.14±0.06 0.21±0.08 0.23±0.10 t 1.3552.6021.9911.0223.5413.0421.6061.6001.465 P 0.1790.0110.0500.3100.0010.0030.1120.1130.147
2.4 两组激素减量值和SLEDAI-2000 评分比较 治疗12 和24 周时, 早期组的激素减量值明显高于对照组, SLEDAI-2000 评分明显低于对照组, 有统计学差异(P<0.05)。见表5。
表5 两组激素减量值和SLEDAI-2000 评分比较( ±s)
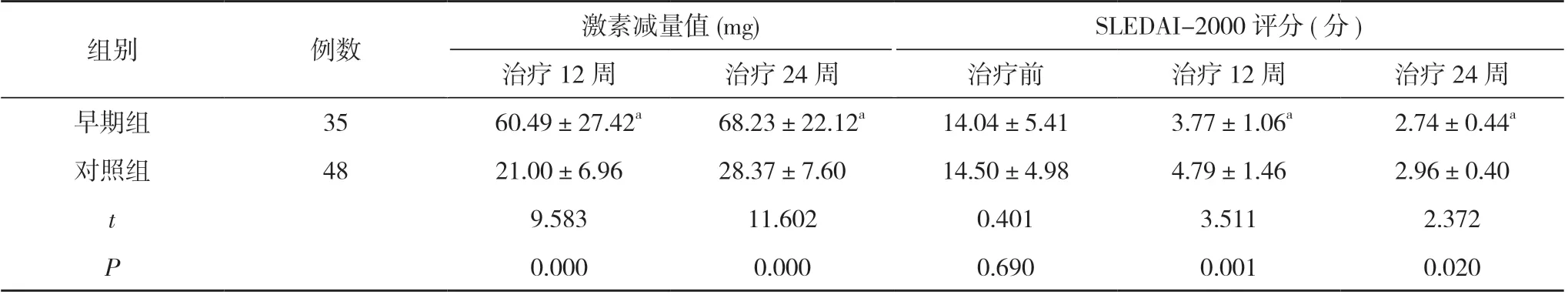
表5 两组激素减量值和SLEDAI-2000 评分比较( ±s)
注:与对照组同时期比较, aP<0.05
组别例数激素减量值(mg)SLEDAI-2000 评分(分)治疗12 周治疗24 周治疗前治疗12 周治疗24 周早期组35 60.49±27.42a 68.23±22.12a14.04±5.41 3.77±1.06a 2.74±0.44a对照组4821.00±6.9628.37±7.6014.50±4.984.79±1.462.96±0.40 t 9.58311.6020.4013.5112.372 P 0.0000.0000.6900.0010.020
2.5 两组主要器官损害情况比较 主要器官损害情况中, 两组发生率最高者均为狼疮性肾炎(早期组51.43%VS 对照组的64.58%), 其次为狼疮性血液系统损害(早期组的17.14%VS 对照组的14.58%)。两组各种主要器官损害发生率对比, 无统计学差异(P>0.05)。见表6。

表6 两组主要器官损害情况比较[n(%)]
3 讨论
糖皮质激素由于具有较强的免疫抑制、抗炎和抗过敏作用, 其是治疗SLE 的基础用药。最早在1952 年发表了一系列SLE 患者接受糖皮质激素治疗的报道。在相关报道中, 18 例患者接受高剂量可的松(200~300 mg/d)治疗, 随着SLE 症状的改善, 可的松逐渐减少。自20 世纪70 年代以来, 高剂量静脉注射甲基强的松龙30 mg/(kg·d)被用于快速控制SLE 相关炎症,并导致狼疮性肾炎患者肾功能的显著持续改善[9]。糖皮质激素的使用, 特别是与其他免疫抑制剂联合使用,显著降低了SLE 相关的死亡率, 5 年和10 年生存率分别从74.8%提高到94.8%和63.2%提高到91.4%[10]。糖皮质激素治疗SLE 的效果是勿容置疑的, 但其副作用也是临床医生顾虑的一大问题, 包括血糖血压升高、消化道溃疡、骨质疏松、感染等。在过去的20 年中,SLE 患者的预期寿命有了极大的增加, 但死亡率仍然是普通人群的3 倍。目前临床尽管对SLE 提高了认识和改善了管理, 但感染仍然是SLE 患者发病、住院和死亡的主要因素。SLE 患者的感染范围广泛, 从机会性感染到常见的细菌和病毒感染, 具有典型或不典型的表现[11]。一项关于SLE 的长期队列研究, 在亚洲的研究中, 约41%的患者死亡原因是感染, 相比欧洲的12%高得多[12]。另一项对长期服用糖皮质激素患者的研究中, 对275072 名成人进行了各种常见感染的风险比评估, 口服糖皮质激素大于15 d(女性:57.8%, 中位年龄:63 岁)与未口服糖皮质激素的患者相比, 对于每种感染, 感染风险比为2.01~5.84[13]。除了感染以外, 糖皮质激素带来的器官损害也逐步被认识, 特别是对眼、脑血管、心血管和肌肉骨骼系统的损害。一篇Meta 分析搜索了49 篇文章涉及16224 例SLE 患者, 统计了与其相关的器官损害, 主要包括白内障、脑血管意外(CVA)、心肌梗死(MI)、总心血管事件(心绞痛、冠状动脉旁路移植术)、缺血性骨坏死、骨质疏松症伴骨折。糖皮质激素不同的影响主要与每日剂量以及暴露剂量有关[14], 因此, 在控制疾病活动的基础上如何减少糖皮质激素带来的副作用是值得医务人员思考的问题。
B 淋巴细胞刺激因子(BlyS)促进了B 淋巴细胞的存活和分化为产生抗体的浆细胞, 其与SLE 的发病过程有密切关系。贝利尤单抗是一种重组人免疫球蛋白IgG1-λ 单克隆抗体, 可结合BlyS, 从而作为SLE 一种新的治疗手段, 其有效性及安全性已得到许多临床试验的证实。多中心、随机、安慰剂对照的BLISS-52、BLISS-76 研究是至关重要的3 期临床研究[15,16]。BLISS-52 从拉丁美洲、亚太和东欧招募患者, 而BLISS-76 招募来自西欧北部、中美洲的患者。两项研究中, 在52 周时贝利尤单抗组对比安慰剂组都有更高的SLE 应答指数4(SRI-4)应答率, 表明能更好地改善SLE 疾病活动度。BLISS-LN 为后批代表最大和最长在活动性狼疮性肾炎患者中进行的3 期研究,这项为期104 周的随机、双盲、安慰剂对照研究涉及448 名成年患者[17], 主要评估贝利尤单抗合并常规治疗在活动性狼疮性肾炎[根据2003 年国际肾脏病学会/肾脏病理学会(ISN/RPS)标准, Ⅲ型、Ⅳ型、Ⅴ型、Ⅲ型+Ⅴ型或Ⅳ型+Ⅴ型]中的疗效;此研究达到了其主要终点, 即肾脏疗效应答(PEER), 尿总蛋白肌酐比值(uPCR)≤0.7;肾小球滤过率(eGFR)降低≤复发前20%或≥60 ml/(min·1.73 m2);没有治疗失败。长期研究也为其安全性提供了依据, 其主要的不良事件为感染、输注反应以及恶性肿瘤。一项7 年的研究最后共纳入177 例患者, 提示每年严重感染发生率≤2%[18]。在使用糖皮质激素第1 年, 感染的发生率最高, 之后逐渐下降。最常见的感染是上呼吸道感染, 其次为蜂窝织炎;每年恶性肿瘤(不包括非黑色素瘤皮肤癌)患者的发生率为0.7%;总体不良事件发生率比较低。在13 年的研究中也得到类似的结论[19]。
《2020 中国系统性红斑狼疮诊疗指南》推荐, 贝利尤单抗适用于难治性或传统治疗效果不佳的SLE 患者[6], 但难治性SLE 患者通常已使用过多量激素才加入生物制剂, 此时往往已出现其相应的副作用。2023 年全球肾脏疾病预后组织(KDIGO)指南指出狼疮性肾炎可在诱导缓解期加入贝利尤单抗治疗。临床医生关注如何在获得令人满意疗效的同时降低激素及免疫抑制剂带来的副作用, 因此本研究着眼于是否在疾病早期加入贝利尤单抗使激素用量减少, 从而减少其带来的副作用。本研究患者的主要器官损害除了指南推荐的狼疮性肾炎外, 还包括狼疮性血液系统损害、神经精神狼疮、弥漫性肺泡出血、肺栓塞以及胃肠道损害等。值得一提的是, 弥漫性肺泡出血属于SLE 患者中病死率极高的危重症, 但本研究中2 例弥漫性肺泡出血患者均成功获救;同时两组各种主要器官损害发生率无统计学差异(P>0.05)。本研究结果还显示, 治疗12 周时, 早期组的ESR 和球蛋白水平明显低于对照组;治疗24 周时, 早期组的Neut 水平明显低于对照组, ALB水平明显高于对照组;治疗12 和24 周时, 早期组的Lym、Hb、C3 水平及激素减量值明显高于对照组,SCr、IgG、IgA 水平及SLEDAI-2000 评分明显低于对照组, 有统计学差异(P<0.05)。
综上所述, 早期应用贝利尤单抗治疗SLE 患者可改善血常规、肝肾功能、血沉及免疫功能, 有利于更快降低激素用量, 不会增加主要器官损害发生风险,期待样本量更大的、观察时间更长的研究来证实这一结论。
