一株耐碱好氧反硝化菌的分离鉴定及其脱氮性能
2024-02-29段兴帆赵毅彪陈小华沈根祥赵晓祥
段兴帆,亢 昕,赵毅彪,陈小华,沈根祥,赵晓祥
(1.东华大学 环境科学与工程学院, 上海;2.上海市环境科学研究院, 上海)
自进入工业化生产以来,人们生活水平显著提高,但由于各种工农业污水的过度排放,致使水体含氮量超标,生态环境恶化,不利于人体健康及环境的可持续发展[1],如何高效、环保地处理含氮废水一直是水处理研究的热点问题。
常见的废水脱氮工艺有物理法、化学法及生物法。与物理法和化学法相比,生物法成本低、对环境友好,被广泛应用于污水处理厂、人工湿地等领域[2]。传统生物脱氮工艺通常包括两个过程,首先由自养硝化菌在好氧条件下将氨氮转化为硝氮或亚硝氮,然后再由异养反硝化菌在厌氧条件下将硝氮或亚硝氮转化为含氮气体以达到脱氮目的[3]。因此,传统生物脱氮过程不能在同一反应器内完成,往往需要大型设备或较长的水力停留时间(hydraulic retention time, HRT)[4]。
好氧反硝化菌是一类能够在有氧条件下进行反硝化作用的微生物,生长周期短,无需额外设置厌氧反应器,设备维护简单[5]。目前,关于好氧反硝化菌的研究多集中于常规环境[6-7],而对极端环境下菌株脱氮特性的关注较少[8]。实际上,好氧反硝化菌对pH的变化敏感,其最适pH值范围一般为6.5~8.0,当pH值超过此范围,好氧反硝化菌的活性就会受到抑制,进而影响菌株的反硝化作用[9]。如在处理化工、制药等含碱废水中,还需添加酸来保障反应的正常进行[10]。此外,盐质量浓度也是影响细菌活性的重要因素,含盐量过高会导致细胞失水甚至裂解。尽管近年来陆续有科学家筛选出能够适应强碱、高盐环境的好氧反硝化菌,但大部分局限于单一耐受性的研究[11]。如王兆阳等[12]虽然分离出一株嗜碱好氧反硝化菌,但并未对其耐盐性做进一步研究;唐婧等[13]筛选出的耐盐好氧反硝化菌在pH值为8.0时反硝化效果最佳。因此,急需筛选能耐受强碱环境及一定盐质量浓度的好氧反硝化菌用以简化处理流程,降低处理成本,以期应用于更广泛的处理领域。
从土壤中分离出一株耐碱好氧反硝化琼氏不动杆菌5-2,通过考察其在不同环境因素下的脱氮特性,发现该菌株不仅能够高效去除环境中的硝氮,还能适应强碱环境(pH=10.0~12.0)及一定盐质量浓度(10~30 g/L)。此外,还对此菌的好氧反硝化相关酶活性及功能基因进行了检测,有望为好氧反硝化菌处理复杂含氮废水的实际应用提供参考。
1 材料和方法
1.1 试验材料
1.1.1 样品来源
采集距地面深约10 cm的稻田土壤300 g,将收集到的新鲜土壤立即低温运输至实验室并保存在4 ℃的冰箱中,用于后续细菌的筛选分离。
1.1.2 培养基
培养基具体配方如下所述。富集培养基:鱼粉蛋白胨质量浓度为5.00 g/L,酵母提取物质量浓度为5.00 g/L,NaCl质量浓度为10.00 g/L。驯化培养基:CH3COONa质量浓度为 1.30 g/L,KH2PO4质量浓度为0.09 g/L,MgSO4·7H2O 质量浓度为0.20 g/L,KNO3质量浓度为 0.72 g/L。LB培养基:胰蛋白胨质量浓度为10.00 g/L,酵母提取物质量浓度为5.00 g/L,NaCl质量浓度为10.00 g/L。微量元素溶液:EDTA质量浓度为15.00 g/L,ZnSO4质量浓度为0.20 g/L,MnCl质量浓度为1.50 g/L,FeSO4·7H2O质量浓度为0.50 g/L,CuSO4·7H2O 质量浓度为0.50 g/L,CoCl·6H2O质量浓度为0.30 g/L,Na2MO4·2H2O质量浓度为0.20 g/L,CaCl2质量浓度为0.10 g/L。好氧反硝化培养基(ADM):CH3COONa质量浓度为 0.62 g/L,KH2PO4质量浓度为0.09 g/L,MgSO4·7H2O质量浓度为0.20 g/L,KNO3质量浓度为0.29 g/L,微量元素溶液体积为2 mL。溴百里酚蓝培养基(BTB):在ADM培养基配方中加入体积为1 mL的1% BTB酒精溶液(0.10 g溴百里酚蓝溶于10 mL酒精)。
在上述培养基配方中加入质量浓度为20.00 g/L的琼脂即可得到相应固体培养基,试验试剂为分析纯,培养基在121 ℃下灭菌15 min后使用。
1.1.3 试验仪器
JA-SERIES型分析天平;UV-1800PC型紫外分光光度计;DSX-280KB24型手提式压力蒸汽灭菌锅;SPH-2102C型立式双层摇床;TECHCOMP CT15RT型离心机;VS-840-1型超净工作台;SU8010型扫描电子显微镜;JY92-II型超声波细胞粉碎机。
1.2 试验方法
检测指标与方法如表1所示。硝氮或总氮的去除率(η)计算式为:η=(ρ1-ρ2)/ρ1×100%,其中ρ1和ρ2分别为试验前后培养基中硝氮或总氮的质量浓度,分析图表采用Excel及Origin 8.6软件进行绘制。

表1 检测指标与方法Table 1 Detection indicators and methods
1.3 菌株的分离鉴定
1.3.1 菌株的富集及分离
称取5 g土样置于盛有100 mL灭菌生理盐水的锥形瓶中,在30 ℃、100 r/min的摇床中振荡20 min后,吸取5 mL悬浮液于富集培养基培养48 h后,再从中吸取2 mL菌液至驯化培养基中培养,重复此操作6次后即可得到好氧反硝化细菌富集液。将富集液按照10倍稀释法梯度稀释,吸取0.1 mL稀释倍数为108的菌液涂布于BTB固体培养基上,于30 ℃培养24 h,挑取使培养基变蓝的单菌作为初筛菌株。将纯化后的单菌株分别接种在ADM培养基中培养48 h,选取硝氮去除率最高的菌株作为后续试验对象。
1.3.2 菌株形态学及扫描电子显微镜观察
1)形态学观察及革兰染色。将菌株挑取至LB固体培养基上,于30 ℃培养24 h后观察菌落状态。同时,对菌株进行革兰染色并观察其在光学显微镜下的染色情况。
2)扫描电子显微镜观察。取培养至对数期的菌液5 mL 在8 000 r/min条件下离心10 min(离心半径为30 mm),用体积分数为2.5%的戊二醛溶液固定12 h,使用扫描电子显微镜放大5 000倍观察。
1.3.3 菌株鉴定及功能基因的扩增
使用上海派森诺生物公司提供的正向引物27F(5′- AGAGTTTGATCCTGGCTCAG-3′)及反向引物1492R(5′-CTACGGCTACCTTGTTACGA-3′)进行16 S rDNA测序,同时以基因组 DNA 为模板,扩增好氧反硝化相关基因(napA、nirK、nirS)[14],引物序列见表2。将测序结果与NCBI数据库中获得的其他微生物16 S rDNA序列进行BLAST比对,并使用MEGA 11.0软件构建系统发育树。

表2 好氧反硝化相关基因序列Table 2 Aerobic denitrification-related gene sequence
聚合酶链式反应(polymerase chain reaction, PCR)体系(50.00 μL): 1.00 μL基因组DNA,5.00 μL 10×Buffer(含 2.50 mmol/L Mg2+),1.00 μL dNTP,1.00 μL Taq聚合酶,1.50 μL 27F,1.50 μL1492R,39.00 μL ddH2O。PCR反应温度条件: 95 ℃ 预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃ 延伸120 s,35个循环。
1.3.4 好氧反硝化酶活性测定
将在LB培养基中培养至对数期的菌株,于10 000 r/min离心10 min后(离心半径为30 mm),用浓度为10 mmol/L磷酸缓冲盐(phosphate buffered saline, PBS)(pH=7.4)溶液清洗3次后重悬菌体于离心管中。使用超声波细胞粉碎机破碎15 min,再次离心后收集上清液即为细胞粗酶液。将适量细胞粗酶液分别加入相应酶反应体系,在35 ℃、90 r/min条件下反应30 min,通过各体系中硝氮及亚硝氮的消耗量来计算酶活力及酶比活力。超声波细胞粉碎机具体工作条件及酶反应体系的构建参照文献[15]。
酶活性单位(U)定义为1 min能转化1 μmol反应物的酶量。酶活力(U/mL)是指1 mL粗酶液中含有的酶活性单位,酶比活力(U/mg)是指1 mg蛋白质中含有的酶活性单位。蛋白质浓度使用Solarbio BCA法试剂盒测定。
1.4 菌株脱氮能力研究
1.4.1 脱氮条件优化
将培养至对数期的菌液以体积分数为2%的接种量分别接种于单一因素变量的ADM培养基中以优化其脱氮条件。具体试验条件如下:
1)在m(C)/m(N)值为12、初始pH值为10.0、转速为90 r/min、温度为35 ℃、盐质量浓度为0 g/L的条件下,优化碳源(甲醇、葡萄糖、蔗糖、柠檬酸、乙酸钠);
2)以乙酸钠为碳源、初始pH值为10.0、转速为90 r/min、温度为35 ℃、盐质量浓度为0 g/L的条件下,优化m(C)/m(N)值(8、10、12、14、16);
3)以乙酸钠为碳源、m(C)/m(N) 值为12、转速为90 r/min、温度为35 ℃、盐质量浓度为0 g/L的条件下,优化初始pH值(6.0、7.0、8.0、10.0、12.0);
4)以乙酸钠为碳源、m(C)/m(N) 值为12、初始pH值为10.0、温度为35 ℃、盐质量浓度为0 g/L的条件下,优化转速(30、60、90、120、150 r/min);
5)以乙酸钠为碳源、m(C)/m(N) 值为12、初始pH值为10.0、转速为90 r/min、盐质量浓度为0 g/L的条件下,优化温度(20、25、30、35、40 ℃);
6)以乙酸钠为碳源、m(C)/m(N)值为12、初始pH值为10.0、转速为90 r/min、温度为35 ℃的条件下,优化盐质量浓度(10、20、30、40、50 g/L)。
培养72 h后测定细菌生物量(OD600)并计算硝氮及总氮的去除率,所有试验重复3次。
1.4.2 脱氮特性研究
在最优条件下,将菌株接种于ADM培养基中,每隔24 h测定其硝氮、亚硝氮、氨氮、总氮质量浓度及OD600值,进一步评价菌株反硝化能力。
2 结果与分析
2.1 好氧反硝化菌的分离
在筛选试验中共得到5个具有好氧反硝化能力的单菌,计算其在24、48 h的硝氮去除率,结果如图1所示。其中菌株5-2在48 h的硝氮去除率最高(91.64%),故选择菌株5-2用于后续试验。

图1 不同菌株的硝氮去除情况Fig.1 Nitrate removal effect of different strains of bacteria
2.2 形态学观察
菌株5-2的外观形态和染色结果如图2所示。

图2 菌株5-2的外观形态和染色结果Fig.2 Morphological appearance and staining results of the bacteria strain 5-2
由图2(a)可知,菌株单菌落呈米黄色且形状规则,边缘光滑。由图2(b)可知,在光学显微镜下可观察到菌株的细胞呈蓝色,结合《伯杰氏系统细菌学手册》(第8版),初步鉴定为革兰阳性菌。由图2(c)可观察到细菌呈杆状,排列紧密无鞭毛。
2.3 菌株鉴定结果
将菌株5-2的16 S r DNA测序结果与NCBI数据库比对,发现其与琼氏不动杆菌ATCC 17908存在亲缘关系,相似性为99.93%。采用MEGA 11软件构建的菌株5-2系统发育树如图3所示,结果表明该菌为琼氏不动杆菌。

图3 根据16S rDNA同源性基因序列构建的菌株5-2系统发育树Fig.3 Phylogenetic tree of strain 5-2 based on the sequence homology of 16S rDNA gene
2.4 菌株脱氮条件的优化
1)碳源。碳源会影响细菌的代谢及电子传递过程,继而影响细菌对氮的利用[16]。不同碳源下培养72 h后菌株生长及脱氮情况如图4所示。由图4可知:以甲醇为碳源时,菌株生长受到抑制(OD600=0.095),硝氮及总氮去除率较低,这可能与甲醇本身具有毒性有关;以柠檬酸为碳源时,OD600值为0.130,硝氮及总氮去除率分别为8.87%及2.25%;以蔗糖为碳源时,OD600值为0.255,硝氮及总氮去除率分别为31.57%及15.78%;以葡萄糖为碳源时,OD600值为0.433,硝氮及总氮去除率分别为68.06%及35.31%;以乙酸钠为碳源时,菌株OD600值最大为0.561,此时,硝氮及总氮的去除率也达到最高,分别为94.64%及53.27%。这说明琼氏不动杆菌5-2可利用葡萄糖、蔗糖及乙酸钠为碳源。相较于葡萄糖与蔗糖,乙酸钠分子结构更为简单,无需经过酶的转化即可直接参与反硝化过程[17]。综上,选择乙酸钠作为后续试验的碳源。

图4 碳源对脱氮性能的影响Fig.4 Effect of carbon source on denitrification performance
2)m(C)/m(N)值。m(C)/m(N)值是影响细菌生长的关键因素,过低或过高的m(C)/m(N)值会影响菌株的脱氮效果[18]。培养72 h后,不同m(C)/m(N)值下菌株生长及脱氮情况如图5所示。

图5 m(C)/m(N)值对脱氮性能的影响Fig.5 Effect of m(C)/m(N) value on denitrification performance
由图5可知,在一定范围内菌株脱氮能力随着m(C)/m(N)值的增加而增强,当超过该范围,m(C)/m(N)值不再是影响菌株脱氮的关键因素。当m(C)/m(N)值由8提高到12时,菌株OD600值由0.415升至0.575,硝氮去除率由73.53%增加到95.71%,总氮去除率由37.24%增加到51.88%;但当m(C)/m(N)值为14和16时,硝氮去除率分别为95.97%及96.47%,总氮去除率分别为52.24%及53.33%,并无明显增加。在An等[19]的研究中也观察到相似现象。综上,琼氏不动杆菌5-2能够适应广泛的m(C)/m(N)值范围,考虑成本及避免不必要的浪费,确定最佳m(C)/m(N)值为12。
3)初始pH值。pH对细菌活性有显著影响。培养72 h后,不同初始pH值下菌株生长及脱氮情况如图6所示。由图6可知,菌株的脱氮能力随着初始pH值的升高而增强,并始终保持着较高的脱氮率。当初始pH值为10.0时,OD600值为0.592,硝氮及总氮去除率最高,分别为98.75%及58.54%;当初始pH值为12.0时,菌株的脱氮能力下降,硝氮与总氮去除率分别为93.08%及53.78%,高于已有报道[20-21]的耐碱好氧反硝化菌。由此可知,琼氏不动杆菌5-2能够很好地适应强碱环境,并表现出优异的反硝化能力。综上,确定最佳初始pH值为10.0。

图6 初始pH值对脱氮性能的影响Fig.6 Effect of initial pH value on denitrification performance
4)转速。溶解氧浓度对菌株的生长速率和传质速率有重要的影响[22],试验中通常通过转速来控制溶解氧的浓度。培养72 h后,不同转速下菌株生长及脱氮情况如图7所示。

图7 转速对脱氮性能的影响Fig.7 Effect of rotation rate on denitrification performance
由图7可知,在一定范围内转速的增加有利于菌株进行反硝化作用,当超过该范围,转速的增加反而会有相反效果。在转速由30 r/min升至90 r/min时,菌株生长良好(OD600值为0.615),其脱氮能力增强,硝氮与总氮的去除率分别可达97.05%及58.58%;但当转速升高至120及 150 r/min时,菌株反硝化能力明显下降,其中转速为150 r/min时,脱氮效果最差,此时OD600值为0.425,硝氮与总氮的去除率分别为73.37%及41.28%。这说明琼氏不动杆菌5-2可能存在溶解氧阈值,当超过阈值,提高转速反而不利于菌株进行反硝化[23]。综上,确定最适转速为90 r/min。
5)温度。已有报道[24]的大多数好氧反硝化菌最适温度为30~37 ℃。培养72 h后,不同温度下菌株生长及脱氮情况如图8所示。由图8可知,过低或过高的温度不利于菌株的生长及氮的去除。当温度为20 ℃,菌株生长不佳,脱氮率最低;当温度为30~35 ℃时,菌株的OD600值和脱氮率明显上升,其中温度为35 ℃时,硝氮及总氮去除率最高分别为97.27%及56.34%;但是当温度继续升高至40 ℃时,菌株OD600值和脱氮率又有所下降。由此可见,当温度低于30 ℃或高于35 ℃时不利于菌株反硝化作用的进行。因此,确定最适宜反硝化温度为35 ℃。
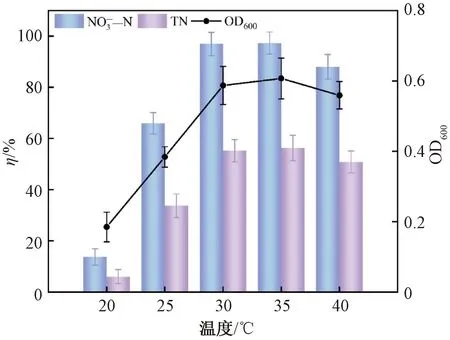
图8 温度对脱氮性能的影响Fig.8 Effect of temperature on denitrification performance
6)盐质量浓度。盐质量浓度的增加对细菌的影响显著。培养72 h后,不同盐质量浓度下菌株生长及脱氮情况如图9所示。由图9可知,随着盐质量浓度的增加,菌株的脱氮能力逐渐下降。在盐质量浓度为10 ~30 g/L时,盐质量浓度对菌株的生长和反硝化速率影响较小,硝氮去除率均大于90%,这与菌株TJPU04[25]在盐质量浓度试验中的表现相似;当盐质量浓度升至为40和50 g/L时,细菌OD600值及脱氮率出现明显下降,盐质量浓度为50 g/L时降至最低,此时OD600值为0.119,硝氮去除率降至8.98%,总氮去除率降至2.12%。总体而言,琼氏不动杆菌5-2的耐盐能力要强于一般好氧反硝化菌[26],这可能是由于该菌株能够产生一些代谢物质使其在一定盐质量浓度下保持渗透平衡[27]。由此证明琼氏不动杆菌5-2具有处理一定浓度含盐废水的潜力。
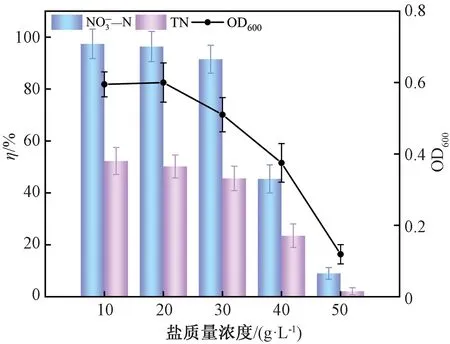
图9 盐质量浓度对脱氮性能的影响Fig.9 Effect of salt mass concentration on denitrification performance
2.5 脱氮特性研究
在上述各个因素最佳条件下琼氏不动杆菌5-2培养120 h后硝氮、亚硝氮、氨氮、总氮的质量浓度及OD600值变化情况如图10所示。

图10 琼氏不动杆菌5-2的反硝化过程Fig.10 Process of denitrification of Acinetobacter junii strain 5-2
由图10可知:在培养24 h后,菌株进入对数生长期(OD600值为0.557),硝氮质量浓度下降至4.05 mg/L,总氮质量浓度下降为27.22 mg/L,出现明显的亚硝氮积累(18.92 mg/L)及少量氨氮(5.96 mg/L),其中氨氮的少量积累可能与菌株的生长有关[28];培养48 h后,菌株硝氮质量浓度为2.82 mg/L,亚硝氮质量浓度开始下降(15.24 mg/L),氨氮质量浓度为7.16 mg/L;培养72 h后,菌株的硝氮质量浓度及亚硝氮质量浓度分别下降为1.03及10.55 mg/L,氨氮质量浓度则上升为8.41 mg/L,这可能与部分细菌的衰亡有关;当继续培养至120 h后,菌株OD600值降为0.566,此时硝氮质量浓度(0.89 mg/L)及总氮质量浓度(14.45 mg/L)均降至最低。结果表明,氮的去除与细菌的生长呈现良好的一致性,并且在整个培养过程中,可观察到亚硝氮先积累后下降及氨氮的少量积累,Yang等[29]、Zou等[30]报道的好氧反硝化菌也被观察到类似情况。
2.6 酶活性及脱氮基因的检测
理论上,好氧反硝化菌主要利用硝酸盐还原酶(nitrate reductase, NAR)和亚硝酸盐还原酶(nitrite reductase, NIR)进行反硝化作用。其中NAR常见编码基因为napA,NIR常见编码基因为nirK及nirS[31]。因此,可通过检测相关酶活性及基因来验证琼氏不动杆菌5-2的好氧反硝化能力。

表3 琼氏不动杆菌5-2的关键酶活力
琼氏不动杆菌5-2的基因检测结果如图11所示,可以看出只有nirK基因被成功扩增。

图11 琼氏不动杆菌5-2反硝化基因的扩增Fig.11 The amplification of denitrification genes of Acinetobacter junii strain 5-2
类似地,在王贺等[32]的研究中也未能检测出napA基因。据此推测可能有以下3个原因:(1)琼氏不动杆菌5-2为革兰阳性菌,而目前筛选得到的好氧反硝化菌大都为革兰阴性菌,革兰阳性菌代谢复杂,可能存在其他代谢途径[33];(2)好氧反硝化机理尚缺乏系统性研究,可能存在未被鉴定出的反硝化酶基因[34];(3)硝氮异化为铵或发生同化作用[35]。此外,nirK基因的成功扩增则表明琼氏不动杆菌5-2具有将亚硝氮还原为一氧化氮的能力,也符合之前的研究[36]中nirS与nirK基因不能同时表达的观点。因此,虽然napA基因未能被检测出来,但是不能否认琼氏不动杆菌5-2具备好氧反硝化能力。
3 结 论
1)从上海市稻田土壤中分离出一株耐碱好氧反硝化琼氏不动杆菌5-2,并通过单因素影响试验确定其最佳脱氮条件。在此条件下,培养120 h后菌株对硝氮及总氮的去除率分别为97.83%及65.85%。
2)琼氏不动杆菌5-2能适应强碱环境及一定盐质量浓度范围。当pH值为10.0~12.0时,盐质量浓度范围为10~30 g/L时,菌株均能正常生长并表现出良好的脱氮效率。此外,相关酶活性及基因检测结果进一步证明琼氏不动杆菌5-2具有将硝氮及亚硝氮还原为气体产物的能力,为处理实际复杂废水提供了理论依据。
