用于乳腺肿瘤细胞三维培养的纤维-水凝胶复合支架的制备及表征
2024-02-29傅思佳刘星星胡梦博李超婧1b王富军1b1b
傅思佳,刘星星,胡梦博,李超婧,1b,王富军,1b,王 璐,1b
(1.东华大学 a.纺织学院,b.纺织面料技术教育部重点实验室, 上海;2.复旦大学附属华山医院泌尿外科, 上海)
乳腺癌是女性最常见的癌症,仅2020年就有230万新病例,已成为全球主要新发癌症类型[1]。正常乳腺组织非常柔软,而乳腺肿瘤组织的机械刚度通常高于周围正常组织,较高的组织硬度会影响肿瘤细胞的增殖、迁移、表型和对药物的敏感性[2-3]。乳腺肿瘤学研究通常在传统的二维(2D)结构中进行培养,但这忽略了细胞外基质(extracellular matrix,ECM)与细胞相互作用的复杂性,导致细胞生物学行为的改变并高估药物疗效[4-5]。与2D培养相比,在模拟ECM三维(3D)结构中培养的肿瘤细胞表现出与体内更接近的生长形态和化学敏感性特征,能够更准确地概括复杂的肿瘤微环境和预测药物治疗效果[6]。
大部分人体正常组织或肿瘤组织的ECM均是由两种不同形态的组分构成的3D大分子网络。其一是由胶原蛋白、弹性蛋白等糖蛋白组成的蛋白质纤维网,起到构建细胞微环境中机械特质的作用;其二是由糖胺聚糖组成的凝胶状基质,能够指导细胞迁移、基质沉积和降解[7-8]。因此,ECM可被视为一种纤维-水凝胶复合结构[9]。为了仿生天然ECM结构,将静电纺丝纤维与水凝胶结合以提高与天然ECM结构的相似性、力学性能和细胞信号传导能力[10]。其中,水凝胶是高度亲水的3D聚合物网络,具有与天然ECM相似的物理和生化特性,可为细胞扩散和物质交换提供支持[11]。海藻酸钠(sodium alginate,SA)是一种从褐藻中提取的天然阴离子多糖,可作为ECM中糖胺聚糖的替代物,已用作封装和固定多种类型细胞[12]。然而,SA力学性能较差且缺乏细胞黏附位点,阻碍了其作为细胞长期培养支架的应用[13]。将具有优异生物相容性和可降解性的聚乳酸-乙醇酸共聚物(poly(lactic-co-glycolic acid,PLGA)纤维纳入水凝胶基质,两者表面在互锁效应下发生机械结合,纤维通过调整应力分布可以改善水凝胶的力学性能[14]。此外,纤维还可以引导细胞聚集并影响细胞行为[15]。
本研究制备了一个结构均匀的静电纺丝-水凝胶3D细胞培养支架。在静电纺丝过程中加入SA粉末,支架在水溶液中润湿的过程中,SA粉末迅速向各方向发生溶胀,使PLGA纤维层间膨胀并改善致密的纤维排列。SA与PLGA纤维形成互穿网络,经冻干后留下高度多孔的纤维-水凝胶复合支架三维结构如图1所示。为改善支架对肿瘤细胞的引导效果,在纤维-水凝胶复合支架中负载富血小板血浆(platelet-rich plasma,PRP)以提高支架的生物活性。PRP是从全血中提取的富含高浓度血小板的血液衍生产品,是生长因子(growth factor,GFs)、细胞因子和纤维蛋白原的天然来源,因此已被用于组织工程和3D细胞培养平台的开发[16]。乳腺肿瘤周围存在高浓度的纤维蛋白,在Ca2+/凝血酶作用下,PRP中的纤维蛋白原重新聚合形成具有微纳米尺度和黏弹性的纤维蛋白网络[17]。本研究将支架用作体外肿瘤模型来培养和评估乳腺肿瘤细胞的生物学行为,并比较2D培养和3D培养所导致的药物敏感性差异。
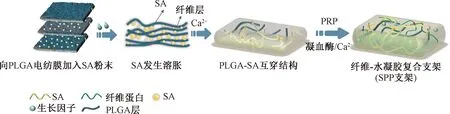
图1 纤维-水凝胶复合支架的制备方法Fig.1 Fabrication of the fiber-hydrogel composite scaffold
1 材料和方法
1.1 材料
PLGA(mPLA/mPGA=50:50,Mw=105 000 g·mol-1)购自济南岱罡生物工程有限公司;N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)、三氯甲烷(chloroform,CF)、海藻酸钠、无水氯化钙(CaCl2)均购自国药集团化学试剂有限公司;凝血酶购自罗恩试剂;兔富血小板血浆(PRP)均购自广州鸿泉生物科技有限公司;人乳腺癌细胞(MCF-7)由中国科学院上海细胞库提供;胎牛血清(fetal bovine serum, FBS)、最低必须培养基(minimum essential medium,MEM)、胰酶、双抗均购自美国Thermo Fisher Scientific公司;4′,6-二脒基-2苯基吲哚(4,6-diqmino-2-phenyl indde, DAPI)溶液、异硫氰酸荧光素酯(fluorescein isothiocyanate, FITC)标记鬼笔环肽均购自北京索莱宝科技有限公司;CCK-8试剂盒购自翌圣生物科技上海有限公司;阿霉素(DOX)购自上海阿拉丁生化科技股份有限公司。
1.2 支架制备
为了比较支架的结构及组分对3D肿瘤模型性能影响,本研究构建了3种3D肿瘤支架,分别为纯SA水凝胶支架,SA与PRP双网络水凝胶(sodium alginate-PRP,SAP)支架,以及负载富血小板血浆的纤维-水凝胶(sodium alginate-PRP-PLGA,SPP)复合支架。具体制备方法如下:
SA水凝胶支架的制备是以去离子水配置10 mg/mL的SA溶液,20 mmol的 CaCl2作为交联剂并进行冷冻干燥得到的。
SAP水凝胶支架是通过将10 mg/mL的SA溶解在稀释2倍后的PRP中,以0.5 U/mL凝血酶和20 mmol的CaCl2作为交联剂并进行冷冻干燥得到的。
制备SPP支架需在进行PLGA静电纺丝的同时添加SA粉末,随后以20 mmol的CaCl2进行交联并冷冻干燥成型以形成PLGA-SA互穿结构。再将其充分浸润在PRP中,通过0.5 U/mL凝血酶和10 mmol的CaCl2诱导形成纤维蛋白网络并激活血小板,冷冻干燥后得到SPP支架。
1.3 支架表征
1.3.1 支架的化学结构表征
支架的化学结构和元素组成通过傅里叶变换红外光谱仪(Nicolet6700,Thermo Fisher Scientific,美国)、X射线光电子能谱仪(Escalab 250Xi,Thermo Fisher Scientific,美国)、能量分散谱仪(EDS)确定。用傅里叶变换红外光谱测试支架的化学键,记录波数为4 000~400 cm-1。使用X射线光电子能谱仪(Escalab 250Xi,Thermo Fisher Scientific,美国)分别分析测试3种支架的所含元素。EDS能谱分析通过使用配备有EDS检测器的FESEM在10 kV加速电压下进行,以获得大面积和随机选择的样品区域内元素组成的平均分布图。
1.3.2 形貌分析
使用场发射电子显微镜(SU8010,Hitachi,日本)观察各支架表面和截面的微观形貌。使用多孔材料孔径分析仪(CFP-1100AI,Porous Materials,美国)测定3D支架的孔径尺寸。每种支架选取50个孔以计算平均孔径。
孔隙率的测量是通过将支架浸入无水乙醇中,使乙醇充分渗透到支架中,支架在温度为25 ℃条件下保持隔夜[18]。支架的孔隙率通过式(1)计算而得。
P=(m1-m0)/(ρV0)×100%
(1)
式中:P为支架孔隙率,%;m0为干燥支架的质量;m1为乙醇渗透后支架的质量;ρ为25 ℃下乙醇的密度;V0为干燥支架的体积。
1.3.3 溶胀性能
将冻干支架在PBS中于37 ℃温育。以固定的时长间隔取出溶胀的支架并用滤纸吸收表面上的过量水后称重m2[19]。根据式(2)计算溶胀率(%):
R=(m2-m0)/m0×100%
(2)
式中:R为支架溶胀率,%。
1.3.4 水接触角
使用接触角测试仪(OCA15EC,Dataphysics,德国)对3种支架进行静态水接触角测试。采用微量注射器滴加4 μL超纯水至支架试样表面,拍摄表面形成的液滴,并用水接触角测试软件处理捕获的成像液滴。每种试样随机选取4个点进行测量并取平均值。
1.3.5 力学特性
将3种支架在PBS中彻底再水合作用后,使用人体内生物管道压缩弹性测试仪测量支架的压缩应力-应变行为。使用直径为20 mm的圆柱形压头,以5 mm/min 的速率压缩样品,直到其应变达50%。每种类型的支架至少测试3个样本,数据记录为平均值(±标准差)。弹性模量由压缩试验得到的应力-应变曲线的初始斜率计算[20]。
1.4 乳腺肿瘤细胞增殖
采用人源乳腺肿瘤细胞MCF-7评估在2D培养板,SA水凝胶支架、SAP水凝胶支架和SPP支架培养对肿瘤细胞生物学行为的影响。MCF-7在补充有FBS(体积分数为10%)和青霉素-链霉素(体积分数为1%)的MEM培养基中培养,并在具有CO2(体积分数为5% )的加湿培养箱中于温度为37 ℃条件下生长。
使用CCK-8试剂盒量化细胞的增殖能力。将3种支架均在酒精缸中灭菌24 h后,在超净台中通风12 h并进行紫外线照射灭菌。分别在传统2D培养板、 SA水凝胶支架、SAP水凝胶支架和SPP支架上以2×104个细胞/孔的密度接种。每2 d更换培养基。培养7 d后,向每孔中加入1 mL工作液(培养基与CCK-8体积比为9∶1),孵育2 h后,将溶液转移到96孔板中以测量450 nm处的光密度(OD)值(每组n=8)。
1.5 细胞形态观察
通过DAPI/FITC鬼笔环肽染色评估细胞在支架中的分布和形态。培养7 d后,用PBS洗涤各支架,用体积分数为4%的多聚甲醛固定细胞30 min,并采用体积分数为0.1% 的TritonX-100对细胞进行透化。细胞骨架用FITC标记鬼笔环肽染色60 min,细胞核用DAPI避光孵育10 min。使用激光共聚焦显微镜(CLSM,ZEISS,德国)观察细胞形态和分布。
1.6 化疗药物敏感性的体外评估
为评估在2D培养板、SA水凝胶支架、SAP水凝胶支架和SPP支架中培养的细胞的耐药性差异,将2×104个MCF-7细胞分别接种在2D培养板、SA水凝胶支架、SAP水凝胶支架和SPP支架上,培养5 d后去除培养基,加入含质量浓度为100 μg/mL的DOX的新鲜培养基,处理细胞48 h。
用上述CCK-8测定法测定药物治疗后的细胞活力,根据式(3)计算细胞活力(%):

(3)
式中:MCF-7(处理)为药物治疗组;MCF-7(未处理)为不加药物组。
1.7 统计分析
所有试验均独立进行,至少重复3次,并计算平均值以确保重现性。使用单因素方差分析(ANOVA) 检验,然后使用Tukey检验进行事后成对比较,显著性差异水平p<0.05表示数据在统计学上存在显著性差异。
2 结果与讨论
2.1 支架的化学结构分析

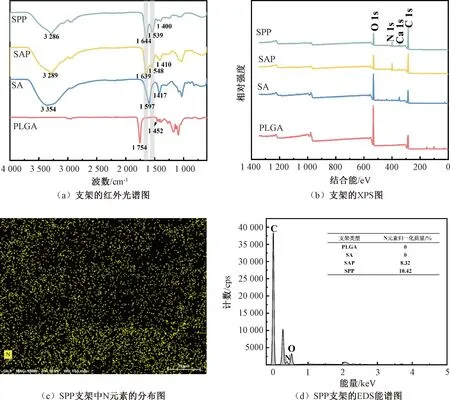
图2 支架的化学结构表征Fig.2 Chemical structure of the scaffolds
XPS元素分析证明SAP水凝胶支架和SPP支架中N元素的存在,如图2(b),且N元素在SPP支架中分布均匀,如图2(c)所示。在PLGA静电纺丝纤维、SA水凝胶支架中未检测到N元素,证实PRP在SPP支架中成功负载,如图2(d)所示。
2.2 支架的形貌分析
肿瘤支架的孔径和孔隙率影响细胞的渗透以及氧气、营养物质和代谢废物的转运,并与支架的溶胀性能和力学性能有关。为探索各支架的微观结构,使用扫面电镜进行微观结构分析支架的形貌和孔径表征,如图3所示。由图3可知,SA水凝胶支架、SAP水凝胶支架和SPP支架均呈现出互连的大孔结构。其中SA水凝胶支架具有最大的平均孔径(169.77±11.30)μm,但孔径大小分布不均(图3(a)~(c)蓝色虚线为SA孔隙)[9]。增加的交联网络和柔性的纤维蛋白聚合物链使SAP水凝胶支架具有孔径较小但更均匀的孔隙,孔径为(41.70±16.46)μm。已有研究[23-24]指出,孔径过大将不利于细胞黏附且损害支架的力学性能。此外,在SAP水凝胶支架和SPP支架的表面和内部都能观察到互连的纤维蛋白网络(见图3(b)、(c)黄色箭头指示),这些蛋白网络连接在SA形成的大孔和PLGA纤维间,丰富的纤维蛋白网络能够为细胞提供黏附表面,促进细胞增殖。进一步观察发现,SPP支架中微纳米级的PLGA纤维存在于SA孔隙中,支架中存在的多孔(平均孔径为(25.83±7.38)μm)和纤维使细胞黏附在孔壁上,并通过相邻层间悬垂的纤维(见图3(e))进行细胞-细胞、细胞-基质相互作用[15]。测试的3种支架的孔隙率均高于80%,能为细胞的浸润、增殖提供充分的空间和渠道(见图3(f))。
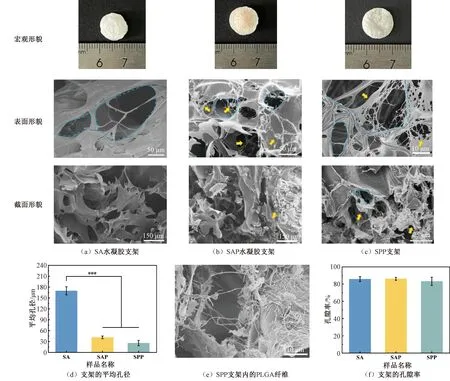
图3 支架的形貌和孔径表征Fig.3 Morphology and pore size of the scaffolds
2.3 溶胀性能和水接触角
支架表面润湿性对细胞的附着、增殖、迁移和活力具有重要意义。支架的水接触角和溶胀性能如图4所示,通过水接触角测试表征加入PLGA纤维后对支架表面润湿性的影响。由图4(a)可知,SA水凝胶支架显示出高亲水性,水滴在接触表面0.14 s后立即被吸收到水凝胶中。相比之下,SAP水凝胶支架的水滴吸收速度略慢(为0.72 s)。这是因为纤维蛋白原在转变成纤维蛋白时疏水性略有增加,导致SAP水凝胶支架的亲水性略有下降,但当纤维蛋白为凝胶状时,其是完全亲水的[25]。PLGA静电纺丝纤维的接触角为126.83°±2.70°,表明PLGA纤维是疏水的,与文献[21]研究结果一致。将PLGA纤维加入支架体系,水滴仍能在0.65 s内迅速渗透到SPP支架内,说明引入水凝胶后,支架由疏水转为亲水,具有较好的表面润湿性。细胞膜具有亲水的寡糖链,SPP支架的表面亲水性将有助于细胞在支架上黏附,适用于细胞培养[26-27]。

图4 不同支架的水接触角和溶胀性能Fig.4 Swelling properties and water contact angles of the scaffolds
吸收液体后的溶胀能力是用于3D支架细胞培养的支架的另一个重要特性,主要取决于其微观结构和亲水性。溶胀性能有效地反映水凝胶对养分和代谢物的渗透和运输能力,并影响水凝胶的力学性能和结构稳定性。本研究测量了支架在PBS中水合24 h后的溶胀率,如图4(b)所示。由图4(b)可知,3种支架均表现出优异的溶胀性能,其中,SA水凝胶支架的溶胀率最高为(3 468±14)%,但试验中观察到,SA水凝胶支架在溶胀过程中逐渐失去稳定的形态结构。由于交联网络的增加,SAP水凝胶支架溶胀率低于SA水凝胶支架,为(2 733±43)%。SPP支架溶胀率为(2 234±81)%略有降低但与SAP水凝胶支架无显著性差异,由此可知纤维的存在不会影响水凝胶的溶胀。纤维组分均匀分布在水凝胶中,其在溶胀过程中始终保持良好的形态结构,如图4(c)所示。这是因为纤维的存在会限制水凝胶的过度溶胀,这将有助于支架维持结构稳定以适用于细胞长期培养。
2.4 支架的力学性能
3D支架的力学性能应能支持肿瘤细胞在较长时间内的生长和增殖。支架压缩应变达50%时(L0为支架高度,图5(a)),应力-应变曲线如图5(b)所示。应变为0~10%时,添加纤维对支架的弹性模量无显著性影响(见图5(c))。这是因为纤维-水凝胶复合支架在压缩过程中承载压缩载荷时有两个阶段的变形。在压缩过程中,水凝胶基质在载荷的方向上被压缩,导致垂直于作用力方向的膨胀。第一阶段,纤维先被拉直,这需要较小的变形力[28]。第二阶段,当应变增加到10%~15%时,SPP支架的弹性模量为(4.79±0.45)kPa,显著高于SAP水凝胶支架(见图5(d))。这时需要更大的力使拉直的纤维持续变形,且随着压缩过程中纤维密度的增加,纤维和水凝胶互连引起负载转移,从而显著增加变形力[29]。此外,SPP支架与乳腺肿瘤组织的模量((4~23)kPa)相当,可以为乳腺癌细胞提供生理相关的微环境[14]。
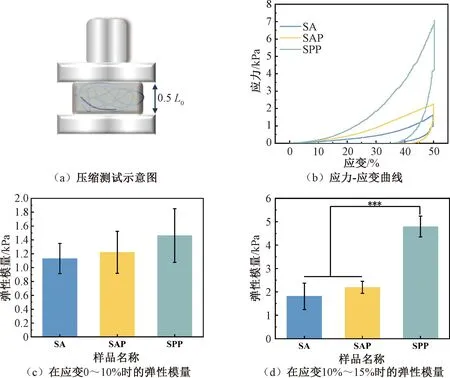
图5 支架的力学性能Fig.5 Mechanical properties of scaffolds
2.5 细胞增殖和形态表征
MCF-7细胞在2D培养板、SA水凝胶支架、SAP水凝胶支架和SPP支架培养下的增殖结果,如图6所示。由图6可知,培养时间为7 d以内,2D培养和3D支架组的吸光度值均增加,表明MCF-7在SA水凝胶支架、SAP水凝胶支架和SPP支架上均能增殖,证实支架适合细胞生长。与2D培养下的快速增殖相比,在3D支架上培养的肿瘤细胞的增值速度较慢,与自然肿瘤的生长速度更接近,这一结果与已有研究[30]一致。SAP水凝胶支架与SA水凝胶支架的比较表明,加入PRP能提高MCF-7增殖,且这种促进作用随着培养时间的增加而逐渐显著。在细胞培养第三天时,SAP水凝胶支架比SA水凝胶支架的细胞增殖率高3.6%;在第七天时,SAP水凝胶支架比SA水凝胶支架的细胞增殖率高4.4%。这是因为PRP中的纤维蛋白能与细胞非特异性结合且不溶于水,为细胞提供更稳定的生长环境。纤维蛋白通常存在于晚期肿瘤的ECM中,且与恶性肿瘤有关,其为肿瘤生长提供初始结构支持,以促进肿瘤细胞分泌形成细胞外基质[31]。

图6 MCF-7细胞在2D和3D培养下的增殖结果Fig.6 MCF-7 proliferation in 2D monolayer culture and 3D scaffolds
培养7 d后,添加PLGA纤维的SPP支架细胞增殖能力比SAP水凝胶支架高33.1%(p<0.01),这可能是因为SPP支架的弹性模量((4.79±0.45)kPa)与乳腺肿瘤组织的ECM刚度更相近且具备纤维和水凝胶这两种ECM必要结构。据文献[2]研究表明,增加的基质刚度可以增强肿瘤细胞-ECM相互作用并促进肿瘤细胞增殖。Jabbari等[32]的研究表明,在模量为5 kPa的水凝胶中培养的MCF-7细胞生成的最好。此外,静电纺丝形成的PLGA纤维能够高度模仿天然ECM的纤维网络,静电纺丝纤维基质已被证明可提供形态学线索,从而改善细胞黏附和增殖[33]。上述研究结果证明SPP支架从化学组成和结构两方面促进了乳腺肿瘤细胞的增殖能力。
进一步观察MCF-7细胞在2D培养板和3D支架中的形态差异,使用DAPI和鬼笔环肽对细胞核与肌动蛋白进行染色,共聚焦观察细胞在2D和3D培养下的形态如图7所示。2D培养的肿瘤细胞在第七天时形成密集的单层,细胞呈现出三角形或多边形扩散形态(见图7(a))。在3D培养中,细胞则表现为圆形梭状的聚集形态。在SA水凝胶支架中细胞聚集但并未形成多细胞肿瘤球(见图7(b))。这是由于SA水凝胶支架的孔过大,细胞更倾向于沿着孔壁生长而无法聚集成球体[34]。SAP水凝胶支架和SPP支架都促进细胞聚集并形成肿瘤多细胞球。不同的是,细胞在SAP水凝胶支架中更倾向于形成独立的多细胞肿瘤球且存在更多单个分布的细胞(见图7(c)),而在SPP支架中观察到形成了两个连接的多细胞肿瘤球(见图7(d)),细胞分布更紧密,这是由于纤维的存在限制了细胞的下沉。此外,2个多细胞肿瘤球体间肌动蛋白的分布表明细胞可能通过纤维交换生化信号以促进细胞交流[35]。
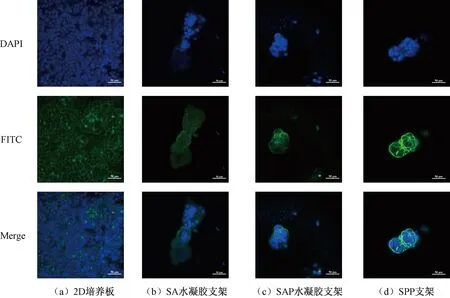
图7 细胞在2D和3D培养下的形态Fig.7 Morphological of cells in 2D monolayer culture and 3D scaffolds
2.6 化疗药物敏感性的体外评估
研究2D培养板以及SA水凝胶支架、SAP水凝胶支架和SPP支架培养下对抗肿瘤药物的化学敏感性。培养肿瘤细胞5 d后,使用100 μg/mL DOX药物处理细胞48 h,经处理后的细胞活力如图8所示。由图8可知,SA水凝胶支架、SAP水凝胶支架和SPP支架培养下的细胞均具有更低的化学敏感性,细胞活力均显著高于2D培养。其中2D培养板细胞活力为15.91%,SA水凝胶支架细胞活力为77.27%,SAP水凝胶支架细胞活力为79.91%,SPP支架细胞活力为88.51%。与SA水凝胶支架和SAP水凝胶支架相比,SPP支架上培养的细胞受到的抑制作用最小,表明SPP支架上培养的MCF-7细胞具有更高的耐药性。这一结果与较高的基质刚度会提高肿瘤细胞耐药性的研究[36]一致。这是因为增加的基质刚度会通过改变肿瘤细胞的蛋白和基因表达(例如,提高ABC转运蛋白和细胞存活促进因子Bcl-2表达)来提高肿瘤细胞的耐药性。另外,纤维促使细胞聚集得更紧密,这种较高的细胞堆积密度会导致药物更难扩散和渗透到中央细胞团中。综上所述,SPP支架通过模拟乳腺肿瘤基质的刚度和物理结构来提高肿瘤细胞对化疗药物的耐药性,表明其具有药物筛选的应用潜力。

图8 DOX药物处理48 h后的细胞活力Fig.8 Cell viability after 48 h of DOX drug treatment
3 结 语
本研究成功构建了负载富血小板血浆的纤维-水凝胶复合支架,模拟天然乳腺肿瘤ECM微环境。纤维的加入一方面使水凝胶支架的弹性模量提高了2.18倍,制备的SPP支架具有与乳腺癌肿瘤组织相似的弹性模量;另一方面,加入纤维还提高了支架的结构稳定性,使其更适用于细胞长期培养。负载PRP为细胞黏附和增殖提供了额外的蛋白网络和生长因子,促进乳腺癌细胞增殖。相比于无纤维增强水凝胶支架,SPP支架上的细胞增殖率提高了33.1%。支架内部乳腺肿瘤细胞呈现促进多细胞球体。在SPP支架上培养的肿瘤细胞具有更低的化学敏感性。研究表明该支架是一种合适的临床前模型,可作为肿瘤生物学研究和药物筛选的体外平台。
