催化热解-金汞齐富集原子吸收光谱法测定土壤调理剂中汞
2024-02-29柴玮玮何倩丽石洪玮毛雪飞
柴玮玮 李 雪 何倩丽 石洪玮 王 旭 毛雪飞
(1. 中国农业科学院农业质量标准与检测技术研究所, 农业农村部农产品质量安全重点实验室, 北京 100081;2. 广东省农业科学院农业质量标准与监测技术研究所, 农业农村部农产品质量安全检测与评价重点实验室,广州 510640)
近年来, 随着土壤问题日渐严重, 土壤调理剂在农业领域的投入使用越来越广泛。 农业行业标准NY/T 3034-2016 《土壤调理剂 通用要求》 定义土壤调理剂为一类加入障碍土壤中用于改善土壤物理、 化学或生物性状的物料, 能够改良土壤结构、降低土壤的盐碱危害、 调节土壤的酸度、 改善土壤的水分状况等[1]。 土壤调理剂产品种类颇多, 来源广泛, 能够有效地改善土壤质地不良的情况, 提高土壤质量和作物生产力, 进一步为农产品的产地安全和质量安全提供重要的保障[2~3]。 土壤调理剂按照来源可以分为矿物源、 化学源、 有机源和农林保水剂4 类[4~5]。 矿物源土壤调理剂是一类含有多种矿物质元素的物料, 主要包括天然矿物、 人工生产的含有多种矿物质元素的可以改善土壤特性的物料和固体废弃物等形式, 常见的矿物源土壤调理剂有牡蛎钙、 蛭石、 沸石、 脱硫废弃物和城市污泥等[3~4]。 化学源土壤调理剂是由化学制剂经过标准化加工而成的一类调理剂, 常见的有盐碱消、 月桂醇乙氧基硫酸铵、 聚马来酸等[4,6]。 有机源土壤调理剂是以动物或植物再加工材料经过标准化加工所生产的一类调理剂, 比较常见的有玉米秸秆、 蚯蚓蛋白酶、 草木灰、 微生物菌剂等[3]。 农林保水剂(如高吸水树脂) 是一类高分子聚合物, 因含有羟基、羧基、 酰胺基等强亲水性基团而具备吸水、 储水等功能[7]。 土壤调理剂的原料来源中, 一些矿物成分、 有机废弃物、 作物秸秆等本身可能存在重金属污染问题, 而加工过程又难以去除这种污染风险[8]。其中, 汞(Hg) 是最常见的重金属污染[4], 经年累月使用含汞的土壤调理剂, 必然会造成土壤中汞的累积, 进一步通过生物富集作用, 造成农产品汞污染。 因此, 如何快速、 准确地检测土壤调理剂中汞对于管控产品安全、 保障耕地质量具有重要意义。
目前, 汞的传统检测方法有冷蒸气原子吸收光谱法 (CVAAS)[9]、 电感耦合等离子体质谱法(ICP-MS)[10]、 氢化物发生原子荧光光谱法 (HGAFS)[11], 这些检测方法具有灵敏度较高、 稳定性较好等特点, 但其前处理手段 (如常用的微波消解、 王水浸提等) 繁琐耗时, 且在处理的过程中容易造成痕量汞的损失, 从而对测定结果造成一定的影响。 固体直接进样技术可以将固体样品直接导入仪器, 无需繁杂的样品前处理过程, 可以避免痕量汞元素的吸附和损失[12]。 虽然此方法能够改善繁琐的前处理手段, 但是基质干扰较严重, 通常采用气相富集、 基体改进剂和标准加入法等方式来改善[13~14]。相比其他金属元素, 汞蒸发温度较低, 伴随蒸发出大量的基体干扰物, 而催化热解和金汞齐能够有效地消除基体干扰[15~18]。
本研究基于催化热解-金汞齐富集原子吸收光谱法测定土壤调理剂中的汞, 旨在为土壤调理剂中汞的监测提供一种高效、 简单的方法, 从而能够及时、 快速、 准确获取土壤调理剂中汞污染情况, 进一步为农业投入品、 农产品产地安全和农产品质量安全提供技术保障。
一、 材料与方法
(一) 仪器与试剂5E-HGT2321 直接进样测汞仪 (长沙开元弘盛科技有限公司, 配镍舟进样舟); MS 天平(瑞士Metter Toledo 公司); 研磨仪(北京托摩根生物科技有限公司); LDO-9140A 烘箱(上海龙跃仪器设备有限公司); 分样筛(迪胜,50 目)。
硝酸(优级纯, 国药集团化学试剂有限公司);重铬酸钾(分析纯, 国药集团化学试剂有限公司);高纯氧气(99.999%, 北京诚为信气体有限公司);实验用水为GB/T 6682 规定的一级用水; 汞标准溶液 [1 000 μg/mL, 国家标准物质研究中心 (北京)]。 汞的系列标准工作溶液: 将汞标准溶液用1%硝酸(V∶V) 逐级稀释制备汞的系列标准工作溶液。
(二) 实验材料本研究选用了具有代表性的土壤调理剂, 按照来源主要分为矿物源, 包括牡蛎钙、 黄腐酸钾; 化学源, 包括盐碱消; 有机源, 包括微生物菌剂、 草木灰; 农林保水剂, 包括保水剂等样品, 均为市售。 其中, 固体样品用烘箱烘干(不超过40℃), 研磨处理后过50 目筛, 于自封袋中常温保存; 液体样品直接量取测定即可。
(三) 实验方法
1.实验原理。 将待测样品在高温条件下经过催化剂的催化热解, 消除有机干扰物后, Hg 被还原为Hg0, 用金汞齐富集后再释放进入检测器, 在253.7 nm 波长处测量汞的原子吸收信号, 采用外标法定量, 具体的工作条件见表1。
2. 标准工作曲线的绘制。 吸取Hg 总量分别为0、 0.5、 2、 5、 10 ng 和总量为0、 10、 50、 200、500、 1 000 ng 的系列标准溶液分别绘制低含量和高含量的标准工作曲线。
二、 结果与讨论
(一) 完全分解温度的优化完全分解温度是指将样品中的汞元素完全蒸发出来, 保证汞能够完全被金汞齐捕获。 本研究采用100 μg/L 汞标准溶液对完全分解温度进行优化, 结果显示, 随着温度的不断升高, 蒸发出汞元素量也不断升高, 直至温度达到500℃以后汞的蒸发信号逐渐趋于平缓期(见图1), 为了确保汞的完全释放, 最终选取700℃作为最佳的分解温度。
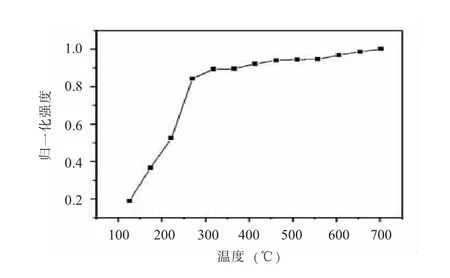
图1 完全分解温度的优化
(二) 金汞齐分解温度的优化金汞齐分解温度是指将捕获在金汞齐上的汞元素完全释放出来。本研究采用100 μg/L 汞标准溶液对金汞齐分解温度进行优化, 结果显示, 随着温度的不断升高, 汞的释放量也不断升高, 当温度达到1 000℃以后汞的释放信号逐渐趋于平缓 (见图2), 因此最终选取1 000℃作为最佳的金汞齐分解温度。
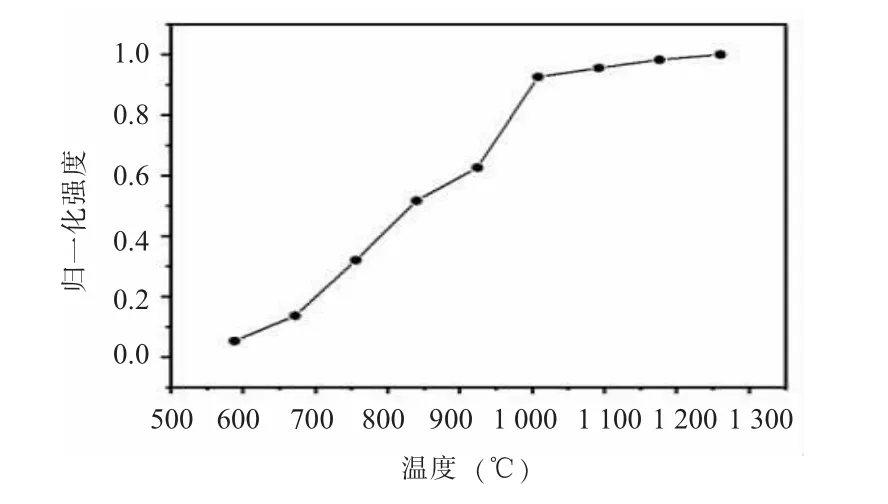
图2 金汞齐分解温度的优化
(三) 方法定量限与检出限本研究绘制了不同含量范围内汞的标准工作曲线, 其中低含量的工作曲线为Y=0.014 22X+0.002 9,R2>0.995; 高含量的工作曲线为Y=0.000 7X+0.001 8,R2>0.999(见图3)。 采用连续测量11 次试剂空白, 来计算方法检出限(LOD) 与定量限 (LOQ)。 其中LOD为3 倍空白值的标准偏差与标准曲线的斜率, LOQ为3.3 倍LOD。 经计算, 得到本方法测定汞的LOD为0.004 ng, LOQ 为0.013 ng。 当进样量为0.1 g时, LOD 和LOQ 分别为0.04 μg/kg 和0.13 μg/kg。

图3 不同含量范围内汞的标准工作曲线
(四) 方法最小取样量评价为了考察本方法所适用的样品最小取样量, 称取粉碎过0.5 mm 孔径筛的土壤调理剂样品10、 30、 50、 100 、 200 mg, 分别测定4 次, 结果见表2。 总体来看, 随着称样量的增加, 样品测试的相对标准偏差 (RSD)逐渐降低。 当取样量在10~50 mg 时, 样品测定值的RSD 在1.1%~51.3%, 整体偏差较大, 其中液体样品(如微生物菌剂) 的偏差较小, 但是样品的测定值存在一定误差。 当取样量在50~200 mg 的范围内, 总体上样品测定值的RSD 在逐渐降低, 除草木灰样品外, 其他样品测定值的RSD 小于10%,表明这个范围的称样量可以满足土壤调理剂样品的测试需求。 但是, 为了保障样品代表性和取 (称)样的方便性, 最终选取的最小取样量为50 mg。 在实际测试过程中可以适当降低进样量来满足汞含量相对较高的样品的测试需求。
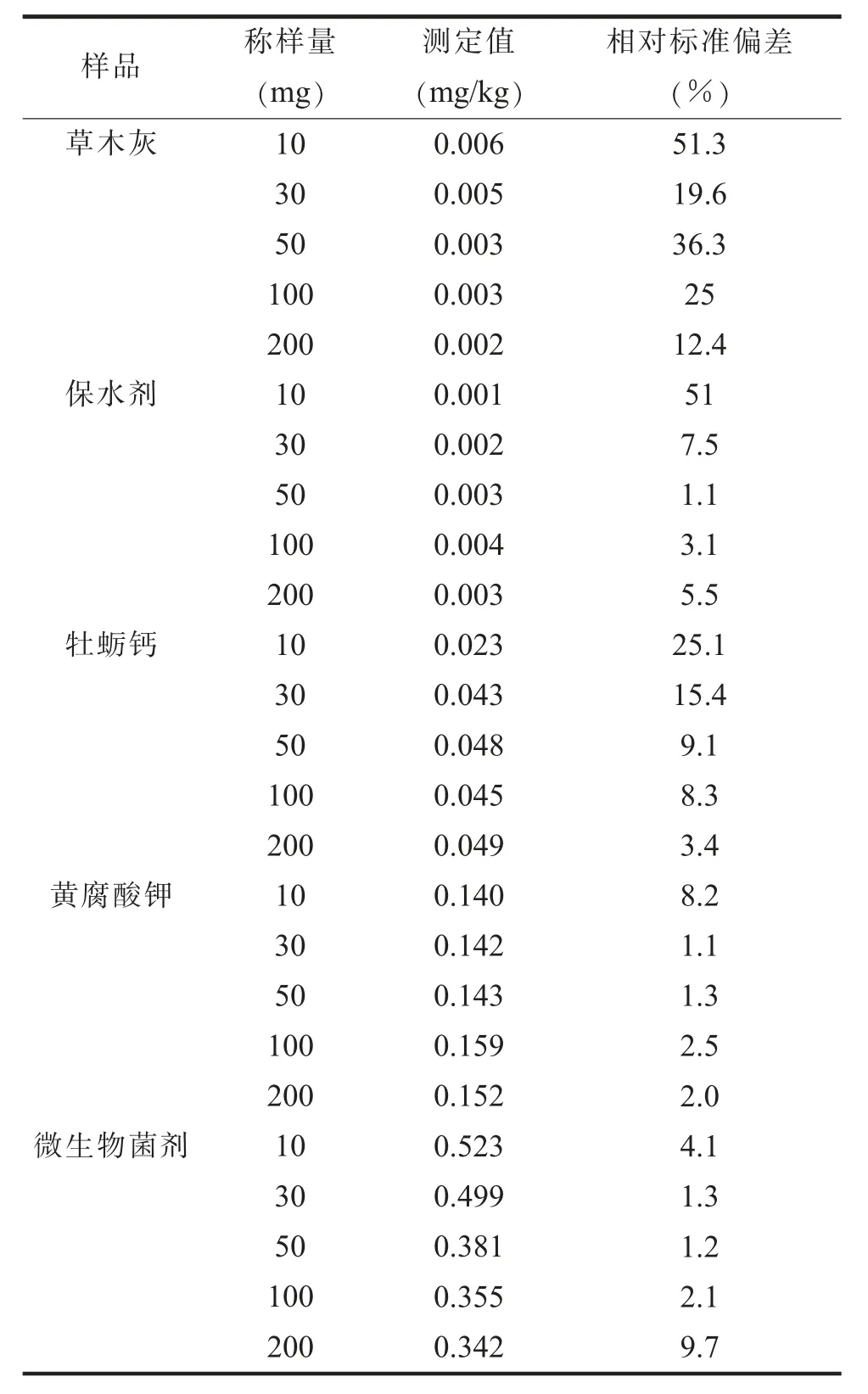
表2 样品最小取样量测试结果 (n=4)
(五) 方法精密度实验
1.实验室内稳定性测试。 为了验证本方法的精密度, 选取了草木灰、 保水剂、 牡蛎钙、 黄腐酸钾和微生物菌剂共5 种样品进行了日内、 日间稳定性测试 (见表3)。 日内稳定性测试, 即样品在同一天测定4 次, 计算RSD 进行评价; 日间稳定性测试则是连续测试4 d (n=6), 测定后分别计算组间RSD 进行评价。 从表3 可以看出, 除草木灰样品由于汞含量比较低, 其日内(9.5%~25.0%)、 日间(21.9%) 稳定性偏差较大外, 其他土壤调理剂样品的日内稳定性 (RSD,n=4) 在2.0%~10.5%,具有良好的日内稳定性。 而保水剂样品由于产品本身的保水性能, 其日间稳定性 (17.5%) 偏差较大, 除此之外, 牡蛎钙、 黄腐酸钾和微生物菌剂的日间稳定性 (RSD,n=6) 在3.6%~9.5%, 具有良好的日间稳定性。 上述结果可以说明本方法测定土壤调理剂中的汞具有良好的实验室内稳定性。

表3 日内、 日间稳定性检测结果
2.实验室间方法学比对。 选取汞含量未知的牡蛎钙、 黄腐酸钾、 草木灰、 盐碱消、 保水剂、 微生物菌剂共6 种土壤调理剂样品来验证本方法的可行性, 制备均质样品500 g, 等量分为5 份, 每个实验室100 g, 每家实验室按照标准方法测定每份样品6 次。 对于典型的样品, 如含量较低的草木灰(加标量为0.1 mg/kg)、 盐碱消(加标量为0.1 mg/kg)、保水剂(加标量为2.0 mg/kg), 采用加标实验进行精密度和准确度评价。 标准工作曲线的制作方法采用外标法, 样品测试数据见表4。 由表4 可以看出, 实验室间RSD 在1.1%~8.8%, 均在10%以内, 5 家实验室之间的数据再现性在可接受范围内, 说明本方法在实验室间具有良好的稳定性。

表4 实验室间比对实验结果 (n=6)
(六) 方法准确性测试为了进一步对方法进行准确性评价, 选择了5 种基质的土壤调理剂, 进行了低水平(0.1 mg/kg) 或高水平(2.0 mg/kg) 汞加标回收率的测试, 结果见表5。 由表5 可以看出, 加标回收率在96%~112%范围内, 表明方法准确性较好。
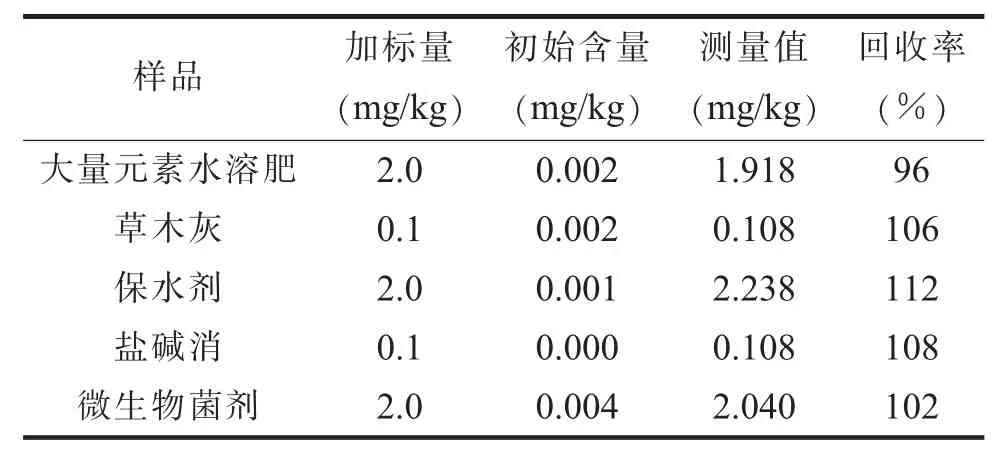
表5 加标回收率实验结果
(七) 实际样品的测定选取微生物菌剂、 牡蛎钙、 黄腐酸钾3 种土壤调理剂样品, 对其进行干燥、 研磨且过0.5 mm 孔径筛后, 用本方法测定,且与NY/T 1978-2010 《肥料 汞、 砷、 镉、 铅、铬含量的测定》 标准方法的测定结果进行对比, 结果见表6。 结果显示, 两种方法测定结果之间的相对误差在4.9%~14.4%, 在可接受的范围内。
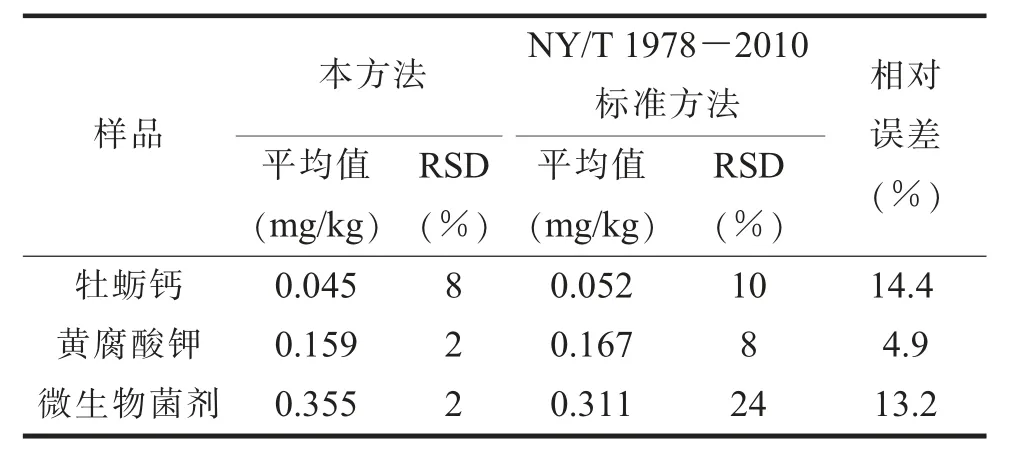
表6 本方法与标准方法测定汞含量结果比较 (n=3)
三、 结论
本研究采用催化热解-金汞齐富集原子吸收光谱法测定不同类型土壤调理剂中的汞, 通过系统的方法学评价, 确定方法的检出限为0.04 μg/kg、 定量限为0.13 μg/kg (进样量0.1 g 时), 线性回归系数(R2) >0.995。 通过实验室内和实验室间比对进行了方法精密度验证, 其中实验室内的日内、 日间稳定性(RSD)分别为2.0%~25.0%和3.6%~21.9%,5 家实验室间测试结果的RSD 为1.1%~8.8%。 同时, 通过不同样品的加标回收实验评价了方法的准确性, 结果显示, 不同土壤调理剂的加标回收率在96%~112%。 并且对实际样品进行测定, 与NY/T 1978-2010 标准方法的测定结果相比, 相对误差在4.9%~14.4%。 本方法采用固体直接进样,无需繁琐的前处理步骤, 减少了汞在前处理阶段的挥发损失, 且操作简单, 省时省力, 同时又绿色环保。 因此, 可进一步将方法推广用于土壤调理剂等农业投入品的汞污染监测, 以进一步保障农产品的产地安全和质量安全。
