电离辐射对不同发育阶段肺泡类器官的损伤及机制
2024-02-29赵国平吴李君陈少鹏
韩 蕊,张 雯,王 润,赵国平,吴李君,韩 伟,陈少鹏
(1.安徽大学 物质科学与信息技术研究院,安徽 合肥 230601;2.中国科学技术大学 环境科学与光电技术学院,安徽 合肥 230026;3.中国科学院合肥物质科学研究院 强磁场中心,安徽 合肥 230031;4.中国科学院合肥物质科学研究院 健康与医学技术研究所,安徽 合肥 230031;5.皖南医学院 基础医学院,安徽 芜湖 241002)
核反应堆事故或蓄意恐怖主义行动造成的急性放射泄漏威胁是一个重大的公共安全和健康问题.例如,切尔诺贝利和福岛核电站事故引起人们的广泛焦虑[1].暴露于辐射环境时,放射性粒子经呼吸进入肺部导致肺损伤[2].此外,放射治疗(放疗)是胸部肿瘤的重要临床治疗手段,但治疗中,常见副作用为放射性肺损伤,影响患者生存质量甚至生命[3].
肺泡是气体交换的主要场所,主要由两种类型的上皮细胞组成,立方形Ⅱ型肺泡上皮(alveolar typeⅡepithelial,简称AT2)细胞和鳞状Ⅰ型肺泡上皮(alveolar typeⅠepithelial,简称AT1)细胞.AT2细胞的主要功能是分泌表面活性剂以防止肺泡塌陷,并在肺泡受损时,作为干细胞再生AT1细胞[4].AT1细胞介导气体交换,是肺主要的功能性细胞[5].动物和细胞学实验的相关研究显示,辐射对AT1细胞的损伤是放射性肺损伤的触发因素[6],AT2细胞是肺纤维化发生的驱动因素[7].辐射引起AT2细胞发生DNA损伤、内质网应激、线粒体功能障碍等,导致AT2细胞死亡;也可以引起端粒损耗、活性氧类(ROS)产生等,导致AT2细胞发生细胞衰老[8].但由于动物和细胞学实验受限于伦理、种属差异、无法实时观察生理病理变化等,诸多问题目前仍不清楚.近年来类器官技术的发展,为深入开展此项研究带来了新的机遇.
干细胞或器官祖细胞发育分化成不同类型的细胞,这些细胞在一定受限空间内自组织形成类器官,类器官可以更好地模拟人体器官在模型动物上无法重现的特性和多细胞之间的相互作用[9].从2011年至今,已经相继有多种类型类器官的报道,目前已建成的3D类器官模型主要有肾、肺、肠、脑、视网膜,胃[10],心脏[11],肝脏和胰腺[12]以及皮肤[13]等.2019年,肺类器官的长期培养方法被建立[14].组织来源的肿瘤类器官主要用于预测病人对放射治疗的敏感性[15]和药物作用筛选[16];干细胞来源的肺类器官主要用于探索病毒感染机制[17]以及肺纤维化和肺癌等肺部疾病的潜在研究[16];此外,近年肺类器官已开始应用于毒理学研究[18-19].但类器官在辐射损伤的研究中鲜有应用,尤其辐射对肺发育的影响.笔者以人源肺类器官为模型,探究辐射诱导不同发育阶段的肺类器官的损伤机制,以期为肺再生的机制研究提供依据.
1 材料与方法
1.1 实验材料
人源胚胎干细胞(hESC-H9),购自Wicell公司;m TeSR1胚胎干细胞培养基(货号:85850)、胚胎干细胞消化液ReLeSRTM1(货号:5872)、CHIR99021(货号:72052)购自StemCell Technologies公司;Matrigel人胚胎干细胞培养基质胶(货号:354277)、细胞回收液(货号:354253)、Matrigel生长因子基质胶(货号:356231)购自Corning公司;RPMI1640培养基(货号:C11875500BT)、DMEM F/12(货号:C11330500BT)、Advanced DMEM F/12(货号:12634010)、GlutaMAX(货号:35050061)、B27(货号:17504-044)、地塞米松(Dexamethasone,货号:D4902)、ITS(货号:41400-045)、Tryp LE(货号:12604-013)均购自Gibco公司;Activin A(货号:C687)、Noggin(货号:CB89)、FGF4(货号:CR08)、FGF10(货号:CR11)、KGF(货号:CH73)均购自近岸蛋白公司;SB431542(货号:HY-10431)、DAPT(货号:HY-13027)、8-Br-c AMP(货号:HY-12306)、IBMX(货号:HY-12318)均购自MCE公司;BMP4(货号:120-05ET)购自Peprotech公司;ATRA(货号:04-0021)购自Stemgent公司;BSA(货号:A8020)、Triton-X100(货号:T8200)、RIPA缓冲液(货号:r0020)购自Solarbio公司;Trizol试剂(货号:15596018)购自Ambion公司;Hifair® Ⅲ1st Strand cDNA Synthesis Super Mix(货号:11141ES60)购自Yeasen Biotechnology公司;Hochest33342(货号:H3570)购自Invitrogen公司;抗淬灭剂(货号:P0128S-2)购自碧云天公司;Tween20(货号:1247ML500)购自Biofroxx公司.
1.2 胚胎干细胞的培养
按批号查询人胚胎干细胞培养基质胶Matrigel的浓度,根据使用浓度和包被面积计算后包被6孔板,置于室温1 h后用于hESCs细胞的培养.每天用预热的DPBS清洗并更换新鲜m TeSR1培养基,置于37℃培养箱中继续培养.细胞约3~5 d生长至80%汇合度时,可按照1∶5至1∶10的比例进行传代.
1.3 不同发育阶段肺泡类器官的诱导分化
用预热的DPBS 轻柔洗1 次对数生长期的hESCs,加入含有Activin A(100 ng·m L-1)和CHIR99021(2μmol·L-1)的定型内胚层(DE)阶段诱导培养基,每天更换培养基.第4天,细胞用预热的Advanced DMEM F/12培养基轻柔洗1次,加入含有Noggin(200 ng·m L-1),FGF4(500 ng·mL-1),CHIR99021(2μmol·L-1)和SB431542(10μmol·L-1)的前肠内胚层(AFE)诱导阶段培养基,每天换液.第8天时,向细胞中加入适量Tryp LE消化液消化10 min,收集细胞,加入一定比例预冷Matrigel,吹打混匀后种板,37 ℃培养箱放置约15 min,加入含有BMP4(20 ng·m L-1),ATRA(0.5μmol·L-1),CHIR99021(3.5μmol·L-1),GlutaMAX,2%B27的腹侧前肠内胚层(VAFE)阶段的诱导培养基,每3~4 d换液1次;第15天,加入含有GlutaMAX,2%B27,CHIR99021(3μmol·L-1),FGF10(10 ng·m L-1),KGF(10 ng·m L-1),DAPT(20μmol·L-1)的肺祖类器官阶段的诱导培养基,每3~4 d传代1次;第22天,加入含有地塞米松(50 nmol·L-1),8-Br-c AMP(100μmol·L-1),IBMX(100μmol·L-1),KGF(10 ng·m L-1),2%B27,0.25%BSA,0.1%ITS,CHIR99021(3 μmol·L-1),SB431542(10μmol·L-1)的肺泡类器官阶段的诱导培养基,每3~4 d传代1次.
1.4 实时荧光定量PCR
按试剂盒的操作说明,采用Trizol试剂提取总RNA,将1μg总RNA 使用Hifair® Ⅲ1st Strand cDNA Synthesis Super Mix试剂盒反转录为cDNA.相应引物和SYBR Green Master Mix配制qPCR反应体系,反应在Roche LightCycler 480 PCR系统上进行,每个实验至少重复3次.
1.5 细胞免疫荧光染色
取种于爬片上的细胞,预冷的PBS清洗后用4%多聚甲醛室温固定细胞20 min;加入PBS清洗3次,0.3%Triton-X100室温通透30 min;PBS清洗3次后用含5%BSA的封闭液室温封闭细胞1 h;弃去封闭液,加入封闭液稀释的一抗于室温下孵育1 h;吸弃一抗并用PBS清洗3次,用封闭液稀释的二抗于室温下避光孵育1 h;吸弃二抗,加入PBS清洗3次,Hochest33342覆盖细胞10 min后,滴加抗淬灭剂,封片,在荧光显微镜或激光共聚焦显微镜下观察.
1.6 类器官免疫荧光染色
取处理后的类器官,加入预冷的PBS 清洗类器官,弃去PBS 后加入细胞回收液于冰上溶解Matrigel 45 min,收集类器官于离心管中,离心弃上清;加入4%的多聚甲醛于4℃固定45 min,补加0.1%Tween20,离心弃上清;加入0.5%Tween20于4 ℃通透30 min;加入含0.1%Tween20和3%BSA的PBS室温封闭类器官1 h;用含0.1%Tween20和0.1%BSA的PBS配制的TBPBS稀释一抗,置于4℃摇床过夜孵育;TBPBS清洗类器官3次,用TBPBS稀释二抗,室温避光孵育1.5 h;TBPBS清洗类器官3次,Hochest33342复染10 min后,将类器官置于载玻片上;滴加抗淬灭剂后加盖玻片封片,在荧光显微镜或激光共聚焦显微镜下观察.
1.7 PI染色
取处理后的细胞,Tryp LE消化后收集至离心管中,离心弃上清;加入PBS离心清洗1次,加入100μg·mL-1的PI染料,避光于冰上孵育15 min;离心弃去PI染液,加入PBS重悬细胞,流式细胞仪检测.
1.8 蛋白免疫印迹
使用含有蛋白酶抑制剂和钒酸钠的RIPA裂解液裂解细胞,超声后离心取蛋白质上清,用BCA 试剂盒对蛋白质定量,取等量的蛋白质进行聚丙烯酰胺凝胶电泳(SDS-PAGE);将蛋白质从丙烯酰胺凝胶转移到硝化纤维素膜上,用5%脱脂奶对膜封闭;加入一抗,置于4℃孵育过夜;加入二抗在室温下孵育1 h,成像观察.
1.9 流式细胞分析
将细胞回收液加入处理后的类器官培养板中,冰上溶解Matrigel 45 min;收集类器官于离心管中,离心弃上清;加入Tryp LE于37℃消化15 min,补加PBS,离心弃上清;加入1 m L 4%多聚甲醛室温固定细胞10 min,补加PBS至6 mL,离心弃上清;加入1 mL 0.2%Triton-X100室温通透细胞20 min,补加PBS至6 mL,离心弃上清;加入1 mL 1%FBS室温封闭1 h,离心弃上清;加入封闭液稀释的一抗200μL,室温孵育细胞1 h,补加PBS至6 mL,离心弃上清;加入封闭液稀释的二抗200μL,室温避光孵育细胞1 h,补加PBS至6 m L,离心弃上清;加入1 m L 100μg·mL-1的PI染料,避光于冰上孵育15 min,补加PBS至6 m L,离心弃上清;加入100μL PBS将细胞混匀,流式细胞仪避光检测.
2 结果与分析
2.1 人源肺泡类器官的模型构建
为了在体外研究辐射对不同发育阶段人肺泡的损伤,首先需要构建人肺泡类器官模型.由于该研究中使用的肺泡类器官是由多能诱导干细胞而来,故首先用流式细胞术对hESCs的干性进行鉴定,结果显示98.9%的细胞均为OCT4和Nanog双阳性细胞(图1(a)),表明该研究使用的hESCs保持着良好的干性特征.
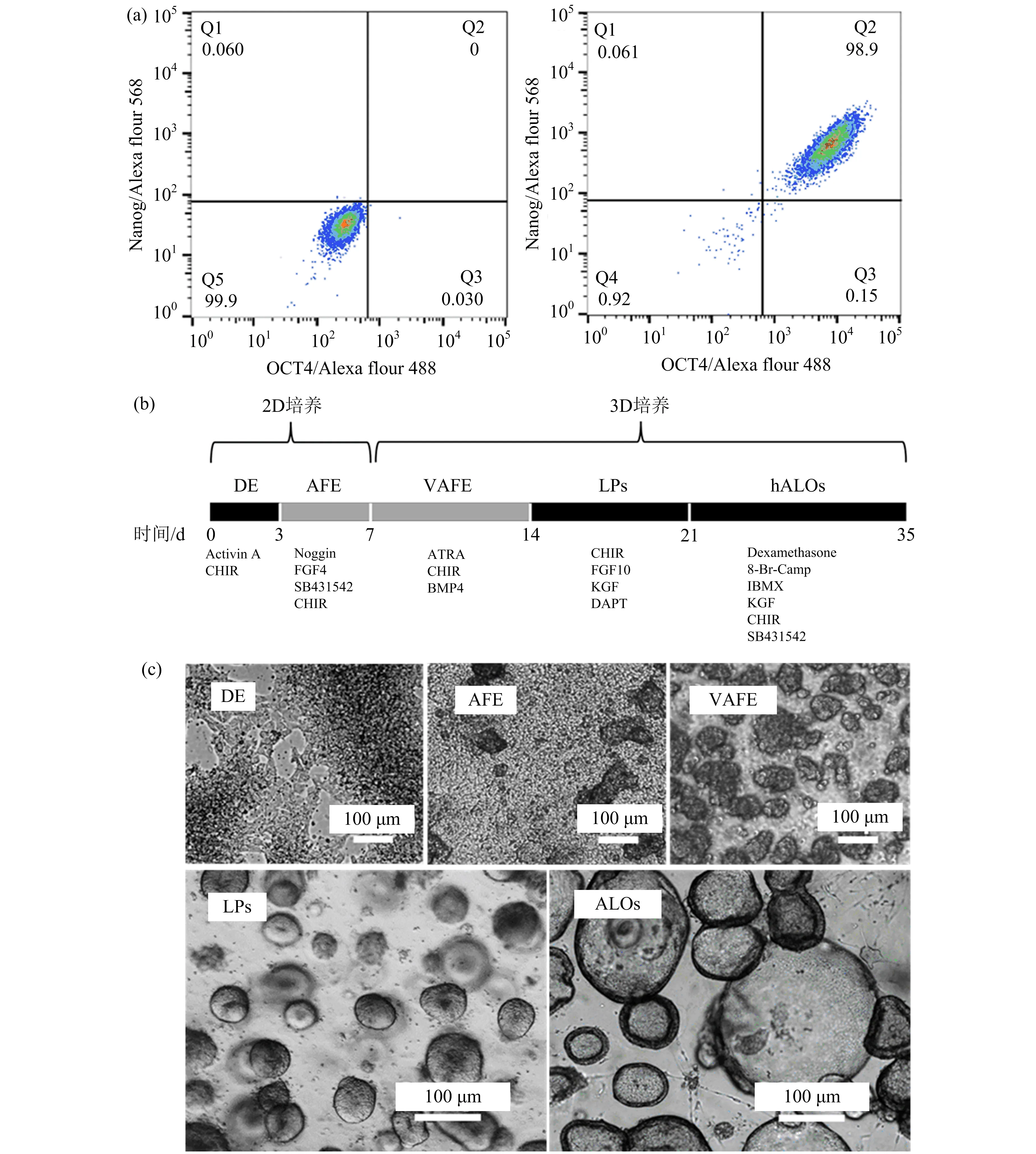
图1 人源胚胎干细胞诱导培养肺泡类器官
参考Pei等[20]诱导肺泡类器官的方案,用人胚胎干细胞(embryonic stem cells,简称hESCs)进行人源肺祖类器官(lung progenitors,简称LPs)和肺泡类器官(alveolar organoids,简称ALOs)的构建.诱导流程和不同诱导阶段添加的细胞因子如图1(b)所示:前7天为2D细胞培养,其中第0~3天为定型内胚层阶段(definitive endoderm,简称DE),使用定型内胚层诱导培养基;第4~7天为前肠内胚层阶段(anterior foregut endoderm,简称AFE),使用前肠内胚层诱导培养基.第7天时将消化得到的细胞与Matrigel混合培养,且使其逐渐形成3D类器官.第8~14天为腹部前肠内胚层阶段(ventralized anterior foregut endoderm,简称VAFE),使用腹部前肠内胚层诱导培养基;第15~21天为LPs阶段,使用LPs诱导培养基;第22~35天为ALOs阶段,使用ALOs诱导培养基.各阶段细胞的示意图如图1(c)所示,在培养的第4天细胞密度逐渐增大,第5天逐渐有大量紧密的细胞团飘浮培养基中,第21天形成100~200μm 的人源肺祖类器官,第35天形成200~500μm 的肺泡类器官.
接着,笔者对各个诱导阶段的类器官进行鉴定.首先,使用实时荧光定量PCR对各时期标志基因的转录水平进行检测,结果如图2(a)所示,DE阶段干性基因OCT4转录水平明显下调,DE阶段标志基因FOXA2/SOX17分别上升几十甚至上百倍,表明诱导开始进入DE阶段;LPs阶段TTF1的表达量上调了300倍左右,SOX2和SOX9也明显上调;在诱导了35 d的ALOs阶段,HOPX/SFTPB/SFTP都有成百上千倍的上调.用免疫荧光实验进一步在蛋白水平验证不同时期的类器官诱导情况,如图2(b)所示,在不同阶段OCT4、FOXA2、SOX17、TTF1、EpCAM、平足蛋白(podoplanin)、肺表面活性物质相关蛋白C(prosurfactant protein C,简称pro-SPC)都有一定程度表达,这些蛋白的表达进一步证明各阶段肺泡类器官模型成功建立.

图2 肺泡类器官培养各阶段的鉴定结果
2.2 辐射诱导hESCs和DE细胞的损伤
人源肺泡类器官模型构建成功之后,探究γ射线对hESCs和DE阶段细胞的影响.首先分别使用1,5,10 Gy的γ射线分别对hESCs和DE阶段的细胞进行照射处理,24 h后进行PI染色,流式细胞术分析细胞的存活状况,结果如图3所示.发现1 Gy的γ射线处理24 h,hESCs的死亡增加了13倍(图3(a)左),在10 Gy处理组,约98%的细胞发生了死亡;而DE阶段细胞死亡比例虽然呈上升趋势,但在辐射前后没有显著差异(图3(a)右).之后,对2种细胞在不同剂量辐射处理后,Western Blot检测各自标志性蛋白的表达量变化,结果显示(图3(b)左),hESC的干性相关蛋白在24 h没有明显变化,可能是细胞死亡太多,且时间较短,细胞还没有发生分化.但DE阶段细胞中,与其分化相关的蛋白SOX17的表达量在5 Gy和10 Gy时显著下调,故推测辐射会影响DE阶段细胞向肺泡类器官的分化能力.为了验证这一猜想,对第3天的DE阶段细胞辐射后,立即将培养基更换为AFE阶段的诱导培养基,并继续诱导14 d,观察类器官形成情况,结果如图3(d)所示,对照组在第2天开始出现明显的球体样的细胞团聚集,第4天致密的细胞团大量增加,第14天便形成典型的肺祖类器官的形态;而1 Gy处理组中虽然在第4天有少量聚集的细胞团出现,但第14天时并未形成明显的类器官形态;5 Gy和10 Gy处理组在辐射处理之后的第2天,就出现明显的细胞密度不足,且第4天还出现异常的分化细胞的状态,在第14天无法自组装形成类器官.最后,对第14天形成的类器官的尺寸进行统计,结果如图3(c)所示,即使是1 Gy低剂量的辐射处理,也会使DE阶段细胞的分化功能受到明显损伤,几乎无法形成类器官.

图3 1,5,10 Gy的γ射线对hESCs和DE阶段细胞的影响
2.3 辐射诱导肺祖类器官的损伤
随后,对诱导21 d形成的LPs进行了γ射线照射处理,结果显示辐射1 d之后,不同剂量处理下的LPs与对照组相比,在形态学上没有明显变化(如图4(a)所示);但辐射3 d之后,5 Gy和10 Gy处理下的LPs周围及腔内开始出现明显的死亡细胞,类器官开始出现明显的损伤[21](如图4(b)所示);辐射后的第7天,对照组和1 Gy处理下的类器官明显变大,且生长状态良好,但5 Gy和10 Gy处理下的LPs依然保持在受损状态(如图4(c)所示).故对类器官的受损情况进行了统计,图4(d)为不同剂量不同时间时,受损类器官所占比例;图4(e)为不同辐射剂量不同时间时,受损类器官产生的散细胞的迁移距离.统计结果显示,肺祖类器官在辐射后第3天开始出现明显损伤,且损伤一直保持到第7天甚至更长时间,没有出现较明显的修复现象;1 Gy的低剂量对LPs没有明显损伤,但中剂量的5 Gy和高剂量的10 Gy对LPS的损伤几乎没有差异.
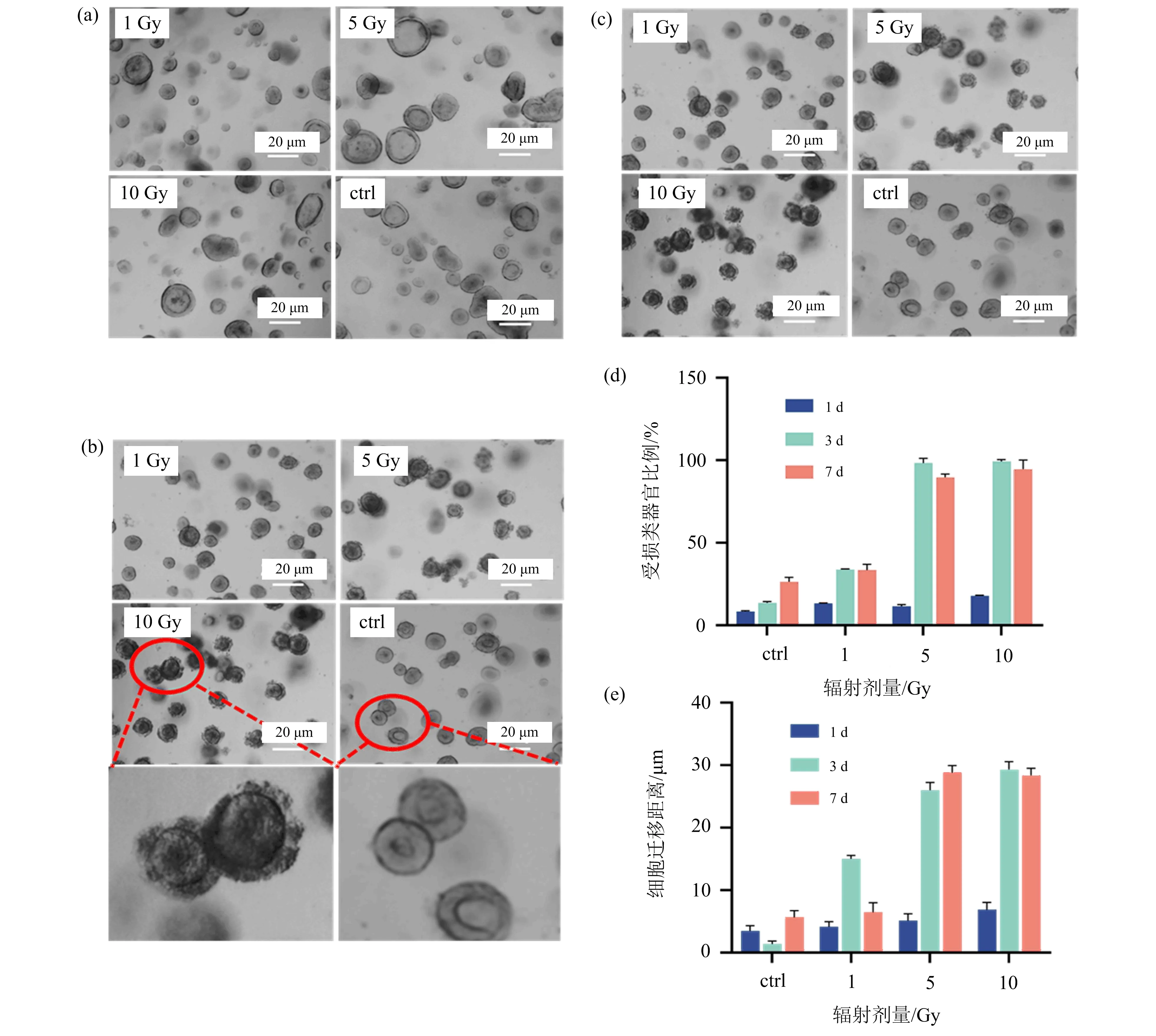
图4 辐射对肺祖类器官的影响
2.4 辐射对肺祖类器官分化的影响
前面的结果表明中高剂量辐射导致肺祖类器官的明显损伤,接着通过检测LPs分化相关转录因子TTF1,研究辐射对LPs向ALOs分化的影响.检测结果显示,γ射线处理3,7 d之后,5 Gy和10 Gy处理组TTF1基本不表达(图5(a)),表明高于5 Gy的γ射线辐射可导致类器官严重受损,并可影响其进一步分化.为了寻找辐射对分化影响的直接证据,辐射之后,立即将LPs培养基更换为ALOs诱导培养基,并在第35天时进行观察与检测.图5(b)的明场图显示,1 Gy辐射处理之后的LPs再继续形成ALOs时与对照组没有明显差异,但5 Gy和10 Gy处理之后的LPs继续形成ALOs时,ALOs的状态和形成率都受到较大影响,甚至失去类器官明亮饱满、边缘清晰的典型特征,成为黑色不透亮的团状聚集体.同时,对形成的ALOs进行的免疫荧光鉴定结果显示(图5(c)),辐射导致AT2细胞分泌的表面活性物质C表达量降低甚至不表达,表明辐射后的LPs并未形成ALOs.以上结果表明,中高剂量的辐射会抑制LPs向ALOs的分化.

图5 辐射对肺祖类器官分化的影响
2.5 辐射诱导肺泡类器官的损伤
肺泡是肺的主要功能单元.为了研究辐射对肺泡细胞的影响,对35 d形成的ALOs进行辐射处理,并在处理1 d和7 d之后分别检测,结果如图6所示.

图6 辐射对肺泡类器官的影响
明场图结果显示,不同辐射剂量处理的类器官在形态学上并无明显差异(图6(a)).流式细胞术检测结果显示辐射1 d后AT1和AT2细胞数的比例没有发生明显变化,但辐射7 d后两种细胞的比例均呈现下降趋势,尤其是10 Gy处理组的AT1细胞和AT2细胞数比例均显著性下降,分别下降了68.3%和76%(图6(b)).最后,通过文献报道和生信分析,笔者筛选了一些与肺分化相关并在肺泡中表达的基因[22],包括NFIB,KLF2,YAP1,HOXA5和NUMB.辐射后,对这些基因的转录水平进行检测.结果显示,辐射后第1天,NUMB的转录水平明显上调(图6(c)左).NUMB的表达与祖细胞的分化相关,推测辐射的第1天,类器官可能通过激活祖细胞分化,来补充受损的功能性细胞.辐射后第3天,NUMB的转录水平回落,NFIB,KLF2,YAP1和HOXA5的转录水平都大幅上调(图6(c)中).4个基因NFIB,KLF2,YAP1和HOXA5与非小细胞肺癌等恶性肿瘤的发生密切相关,该结果表明类器官中有恶性转化的发生.虽然7 d后,NFIB和YAP1转录水平有所回落,但KLF2和HOXA5仍保持较高水平(图6(c)右).以上结果表明,辐射7 d内,肺泡类器官形态上虽然没有较大影响,但其基因的表达已受到很大影响,这可能对肺泡功能产生长期影响.
3 讨论
类器官因可以维持其天然组织的遗传和表型特征[23],已广泛应用于高通量药物筛选、精准医疗、器官组织发育以及组织再生领域[24].同时,类器官是一种体外培养的多细胞体系,便于研究细胞间的协作,因此,近年来类器官开始应用于毒理学研究[19].
笔者建立并运用人源肺泡类器官模型开展辐射诱导不同发育阶段肺损伤的研究,采用了Pei等[20]的方法,构建了多种肺类器官.同已报道的其他人肺类器官培养方案(如气液交界面系统[25]、以基质胶为介质的克隆球[26]、支气管肺泡样结构[27]和来自成体干细胞和多能干细胞的肺类器官[28-29]等)相比,笔者采用的类器官模型培养周期相对较短,可以较好地反映人体肺泡的细胞构成,并且可以在体外扩大培养的同时还能保持类器官长时间的结构完整性和遗传特征的稳定性.但在类器官构建的过程中,需要严格注意诱导分化时细胞的密度和诱导时长,这对各阶段的分化效率来说非常重要;为了保证类器官良好的3D结构,要保证基质胶的浓度在80%以上并及时更新基质胶.
笔者的研究表明不同发育阶段的肺泡类器官对辐射的敏感性不同.随着肺泡类器官的诱导进展,发现DE期的细胞较干细胞更耐辐射.辐射虽然引起DE期细胞的分化,但导致的细胞死亡要低于受辐射的干细胞.LPs类器官辐射后形态学发生明显的变化,出现向外迁移的细胞,并随着剂量的增加逐渐丧失诱导成ALOs类器官的能力.ALOs类器官辐射后仍保持着原有的形态学特征,但其AT1和AT2细胞数的比例发生了变化,关键标志性基因的表达也出现显著性变化.已有报道显示AT2细胞的缺失和功能障碍在放射性肺损伤中起着核心作用[7],在AT2细胞出现的结果与小鼠模型上观察到的有一定的相似性.总之,笔者所建立的人源肺泡类器官辐射损伤模型,较系统地观察了不同发育阶段的人源肺泡类器官对辐射的损伤响应,有助于进一步揭示放射性肺损伤的机制.
目前类器官的应用依然存在许多限制.首先,类器官建模的技术方案还不够客观、规范,这可能影响类器官的可重复性,导致研究结果出现偏差.目前对于肺泡类器官来说,只能够比较好地模拟上皮细胞的发生发展,但肺部的发育分化是上皮细胞和间充质细胞互相作用的结果,甚至还包括血管的发生以及和免疫细胞之间的相互作用,所以单独的上皮细胞之间的关系尚未完全阐明肺器官的真实结构,需要建立更接近人体水平的类器官.肺类器官未来可以用以探索污染物与靶组织和器官之间的相互作用,以评估暴露于各种环境毒素对肺部的急性和慢性不利影响;或者用于研究肺部疾病的病理过程和药物靶点,例如肺炎、慢性肺纤维化、慢阻肺等.
