贝伐珠单抗联合雷替曲塞或卡培他滨治疗晚期结直肠癌疗效比较*
2024-02-29陈宝胜程进生周文勇刘雅刚
贾 楠,宋 哲,陈宝胜,程进生,周文勇,刘雅刚
(1. 河北省沧州市中心医院,河北 沧州 061001; 2. 河北省沧州市献县人民医院,河北 沧州 062250)
结直肠癌早期症状较轻且发病隐匿,主要表现为排便异常、腹痛腹胀等,有半数患者初诊时已处于晚期,丧失了最佳手术根治切除时机[1-2]。药物(如卡培他滨)是结直肠癌的重要治疗方式,有报道指出,中老年结直肠癌的治疗方案中贝伐珠单抗联合卡培他滨的效果良好[3]。近年来的国内外研究表明,贝伐珠单抗联合其他抗癌药物可有效改善晚期结直肠癌患者的预后,并使其生存获益[4-5]。贝伐珠单抗常用于治疗结直肠癌、肺癌、肝细胞癌、肾细胞癌、宫颈癌等,其机制为通过结合并抑制血清血管生长因子并防止该因子与血管内皮细胞生长因子受体1(FLT1)、血管内皮细胞生长因子受体2(KDR)结合,从而限制或控制病灶处的血管生长,且贝伐珠单抗与其他化学药物治疗(简称化疗)药物联用,抗癌效果更突出,推测是贝伐珠单抗降低了肿瘤内部压力,有利于其他化疗药物的靶向作用[6]。雷替曲塞治疗结直肠癌的临床效用与卡培他滨相近,有报道表明,雷替曲塞作为一种抗叶酸制剂(喹啉叶酸类似物),可通过强效抑制胸腺嘧啶合成酶的活性,阻断肿瘤细胞生长,从而对多种实体恶性肿瘤(结直肠癌、食管癌、胃癌、恶性胸膜瘤等)的效果明显[7]。有研究指出,造成肿瘤细胞不断增殖、分化和转移的原因是大量的新生血管生成和肿瘤免疫逃逸,高水平血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、血小板源性生长因子(PDGF)促进了与肿瘤相关的新生血管大量生成,从而为肿瘤提供营养物质,而T 淋巴细胞亚群异常表达会使肿瘤细胞成功实现免疫逃逸,并最终通过持续增殖和获得营养供给来完成对宿主机体的侵袭与转移[8]。为此,本研究中比较了贝伐珠单抗联合雷替曲塞或卡培他滨治疗晚期结直肠癌的临床疗效,以及对患者的生存状况及治疗预后的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:患者性别不限;年龄22~70 岁;符合《中国结直肠癌诊疗规范(2017 年版)》诊断标准[9](同时以该标准进行临床TNM 分期);依从性良好,可按时复诊或接受随诊安排;预计生存时间大于3 个月。本研究经沧州市中心医院医学伦理委员会批准(批件号:2018 - 012 - 01),患者及其家属签署知情同意书。
排除标准:妊娠期或哺乳期;依从性较差;合并心、肺、肝、肾功能严重障碍,免疫系统疾病,其他恶性肿瘤;对本研究拟用药物有禁忌证。
病例选择与分组:选取沧州市中心医院2021 年2 月至2022 年8 月收治的晚期结直肠癌患者110 例,按随机数字表法分为贝伐珠单抗+卡培他滨组(简称贝+卡组)和贝伐珠单抗+雷替曲塞组(简称贝+雷组),各55 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组患者一般资料比较(n=55)Tab.1 Comparison of the patients′ general data between the two groups(n = 55)
1.2 方法
两组患者均予贝伐珠单抗注射液(德国Roche DiagnosticsGmbH,国药准字S20120069,规格为每瓶16mL),加入0.9%氯化钠注射液100 mL静脉滴注,首次给药剂量为7.0 mg/ kg,滴注2 h(后根据患者耐受性调整为1.5 h)。贝+ 卡组第1~14 天加用卡培他滨片(江苏恒瑞医药股份有限公司,国药准字H20133366,规格为每片0.15 g)口服,每日给药总剂量为1 000 mg/m2,每日2 次。贝+ 雷组另外建立一组静脉滴注通路加用注射用雷替曲塞(南京正大天晴制药有限公司,国药准字H20090325,规格为每支2 mg),溶于100 mL 0.9%氯化钠注射液,静脉滴注,给药剂量为3 mg/ m2,15 min内滴完。两组均以3 周为1 个疗程,共治疗6 个疗程,并随访6 个月。
1.3 观察指标与疗效判定标准
观察指标:1)血管生长因子。取患者治疗前后空腹静脉血,离心,取上清,采用酶联免疫吸附法检测VEGF,bFGF,PDGF 的水平。2)T 淋巴细胞亚群。采用流式细胞术检测患者T 淋巴细胞亚群CD3+,CD4+,CD8+的水平。
近期疗效:采用实体瘤临床疗效评价标准(RECIST 1.1)[10]判定。完全缓解(CR):治疗后,病灶完全消失;部分缓解(PR):治疗后,病灶缩小≥30%;疾病稳定(SD):治疗后病灶缩小<30%或病灶长径增加≤20%;疾病进展(PD):治疗后,出现新病灶或病灶长径增加>20%。统计总生存期(OS,为患者从分组起至任何原因引起死亡的时间)及无进展生存期(PFS,指患者从接受治疗起至观察到疾病进展或发生因任何原因死亡之间的时间)。疾病控制(DC)= CR + PR + SD,客观缓解(OR)=CR+PR。
安全性:晚期结直肠癌患者不良反应依据美国国立癌症研究所通用毒性标准(NCI CTC 4.0)[11]判定,包括周围神经毒性、恶心呕吐、贫血、骨髓抑制、腹泻、手足综合征、血小板计数下降、肝功能损伤等,均分为Ⅰ-Ⅳ级。
1.4 统计学处理
采用SPSS 21.0 统计学软件分析。计数资料以率(%)表示,行χ2检验;计量资料符合正态分布的以表示,行t检验;等级资料行秩和检验。P<0.05 为差异有统计学意义。
2 结果
结果见表2 至表5。贝+卡组患者OS 和PFS 分别为(12.26±2.94)个月和(6.17±1.74)个月,与贝+雷组的(12.57 ± 2.15)个月和(6.62 ± 1.80)个月相当(t=0.631,1.333,P=0.529,0.185)。
表3 两组患者T淋巴细胞亚群水平比较(,%,n=55)Tab.3 Comparison of T lymphocyte subset levels between the two groups(,%,n = 55)

表3 两组患者T淋巴细胞亚群水平比较(,%,n=55)Tab.3 Comparison of T lymphocyte subset levels between the two groups(,%,n = 55)
注:与本组治疗前比较,*P <0.05。表4同。Note:Compared with those before treatment,*P < 0.05 (for Tab.3 - 4).
+++组别CD3 CD4 CD8治疗后55.76±2.24*60.13±3.09*8.492<0.01治疗前51.32±3.76 50.45±3.51 1.254 0.212贝+卡组贝+雷组t值P值治疗前33.28±4.59 32.07±4.44 1.405 0.163治疗后40.94±2.13*42.54±2.65*3.490<0.01治疗前37.50±3.83 36.18±3.75 1.826 0.071治疗后28.72±2.29*24.66±2.47*8.939<0.01
表4 两组患者血管生长因子水平比较(,pg/mL,n=55)Tab.4 Comparison of angiogenic factor levels between the two groups(,pg / mL,n = 55)
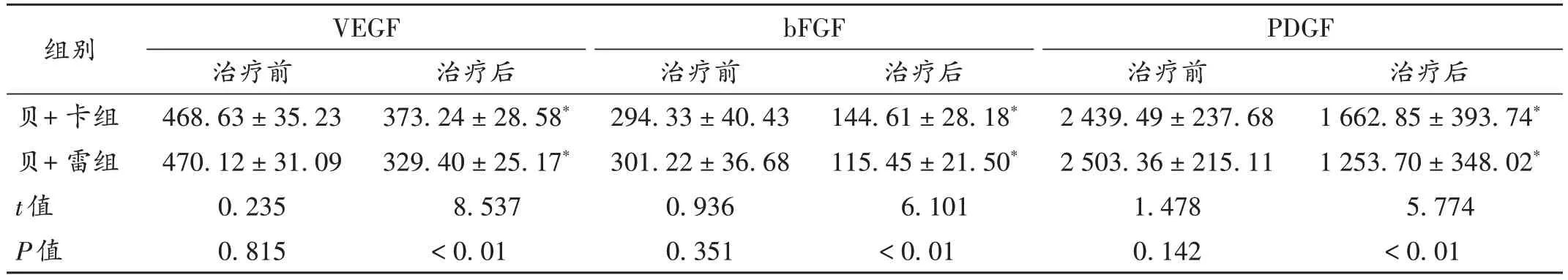
表4 两组患者血管生长因子水平比较(,pg/mL,n=55)Tab.4 Comparison of angiogenic factor levels between the two groups(,pg / mL,n = 55)
组别贝+卡组贝+雷组t值P值VEGF治疗前468.63±35.23 470.12±31.09 0.235 0.815治疗后1 662.85±393.74*1 253.70±348.02*5.774<0.01治疗后373.24±28.58*329.40±25.17*8.537<0.01 bFGF治疗前294.33±40.43 301.22±36.68 0.936 0.351治疗后144.61±28.18*115.45±21.50*6.101<0.01 PDGF治疗前2 439.49±237.68 2 503.36±215.11 1.478 0.142

表5 两组患者不良反应发生情况比较[例(%),n=55]Tab.5 Comparison of the incidence of adverse reactions between the two groups[case(%),n = 55]
3 讨论
3.1 我国老年晚期结直肠癌患者可选二线方案
2018 年,我国癌症统计报告指出,30 年来我国结直肠癌的发病率与死亡率均呈上升趋势,且死亡率在全部恶性肿瘤中居第5 位,被确诊时一般已处于中晚期[10-11]。全球恶性肿瘤中结直肠癌死亡人数高居第3 位,且在亚洲上升幅度较其他地区显著[12]。临床治疗晚期结直肠癌主要方案为化疗,且已有大量临床数据及研究证实,化疗可升高晚期结直肠癌患者5 年生存率[13]。目前,我国结直肠癌患者中年龄在65 岁以上的占70%,而近些年我国老龄化人口趋势也在不断加重。因此,基于我国主体化老龄结直肠癌晚期患者的身体体征和机能考虑,用药方案可考虑二线治疗方案,更加注重患者用药的耐受性、安全性和临床预后[14]。
3.2 血管-免疫交联对结直肠癌疗效良好
肿瘤血管及其血管生长因子在肿瘤发生,病情进展及恶化,以及侵袭转移至机体各器官组织的机制中发挥了巨大作用。肿瘤血管有助于恶性肿瘤生长和侵袭转移,因其可不断从宿主机体获取营养和氧气并输送给肿瘤,肿瘤还可通过肿瘤血管不断转移肿瘤细胞,而血管生长因子的异常表达促进了宿主机体肿瘤血管生长[15]。肿瘤及其肿瘤细胞可成功逃脱免疫检查,与机体免疫微环境及T淋巴细胞亚群异常表达相关。异常的肿瘤血管创造了一种酸性或缺氧微环境,该环境下不利于免疫细胞发挥作用,但在不同的T淋巴细胞亚群中又起到促血管生成的作用。因此肿瘤血管与免疫微环境之间,血管生长因子与T淋巴细胞亚群之间存在互相影响,称为“血管-免疫交联”[16]。故抗肿瘤血管生成药物与免疫检查点抑制剂联用在临床抗恶性肿瘤方面逐步成为主流手段。本研究结果显示,两组患者治疗后的T 淋巴细胞亚群CD3+和CD4+水平均显著升高,CD8+水平和血清血管生长因子VEGF,bFGF,PDGF 水平均显著下降,且贝+ 雷组患者的改善程度均显著优于贝+卡组。因此,说明了采用前一方案可显著改善结直肠癌患者机体免疫内环境,抑制肿瘤血管生长。
本研究结果显示,两组患者客观缓解率与疾病控制率,以及OS 和PFS 均无显著差异。说明2 种用药方案的临床疗效及生存获益相当。同时,贝+雷组患者治疗后的Ⅰ-Ⅱ级恶心呕吐、腹泻、手足综合征和周围神经毒性发生率显著低于贝+ 卡组,且贝+ 雷组Ⅲ- Ⅳ级手足综合征、腹泻的发生率较贝+卡组显著更低,说明雷替曲塞对患者日常生活质量的影响小于卡培他滨。且国外的临床文献指出,部分患者在口服卡培他滨后会出现严重不良反应,包括消化道不良反应、贫血、肝功能损伤、恶心呕吐、手足综合征等[17],严重影响患者的生活质量和治疗依从性。贝伐珠单抗是抗血管生成药,其机制是通过与血管内皮生长因子A(VEGF - A)结合抑制新生肿瘤血管生成,且已有准确临床数据证实,在晚期结直肠癌一线及二线治疗方案中,采用贝伐珠单抗可极大增加患者的生存获益[18]。
综上所述,贝伐珠单抗联合雷替曲塞或卡培他滨治疗晚期结直肠癌,患者可获得相近的疗效,但前一方案在改善患者血清血管生长因子及T 淋巴细胞亚群方面更具优势。
