注射用盐酸头孢甲肟丁基橡胶塞质量控制研究*
2024-02-29郭胜才席时东戴安印周文威
郭胜才,席时东,戴安印,周文威
(1. 中国人民解放军联勤保障部队第九〇三医院,浙江 杭州 310013; 2. 浙江省宁波市药品检验所,浙江 宁波 315000; 3. 浙江省宁波市第二医院,浙江 宁波 315010)
药用卤化丁基橡胶塞呈立体网状多孔结构,主要成分是生胶,具有良好的弹性、阻隔性、低萃取性,对热、臭氧和化学品有良好的抗耐性。为确保胶塞符合药用质量要求,需在胶塞中添加配合剂。配合剂按作用的不同,可分为硫化剂、硫化促进剂、防老剂、填充剂、着色剂及活性剂等[1-4]。硫磺和二硫化四甲基秋兰姆(下文简称秋兰姆)分别是常用的硫化剂和硫化促进剂,其可使橡胶胶料通过生胶分子间交联,生成三维网络结构[1]。抗氧剂可延长胶塞材料的寿命,抑制或延缓胶塞老化,其中2,6 - 二叔丁基- 4 - 甲基苯酚(BHT)是优良的通用型酚类抗氧剂,在橡胶塞的生产中应用广泛[5]。但配合剂可能存在对人体有害的成分,且影响胶塞与药物的相容性[2-3],单质硫和常见抗氧剂可从胶塞迁移至药品中,因此多国对胶塞中的抗氧剂、硫化剂等有关成分作了限量规定。基于此,本研究中参考2020年版《中国药典(二部)》和相关文献[6-15],建立了同时测定药用丁基胶塞中单质硫、秋兰姆和BHT 含量的高效液相色谱(HPLC)法,并将其用于市场上多批胶塞和药品样品的检测,为注射用头孢甲肟药品的质量控制和药品与包材的相容性研究提供参考。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1200 型高效液相色谱仪,配二极管阵列检测器(美国Agilent 公司);CP225D 型电子分析天平(德国Sartorius 公司,精度为0.001 g);SB - 5200DTN 型超声波清洗器(宁波新芝生物科技股份有限公司);ST40R型离心机(美国Thermo Fisher Scientific 公司)。
1.2 试药
注射用盐酸头孢甲肟(含胶塞)为2018年国家药品抽检样品,其中S1 - S4,S5 - S7,S8 - S9,S10 - S13,S14 - S17,S18 - S20,S21 - S23,S24 - S29 样品分别由厂家A-H 提供;空白丁基橡胶塞(由厂家A-H 提供,各2 个;分别由厂家I,J,K,K,I,L,L,K 生产,编号分别为I1、I2,J1、J2,K1、K2,K3、K4,I3、I4,L1、L2,L3、L4,K5、K6);秋兰姆对照品(批号为stbf1299v,含量97%),BHT 对照品(批号为bcbv3237,含量>99.0%),均购自德国Merck 公司;单质硫对照品(国药集团化学试剂有限公司,批号为20170227,含量99.999%);乙腈为色谱纯,二氯甲烷、无水乙醇、三氟乙酸均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Shiseido CAPCELL PAK MGⅡC18柱(250 mm × 4.6 mm,5 µm);流动相:1%三氟乙酸水溶液(A)-乙腈(B),梯度洗脱(0~6 min时30%A,6~26 min时30%A →10%A,26~31min时30%A);流速:1.0mL/min;检测波长:280 nm;柱温:25 ℃;进样量:20µL。
2.2 溶液制备
分别取秋兰姆、BHT、单质硫对照品19.40,23.30,10.07 mg,精密称定,分别置50 mL 容量瓶中,加入二氯甲烷-无水乙醇(1∶1,V/V)溶解并定容,摇匀,即得质量浓度分别为388.0,461.3,201.4µg/mL 的单一对照品溶液,各取适量,置同一容量瓶中,稀释10倍,制成混合对照品溶液。
取药品粉末或剪碎的空白胶塞样品2 g,精密称定,置具塞锥形瓶中,加入二氯甲烷-无水乙醇(1∶1,V/V)10 mL,称定质量,100 ℃水浴回流3.5 h,放冷,再次称定质量,用二氯甲烷-无水乙醇(1∶1,V/V)补足减失的质量,经0.45 µm 微孔滤膜滤过,取滤液,即得供试品溶液或胶塞供试品溶液。
2.3 方法学考察
系统适用性试验:取2.2项下对照品溶液和胶塞供试品溶液各适量,按2.1 项下色谱条件进样测定,记录色谱图。结果胶塞供试品溶液色谱中,在与对照品溶液相同保留时间处有相应BHT、单质硫色谱峰,理论板数按秋兰姆峰、BHT 峰、单质硫峰计均大于2 000,保留时间分别为4.389,12.985,23.872 min,各成分峰之间分离良好,分离度均大于2.0。详见图1。
线性关系考察:精密量取2.2 项下3 种单一对照品溶液各适量,加入二氯甲烷-无水乙醇(1∶1,V/V)分别稀释至每1 mL 含BHT 0.46,0.74,0.92,4.61,23.07,46.13,230.67 µg,单质硫0.20,0.32,0.40,2.01,10.07,20.14,100.70 µg,秋兰姆0.000 2,0.000 3,0.000 5,0.001 0,0.001 9,0.009 7,0.048 5µg的系列单一对照品溶液。取20µL,按2.1项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(X,µg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归。结果见表1。
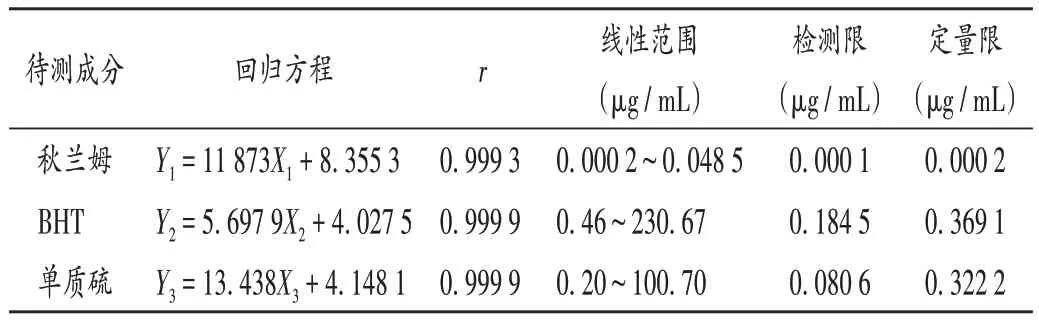
表1 线性关系及检测限、定量限考察结果Tab.1 Results of the linear relation test,LOD and LOQ investigation
检测限与定量限考察:取“线性关系考察”项下的系列单一对照品溶液各适量,稀释,按2.1 项下色谱条件进样测定,以信噪比为10∶1 和3∶1 时的待测成分质量浓度为定量限和检测限。结果见表1。
精密度试验:取2.2 项下混合对照品溶液(分别含秋兰姆0.009 7 µg/ mL,BHT 4.61 µg/ mL,单质硫2.01µg/mL)适量,按2.1项下色谱条件连续进样测定6次,记录峰面积。结果秋兰姆、BHT、单质硫峰面积的RSD分别为1.09%,0.46%,1.44%(n=6),表明仪器精密度良好。
稳定性试验:取2.2 项下混合对照品溶液适量,分别于室温放置1,9,30 d 时按2.1 项下色谱条件进样测定,记录峰面积。结果秋兰姆、BHT、单质硫保留时间的RSD分别为0.30%,0.60%,0.47%,峰面积的RSD分别为1.94%,1.53%,1.38%(n=3),表明混合对照品溶液在室温条件下放置30 d内基本稳定。
加样回收试验:取已知含量的A厂家胶塞(编号为I1)2 g,精密称定,置具塞锥形瓶中,分别精密加入每1 mL含秋兰姆0.048µg BHT 23.05µg、单质硫10.07µg的单一对照品溶液4,5,6 mL,按2.2项下方法制备胶塞供试品溶液,再按2.1项下色谱条件进样测定,记录峰面积,并计算加样回收率。结果见表2。

表2 加样回收试验结果(n=9)Tab.2 Results of the recovery test(n=9)
2.4 样品含量测定
取注射用头孢甲肟粉末及经剪碎的包材胶塞、空白胶塞样品,按2.2项下方法制备供试品溶液及胶塞供试品溶液,按2.1项下色谱条件进样测定,记录峰面积。采用外标法计算待测成分含量,结果见表3 至表5(S0 为日本武田制药公司所产原研药,使用覆膜丁基胶塞);与20 ℃及以下(阴凉库)存放比较,药品粉末样品60 ℃条件下倒置存放5 d 后包材胶塞BHT 含量无显著变化(t= 1.284,P>0.05),单质硫含量显著减少(t=2.928,P<0.05),详见表6。以上检测中均未检出秋兰姆。

表3 空白胶塞样品含量测定结果(μg/g,n=3)Tab.3 Results of content determination of relevant ingredients in blank rubber stoppers(μg/g,n=3)
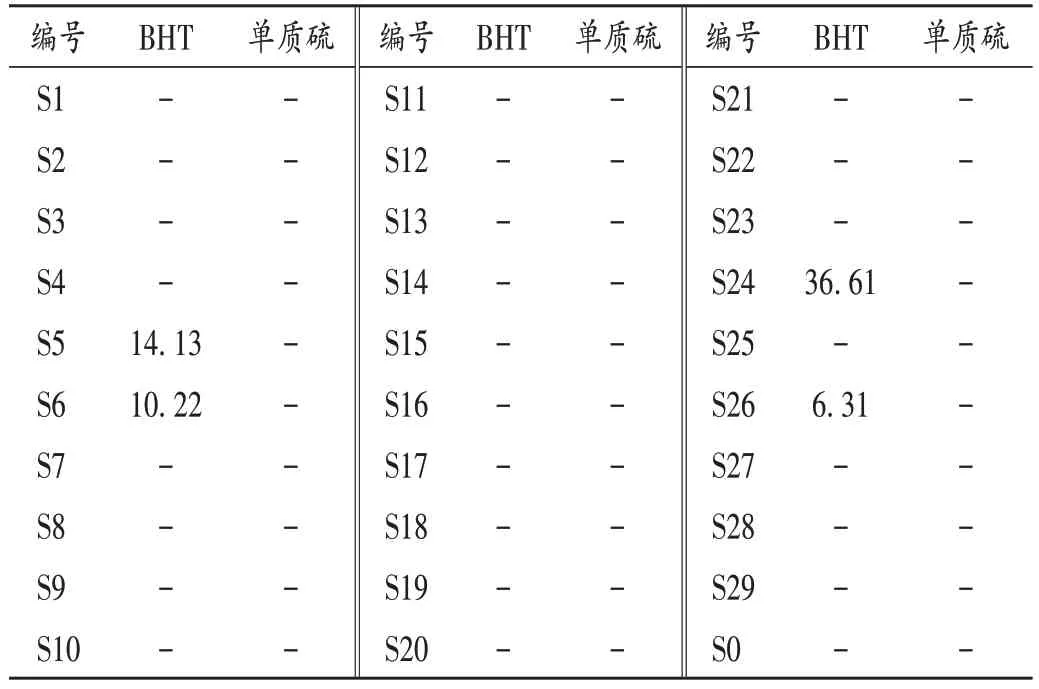
表4 注射用头孢甲肟粉末样品的含量测定结果(μg/g,n=3)Tab.4 Results of content determination of relevant ingredients in Cefmenoxime Hydrochloride for Injection powder(μg/g,n=3)

表5 包材胶塞样品含量测定结果(μg/g,n=3)Tab.5 Results of content determination of relevant ingredients in packaging rubber stoppers(μg/g,n=3)

表6 60 ℃下倒置5 d后包材胶塞含量测定结果(μg/g,n=3)Tab.6 Results of content determination of relevant ingredients in packaging rubber stoppers after inversion at 60 ℃for 5 d(μg/g,n=3)
3 讨论
3.1 色谱条件选择
预试验中考察了不同配比的甲醇-水、乙腈-水、乙腈-四氢呋喃-水、乙腈-0.1%三氟乙酸等溶剂作为流动相的分离效果,结果显示,以乙腈- 0.1%三氟乙酸(90∶10,V/V)为流动相时秋兰姆、BHT和单质硫的分离效果较好,色谱峰峰形对称,但秋兰姆保留时间过短,易受溶剂峰干扰,因此以乙腈- 0.1%三氟乙酸作为流动相时,前6 min 两者体积比为70∶30,待秋兰姆出峰后,流动相配比调整为90∶10(V/ V),这样既可避免溶剂峰对秋兰姆峰的干扰,又可缩短分析时间,提高分析效率。利用光电二极管阵列检测器可在线获得3种待测成分的紫外光谱图的特点,比较紫外检测光谱图,发现在280 nm 波长处3 种待测成分均有较强紫外吸收,故选择280 nm作为检测波长。
3.2 提取方式选择
比较了无水乙醇、乙腈、二氯甲烷、二氯甲烷- 无水乙醇(1∶1,V/V)作为提取溶剂的3 种待测成分的得率,发现二氯甲烷- 无水乙醇(1∶1,V/ V)对BHT 和单质硫的提取更完全,但在胶塞提取试验中均未检测到秋兰姆。另外考察了超声提取和溶剂回流提取及不同回流时间对待测成分溶出的影响,发现超声提取不及溶剂回流提取的提取率高,溶剂回流提取3.5 h达最大提取率,延长提取时间不会显著影响提取结果,因此确定提取时间为3.5 h,但秋兰姆在加热回流条件下的加样回收率较低。
3.3 测定结果分析
本研究结果显示,所有样品均未检出秋兰姆,可能因为秋兰姆在丁基橡胶塞生产过程中与其他添加剂发生反应或秋兰姆类之间发生相互反应,导致其在硫化过程中被消耗殆尽,故检测不到[1]。秋兰姆的加样回收率低于70%,可能还与其热稳定性较差有关。不同制剂生产厂家提供的空白胶塞和实际样品使用丁基橡胶塞中BHT 和单质硫的测定结果不一致,批次差异大,说明胶塞生产厂家质量不够稳定。2 家国内公司与(原研厂家)日本武田制药公司生产的注射用头孢甲肟粉末使用覆膜丁基胶塞,其他厂家均使用普通丁基橡胶塞,使用覆膜丁基胶塞的药品粉末中未检出BHT 和单质硫。20 ℃及以下存放样品和60 ℃下倒置5 d 后样品的丁基橡胶塞中BHT 含量无显著差异,但单质硫的含量显著减少,表明温度对丁基橡胶塞中BHT 的迁移无太大影响,但对单质硫的迁移影响较大,可能有更多的硫迁移到了药品粉末中,提示药品应在阴凉库中保存。个别厂家的药品粉末样品中也检出BHT,但均未检出单质硫,说明存在BHT向药品粉末迁移的情况,需要制剂生产厂家对丁基橡胶塞除按现行国家药品包材标准检验外,还需重视其与制剂相容性引起的质量问题。
