新型冠状病毒灭活疫苗(Vero 细胞)内毒素检查方法比较*
2024-02-29孙也婷许馨月张立志
袁 晶,孙也婷,许馨月,王 琳,张立志
(北京科兴中维生物技术有限公司,北京 102600)
目前,新型冠状病毒(简称新冠病毒)灭活疫苗(Vero细胞)已成为全球获批上市疫苗。然而,疫苗中若混入细菌内毒素,则能激活机体中性粒细胞释放内源性热原物质,并作用于体温调节中枢引起机体发热[1-2],随后发生严重休克,且接种者通常在确诊前就已死亡[3]。因此,各国药典已明确指出需控制疫苗中的内毒素浓度。疫苗注射剂中细菌内毒素的主要来源除细菌污染外,还有生产和控制阶段与产品接触的材料和介质[4-5]。细菌内毒素的检查方法包括凝胶法和光度测定法,其中凝胶法已被作为检查注射剂药品细菌内毒素的“仲裁”方法[6],光度测定法中的动态浊度(TKA)法也已收载于各国药典。鲎已被列为国家二级保护动物,导致鲎试剂的获取逐渐受到严格限制,亟需寻求减少鲎试剂使用量的替代检测方法。微量动态显色(mKCA)法是新一代的光度测定检查方法,具有节省鲎试剂、高灵敏度、强抗干扰能力、数据完整和可追溯等特点[7]。然而,这3种检查方法用于新冠病毒灭活疫苗内毒素检查的适宜性和精确性尚未明晰。鉴于此,本研究中拟讨论并筛选出最适宜的新冠病毒灭活疫苗(原液和成品)内毒素定量检测方法,以期为相应疫苗的数据追溯、质量安全控制提供技术支持。现报道如下。
1 仪器与试药
1.1 仪器
TAL-40D型试管恒温仪[恒温精度(37±0.2)℃],Bioprobe Robot I 细菌内毒素检测系统(精度变异系数≤0.2%,0.3~3 Abs),细菌内毒素检查96孔反应板(内毒素浓度<0.005 EU/mL),均购自湛江安度斯生物有限公司;MS 3 D S025 型漩涡混合器(德国IKA 公司,功率为10 W);LKL164 - 03 型64 通道动态试管仪(英国Lab Kinetics公司,光学精度漂移小于±3%/30 min)。
1.2 试药
新冠病毒灭活疫苗原液及成品(Vero 细胞,北京科兴中维生物技术有限公司,原液批号分别为C202112-005 - 1,C202112 - 005 - 2,C202112 - 005 - 3,C202112 - 006 - 1,C202112 - 006 - 2,C202112 -006-3,C202112-007-1,C202112-007-3,成品批号分别为OD202201001,OD202201002,OD202201003,OD202201005,ON202201002,ON202201006,规格均为每瓶0.5 mL);细菌内毒素工作标准品(中国食品药品检定研究院,批号为150601-202191,规格为每支90 EU);鲎试剂1(福州新北生化工业有限公司,批号为22090212,灵敏度为0.03 EU/mL,规格为每支0.1 mL),鲎试剂2(批号分别为2009181,2112290,灵敏度为0.03 EU/mL,规格为每支0.1 mL,用于凝胶法),鲎试剂3(批号为2105210,灵敏度为0.01 EU/mL,规格为每支1.25 mL,用于光度测定法),细菌内毒素检查用水(BET 用水,批号为2106010,内毒素浓度<0.003 EU/ mL,规格为每瓶100 mL),均购自湛江安度斯生物有限公司。
2 方法与结果
2.1 试剂可靠性评价
2.1.1 凝胶法鲎试剂灵敏度复核
吸取BET用水1.0 mL,加入1支细菌内毒素工作标准品中,振荡15 min,混匀,获得终浓度为90 EU/mL的工作标准溶液。鲎试剂灵敏度(λc)按公式λc=lg-1(ΣX/4)计算,式中,X为反应终浓度的对数(lg)值,反应终浓度即系列递减的内毒素浓度中最后一个呈阳性结果(+)的浓度,4为每个浓度的平行管数。当λc为0.5λ~2.0λ时,判定该鲎试剂可用于内毒素检查。结果2 个厂家的鲎试剂均符合规定和检测要求。
2.1.2 光度测定法标准曲线可靠性试验
以BET 用水稀释细菌内毒素工作标准溶液,配制成浓度分别为10.0,1.00,0.10,0.01 EU/mL 的内毒素标准溶液,每一浓度平行3 份,最低稀释浓度不低于鲎试剂的标注检测限,同时设立2 管阴性对照(NC)。按鲎试剂说明书要求加入试剂,检测405 nm 波长处的吸光度(OD)值,以反应时间(t)对浓度(c)的lg 值进行线性拟合。当NC 的内毒素检测值小于标准曲线最低点的检测值或反应时间大于标准曲线最低点的反应时间,TKA法的CV<10%[8],mKCA 法的CV≤20%[9]时,判定该试验条件成立;当标准曲线的|r|≥0.980 时,判定该试验有效,该鲎试剂可用于内毒素检查。以lgc为横坐标、lgt为纵坐标进行线性回归,得回归方程lgt1= 2.90 -0.25 lgc1,lgt1=2.90-0.28 lgc2(见图1),标准曲线最低浓度均大于NC的内毒素浓度,|r|>0.980,CV<10%(见表1)。可见,曲线可靠,试验结果可信,鲎试剂符合要求。
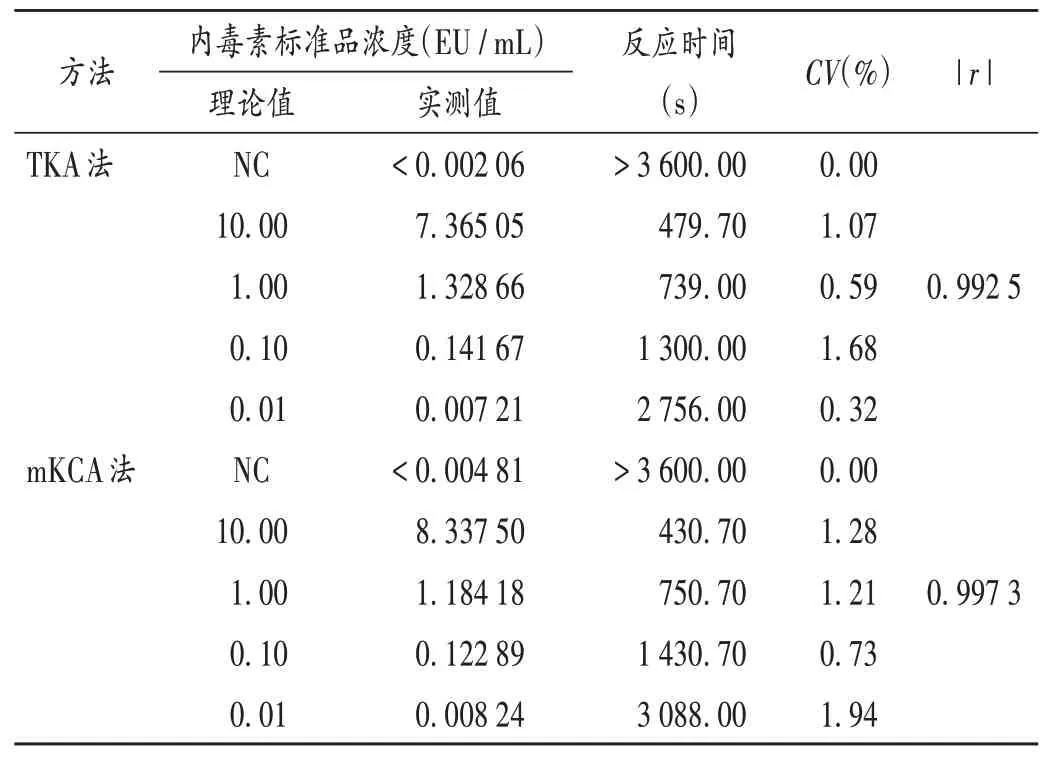
表1 光度测定法鲎试剂标准曲线可靠性试验结果Tab.1 Results of the reliability test of TAL standard curve by photometric assays
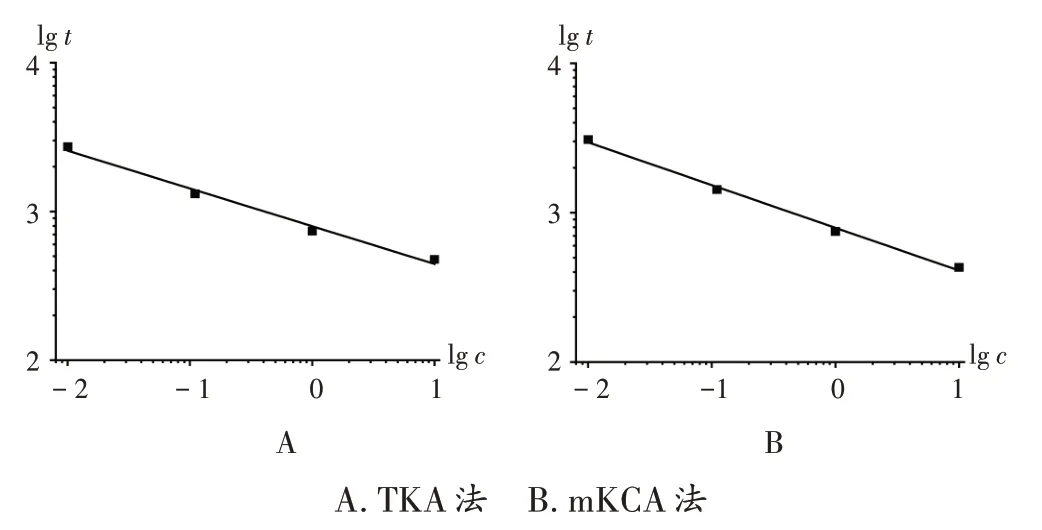
图1 回归曲线A.TKA B.mKCAFig.1 Regression curves
2.2 干扰初筛试验
2.2.1 细菌内毒素限值(L)的确定
新型冠状病毒灭活疫苗(Vero 细胞)内毒素L,原液为不超过5 EU/600 SU,成品为不超过每剂5 EU。
2.2.2 最大有效稀释倍数(MVD)的确定
MVD=CL/λ。式中,C为供试品疫苗的体积分数,单位为mL/mL;L的单位为EU/mL;λ为凝胶法鲎试剂的标示灵敏度(EU/mL),或为光度测定法中标准曲线最低内毒素浓度。计算得凝胶法、TKA 法、mKCA 法中供试品的MVD分别为333倍、1 000倍、1 000倍。
2.2.3 干扰初筛试验
取Vero 细胞原液、成品各1 批,作为供试品分别进行干扰初筛试验。
凝胶法:将供试品稀释10 倍、20 倍、40 倍(均不超过MVD),作为供试品阴性对照溶液(NPC),同时制备2λ浓度标准内毒素的溶液作为供试品阳性对照(PPC)。取2 个厂家的鲎试剂分别与PPC 和NPC 进行反应,每一浓度设置2 个平行,并设阳性对照(PC)和NC。在NC 为阴性且PC 为阳性前提下,各稀释倍数中,NPC均为阴性,PPC均为阳性,则认为在该浓度下无干扰。初步筛选出供试品的最小无干扰浓度,用于正式干扰试验。初筛结果显示,供试品(原液和成品)在稀释到10倍及以上浓度时未见增强或抑制的干扰作用,且2个厂家鲎试剂的检测结果一致(见表2;+/- 分别为阳性/阴性反应,表4同),故选择稀释10倍进行正式干扰试验。

表2 凝胶法Vero细胞原液和成品干扰初筛试验结果Tab.2 Results of the interference pre - test of Vero cell bulk and final products by gel - clot method
光度测定法:采用2.1.2 项下方法绘制回归曲线,将供试品稀释20倍、40倍、80倍(均不超过MVD),作为NPC,选择λm作为供试品干扰试验中添加的内毒素浓度,制备PPC。加入相应鲎试剂,每一浓度设置2 个平行,并设NC,分别置64 通道动态试管仪和细菌内毒素检测系统、96 孔反应板中进行检测。反应结束后,根据回归方程分别计算NPC 和PPC 的内毒素浓度Ct和Cs,回收比(R)=(Ct-Cs)/λm× 100%,式中,λm为一个靠近中点的内毒素浓度。根据2.1.2试验条件成立的前提下,当回收比在50%~200%范围内时,说明在该试验条件下供试品溶液无干扰作用,可进行正式干扰试验。结果显示,各稀释倍数的回收率均在该范围内,详见表3,故选择稀释20倍进行正式干扰试验。

表3 光度测定法Vero细胞原液和成品干扰初筛试验结果Tab.3 Results of the interference pre - test of Vero cell bulk and final products by photometric assays
2.3 干扰试验
另取原液、成品各3批,作为供试品,分别进行正式干扰试验。
凝胶法:取上述供试品,以初筛试验所得供试品无干扰稀释倍数分别制备未检验出内毒素且不超过MVD的溶液为干扰试验溶液。按鲎试剂灵敏度复核试验方法操作,用干扰试验溶液作为稀释剂,每一浓度设置4个平行,NC设置2个平行;使用BET用水作为稀释剂,每一浓度设置2 个平行,NC 设置2 个平行。结果当NPC和NC 的所有平行管均为阴性,以BET 用水做稀释剂时的鲎试剂灵敏度实测值符合鲎试剂灵敏度复核试验要求时,认为供试品在该浓度下无干扰作用,试验方为有效。结果2 个厂家的鲎试剂对3 批Vero 细胞原液(C202112 - 005 - 1,C202112 - 005 - 2,C202112 -005 - 3)和3 批成品(OD202201001,OD202201002,OD202201005)的检测结果均在稀释10 倍时无干扰作用,详见表4。
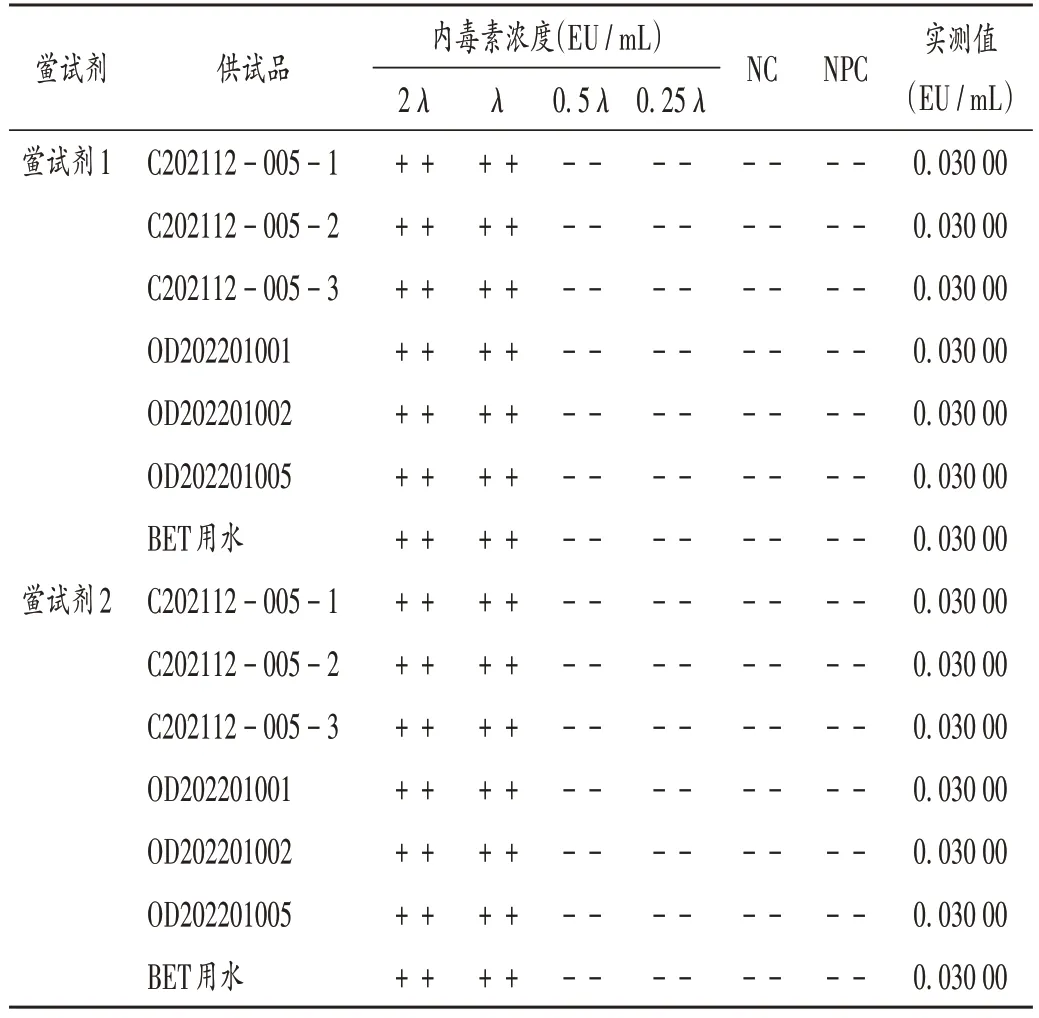
表4 凝胶法干扰试验结果Tab.4 Results of the interference test by gel - clot method
光度测定法:取上述供试品,以干扰初筛试验得到的供试品无干扰稀释倍数分别制备NPC,按干扰初筛试验方法进行干扰验证试验,结果鲎试剂对疫苗稀释20 倍时,3 批原液和成品的回收比均在50%~200%范围内,详见表5。表明在该稀释倍数下对结果无干扰作用,可进行内毒素定量检查。
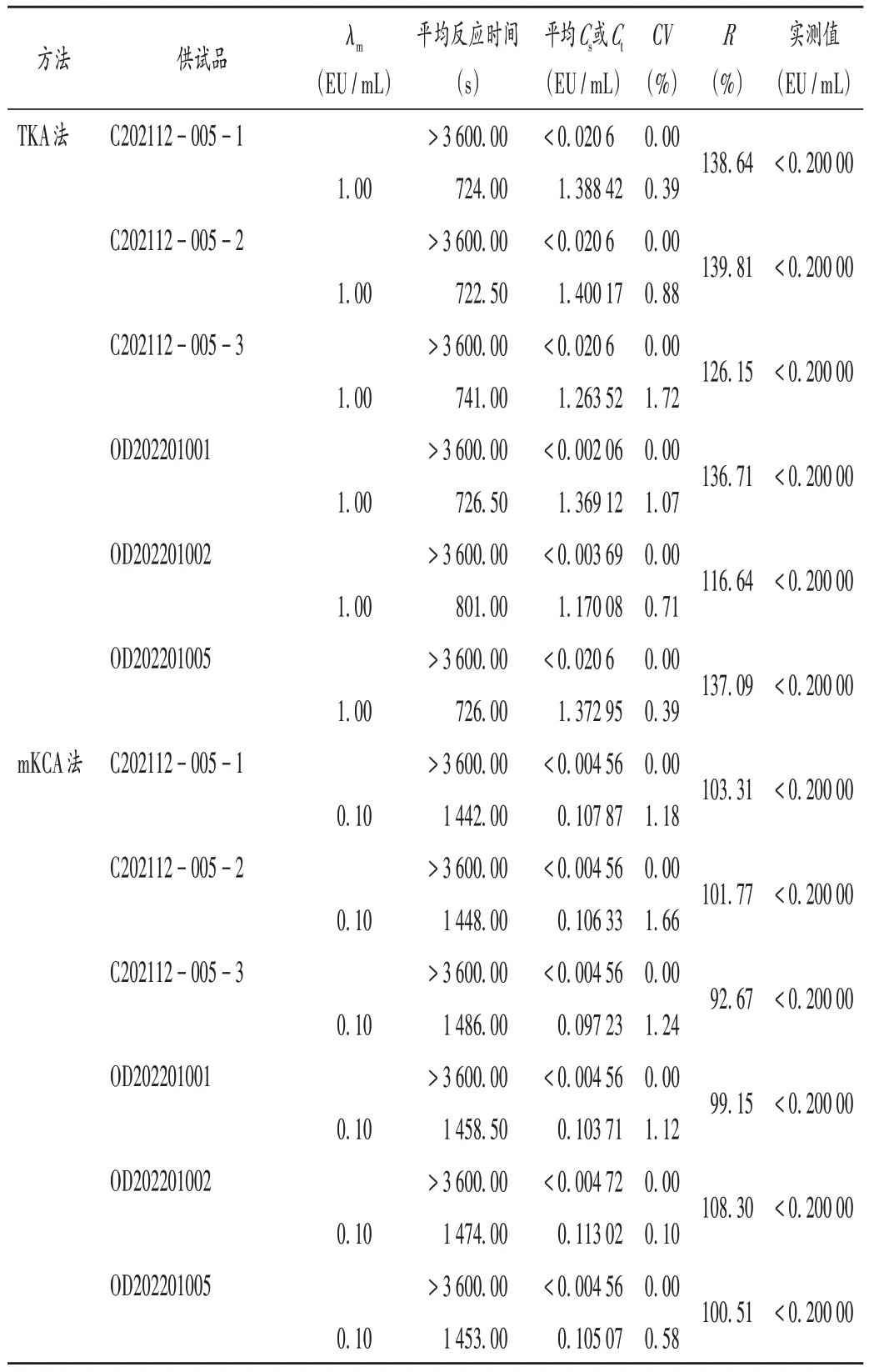
表5 光度测定法干扰试验结果Tab.5 Results of the interference test by photometric assays
2.4 供试品检查
取4批Vero细胞原液(C202112-006-1,C202112-006-2,C202112-006-3,C202112-007- 1)及2 批成品(ON202201006,OD202201003),分别利用3 种检测方法进行内毒素检测,小于限值时为合格。结果内毒素实测值凝胶法均小于0.3 EU/ mL,光度测定法均小于0.2 EU/ mL,均在限值范围内,判定供试品均合格。详见表6。虽然3 种方法检测结果均符合企业质量标准要求,但凝胶法属定性检测,光度法属定量检测,特别是后者中mKCA法的鲎试剂原料使用量更少。

表6 光度测定法的供试品内毒素检查结果Tab.6 Results of the endotoxin determination of test samples by photometric assays
3 讨论
目前,全球已有多个厂家生产新冠病毒灭活疫苗,产量超过50 亿剂。截至2023 年3 月16 日,全球已有132.368 5 亿剂次新冠疫苗接种(数据来自世界卫生组织官网)。在临床试验中,接种新冠病毒灭活疫苗(Vero细胞)的总体不良反应发生率较低,未见死亡病例报告。
疫苗质量安全的保障与内毒素的检查紧密相关。本研究中利用内毒素检查的3 种常用方法检测新冠病毒灭活疫苗(Vero 细胞)原液和成品中内毒素的浓度。发现3种方法使用的鲎试剂均具有可靠性,初筛试验条件对结果均无干扰作用,即影响凝集反应的因素(含电解质、pH、反应时间、温度、鲎试剂来源、供试品颜色和成分等)无干扰作用;测得的供试品内毒素浓度均低于企业规定限值,即符合要求;检测目的和性质略有差异,但检测结果具有一致性。本研究结果提示,mKCA 法能减少鲎试剂的使用量,且能更直观、更大范围、更快速地进行内毒素浓度的定量检查,测得数据回收率较高和变异系数较低,故建议使用mKCA法对新冠病毒灭活疫苗(Vero细胞)原液和成品进行内毒素检查。
在以往的注射液领域,鲎试剂凝胶法检查内毒素的应用最广泛,涉及药物包括喘可治、盐酸法舒地尔、盐酸吡硫醇、单硝酸异山梨酯、高浓度维生素B6、膦甲酸钠氯化钠、柴胡等注射液[10-16]。与凝胶法相比,TKA法更能减少人为判断误差,满足数据完整和可追溯的要求。范治云等[17]建议利用TKA 法检查碘克沙醇注射液的内毒素浓度。与TKA 法相比,mKCA 法使用的鲎试剂更少(用量仅为凝胶法的1/10),还能减少人为操作误差、满足数据完整和可追溯的要求。在以往的疫苗领域,TKA 法[18]和mKCA 法检查内毒素的应用居多,后者尤其适用于检测重组新冠病毒疫苗(CHO 细胞)的内毒素[19]。与本研究相同的是,上述研究均针对新冠病毒,均选用mKCA法检查疫苗中内毒素含量。这进一步佐证了mKCA 法检查新冠病毒灭活疫苗(Vero 细胞)原液和成品内毒素的可行性;不同的是,本研究的检测对象为灭活疫苗,而以往研究检测对象为重组疫苗,且本研究是通过比较3种不同检测方法后得出的结论,数据更全面,更有利于支撑最适方法的结论。可见,该方法可用于新冠病毒灭活疫苗(Vero 细胞)的原料和成品的内毒素检测,可作为灭活疫苗领域的内毒素检查手段,并在灭活疫苗领域广泛应用。
利益冲突:所有作者声明无利益冲突。
