基于多功能纳米酶的高灵敏金黄色葡萄球菌Apt-LFA检测方法
2024-02-28李秀萍孙成栋王晓琼钱志娟彭池方
李秀萍,孙成栋,王晓琼,钱志娟,彭池方*
(1 江南大学 食品学院,江苏 无锡 214122;2 南京海关工业品中心,江苏 南京210001;3 南京海关轻工产品与儿童用品检测中心,江苏 扬州 225009)
食源性疾病尤其是致病菌引起的传染病,是全球主要公共卫生问题之一,每年造成数百万人死亡[1-2]。食品和饮用水中常见的金黄色葡萄球菌、单增李斯特菌、大肠杆菌等是大多数食源性疾病的罪魁祸首[3-4]。致病菌的检测方法众多,但传统的致病菌检测方法操作复杂、检测时间长、需要专业的操作人员。开发食品中病原菌的快速、高特异性和高灵敏度检测方法对食品安全具有重要意义[5-6]。
侧流层析分析(lateral flow assay,LFA)是一种广泛使用的纸基生物传感器。它通常使用比色或荧光试剂作为信号标签,以发出肉眼、光谱仪或手机可读的定性信号[7-8]。LFA通常可以在几分钟内得到测试结果且无需专业训练的操作人员和复杂昂贵的仪器,具有操作简单、检测速度快、检测成本低等优点,在病原菌检测领域有着广阔的应用空间[9]。长期以来,LFA的识别元件一直依赖于抗体,但基于抗体的LFA存在批次间差异大、储存条件高等缺陷[10]。适配体(aptamer,Apt)由于批次间差异较小、热稳定性高、免疫原性低、成本低,有望成为抗体的良好替代品。近年来,研究人员已经设计出多种基于适配体的侧向流动分析试纸条(Apt-LFA),并应用于致病菌的检测。Fang等[11]建立了一种基于等温链置换扩增的Apt-LFA,并成功应用于沙门氏菌的检测,其检测限(limit of detection,LOD)为10 CFU/mL。Ren等[12]用适配体-核酸外切酶Ⅲ辅助扩增与LFA相结合,建立了牛奶中检测大肠杆菌O157∶H7的方法,其LOD为835 CFU/mL。
然而,到目前为止,Apt-LFA在致病菌的实际检测应用方面依然发展缓慢。这主要是因为核酸扩增对操作环境要求较高,与核酸LFA平台集成,很难体现LFA方法的低成本、易操作等优势。基于纳米酶(nanoenzyme)的高催化活性、高稳定性、低成本等特性,越来越多的研究人员利用纳米酶设计LFA新型信号传感器[13-14]。Wei等[15]开发出一种基于Au-Ir NP的侧流层析免疫分析(lateral flow immunoassay,LFIA)方法,并成功应用于2种不同癌症生物标志物的检测,其检测限比传统基于AuNP的LFIA的灵敏度高2个数量级。Wu等[16]设计出基于Fe3O4@Au核壳纳米粒子的Apt-LFA,并成功应用于β-凝血素的检测,其LOD为8 fmol/L。Lai等[17]通过将Fe3O4、PDA和Pd/Pt整合,合成了Fe3O4@PDA@Pd/Pt多功能纳米酶,并将其作为LFIA的探针应用于人绒毛膜促性腺激素和大肠杆菌O157:H7的检测,其LOD分别低至0.009 4 mIU/mL和90 CFU/mL。
受上述研究的启发,本研究将合成一种多功能纳米酶(Fe3O4@MOF@PtPd)作为信号探针,使其具有磁分离和信号放大2种功能;同时整合致病菌的特异性适配体和万古霉素(VAN)作为双重识别单元,进一步提高对革兰氏阳性细菌的识别能力[18-20]。生物素化的适配体与VAN共同完成对金黄色葡萄球菌的识别,结合LFA平台,将Fe3O4@MOF@PtPd纳米探针在试纸条上捕获,进一步通过催化显色,以实现对金黄色葡萄球菌的高灵敏快速检测。
1 材料与方法
1.1 材料与试剂
氯化铁(FeCl3·6H2O)、乙酸胺(NH4OAc)、乙二醇(EG)、乙二胺四乙酸二钠盐(EDTA-2Na)、聚乙烯吡咯烷酮(PVP)、均苯三甲酸(H3btc)、乙醇、碘化钾(KI)、过氧化氢(H2O2)购于国药集团化学试剂有限公司;六水合氯铂酸(H2PtCl6·6H2O)、丙酮、N,N-二甲基甲酰胺(DMF)、四氯钯酸钾(Na2PdCl4)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC-HCl)、N-羟基琥珀酰亚胺(NHS)、盐酸万古霉素(VAN-HCl)、3,3’,5,5’-四甲基联苯胺(TMB)、3,3’-二氨基联苯胺(DAB)、氯金酸(HAuCl4)、柠檬酸三钠购自Sigma-Aldrich公司;5’-三磷酸腺苷(ATP)、单磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸鸟苷(GTP)、三磷酸尿苷(UTP)、三磷酸胞苷(CTP)、牛血清白蛋白(BSA)和链霉亲和素(SA)购自上海生工生物科技有限公司。结合缓冲液(BB)包含50 mmol/L Tris-HCl(pH 7.4)、100 mmol/L NaCl、5 mmol/L KCl和1 mmol/L MgCl2;显色液包含4 mmol/L DAB、3 mol/L H2O2和0.2 mol/L NaAc缓冲溶液(pH 3.5);缓冲液A包含10 mmol/L Tris-HCl(pH 7.9)、50 mmol/L NaCl和10 mmol/L MgCl2;1×TBE运行缓冲液包含89 mmol/L Tris-硼酸(pH 8.3)和2 mmol/L EDTA。实验中使用的吸收垫(SX27)、样品垫(SB06)、共轭垫(VL78)、NC膜(Sartorius CN140)和PVC塑料背胶均购自上海金标生物科技有限公司。所有溶剂均由无菌水配制。
1.2 仪器与设备
XYZ3050三维喷点平台和KM-3100切割器,美国BioDot公司;ZJ600多通道胶体金阅读器,无锡中德伯尔生物技术有限公司;GIC-S100-L61便携式阅读扫描器,苏州海迈精密仪器有限公司;UV-1800分光光度计,日本岛津公司;Zetasizer Nano ZS纳米粒度电位仪,英国马尔文仪器有限公司;EM-2100透射电子显微镜,日本电子株式会社;MicroCal VP-ITC等温滴定量热仪,英国马尔文仪器有限公司;Chirascan v100圆二色光谱仪,英国应用光物理公司;Antaris Ⅱ傅里叶变换红外光谱仪,赛默飞世尔科技(中国)有限公司;D8 ADVANCE X射线衍射仪,布鲁克纳集团(德国)有限公司;BDFACS Calibur流式细胞分析仪,美国碧迪医疗器械(上海)有限公司。
1.3 实验方法
1.3.1 细菌培养
本研究中所用微生物包括:金黄色葡萄球菌(ATCC 29213)、单增李斯特菌(ATCC 19115)、大肠杆菌(ATCC 25922)、鼠伤寒沙门氏菌(CICC 10420)、副溶血性弧菌(CICC 21617)和福氏痢疾杆菌(ATCC 12022)。
将菌株转移到LB琼脂培养基中,37 ℃过夜活化。调整细菌浓度为1×108CFU/mL,波长600 nm条件下的吸光度值为0.8。细菌原液连续稀释10倍至测试浓度,4 ℃储存用于进一步实验。
1.3.2 羧基功能化Fe3O4纳米粒子的制备
通过溶热反应合成羧基功能化的Fe3O4纳米粒子[21],具体步骤如下:将0.8 g FeCl3·6H2O溶解于40 mL乙二醇中,充分搅拌得到透明分散液。将2 g无水NH4OAc和0.5 g EDTA-2Na依次加入分散液,剧烈超声搅拌直至变均匀。将混合物转移到有特氟龙衬里的不锈钢高压釜中,200 ℃充分反应12 h,所得产物用去离子水和乙醇各洗涤3次,并在60 ℃条件下真空干燥12 h。
1.3.3 Fe3O4@MOF纳米颗粒的制备
通过一锅组装程序合成Fe3O4@MOF[22],具体步骤如下:将50 mg上述羧基功能化的Fe3O4分散于4 mL的FeCl3·6H2O乙醇中,加入4 mL H3btc乙醇溶液(10 mmol/L),持续搅拌10 min。在70 ℃条件下继续搅拌2 h后,通过外部磁场分离并收集产物,用乙醇洗涤3次。将产物中继续加入以上相同量的FeCl3·6H2O乙醇溶液和H3btc乙醇溶液,进一步生长反应,该过程重复5次。最后通过外部磁场回收样品,乙醇洗涤3次,60 ℃真空干燥12 h。
1.3.4 铂钯纳米立方的制备
铂钯纳米立方(PtPd NCs)的制备过程如下[23]:1 mL Na2PdCl4(20 mmol/L)、1 mL H2PtCl6·6H2O (20 mmol/L)、83 mg KI、160 mg PVP与10 mL的DMF混合,混合物超声2 min,130 ℃加热5 h,冷却至室温并用丙酮洗涤沉淀3次。重悬至DMF中4 ℃储存。
1.3.5 磁性复合纳米酶的制备
Fe3O4@MOF@PtPd、Fe3O4@MOF@Pt、Fe3O4@MOF@Pd磁性复合纳米酶的制备参照文献[24-25]并进行改良,具体步骤如下:分别将200 μL合成的PtPd NCs、Pt NCs和Pd NCs溶液在剧烈搅拌下滴加到2 mL含Fe3O4@MOF的DMF中(10 mg/mL),室温下搅拌2 h。通过外部磁场回收样品并用乙醇洗涤,60 ℃条件下真空干燥12 h,保存备用。
1.3.6 磁性纳米酶标记VAN和cDNAc探针的制备
探针制备根据文献[19,26]进行改良。Fe3O4@MOF@PtPd@BSA探针是在EDC的作用下,通过MIL-100(Fe)上残留的羧基与BSA的氨基之间形成氨基键获得,具体步骤如下:2 mL Fe3O4@MOF@PtPd悬浮液(10 mg/mL)用磷酸缓冲液(PBS,0.01 mol/L,pH 7.4)洗涤3次,重悬于含有5.8 mg EDC和6.5 mg NHS的PBS中。活化1 h后,PBS洗涤3次,并分散在含有24 mg BSA的PBS(8 mL)中。2 h后,通过外部磁场收集BSA修饰的Fe3O4@MOF@PtPd,PBS洗涤3次,分散于PBS中。
为制备Fe3O4@MOF@PtPd@VANcDNAc,室温下用5 mg/mL EDC和5 mg/mL NHS将10 mg/mL VAN在1.0 mL PBS中活化10 min,得到混合液A。同时,室温下用5 mg/mL EDC和5 mg/mL NHS将20 μL cDNAc(100 μmol/L)在1 mL PBS中活化10 min,得到混合液B。将混合液A和混合液B加入到上述经BSA修饰的Fe3O4@MOF@PtPd中,37 ℃、180 r/min条件下反应6 h,PBS洗涤3次,分散于2 mL PBS中,其中含10%蔗糖和0.25% Tween-20。将探针储存于4 ℃备用。
1.3.7 磁性纳米酶标记探针对菌的捕获性能
研究磁性纳米酶标记探针对致病菌的捕获能力,对其进行定量评估。将原菌液以及被探针捕获后的上清液在LB固体培养基上37 ℃过夜,用于活细胞计数,根据下式计算捕获效率:
(1)
式中:E表示捕获效率;O表示原始细菌的数量;R表示被探针捕获后上清液中的细菌数量。
1.3.8 侧流层析装置的组装
使用4种材料制备侧流层析装置。将样品垫、NC膜、吸收垫依次贴在PVC胶背上,每部分重叠2 mm,在PVC胶背下正对NC膜的位置贴上软磁铁;将样品垫、金标垫、NC膜和吸收垫依次贴在PVC底板上,每部分重叠2 mm。用三维喷点平台在NC膜的测试线(T线)和对照线(C线)上分别喷洒2 mg/mL SA和83 μmol/L SA-Bio-DNAc,并在37 ℃条件下干燥4 h,T线和C线之间的距离是5 mm。最后,将试纸切成宽度为4 mm的试纸条,4 ℃条件下储存。
1.3.9 致病菌的检测
首先,将细菌培养液进行预处理,处理方式同流式细胞分析实验。然后,将6 μL Fe3O4@MOF@PtPd@VANcDNAc(0.5 mg/mL,由Fe3O4确定)和生物素化Apt(40 nmol/L)加入相同浓度致病菌(0、1×10、5×10、1×102、5×102、1×103、5×103、1×104、5×104、1×105、1×106、1×107和1×108CFU/mL)的悬浮液,总体积为200 μL。在37 ℃条件下孵育60 min后,通过磁分离将未结合的致病菌分离,所得沉淀物重新悬浮于200 μL的运行缓冲液(4×SSC,0.5% Tween-20,pH 7)中。取70 μL滴在侧流层析装置的样品垫上,8 min后在测试条T线和C线处滴加0.8 μL显色液,催化90 s,用智能手机拍摄测试条的照片。
1.3.10 实际样品分析
为验证设计的LFA在实际分析中的适用性,在牛奶中进行加标回收实验。将已知浓度的细菌(1×102、1×104、1×106和1×108CFU/mL)添加到25 mL牛奶中,根据国标GB 4789.2—2022[27],将加标的25 mL牛奶加入225 mL BB缓冲液中。空白样品的阴性对照也按相似程序制备。最后,用设计的LFA对加标样品进行检测。
1.3.11 数据收集和处理
使用智能手机拍摄测试条的照片,使用Image J处理获得灰度值,使用Origin 2021处理数据并绘制图像,使用相对信号强度作为优化指标。
2 结果与讨论
2.1 Fe3O4@MOF@PtPd的合成与表征
Fe3O4纳米颗粒的透射电子显微镜(TEM)图像(图1a)显示,它具有良好的均匀性和单分散性,粒径为235±12 nm,与之前报道一致[21]。Fe3O4纳米颗粒作为MIL-100(Fe)原位生长的核心,通过组装形成Fe3O4@MOF纳米结构。TEM图像(图1b)显示,获得的Fe3O4@MOF具有清晰的核壳结构,经过5个生长周期,磁芯周围具有一层平均厚度为50±5 nm的MIL-100(Fe)壳层,表明MIL-100(Fe)成功包覆在Fe3O4纳米颗粒表面。将8 nm的PtPd NCs包覆在Fe3O4@MOF表面,进一步制备出Fe3O4@MOF@PtPd,其TEM图像(图1c)显示,高密度的PtPd NCs分布在Fe3O4@MOF表面,说明PtPd NCs成功负载。
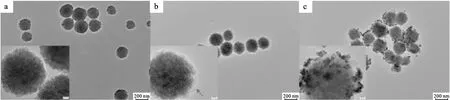
图1 Fe3O4(a)、Fe3O4@MOF(b)和Fe3O4@MOF@PtPd(c)的TEM图像
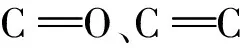

图2 复合材料的FT-IR光谱(a)及磁滞曲线(b)
2.2 Fe3O4@MOF@PtPd的催化性能
合成的Fe3O4@MOF@PtPd纳米酶由Fe3O4纳米颗粒、MIL-100(Fe)和铂钯纳米立方(PtPd NCs)组成。MIL-100(Fe)固有的高过氧化物酶活性可以提高纳米酶的催化性能,其作为多孔间隔层还可以较好的保留Fe3O4纳米粒子的磁性,也可作为吸附层装载大量的PtPd NCs。PtPd NCs的双金属协同效应可以进一步增强纳米酶的催化能力[23,28]。具有纳米酶性质的纳米复合材料的信号放大能力通常由其过氧化物酶活性决定,为进一步测定其过氧化物酶活性,记录MIL-100(Fe)、PtPd NCs、Fe3O4、Fe3O4@MOF@PtPd催化氧化TMB前后在450、650 nm处的吸光度,发现4种材料的最低可检出限分别为5 000、5 000、500、500 fmol/L。在加入H2O2与TMB后,4种纳米材料的LOD值出现不同程度的下降,分别为250、500、100、2.5 fmol/L(图3)。因此,与MIL-100(Fe)、PtPd NCs、Fe3O4相比,Fe3O4@MOF@PtPd具有更好的过氧化物酶活性,选择其作为纳米标记材料进一步用于后续研究。
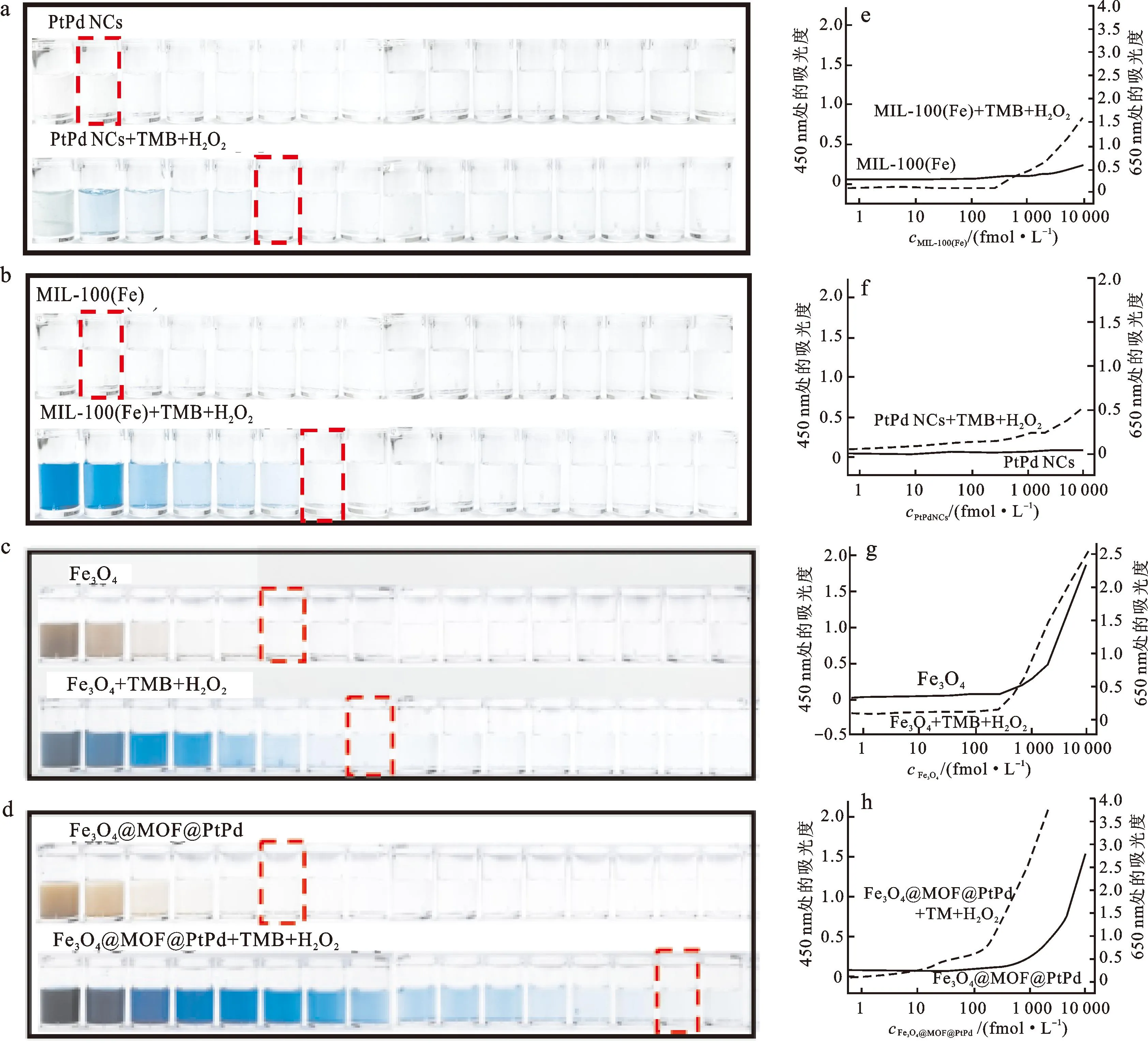
a、b、c、d分别为MIL-100(Fe)、PtPd NCs、Fe3O4、Fe3O4@MOF@PtPd催化H2O2(0.1 mmol/L)和TMB(1 mmol/L)反应前后的照片,颗粒从左至右物质的量浓度依次为10 000、5 000、2 000、1 000、750、500、250、100、75、50、25、10、7.5、5、2.5和1 fmol/L;e、f、g、h分别为MIL-100(Fe)、PtPd NCs、Fe3O4、Fe3O4@MOF@PtPd催化H2O2-TMB前后,体系在450 nm和650 nm处的吸光度值。
2.3 磁性纳米酶标记探针对菌的捕获性能
由图4可见,磁性纳米酶标记探针对1×102~1×104CFU/mL的金黄色葡萄球菌均具有较高的捕获效率,探针富集后剩余的细菌数量远远小于原菌液中的细菌数量,计数分析显示捕获效率均超过90%以上。

图4 磁性纳米酶标记探针对目标菌的富集能力评估
2.4 LFA方法的优化
基于Fe3O4@MOF@PtPd磁性纳米酶可增强Apt与病原菌的结合亲和力,开发新型侧流层析传感器,通过单因素实验分析,对显色液中VTMB∶VH2O2、显色液体积、显色时间、Fe3O4@MOF@PtPd信号探针体积4个实验参数进行优化,以获得最佳实验条件,结果如图5所示。可以看出,LFA的最佳测定参数为:VTMB∶VH2O2=5∶5,显色液体积为0.5 μL,滴加显色液30 s后进行数据记录,Fe3O4@MOF@PtPd(0.5 mg/mL)信号探针的使用体积为1.0 μL。
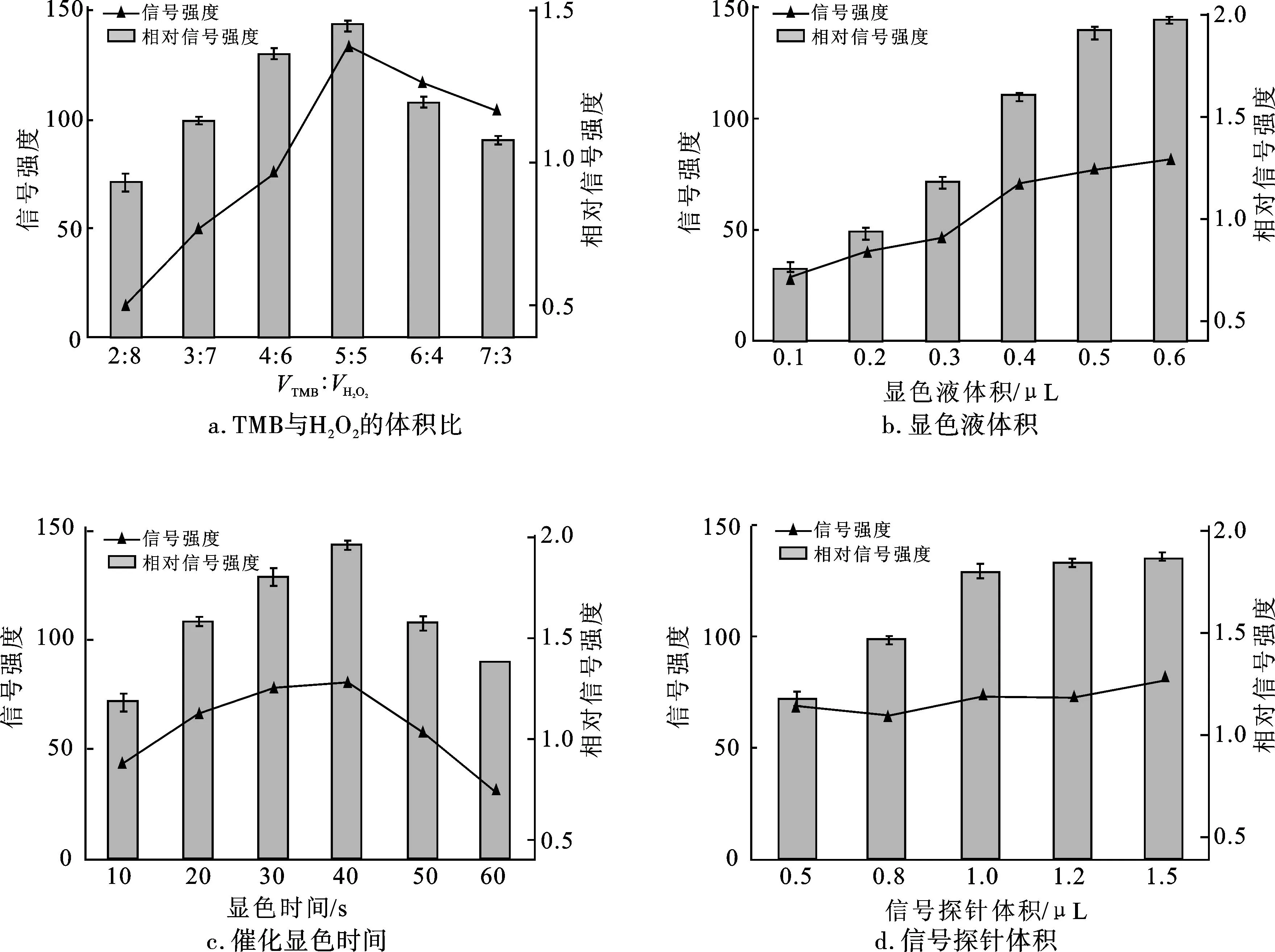
图5 LFA方法优化单因素实验
2.5 侧流层析传感器的性能测定
在上述优化的最佳实验条件下,对所开发的侧流层析传感器性能进行评估,发现经过多功能Fe3O4@MOF@PtPd纳米酶催化后的T线强度随金黄色葡萄球菌浓度的增加而增大(图6a)。该LFA的校准曲线(图6b)显示,其检测金黄色葡萄球菌的线性范围为10~100 000 CFU/mL(R2=0.976),LOD值为2 CFU/mL。

图6 所开发LFA的性能测定
通过整合致病菌的特异性适配体和VAN作为双重识别单元,可实现对革兰氏阳性细菌的高特异性识别。其中,VAN修饰在Fe3O4@MOF@PtPd表面,可与革兰氏阳性细菌细胞壁上的D-Ala-D-Ala位点结合[26,29-30],实现细菌的富集分离。为了验证该LFA对金黄色葡萄球菌的特异性,对几种常见革兰氏阳性菌(1×106CFU/mL)进行检测,包括单增李斯特菌(ATCC 19115)、嗜热链球菌(ATCC 19258)、大肠杆菌(ATCC 25922)、鼠伤寒沙门氏菌(CICC 10420)、副溶血性弧菌(CICC 21617)、福氏痢疾杆菌(ATCC 12022)等。如图7所示,只有靶标是金黄色葡萄球菌时,T线才显示出强烈的信号,因此,该LFA具有良好的特异性。
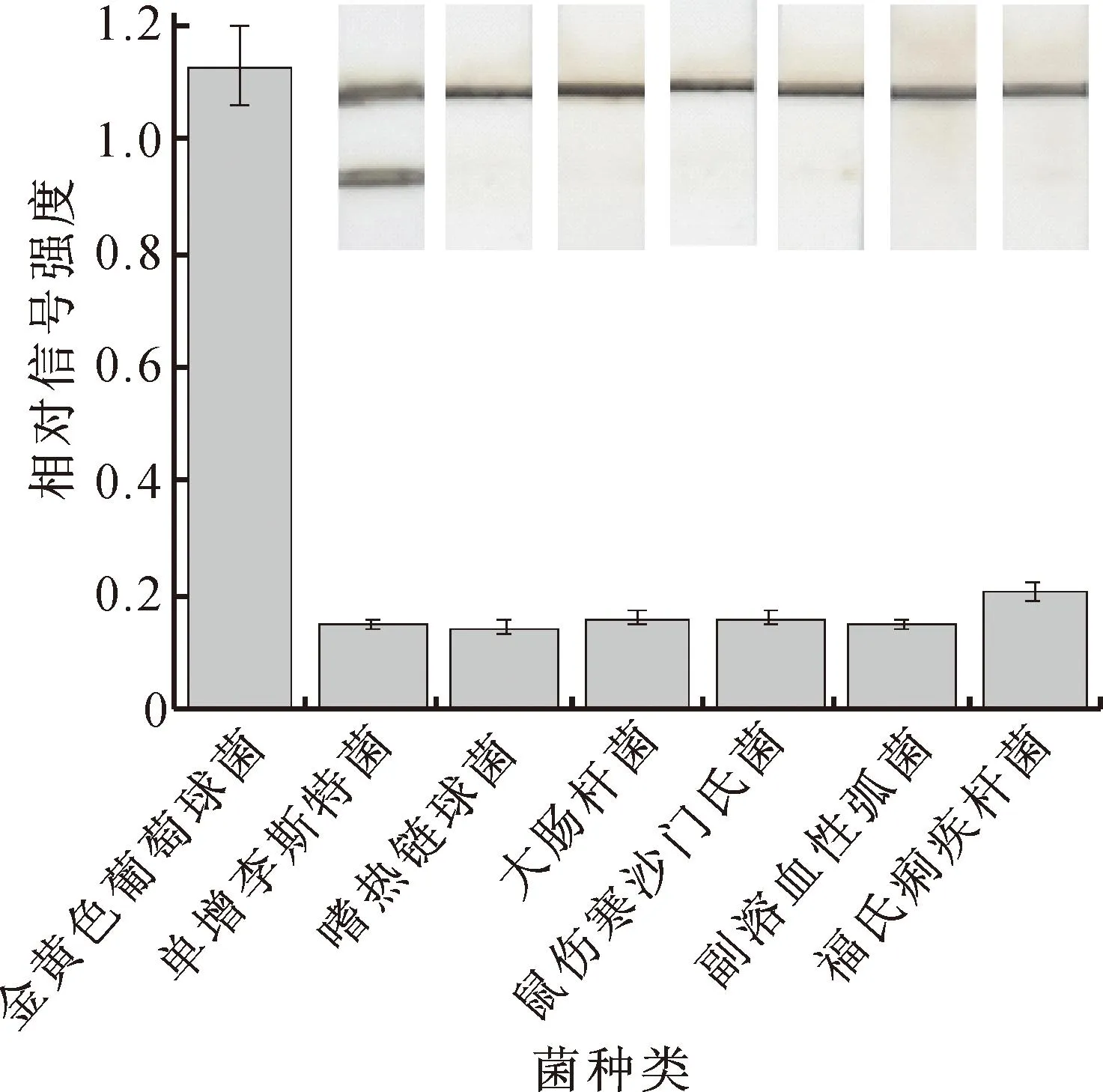
图7 设计的LFA对金黄色葡萄球菌的选择性
在证实该LFA对金黄色葡萄球菌具有良好的选择性后,采用经典加标回收实验评估传感器的实际应用效果,结果如表1所示。该LFA传感器表现出优异的回收率(96.9%~103.4%),且相对标准偏差小于6.7%。因此,设计的LFA传感器可以应用于复杂样品中金黄色葡萄球菌的检测。

表1 LFA传感器对牛奶样品中加标金黄色葡萄球菌的回收结果
3 结论
本研究合成了多功能Fe3O4@MOF@PtPd磁性纳米酶,通过Fe3O4@MOF@PtPd磁性纳米酶增强Apt与病原菌的结合亲和力,开发出新型LFA传感器,实现了金黄色葡萄球菌的快速、高灵敏度检测。该LFA以适配体和万古霉素作为双重识别单元,对革兰氏阳性菌的检测具有普适性,仅需替换特定的适配体就能实现对其他革兰氏阳性菌的检测,为将来开发革兰氏阳性致病菌的POCT传感器提供了新的启示。
