外源诱导子和温度对黑果枸杞悬浮细胞花青素积累的影响
2024-02-28曾海涛仇莹莹陈梦娇
曾海涛,仇莹莹,徐 皓,唐 琪,陈梦娇,郑 涛
(陕西理工大学 生物科学与工程学院,陕西省资源生物重点实验室,秦巴生物资源与生态环境省部共建国家重点实验室(培育),陕南秦巴山区生物资源综合开发协同创新中心,陕西 汉中 723000)
黑果枸杞(Lyciumruthenicum)是茄科(Solanaceae)枸杞属(LyciumL.)多年生灌木,多在干旱、盐碱的荒漠与半荒漠地区以群落形式分布[1-2]。黑果枸杞是迄今为止发现的花青素含量最高的天然野生果实,其花青素含量是蓝莓的18倍,可作为提取原花青素的理想植物资源,有野生“蓝色妖姬”、植物界的“软黄金”等美称[3-4]。花青素具有抗氧化、保护肝脏和抗癌的药理作用,药用价值很高;同时,因其稳定性好、着色性强,花青素含量常被用作评价植物产品质量的关键指标[5-6]。
与传统的整株材料相比,植物细胞悬浮系具有分散性能好、细胞性状及细胞团大小一致、生长重现性快、易于控制等优点,已成为植物生物技术中最有用的工具之一和植物细胞工程研究的热点[7-9]。与直接从天然植物中提取或化学合成相比,通过植物细胞培养生产次生代谢产物具有无可比拟的优势[10],但目前植物细胞培养商业化应用的例子还很少,重要原因之一是目标产物产量过低。为了解决这一问题,对植物悬浮细胞施加外源激素,诱导植物次生代谢产物合成的相关研究备受关注,特别是将调整外源激素诱导条件与优化培养基组分相结合的改良培养方法已被应用于植物悬浮细胞的工厂化生产[11-12]。
外源激素诱导已被广泛用于葡萄[13]、三七[14]、红花[15]、樟叶越桔[16]等植物的悬浮培养体系,并在促进细胞增殖或增加细胞活性成分积累等方面发挥重要调控作用。外源激素可用于调控花青素的合成和果实颜色发育,但不同外源激素对花青素合成的作用不同[17]。其中,脱落酸(abscisic acid,ABA)通过参与花青素的生物合成调控,直接影响花青素的积累并促进果实着色。外施1 g/L ABA能加速蓝莓果实转色、成熟和软化,增加其可溶性固形物的积累,提高果实总花青素含量和抗氧化能力[18]。某些呼吸跃变型水果,如苹果,其果实被喷施ABA(50、100、150 mg/L)后,基因组中的MYB1和bZIP44转录因子编码基因的表达水平显著上调,受其调控的下游结构基因表达量也随之提升,果实氮积累减少的同时碳与糖积累增多,促进了花青素的合成[19]。苹果果实的色泽发育与蔗糖、果糖含量正相关,尤其是组织内的蔗糖含量对花青素积累的影响最显著,暗示了蔗糖分子可能参与细胞内花青素的合成。ABA可与蔗糖交互作用,显著促进草莓果实中与花青素合成相关基因的表达,进而增加果实中花青素的积累[20]。有报道认为,17 ℃的低温条件能诱导苹果MdbHLH3表达,还能促进MdbHLH3的磷酸化修饰,进而增强该转录因子与MdMYB1、MdDFR、3MdUFGT等基因启动子区域的结合能力,最终促进花青素的合成[21]。茉莉酸甲酯也对花青素的合成起正向调节作用,其处理橡胶树体胚可以诱导花青素的合成积累,使树体胚呈红色[22]。
目前,关于黑果枸杞中花青素的研究已有较多报道,植物组织培养技术也已被广泛用于药用活性成分积累等研究。但黑果枸杞悬浮细胞体系的建立以及外源激素和温度对黑果枸杞悬浮细胞中花青素积累的影响鲜有报道。本研究以黑果枸杞细胞培养作为模式体系,研究外源激素诱导子、低温及二者的协同作用对黑果枸杞细胞生长和花青素积累的影响,以期为黑果枸杞悬浮细胞的培养和花青素积累提供参考。
1 材料与方法
1.1 黑果枸杞悬浮细胞培养体系的建立
供试材料源自宁夏农科院的黑果枸杞种子。取适量黑果枸杞种子置于50 mL离心管中,在超净台上消毒。加入15 mL无菌水,反复摇晃3 min,倒出无菌水加入15 mL 75%酒精,摇晃30 s,倒掉酒精,用无菌水清洗2次,再加入20 mL 10%次氯酸钠震荡摇晃10~15 min,无菌水清洗3次。
将配置的1 L WPM(woody plant medium)培养基平均分装于20个培养瓶中,密封膜密封。121 ℃条件下高压蒸汽灭菌18 min,冷却。
在超净台中用枪头吸取几颗枸杞种子,点种到WPM培养基上,25 ℃、光(12 h)/暗(12 h)周期性照明条件下培养 25 d。
以黑果枸杞无菌苗的叶片为外植体,在附加0.5 mg/L激动素(KT)+2.0 mg/L 2,4-二氯苯氧乙酸(2,4-D)+20.0 g/L蔗糖+6.0 g/L琼脂的培养基上诱导愈伤组织。每15~20 d收取白绿色、松脆的愈伤组织在相同培养基上进行继代培养,将连续继代3次以上的愈伤组织接种到装有100 mL液体培养基的三角瓶中,置于恒温振荡摇床120 r/min、25 ℃条件下悬浮培养。
1.2 外源诱导剂的制备
用无菌水配制不同质量浓度的蔗糖溶液(6、12、18、20、30 g/L)和茉莉酸甲酯溶液(10、50、100、200、300 mg/L);ABA用少量无水乙醇溶解后,加适量去离子水定容,配置成不同质量浓度的ABA溶液(1、2、3、4、5 mg/L)。配置材料高温灭菌后于4 ℃冰箱保存备用。
1.3 外源诱导剂的处理
1.3.1 蔗糖对悬浮细胞的诱导处理
将培养至第11天的细胞按照5%~10%的比例接种于含100 mL WPM液体培养基的三角瓶(250 mL)中,将5种质量浓度的蔗糖溶液分别添加到液体培养基中,以含有20 g/L蔗糖的WPM培养基作为对照组。每个处理设置3个重复,诱导培养7 d后取样,测定细胞生物量(细胞鲜重、干重)及花青素含量。培养条件为:培养液的初始pH值为5.6~6.0,120 r/min、25 ℃恒温摇床培养。
1.3.2 茉莉酸甲酯和ABA对悬浮细胞的诱导处理
将培养至第11天的细胞按照5%~10%的比例接种于含100 mL WPM液体培养基的三角瓶(250 mL)中,将5种质量浓度的茉莉酸甲酯溶液及5种质量浓度的ABA溶液经0.22 μm微孔滤膜过滤,按每瓶1.0 mL添加到培养基中作为诱导处理组,分别以添加1.0 mL无菌水、1.0 mL无水乙醇的培养基作为对照组。每个处理设置3个重复,诱导培养7 d后取样,培养条件如1.3.1,测定细胞生物量及花青素含量。
1.3.3 温度对悬浮细胞的诱导处理
将培养至第11天的悬浮细胞按照5%的比例接种于含100 mL WPM液体培养基的三角瓶(250 mL)中,置于摇床中。在温度分别为16 ℃、25 ℃、40 ℃,培养液初始pH值为5.6~6.0,摇床转速为120 r/min的条件下培养细胞,以25 ℃的悬浮细胞液作为对照组。每个处理设置3个重复,诱导培养7 d后取样,测定细胞生物量以及花青素含量。
1.3.4 外源激素和温度对悬浮细胞的复合处理
将培养至第11天的细胞按照5%~10%的比例接种于含100 mL WPM液体培养基的三角瓶(250 mL)中,低温+蔗糖/茉莉酸甲酯/ABA作为诱导处理,以添加1.0 mL无菌水或1.0 mL无水乙醇的培养基作为对照组。每个处理设置3个重复,诱导培养7 d后取样,测定细胞生物量及花青素含量。
1.4 细胞生物量的测定
细胞鲜重:将悬浮细胞摇匀后倒入抽滤瓶中进行抽滤,期间用超纯水冲洗细胞,抽滤至滤纸不再滴水,此时的重量计为细胞鲜重[23]。
细胞干重:将抽滤后的细胞置于60 ℃ 烘箱中烘干24 h,称重记为细胞干重。
1.5 花青素含量的测定
花青素含量的测定参考Zhang等[7]的方法。称取鲜重0.15 g的黑果枸杞悬浮细胞,加入50%冰醋酸,旋转振荡摇匀后,黑暗条件浸提1 h。提取液在8 000 r/min条件下离心10 min,经0.22 μm微孔滤膜过滤后收集上清液,得到花青素提取液。取1 mL花青素提取液加入3 mL Mcllvaine缓冲液(14.7 g/L Na2HPO4·2H2O 和16.7 g/L无水柠檬酸,pH 3.0),在535 nm波长下测定吸光度,以V50%冰醋酸∶VMcllvaine缓冲液=1∶3的溶液作为空白对照,以色度值代表悬浮细胞的花青素相对含量。花青素相对含量和花青素相对产量按如下公式[24]进行计算:
花青素相对含量=0.1×吸光度×稀释因子,
花青素相对产量=细胞鲜重×花青素相对含量。
式中稀释因子为80。
1.6 pH值的测定
每隔3 d对黑果枸杞悬浮细胞的pH值进行测定。取5~10 mL培养物于试管,先用蒸馏水清洗电极,再用培养物清洗后,把电极浸入被测溶液中读取pH值。3次重复测定取平均值。
1.7 数据处理与分析
用Excel 2010、Origin Pro Lab 2023软件对数据进行整理和作图,用SPSS 24.0对数据进行统计分析,采用Duncan法比较数据的组间差异,显著性水平设定为P<0.05。
2 结果与分析
2.1 黑果枸杞愈伤组织的诱导情况
WPM培养基中添加 0.5 mg/L KT+2.0 mg/L 2,4-D+20.0 g/L蔗糖+5.0 g/L琼脂对诱导黑果枸杞外植体愈伤组织的效果最佳,优化后的继代愈伤组织诱导最佳培养基为WPM+0.5 mg/L KT+2.0 mg/L 2,4-D+0.1 mg/L萘乙酸(NAA)+20.0 g/L蔗糖+6.0 g/L琼脂。在该培养条件下,愈伤组织具有旺盛的自我增殖能力,容易散碎且速度快,组织块大。最初形成的愈伤组织为绿色,先端有紫色。愈伤组织从外植体上剥离后,在继代培养基上每18~25 d 继代1次。随着继代次数的增加,初代愈伤组织中的紫色逐渐消失。经过3次继代后,可得到适于悬浮培养的黄绿色、蓬松愈伤组织,接种成活率为100%(图1)。

图1 黑果枸杞愈伤组织的诱导
2.2 黑果枸杞悬浮细胞体系的建立
在WPM液体培养基中添加 0.5 mg/L KT+2.0 mg/L 2,4-D+0.01 mg/L NAA+30 g/L蔗糖,该条件下黑果枸杞悬浮细胞的生长曲线呈“S”形,如图2所示,可分为迟缓期(0~8 d)、对数生长期(8~18 d)和减速期(18~22 d)。在0~8 d期间,细胞生长缓慢,活细胞数量增加较慢;在8~18 d期间,细胞处于对数生长期,活细胞数量迅速增加;18 d后,活细胞数量减少,生长减缓。活细胞数量在悬浮培养第18天时达到峰值,约为7.93×105个/mL。在后续继代过程中,每50 mL接种量添加 2~5 g愈伤组织,可快速建立起生长稳定的悬浮细胞培养体系。为保持较高的细胞分裂能力和细胞活性,继代培养最佳时间为18 d。
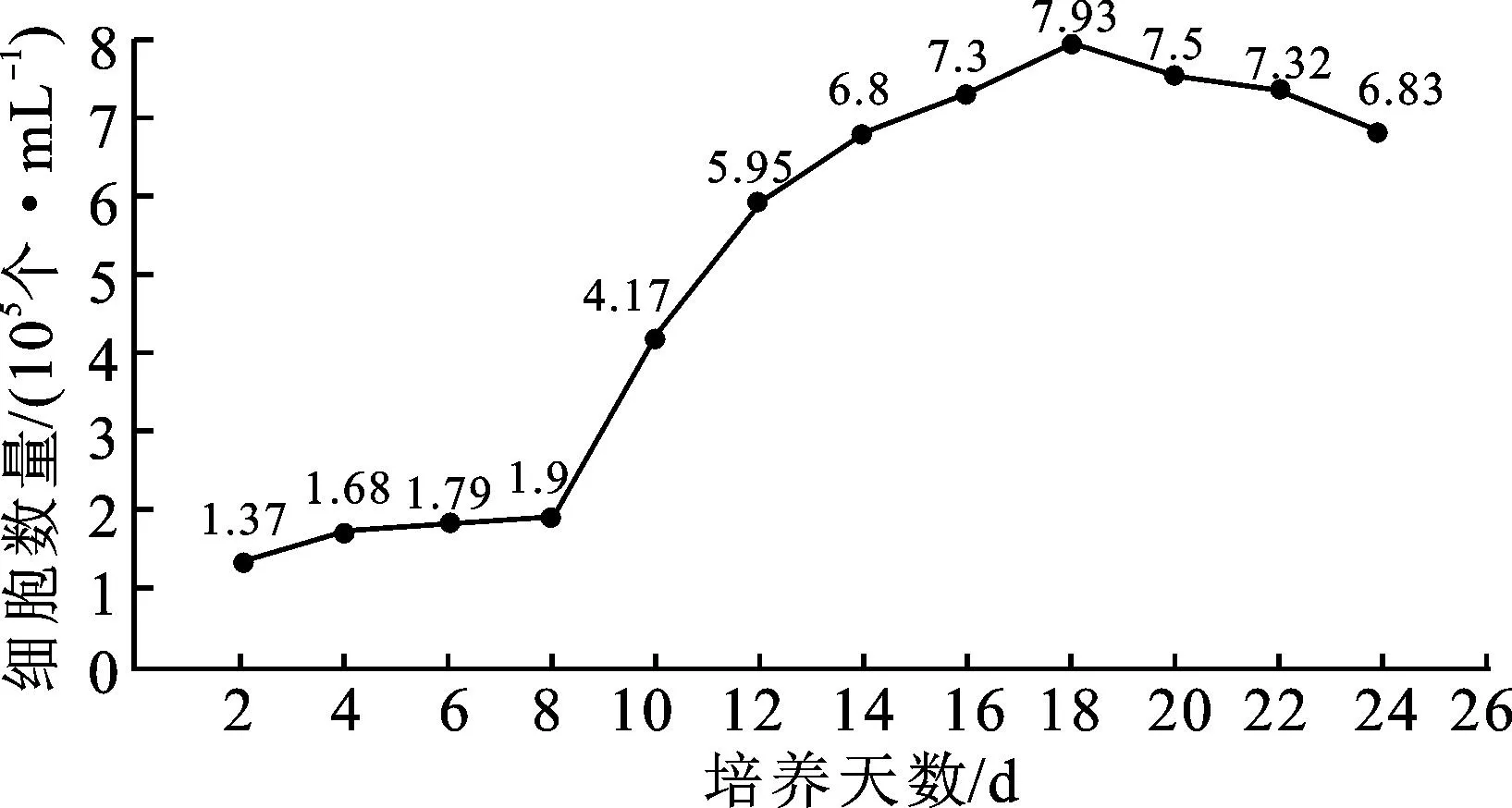
图2 黑果枸杞悬浮细胞生长曲线
2.3 外源诱导子对黑果枸杞悬浮细胞中花青素积累的影响
2.3.1 外源诱导子对悬浮细胞生物量的影响
由图3所示,不同种类和质量浓度的外源激素对黑果枸杞悬浮细胞生物量具有显著影响。以含有20 g/L蔗糖的WPM培养基作为对照,6、12、30 g/L蔗糖处理的细胞鲜重分别为102.84±0.23 g、148.39±0.87 g、161.73±0.80 g,较对照组分别显著降低45.96%、22.02%、15.01%(P<0.05);6、12、30 g/L蔗糖处理的细胞干重分别为2.34±0.14 g、3.38±0.31 g、3.68±0.09 g,较对照组分别显著降低85.04%、28.23%、17.66%(P<0.05)。可见,6、12、30 g/L蔗糖诱导能够显著抑制黑果枸杞悬浮细胞的生物量。经50、100、200 mg/L 茉莉酸甲酯处理后,悬浮细胞的鲜重分别为204.39±4.52 g、242.13±2.16 g、217.79±2.69 g,较对照组分别显著升高了10.77%、31.22%、18.03%(P<0.05);悬浮细胞的干重分别为4.68±0.10 g、5.55±0.05 g、4.99±0.06 g,较对照组分别显著升高了10.72%、31.21%、17.97%(P<0.05)。经1、2 mg/L ABA处理后,悬浮细胞的鲜重分别为235.83±1.77 g和316.46±1.94 g,与对照组相比分别显著升高18.42%和58.91%(P<0.05);悬浮细胞干重分别为7.40±0.36 g和9.93±0.61 g,与对照组相比分别显著升高18.38%和58.90%(P<0.05)。经3、4、5 mg/L ABA处理的细胞鲜重与对照组相比分别显著降低28.68%、33.59%、45.80%(P<0.05),细胞干重与对照组相比分别显著降低28.63%、33.62%、45.51%(P<0.05)。由此可见,1 mg/L和2 mg/L ABA处理能够显著增加黑果枸杞悬浮细胞的生物量,而高浓度ABA会抑制黑果枸杞悬浮细胞的生长。
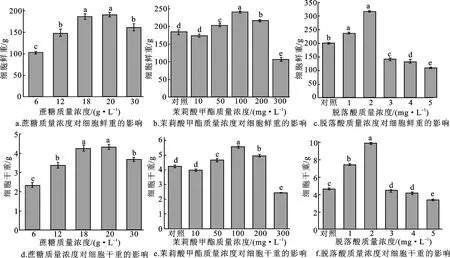
图3 不同质量浓度的诱导子对黑果枸杞悬浮细胞生物量的影响
2.3.2 外源诱导子对悬浮细胞花青素积累的影响
如图4所示,不同质量浓度的外源诱导子对黑果枸杞悬浮细胞花青素含量的积累有显著影响。在蔗糖处理组,30 g/L蔗糖处理效果最佳,悬浮细胞中花青素相对含量最高,为6.72±0.07,与20 g/L蔗糖组相比提升了53.35%。在茉莉酸甲酯处理组,100、200、300 mg/L 茉莉酸甲酯处理组的花青素相对含量较对照组分别提升14.85%、42.00%、16.47%(P<0.05),200 mg/L茉莉酸甲酯的诱导效果最优。在1 mg/L和2 mg/L ABA处理组,花青素相对含量分别为6.61±0.09和6.55±0.06,与对照组相比分别显著升高64.02%和62.53%(P<0.05);而在3 mg/L、4 mg/L和5 mg/L ABA处理组,花青素相对含量与对照组相比分别显著降低42.43%、40.45%和72.95%(P<0.05)。可见,1 mg/L和2 mg/L ABA处理能够显著促进黑果枸杞悬浮细胞中的花青素积累。
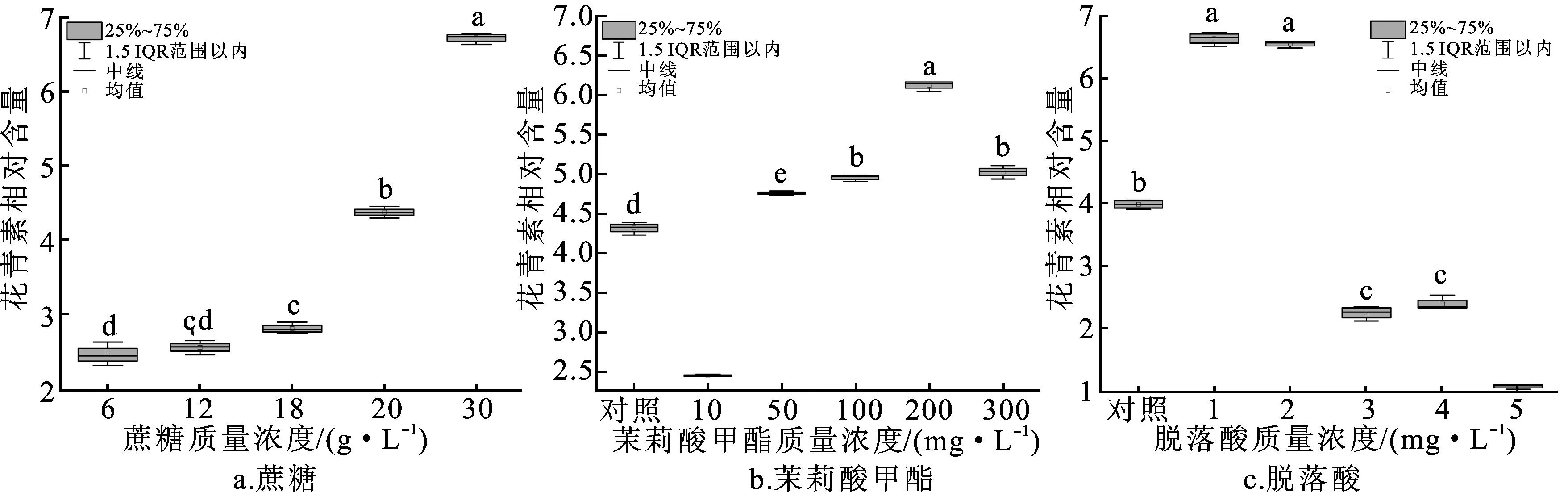
图4 不同外源诱导子对黑果枸杞悬浮细胞中花青素相对含量的影响
如图5所示,不同外源诱导子对黑果枸杞悬浮细胞中花青素相对产量均具有显著影响。在30 g/L蔗糖处理组,悬浮细胞的花青素相对产量为1 086.26±34.48,与对照组相比提高30.33%,可见30 g/L蔗糖添加能够显著提高黑果枸杞悬浮细胞的花青素产量。在50、100和200 mg/L茉莉酸甲酯处理组,花青素相对产量比对照组分别提升22.08%、50.71%和67.60%,其中,200 mg/L茉莉酸甲酯能显著促进黑果枸杞悬浮细胞的花青素产量。在1 mg/L和2 mg/L ABA处理组,花青素相对产量分别为 1 558.86±22.24和2 072.84±14.93,与对照组相比分别显著升高94.23% 和158.27%(P<0.05);而3 mg/L、4 mg/L和5 mg/L ABA处理组的花青素相对产量比对照组显著降低58.94%、60.45%和582.21%(P<0.05)。可见,1 mg/L和2 mg/L ABA更有利于黑果枸杞悬浮细胞中的花青素产量提升。
2.4 温度对黑果枸杞悬浮细胞中花青素积累的影响
如图6所示,在16 ℃和40 ℃处理组黑果枸杞悬浮细胞的鲜重分别为210.92±8.06 g和192.71±6.07 g,与对照组(25 ℃,207.05±14.36 g)相比分别降低3.03%和8.63%;两组的细胞干重分别为4.19±0.16 g和3.95±0.10 g,与对照组相比分别降低5.20%和10.63%。实验结果表明,16 ℃和40 ℃处理会抑制黑果枸杞悬浮细胞的生物量,但抑制效果不显著。
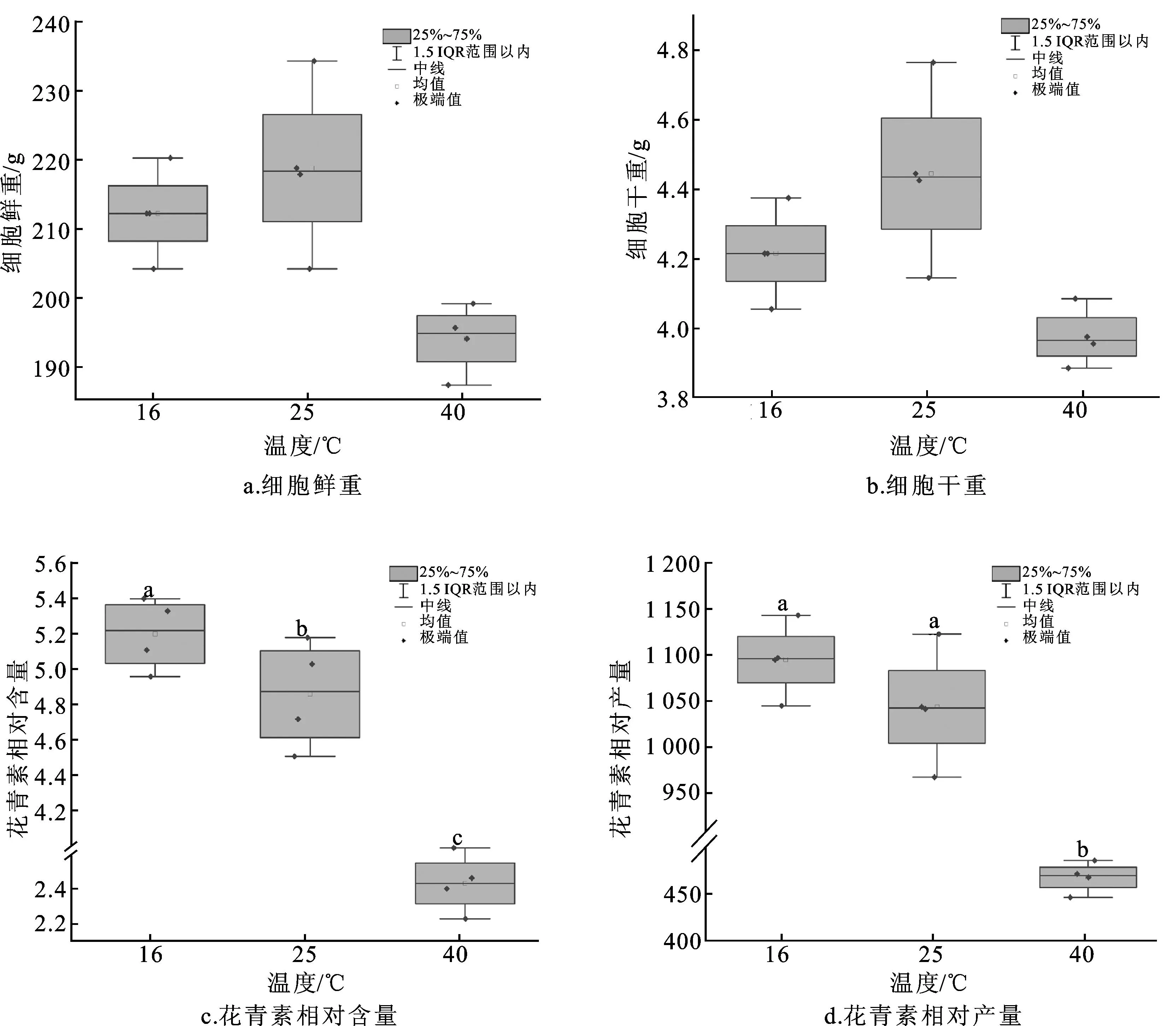
图6 温度对黑果枸杞悬浮细胞生物量及花青素积累的影响
在16 ℃处理组,黑果枸杞悬浮细胞的花青素相对含量为5.15±0.26,较对照组(25 ℃,2.76±0.36)显著提升86.59%(P<0.05);花青素相对产量为1 086.24±48.88,较对照组提升4.91%。在40 ℃处理组,黑果枸杞悬浮细胞的花青素相对含量为2.38±0.13,较对照组显著下降15.96%(P<0.05);花青素相对产量较对照组下降55.70%。由此可见,16 ℃处理可显著增加黑果枸杞悬浮细胞的花青素含量(P<0.05)。
2.5 低温和外源激素复合处理对花青素积累的影响
复合诱导处理与单一诱导处理相比,具有效果强、产量高、底物选择性强的特点,为通过植物细胞团培养生产次生代谢活性化合物提供了有效途径。本研究利用筛选出的最优浓度外源激素(30 g/L蔗糖、200 mg/L茉莉酸甲酯、2 mg/L ABA)和16 ℃的温度条件对黑果枸杞悬浮细胞进行复合处理,探索复合处理对细胞生物量和花青素积累的影响。
2.5.1 复合处理对悬浮细胞生物量的影响
如图7所示,16 ℃单独处理对黑果枸杞细胞生物量影响不显著,16 ℃+30 g/L蔗糖、16 ℃+200 mg/L茉莉酸甲酯和16 ℃+2 mg/L ABA复合处理均会显著抑制细胞生长,其中16 ℃+2 mg/L ABA对悬浮细胞的生物量抑制效果最明显,细胞鲜重由对照组的217.24 g降至90.09 g,细胞干重由4.22 g降至1.75 g。
2.5.2 复合处理对花青素积累的影响
在16 ℃单独处理组,黑果枸杞细胞的花青素相对含量由4.11增加至5.15,较对照组增加了25.30%;花青素相对产量则由892.86增加至1 086.43,较对照组增加21.68%。在16 ℃+200 mg/L茉莉酸甲酯复合处理组,花青素相对含量由4.11增加至 6.27,提高1.53倍(P<0.05);花青素相对产量由892.86增加至1 223.95,提高1.37倍(P<0.05)。此外,与对照组相比,16 ℃+30 g/L蔗糖复合处理组花青素产量提升3.87%,而16 ℃+2 mg/L ABA复合处理会显著抑制悬浮细胞的花青素产量(图7)。
3 讨论
植物细胞培养技术已成为工业化生产天然产物的有效途径之一,建立高效、稳定的悬浮细胞系是植物细胞大规模培养的前提[25]。用于建立悬浮细胞系的愈伤组织要有较好的松散性和再生能力,本实验的研究结果表明,黑果枸杞的愈伤组织具有旺盛的自我增殖能力,容易散碎且速度快,易诱导培养出黄绿色、蓬松的愈伤组织,适合建立悬浮细胞系。
植物细胞培养过程中次生代谢产物的产率通常较低,这在很大程度上限制了植物细胞培养的产业化。目前,提高植物细胞培养中次生代谢产物产量的方法主要包括优化培养条件、添加前体和外源激素以及改进培养方法等。Hao等研究发现喷施外源ABA能显著促进银杏悬浮细胞花青素化合物的合成与积累[26]。在胀果甘草悬浮培养细胞中添加茉莉酸甲酯能显著诱导甘草总黄酮的合成,其最大产量达到对照的3.39倍[27]。30 g/L的蔗糖能促进葡萄悬浮细胞中花青素积累,而7.5 g/L和15 g/L的蔗糖则抑制花青素的积累[28]。这些研究结果表明添加外源激素可以提高悬浮培养细胞中花青素的含量。本研究建立和优化了黑果枸杞悬浮培养细胞的培养条件,活细胞数量在悬浮培养第18天时达到峰值。30 g/L蔗糖、200 mg/L 茉莉酸甲酯、2 mg/L ABA单一处理均能显著促进悬浮细胞花青素产量的提升,其中ABA的处理效果最佳,这与前人的研究结果一致,表明有望通过添加外源激素来提升黑果枸杞悬浮细胞中花青素的含量和产量。
此外,许多研究表明,2种或多种提高次生代谢产物产量的外源诱导子复合,在提高次生代谢产物产量方面具有协同或相加效应[29-31]。常志凯等发现在高温胁迫1 d后再加入茉莉酸甲酯的复合处理对白桦细胞次生代谢产物总三萜合成的诱导作用最强,且三萜合成酶基因的相对表达量都不同程度的高于单独高温处理[32]。本研究探究低温和外源激素复合作用对黑果枸杞悬浮细胞生产花青素的影响。不同外源激素对细胞中花青素积累均具有一定的促进作用,200 mg/L 茉莉酸甲酯、2 mg/L ABA处理能在提高黑果枸杞细胞生物量的同时促进花青素的积累,最高产量为对照的2.32倍。在16 ℃和3种外源激素的复合处理下,16 ℃和茉莉酸甲酯的复合处理能够显著促进悬浮细胞花青素的积累,单位鲜细胞花青素含量较对照提高1.53倍,花青素产量较对照提高1.37倍。实验结果表明在植物细胞培养生产次生代谢产物的过程中,低温和诱导子的联合作用对次生代谢物产量的提高具有重要价值。
4 结论
本研究以黑果枸杞无菌苗的叶片为外植体诱导愈伤组织并建立细胞悬浮体系。愈伤组织诱导的最佳培养体系为WPM+0.5 mg/L激动素+2.0 mg/L 2,4-二氯苯氧乙酸+20.0 g/L蔗糖+6.0 g/L琼脂,悬浮细胞培养的最优体系为WPM+0.5 mg/L激动素+2.0 mg/L 2,4-二氯苯氧乙酸+0.01 mg/L萘乙酸+20.0 g/L蔗糖;活细胞数量在第18 d时达到峰值,为7.93×105个/mL。在30 g/L蔗糖、200 mg/L茉莉酸甲酯、2 mg/L脱落酸及16 ℃单一处理下,黑果枸杞悬浮细胞的花青素含量均显著增加,其中,2 mg/L脱落酸诱导效果最佳;在200 mg/L茉莉酸甲酯+16 ℃的复合诱导处理下,黑果枸杞悬浮细胞的花青素产量显著增加。今后可通过优化黑果枸杞悬浮细胞的培养体系及添加外源激素进一步调控悬浮细胞花青素的积累,为利用悬浮细胞系等离体培养体系开发黑果枸杞植物资源奠定了基础。
