基于(4+1)环化反应绿色合成新型吡咯及其衍生物
2024-02-28付雪菊何享鸿
付雪菊, 徐 可, 韩 波, 何享鸿
(成都中医药大学 药学院 西南特色中药资源国家重点实验室,四川 成都 611137)
吡咯具有抗菌[1]、抗真菌[2]、降胆固醇[3]、抗炎[4]、抗氧化[5]和抗肿瘤[6]等显著的生物和药理活性,还可以作为酶抑制剂,如逆转录病毒的逆转录酶(人类免疫缺陷病毒Ⅰ型),聚合酶(ADP-核糖)[7],脯氨酸-4-羟基化酶[8],细胞DNA聚合酶,糖原合成酶激酶-3(GSK-3)[9]和蛋白激酶[10]。由此可见,吡咯及其衍生物在临床治疗中具有多样性和有效性。因此,许多研究人员一直致力于挖掘吡咯骨架在疾病治疗中的潜力。例如,从心叶青牛胆草中分离提取的天然产物3,4-二羧酸酯吡咯被证明可恢复MDA-MB-231细胞中的p53活性,从而有效诱导ROS和线粒体介导的细胞凋亡,并且还在小鼠体内诱导EAT细胞死亡,从而抑制肿瘤增殖[11]; NISHIDA课题组[12]合成的多取代吡咯衍生物通过可逆地和K+竞争性离子结合,表现出强效的H+,K+-ATP酶抑制活性,能抑制胃酸分泌,具有潜在的抗溃疡作用; KANG课题组[13]合成了一系列3-甲酰胺多取代吡咯衍生物。由于该类化合物与5-HT2A、 5-HT2C受体和5-HT转运蛋白具有良好的亲和力,因此被认为可以作为一类新型抗抑郁药继续研究。
2-烯丙基丙二腈是缺电子烯烃[14-15],常作为1,2-偶极子、1,4-偶极子或1,5-偶极子参与环加成反应,因而被广泛应用于天然产物和药物分子的合成中,如图1(a)所示。例如,2-烯丙基丙二腈作为1,2-偶极子与重氮化合物之间发生的(2+1)环加成,能以非对映发散的方式有效合成各种官能团环丙烷[16]。同时,还可以作为1,5-偶极子,如2-烯丙基丙二腈与亚胺碘烷N1合成子经过1,6-氮杂迈克尔加成发生(5+1)环化反应,进而合成2-氨基吡啶[17]。除此之外,钯催化的乙烯碳酸酯与2-烯丙基丙二腈经过区域发散的(4+5)环化反应能有效获得高产率的九元环产物[18]。然而,2-烯丙基丙二腈作为1,4-偶极子的(4+1)环化研究较少。此外,硫亚胺是亚硫醚的氮类似物,也被称为硫-氮叶立德。该结构中存在易变的SIV=N键,亲核和亲电试剂都可以在该键上反应。水作为自然界常见的质子溶剂,由于其对大多数有机化合物的溶解效果较差,很少作为最佳溶剂应用于有机反应中,但是水具有经济性、安全性和良好的生物相容性等优良特性,因此水被认为是一种理想的可再生绿色溶剂。
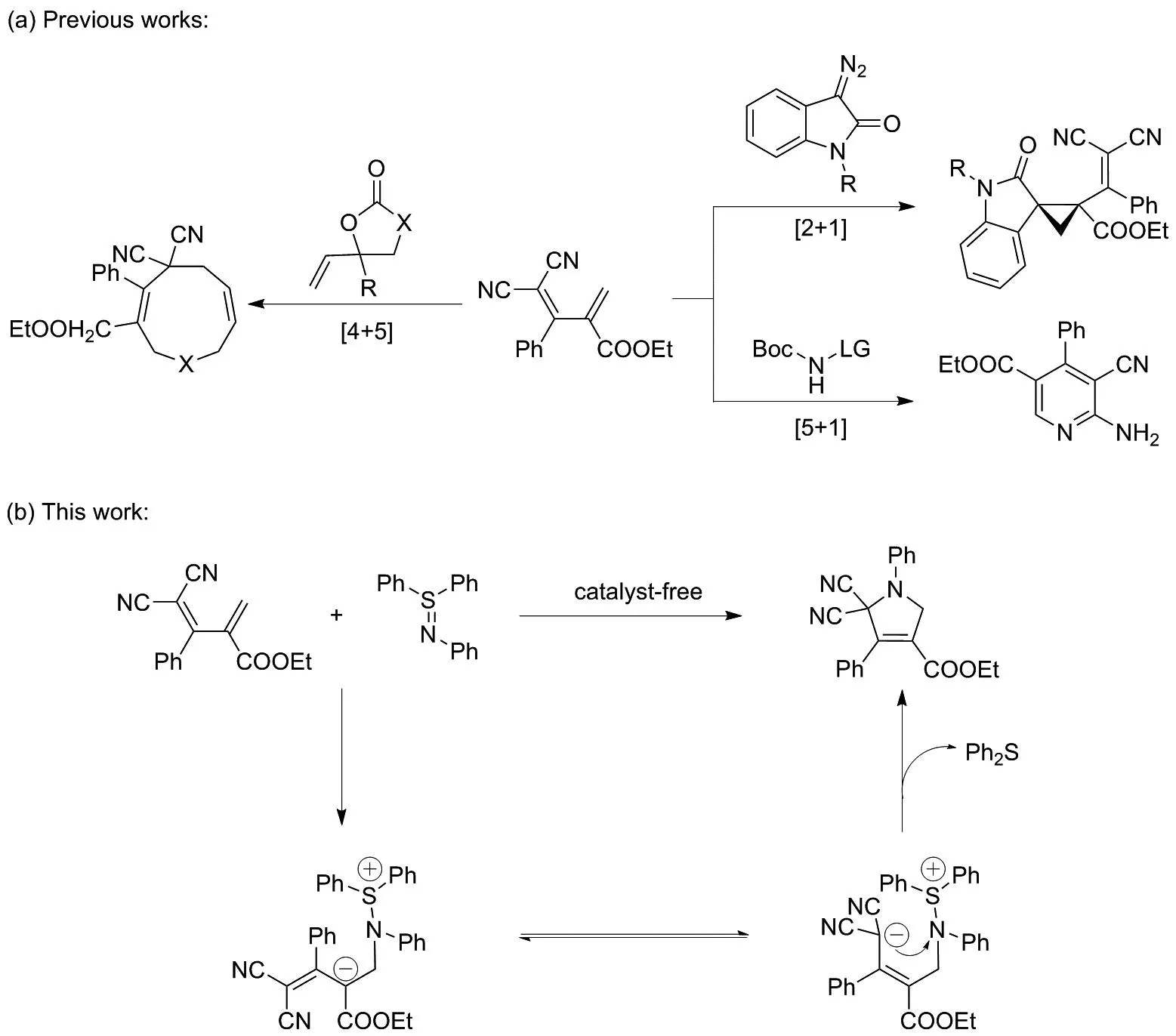
图1 2-烯丙基丙二腈环加成反应Figure 1 Cycloaddition reaction of 2-allylmalononitrile
基于此,本研究首次以水为溶剂,利用2-烯丙基丙二腈作为C4合成子与硫亚胺成功构建(4+1)环加成反应,生成新型5,5-二氰基-3-羧酸乙酯吡咯,如图1(b)所示。并在最佳条件下对底物的普适性进行探究,合成了9个不同取代的多取代吡咯3a~3i(图2)。
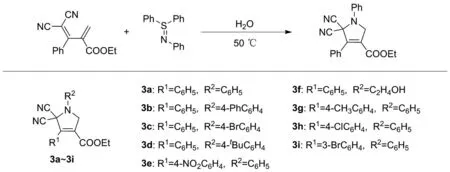
图2 (4+1)环化反应普适性考察Figure 2 Study on the universal of (4+1) cyclization reaction
1 实验部分
1.1 仪器与试剂
BUCHI M-565型熔点仪; Bruker-600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); Agilent G1969-85000型质谱仪。
二苯硫醚,苯胺,4-溴苯胺,4-苯基苯胺,4-叔丁基苯胺,乙醇胺,苯甲醛,4-氯苯甲醛,3-溴苯甲醛,4-硝基苯甲醛,4-甲基苯甲醛,丙二腈,分析纯,上海麦克林生化科技有限公司;无水二氯甲烷,甲苯,碳酸钾,三苯基膦,无水乙醇,国药集团化学试剂有限公司;自来水。
化合物1a[19]和2a[20]按文献方法合成。
1.2 3a~3i的合成
将1a(25 mg, 0.12 mmol)、S,S-二苯基硫亚胺2a(27 mg, 0.10 mmol)依次加入反应试管中。用水作溶剂(1.00 mL),于50 ℃油浴加热条件下反应3~4 h(TLC监测)。经硅胶柱层析(洗脱剂:石油醚 ∶乙酸乙酯=20 ∶1,V∶V)纯化得固体3a~3i。
5,5-二氰基-1,4-二苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3a):黄色固体,收率73%, m.p.139~142 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.47(dd,J=8.4 Hz, 1.8 Hz, 2H), 7.45~7.42(m, 2H), 7.41~7.38(m, 1H), 7.38~7.33(m, 2H), 7.20(t,J=7.2 Hz, 2H), 7.02(d,J=7.5 Hz, 1H), 4.53(s, 2H), 4.09(q,J=7.2 Hz, 2H), 0.96(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 161.1, 142.8, 141.0, 129.7, 129.1, 128.9, 128.1, 125.7, 121.5, 117.3, 115.1, 113.7, 63.4, 62.3, 41.5, 13.4; HR-MS(ESI-TOF)m/z: calcd for C21H17N3NaO2{[M+Na]+}366.1218, found 366.1208。
1-(4-苯基)-苯基-5,5-二氰基-4-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3b):白色固体,收率72%, m.p.113~116 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.81(d,J=8.4 Hz, 1H), 7.68(s, 1H), 7.48(t,J=8.4 Hz, 4H), 7.40(d,J=7.2 Hz, 2H), 7.36(td,J=7.8 Hz, 1.8 Hz, 4H), 7.27(t,J=7.2 Hz, 1H), 6.99(d,J=8.4 Hz, 1H), 4.49(s, 2H), 4.05(q,J=7.2 Hz, 2H), 0.92(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 160.1, 158.9, 140.8, 139.7, 138.9, 137.4, 133.6, 129.7, 128.6, 128.1, 127.9, 127.3, 127.1, 126.5, 125.9, 120.4, 112.7, 62.2, 61.3, 40.4, 12.4; HR-MS(ESI-TOF)m/z: calcd for C27H21N3NaO2{[M+Na]+}422.1531, found 422.1527。
1-(4-溴苯基)-5,5-二氰基-4-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3c):黄色固体,收率69%, m.p.119~121 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.84(d,J=7.2 Hz, 2H), 7.71(s, 1H), 7.60~7.49(m, 1H), 7.47(t,J=7.8 Hz, 2H), 7.37(d,J=6.6 Hz, 3H), 4.44(s, 1H), 4.03(q,J=7.2 Hz, 2H), 0.92(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 158.9, 140.8, 133.6, 131.7, 129.7, 128.6, 128.3, 127.9, 127.1, 121.9, 117.6, 115.3, 112.5, 62.2, 61.4, 40.5, 12.4; HR-MS(ESI-TOF)m/z: calcd for C21H16BrN3NaO2{[M+Na]+}444.0324, found 444.0320。
1-(4-(叔丁基)苯基)-5,5-二氰基-4-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3d):白色固体,收率77%, m.p.103~106 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.83(d,J=7.2 Hz, 1H), 7.46(t,J=7.8 Hz, 1H), 7.39(d,J=7.2 Hz, 2H), 7.31(d,J=7.2 Hz, 1H), 7.28(d,J=8.4 Hz, 2H), 6.88(d,J=8.4 Hz, 2H), 4.41(s, 2H), 4.01(q,J=7.2 Hz, 2H), 1.23(s, 9H), 0.86(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 158.9, 147.9, 139.1, 133.6, 129.7, 128.7, 128.6, 128.0, 127.8, 127.1, 125.5, 120.3, 112.8, 62.4, 61.2, 40.4, 33.5, 30.3, 12.3; HR-MS(ESI-TOF)m/z: calcd for C25H25N3NaO2{[M+Na]+}422.1844, found 422.1839。
5,5-二氰基-4-(4-硝基苯基)-1-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3e):黄色固体,收率71%, m.p.121~123 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.47(t,J=7.8 Hz, 1H), 7.35~7.24(m, 4H), 7.15(t,J=7.8 Hz, 1H), 7.06~7.01(m, 1H), 7.00(d,J=7.2 Hz, 2H), 4.40(s, 2H), 4.08(q,J=7.2 Hz, 2H), 0.96(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 159.8, 141.6, 139.7, 133.6, 129.7, 128.8, 128.6, 126.5, 126.4, 126.1, 125.2, 121.2, 112.6, 61.9, 61.5, 40.2, 12.5; HR-MS(ESI-TOF)m/z: calcd for C21H16N4NaO4{[M+Na]+}411.1069, found 411.1066。
5,5-二氰基-1-(2-羟基乙基)-4-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3f):白色固体,收率77%, m.p.101~104 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.39~7.24(m, 5H), 5.18(s, 1H), 4.67(d,J=4.8 Hz, 2H), 4.62~4.54(m, 2H), 4.05(q,J=7.2 Hz, 2H), 3.94~3.91(m, 2H), 0.97(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 161.1, 151.8, 135.2, 132.7, 129.6, 128.0, 127.8, 116.2, 115.2, 82.3, 79.1, 68.3, 60.4, 50.8, 13.6; HR-MS(ESI-TOF)m/z: calcd for C17H17N3NaO3{[M+Na]+}334.1168, found 334.1159。
5,5-二氰基-1-苯基-4-(p-甲苯基)-2,5-二氢-1H-吡咯-3-羧酸乙酯(3g):白色固体,收率69%, m.p.99~101 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.41(d,J=6.6 Hz, 1H), 7.38(s, 1H), 7.33~7.30(m, 2H), 7.29~7.25(m, 2H), 6.93(t,J=7.2 Hz, 1H), 6.89(dd,J=8.4 Hz, 1.8 Hz, 2H), 4.13(q,J=7.2 Hz, 2H), 3.99(s, 2H), 2.41(s, 3H), 0.98(t,J=7.2 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 156.4, 142.5, 139.3, 138.9, 129.3, 128.9, 128.6, 124.4, 123.2, 118.5, 116.0, 115.7, 115.6, 77.0, 59.9, 50.9, 21.4, 14.4; HR-MS(ESI-TOF)m/z: calcd for C22H19N3O2{[M+H]+}357.1477, found 357.1471。
4-(4-氯苯基)-5,5-二氰基-1-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3h):黄色固体,收率73%, m.p.119-122 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.39~7.32(m, 4H), 7.30(t,J=7.2 Hz, 2H), 6.93(t,J=7.8 Hz, 1H), 6.89(dd,J=7.8 Hz, 1.8 Hz, 2H), 4.57(s, 2H), 4.14(q,J=8.4 Hz, 2H), 1.04(t,J=7.8 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 158.4, 142.5, 138.3, 134.8, 129.7, 129.5, 128.9, 128.5, 126.3, 124.8, 123.2, 118.5, 116.0, 77.0, 60.1, 50.9, 14.4; HR-MS(ESI-TOF)m/z: calcd for C21H16ClN3NaO2{[M+Na]+}400.0829, found 400.0823。
4-(3-溴苯基)-5,5-二氰基-1-苯基-2,5-二氢-1H-吡咯-3-羧酸乙酯(3i):白色固体,收率62%, m.p.131~133 ℃;1H NMR(600 MHz, Chloroform-d)δ: 7.69(t,J=1.5 Hz, 1H), 7.61~7.48(m, 2H), 7.31(t,J=7.8 Hz, 3H), 6.95(t,J=7.2 Hz, 1H), 6.88(dd,J=7.8 Hz, 1.2 Hz, 2H), 4.45(s, 2H), 4.14(q,J=7.2 Hz, 2H), 1.01(t,J=7.8 Hz, 3H);13C NMR(151 MHz, CDCl3)δ: 166.3, 142.8, 140.0, 132.7, 131.9, 130.3, 129.6, 128.8, 126.7, 126.7, 124.3, 123.1, 118.6, 115.8, 115.5, 76.8, 60.3, 50.9, 14.4; HR-MS(ESI-TOF)m/z: calcd for C21H16BrN3NaO2{[M+Na]+}444.0324, found 444.0317。
2 结果与讨论
2.1 反应条件优化
为提高5,5-二氰基-3-羧酸乙酯吡咯骨架化合物的收率,考察了溶剂、温度和添加剂对反应收率的影响。首先对溶剂进行筛选,从表1可以看出,非质子溶剂相比质子溶剂反应良好,尤其以具有经济性、安全性和良好的生物相容性的H2O作为溶剂时,目标产物收率可以达到71%(Entry 6)。进一步筛选温度,可以看出,该反应在常温下几乎不反应;温度为50 ℃时反应收率为73%;设定反应时间为4 h,在反应温度超过50 ℃时,目标产物收率基本保持稳定(Entries 6, 9~10),然而当温度为40 ℃时,收率明显下降,为59%(Entry 8)。考虑到质子酸可能会增强2-烯丙基丙二腈的缺电性,本文进行了质子酸类添加剂的筛选,包括醋酸、三氯化铝、对甲苯磺酸和苯甲酸。在以H2O作为溶剂,反应温度为50 ℃时,这4种质子酸对反应没有明显影响(Entries 11~14)。综上所述,溶剂、温度对该反应有明显影响,最佳反应条件为:在温度为50 ℃的条件下,以水为溶剂进行反应。
2.2 反应机理
在不同取代的5,5-二氰基-3-羧酸乙酯吡咯烷产物合成中,所有反应均显示出单一的化学选择性。质谱上监测到反应过程中S,S-二苯基硫亚胺进攻2-烯丙基丙二腈产生的过渡态,并且随着反应时间的增加,峰值逐渐减小。因此推断,该反应为直接进行(4+1)环化生成吡咯产物。S,S-二苯基硫亚胺在50 ℃下被活化,发生亲核反应,进攻缺电子烯烃末端,然后电子发生转移,进一步进行环加成,同时脱去二苯硫醚,最终得到多取代吡咯产物。在该反应中,S,S-二苯基硫亚胺的N上无论是连着吸电子基团还是供电子基团都有良好的收率。由此可以得出,该反应具有良好的底物耐受性,不受电子效应影响。
本文探究了2-烯丙基丙二腈在1,4-偶极环化的新反应模式,开发了2-烯丙基丙二腈与S,S-二苯基硫亚胺直接(4+1)环化反应,以较好收率成功构建了一类新型多取代吡咯化合物(3a~3i)。该反应具有反应条件温和,化学选择性单一的特征。
