新型磺酰基吲哚萘醌类化合物的合成及其光物理性质
2024-02-28李福裕黄东伟王继宇1
胥 红, 汪 蓓, 李福裕, 肖 瑶, 黄东伟, 王继宇1,*
(1. 中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100049; 3. 西华大学 化学系,四川 成都 610039)
醌类化合物广泛分布于自然界中,是许多天然药物的有效成分,具有抗癌、抗疟疾、抗炎和抗菌等多种生物活性[1-2],而且具有独特的光物理性质。目前,醌类化合物的官能化已得到广泛研究,已有多种方式实现醌类化合物的烷基化、芳基化、酰基化和三氟甲基化[3-9]。研究发现,芳基磺酰基醌类化合物及其类似物具有良好的生物活性,是大肠杆菌FABH酶的有效抑制剂,其中,2-(4-甲基苯磺酰基)-1,4-萘醌对结核分枝杆菌FABH(mTFABH)具有较好的抗结核活性(图1)[10]。目前关于醌类化合物的直接磺酰基化生成磺酰基醌类衍生物的报道仅有2例。2014年和2016年,王大伟等[10]和黄年玉等[11]分别报道了采用Pd或Ir催化剂直接实现萘醌与磺酰氯的偶联,构建了一系列磺酰基醌衍生物,如图2(a)所示。因此,开发新的便捷、高效的方法构建磺酰基醌衍生物具有重要意义。
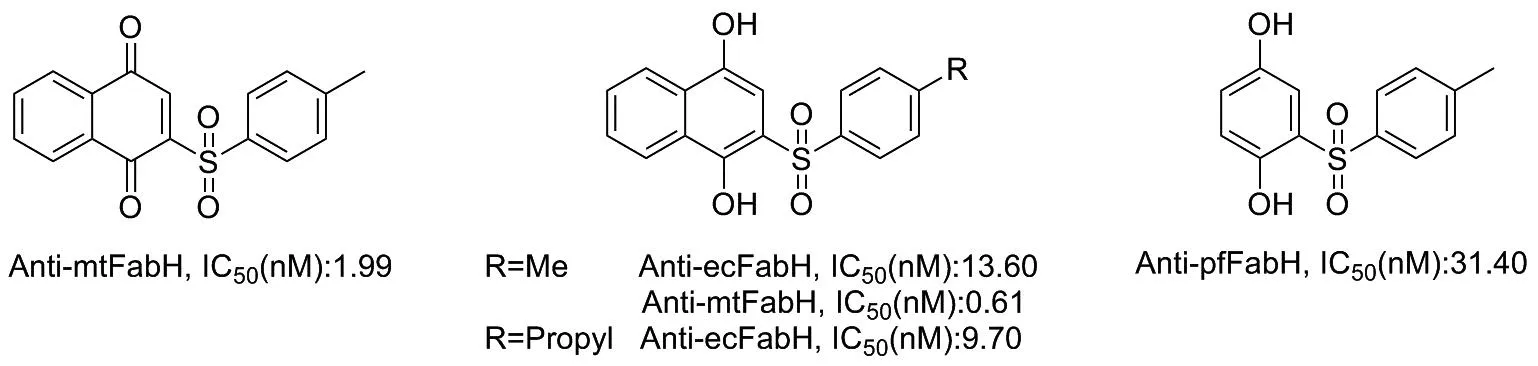
图1 一些代表性的磺酰基醌类化合物及类似物Figure 1 Several representative sulfonyl quinone derivatives and analogs
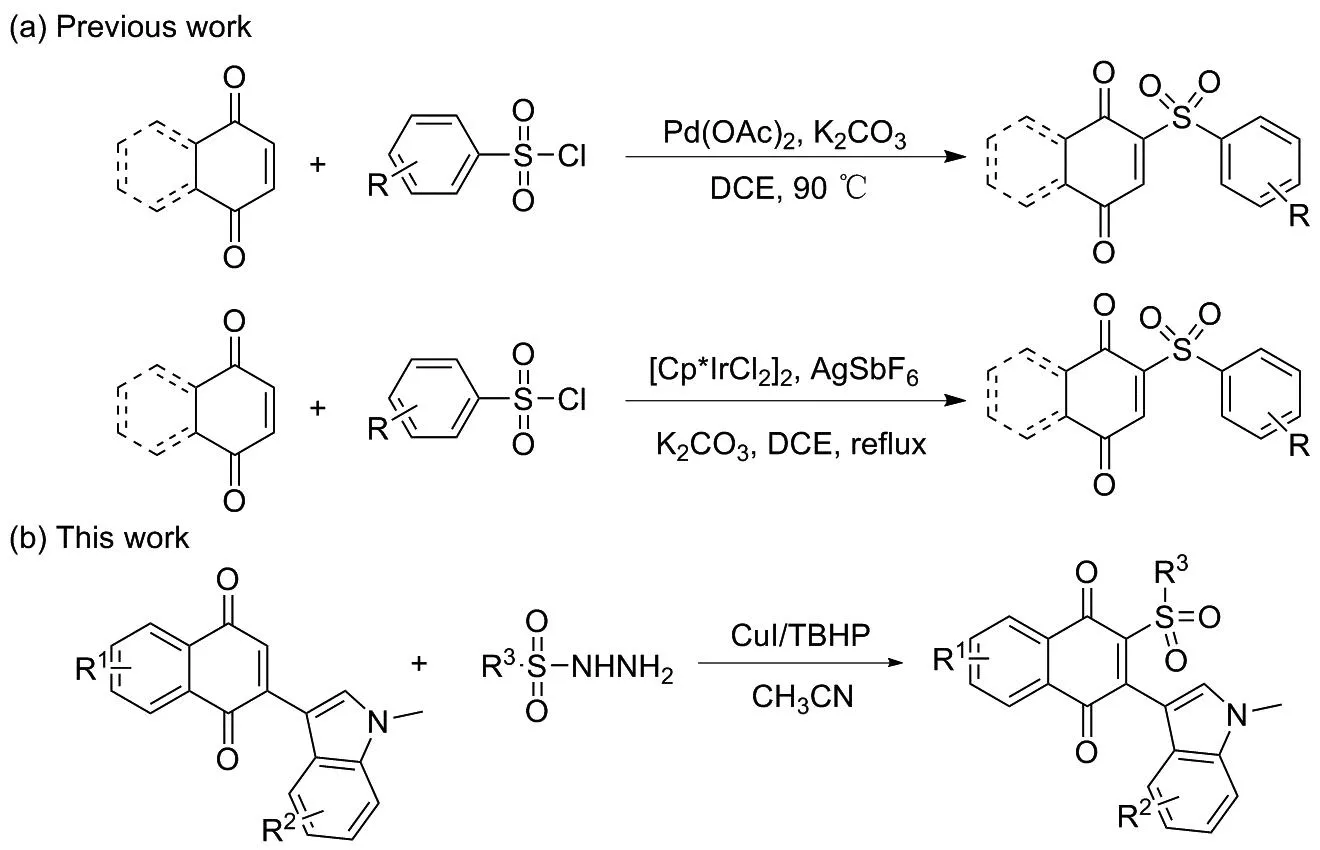
图2 醌类化合物的直接磺酰基化Figure 2 Direct sulfonylation of quinone-compounds
在前期的研究工作中,本课题组[12]围绕吲哚萘醌骨架构建了多种萘醌多元化合物,其均能表现出独特的光物理性质。例如,2020年,通过钴催化吲哚萘醌与芳胺的偶联反应/环化芳构化反应有效构建的含氮杂萘醌多元并环化合物表现出良好的光物理性质,可以作为荧光探针选择性识别甲磺酸[13]。 2021年,B(C6F5)3催化三分子串联反应构建的萘醌吲哚并双琥珀酰亚胺衍生物具有较高的荧光量子产率,可以作为比色传感器选择性识别碳酸盐[14]。 2023年,B(C6F5)3催化吲哚萘醌与炔酸酯的[4+2]环化反应构建的醌并咔唑化合物可以通过取代基变化或官能团转化调控化合物的光物理性质[15]。虽然吲哚萘醌多元并环化合物具有如此优良的光物理性质,但是目前还没有简单官能化的吲哚萘醌化合物的相关光物理性质研究,特别是磺酰基吲哚萘醌化合物的光物理性质探究。
根据研究发现,磺酰肼是常用的自由基前体,可以在氧化条件下选择性生成磺酰基自由基,快速构建C—S键[16]。基于此,以吲哚萘醌和磺酰肼为底物,通过金属盐碘化亚铜(CuI)和过氧化叔丁醇(TBHP)介导的氧化自由基历程,方便快捷地构建2-磺酰基吲哚萘醌化合物,如图2(b)所示,并对其光物理性质进行初步探究。
1 实验部分
1.1 仪器与试剂
Agilent 400 MHz型核磁共振仪(CDCl3为氘代试剂,TMS为内标); Thermo Scientific Exactive Orbitrap型高分辨质谱仪; Hanon MP430型熔点仪; UNICO4802型紫外-可见双光束分光光度计; FLUROMAX-4型荧光分光光度计。
1-甲基吲哚、4-甲基吲哚、5-甲基吲哚、碘甲烷、氢氧化钾(KOH)、二甲基亚砜(DMSO)、萘醌、氯化铋、4-甲基苯磺酰肼、4-甲氧基苯磺酰肼、苯磺酰肼、甲基磺酰肼、碘化亚铜、过氧化叔丁醇(70%)、乙腈(CH3CN),Adamas-探索平台。6,7-二甲基萘醌根据文献合成[17-18]。其余试剂与溶剂均为分析纯。
1.2 合成
(1) 化合物2的合成
以1-甲基吲哚(2a)的合成为例。于30 mL反应管中,依次加入1-H吲哚(117 mg, 1.0 mmol)、氢氧化钾(112 mg, 1.0 mmol)和2 mL DMSO,再在搅拌状态下滴加碘甲烷(282 mg, 2.0 mmol),于室温搅拌反应5 h。反应结束后,向反应体系中加入3 mL饱和食盐水,再用乙酸乙酯(3×3 mL)萃取,有机相用无水硫酸镁干燥,过滤,浓缩,经柱层析纯化(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶5,V∶V)得淡黄色液体化合物2a,产率99%。
(2) 化合物4的合成
以2-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(4a)的合成为例。于30 mL反应管中,依次加入萘醌(158 mg, 1.0 mmol)、氯化铋(31.5 mg, 0.1 mmol)和5 mL水,再在搅拌状态下滴加1-甲基吲哚(131 mg, 1.0 mmol),于60 ℃搅拌反应24 h。反应结束后,冷却至室温,用二氯甲烷(3×5 mL)萃取,无水硫酸镁干燥,过滤,浓缩,经柱层析纯化(洗脱剂:二氯甲烷 ∶石油醚=3 ∶1,V∶V)得淡黄色固体化合物4a,产率81%[12]。
(3) 化合物6的合成
以2-((4-甲基苯基)磺酰基)-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6a)的合成为例。于30 mL封管中,依次加入4a(57.4 mg, 0.2 mmol)、对甲苯磺酰肼(74 g, 0.4 mmol)、碘化亚铜(0.24 mmol) 和2 mL乙腈,再滴加过氧化叔丁醇(51 mg, 0.4 mmol),于90 ℃搅拌反应12 h。反应结束后,冷却至室温,浓缩溶剂,经硅胶柱层析纯化(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶5,V∶V),得黄褐色固体化合物6a,产率58%。
2-((4-甲基苯基)磺酰基)-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6a):黄褐色固体,收率58%, m.p.87~88 ℃;1H NMR(400 MHz, CDCl3)δ: 8.3~8.1(m, 2H), 8.0(d,J=8.4 Hz, 2H), 7.9~7.7(m, 2H), 7.6(dt,J=8.1 Hz, 1.0 Hz, 1H), 7.4(ddd,J=8.1 Hz, 6.8 Hz, 1.1 Hz, 1H), 7.4~7.3(m, 3H), 7.2(ddd,J=8.0 Hz, 6.8 Hz, 1.1 Hz, 1H), 7.1(s, 1H), 3.8(s, 3H), 2.4(s, 3H);13C NMR(100 MHz, CDCl3)δ: 183.9, 183.3, 143.9, 143.1, 137.4, 137.0, 136.0, 132.8, 132.7, 131.7, 131.3, 129.0, 126.9, 126.2, 125.5, 125.1, 124.4, 121.0, 119.7, 114.6, 109.4, 30.3, 20.6; HR-MS(ESI)m/z: calcd for C26H19NNaO4S+{[M+Na]+}464.0933, found 464.0932。
2-((4-甲基苯基)磺酰基)-3-(1,4-二甲基-1H-吲哚-3-基)-1,4-萘醌(6b):黄褐色固体,收率32%, m.p.125~126 ℃;1H NMR(400 MHz, CDCl3)δ: 8.2~8.0(m, 2H), 7.9(d,J=8.4 Hz, 2H), 7.7~7.6(m, 2H), 7.3~7.2(m, 3H), 7.2(d,J=1.2 Hz, 2H), 7.0(s, 1H), 3.7(s, 3H), 2.3(s, 3H), 2.3(s, 3H);13C NMR(100 MHz, CDCl3)δ: 184.0, 183.3, 143.8, 143.3, 137.1, 135.9, 135.9, 132.8, 132.7, 131.8, 131.3, 131.0, 130.6, 129.0, 127.4, 126.8, 126.2, 125.1, 124.5, 118.8, 114.1, 109.1, 30.3, 20.6, 20.3; HR-MS(ESI)m/z: calcd for C27H21NNaO4S+{[M+Na]+}478.1092, found 478.1089。
2-((4-甲基苯基)磺酰基)-3-(1,5-二甲基-1H-吲哚-3-基)-1,4-萘醌(6c):黄褐色固体,收率22%, m.p.89~90 ℃;1H NMR(400 MHz, CDCl3)δ: 8.2~8.1(m, 2H), 8.0~7.9(m, 2H), 7.8~7.7(m, 2H), 7.4~7.3(m, 3H), 7.2(d,J=1.2 Hz, 2H), 7.1(s, 1H), 3.8(s, 3H), 2.4(d,J=3.0 Hz, 6H);13C NMR(100 MHz, CDCl3)δ: 185.0, 184.4, 144.8, 144.4, 138.2, 137.0, 136.9, 133.8, 133.7, 132.8, 132.4, 132.1, 131.7, 130.0, 128.5, 127.9, 127.2, 126.2, 125.6, 119.9, 119.1, 115.1, 110.2, 31.4, 21.6, 21.4; HR-MS(ESI)m/z: calcd for C27H21NNaO4S+{[M+Na]+}478.1094, found 478.1089。
6,7-二甲基-2-((4-甲基苯基)磺酰基)-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6d):黄褐色固体,收率33%, m.p.76~77 ℃;1H NMR(400 MHz, CDCl3)δ: 8.0(s, 1H), 7.9(s, 1H), 7.9(s, 1H), 7.6(d,J=8.2 Hz, 1H), 7.4(t,J=7.7 Hz, 1H), 7.4~7.3(m, 3H), 7.3(s, 1H), 7.2(d,J=7.4 Hz, 1H), 7.0(s, 1H), 3.8(s, 3H), 2.4(s, 3H), 2.4(s, 6H);13C NMR(100 MHz, CDCl3)δ: 184.2, 183.6, 143.8, 142.7, 137.6, 137.1, 135.9, 129.9, 129.4, 129.0, 127.2, 126.9, 126.2, 125.4, 124.4, 120.9, 119.8, 114.9, 109.4, 30.3, 20.6, 19.2; HR-MS(ESI)m/z: calcd for C28H23NNaO4S+{[M+Na]+}492.1294, found 492.1245。
2-((4-甲基苯基)磺酰基)-3-(1H-吲哚-3-基)-1,4-萘醌(6e):黄褐色固体,收率67%, m.p.91~92 ℃;1H NMR(400 MHz, CDCl3)δ: 9.8(s, 1H), 8.1~8.0(m, 2H), 7.8~7.7(m, 4H), 7.4(t,J=8.0 Hz, 2H), 7.3~7.2(m, 1H), 7.2~7.1(m, 3H), 7.0(s, 1H), 2.3(s, 3H);13C NMR(100 MHz, CDCl3)δ: 183.7, 182.3, 144.0, 141.1, 137.3, 136.8, 135.0, 132.9, 131.3, 131.2, 131.2, 128.9, 127.4, 126.7, 126.0, 126.0, 125.5, 125.2, 121.2, 120.0, 113.1, 111.6, 20.6; HR-MS(ESI)m/z: calcd for C25H17NNaO4S+{[M+Na]+}450.0779, found 450.0776。
2-((4-甲氧基苯基)磺酰基)-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6f):黄褐色固体,收率41%, m.p.60~61 ℃;1H NMR(400 MHz, CDCl3)δ: 8.2~8.1(m, 1H), 8.1~8.1(m, 1H), 8.0(d,J=2.1 Hz, 1H), 7.9(d,J=2.1 Hz, 1H), 7.8~7.7(m, 2H), 7.5(dd,J=8.2 Hz, 1.0 Hz, 1H), 7.4~7.2(m, 2H), 7.1(ddd,J=7.9 Hz, 6.7 Hz, 1.1 Hz, 1H), 7.0(s, 1H), 6.9(d,J=2.1 Hz, 1H), 6.9(d,J=2.1 Hz, 1H), 3.8(s, 3H), 3.7(s, 3H);13C NMR(100 MHz, CDCl3)δ: 183.9, 183.4, 162.8, 143.2, 137.3, 135.9, 132.8, 132.7, 131.7, 131.7, 131.3, 131.3, 129.3, 126.2, 125.4, 125.1, 124.3, 121.0, 119.7, 114.3, 113.6, 109.4, 54.7, 30.3; HR-MS(ESI)m/z: calcd for C26H19NNaO5S+{[M+Na]+}480.0885, found 480.0882。
2-苯磺酰基-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6g):黄褐色固体,收率53%, m.p.80~81 ℃;1H NMR(400 MHz, CDCl3)δ: 8.3~8.1(m, 2H), 8.1~8.1(m, 2H), 7.8~7.7(m, 2H), 7.6~7.5(m, 4H), 7.4(ddd,J=8.2 Hz, 6.8 Hz, 1.1 Hz, 1H), 7.4(dt,J=8.5 Hz, 1.0 Hz, 1H), 7.2(ddd,J=8.0 Hz, 6.9 Hz, 1.1 Hz, 1H), 7.1(s, 1H), 3.8(s, 3H);13C NMR(100 MHz, CDCl3)δ: 183.9, 183.4, 143.1, 140.0, 137.5, 136.0, 132.8, 132.8, 131.7, 131.4, 130.9, 128.4, 126.8, 126.2, 125.6, 125.2, 124.4, 121.1, 119.8, 115.1, 109.5, 30.3; HR-MS(ESI)m/z: calcd for C25H17NNaO4S+{[M+Na]+}450.0779, found 450.0776。
2-甲基磺酰基-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6h):黄褐色固体,收率60%, m.p.68~69 ℃;1H NMR(400 MHz, CDCl3)δ: 8.2~8.1(m, 2H), 7.8~7.7(m, 2H), 7.6(d,J=8.1 Hz, 1H), 7.4(s, 2H), 7.3~7.2(m, 1H), 7.1(s, 1H), 4.1(s, 3H), 3.4(s, 3H);13C NMR(100 MHz, CDCl3)δ: 183.8, 183.4, 142.3, 137.5, 135.6, 132.9, 132.8, 131.6, 131.4, 131.2, 126.1, 125.7, 125.2, 123.9, 121.4, 119.7, 114.3, 109.7, 43.4, 30.7; HR-MS(ESI)m/z: calcd for C20H15NNaO4S+{[M+Na]+}388.0625, found 388.0619。
1.3 光物理性质测试
溶液配制:称取一定量化合物6溶解于乙腈溶剂,配制成浓度为2.5×10-5mol·L-1的溶液。
荧光发射光谱参数设置:发射波长扫描范围为430~800 nm,激发波长为各化合物紫外/可见光谱的最大吸收峰波长(λmax),发射狭缝宽度为5 nm,激发狭缝宽度为5 nm,灵敏度为1,扫描速率为中速。
2 结果与讨论
2.1 合成条件优化
通过对磺酰基萘醌衍生物(6)的合成条件进行优化,结果见表1。以2-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(4a)和4-甲基苯基磺酰肼(5a)为底物,于90 ℃的油浴锅中反应12 h,依次考察了金属盐、氧化剂和溶剂对磺酰化反应的影响。首先对金属盐的种类进行筛选。由表1(序号1~4)可以看出,不加入金属盐,该反应不能发生;多种铜盐都可以介导该反应,其中CuI的介导效果最佳。接着,对氧化剂进行筛选,由表1(序号5~8)可知,当不外加氧化剂时,反应不能发生;当加入过氧化二叔丁基(DTBP)、过氧化氢(H2O2)和过硫酸钾(K2S2O8)时,该反应能发生,但效果不佳;加入氧化叔丁醇(TBHP)时,收率最高,因此TBHP为合适的氧化剂。最后,对溶剂进行筛选,由表1(序号9~11)可知,以四氢呋喃(THF)、 1,2-二氯乙烷(DCE)为溶剂时,该反应也能很好进行,只是效果略差于乙腈(CH3CN)。因此,该反应的最佳反应条件为:以CuI为金属盐,TBHP为氧化剂,乙腈为溶剂,于90 ℃油浴中反应12 h。
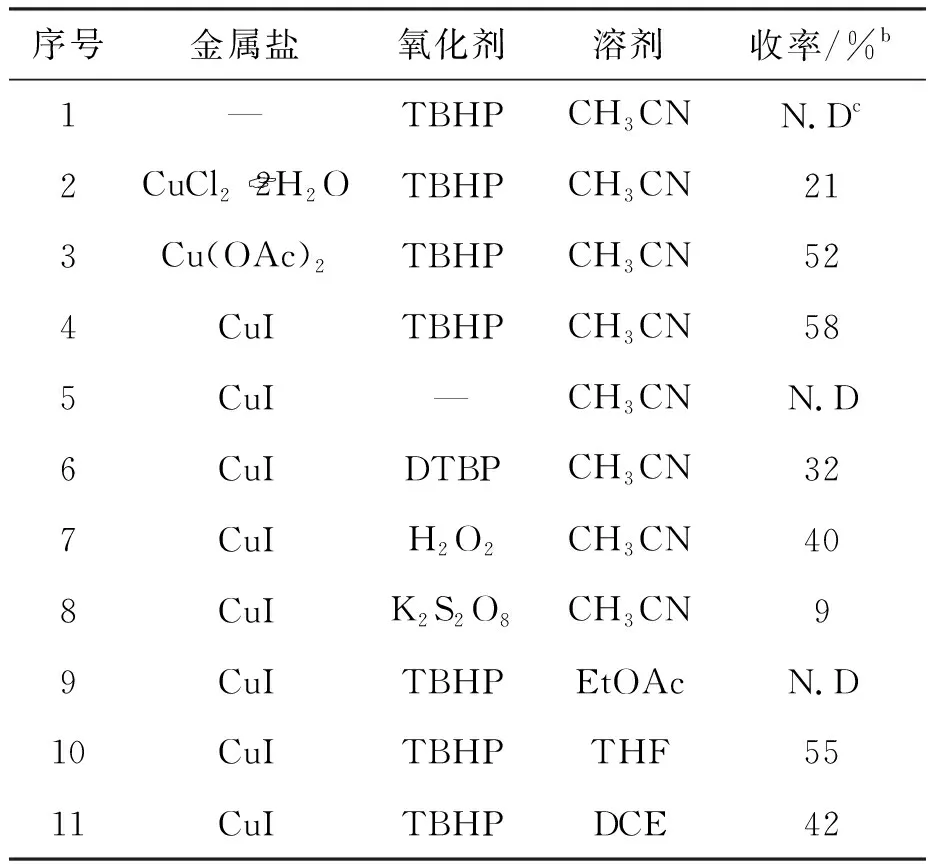
表1 化合物6的合成条件优化aTable 1 Optimization of synthesis conditions of compound 6
2.2 底物扩展
在最佳反应条件下,进行了底物扩展(图3)。 2-(1,4-二甲基-1H-吲哚-3-基)-1,4-萘醌(4b)、 2-(1,4-二甲基-1H-吲哚-3-基)-1,4-萘醌基)-1,4-萘醌(4c)可能由于位阻较大的原因,只能以较低的收率转化为目标产物6b和6c(图4)。 6,7-二甲基-2-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(4d)也能适用于反应,能以33%收率得到目标磺酰化产物6d。特别地,2-(1H-吲哚-3-基)-1,4-萘醌能很好地适用于该反应,能以67%收率得到目化合物6e。当苯磺酰肼的苯基上带有强给电子基团甲氧基或不带取代基时,该反应也能以中等收率得到磺酰化产物6f和6g。此外,甲磺酰肼也适用于该反应,能以较好的收率转化为2-甲基磺酰基-3-(1-甲基-1H-吲哚-3-基)-1,4-萘醌(6h)。通过该路线,能够便捷地得到多种取代的磺酰基萘醌衍生物,说明该合成路线具有实际应用的价值。
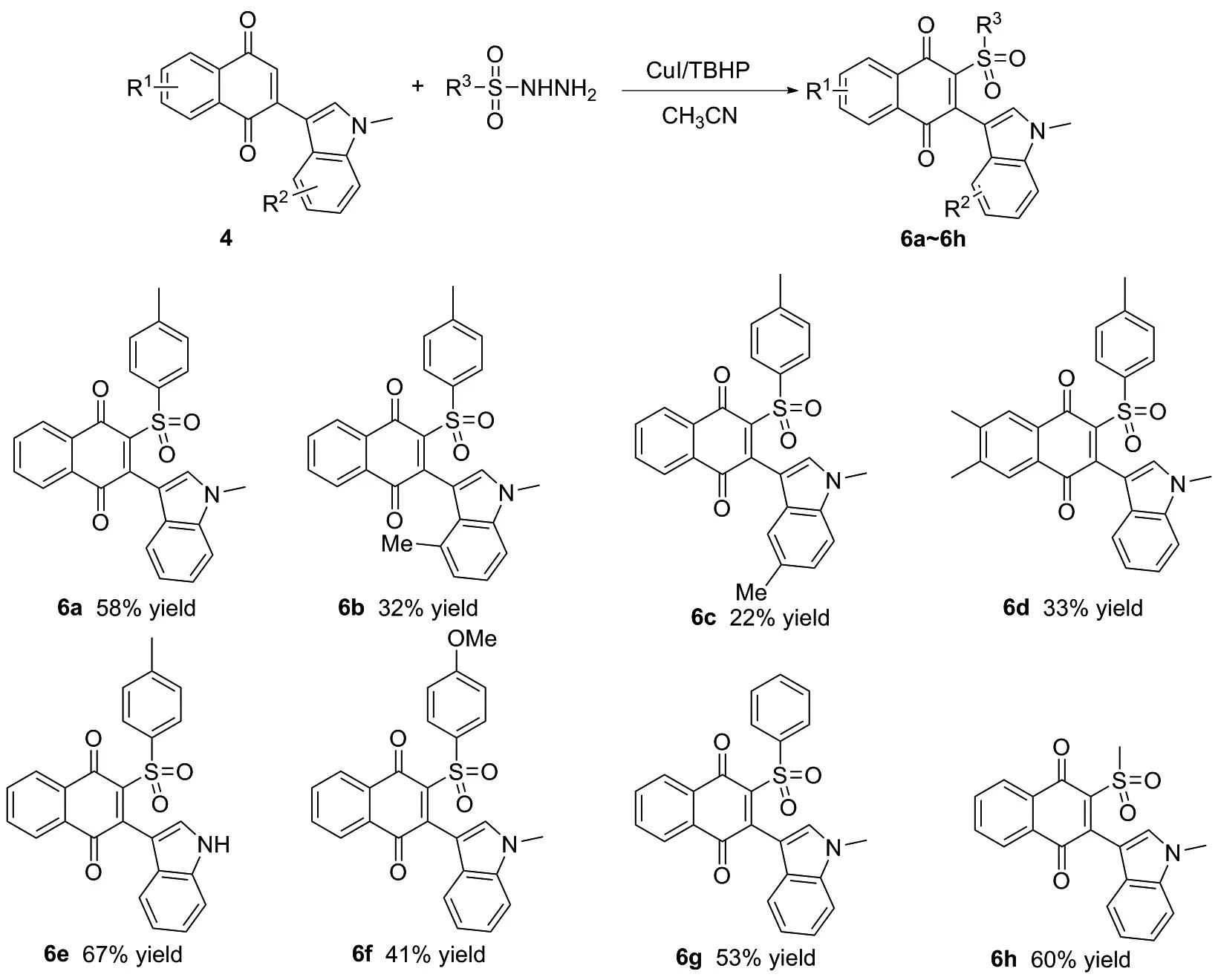
图3 底物扩展Figure 3 Scope of substrates

图4 合成6a可能的反应机理Figure 4 Possible reaction mechanism of synthesis 6a
2.3 可能的反应机理
根据已有的文献报道和实验结果[7-8,16],以化合物6a为例,推测可能的反应机理如图4所示。首先,对甲基苯磺酰肼在Cu(OAc)2/TBHP的介导下生成磺酰基自由基A。接着,自由基中间体A对吲哚萘醌的萘醌双键进行加成生成自由基中间体B。最后,中间体B进一步氧化生成6a。
2.4 光物理性质分析
通过对化合物6进行光物理性质分析,结果如表2和图5~6所示。该类化合物最大紫外吸收峰波长(λmax)范围为400~420 nm,最大荧光发射峰波长(λem)范围为462~502 nm。相较模板化合物6a,当吲哚苯环上带有给电子取代基甲基或苯甲酰基上带有强给电子取代基甲氧基或磺酰基上直接连给电子取代基甲基时,化合物6b,6c,6f和6h的最大紫外吸收峰会轻微红移;当萘醌苯环上带有给电子取代基甲基或苯磺酰基的苯环上不带取代基时,化合物6d,6g的最大紫外吸收峰会出现轻微蓝移。通过对化合物6的荧光发射光谱进行分析后发现,相较化合物6a,当吲哚N上不带取代基(6e)或吲哚苯环上带甲基取代基(6b或6c),以及萘醌苯环上带甲基取代基(6d)时,化合物的荧光发射强度大幅度减弱;当磺酰基连接强给电子基甲氧基(6f)时,化合物的荧光发射强度会增强;但是当磺酰基连接甲基(6g)或苯基(6h)时,化合物的荧光发射强度会减弱。基于此,可以通过调节化合物不同位置的取代基来实现化合物的最大紫外吸收波长以及荧光强度的调控,这对具有良好光物理性质的化合物的构建具有重要意义。

表2 化合物6的光物理性质Table 2 Photophysical properties of compounds 6

λ/nm图5 化合物6a~6h 在乙腈中的紫外吸收谱图Figure 5 UV-Vis spectra of compounds 6a~6h in CH3CN
基于前期吲哚萘醌多元并环化合物的合成与光物理性质探究工作,本文设计了碘化亚铜/过氧化叔丁醇介导的氧化自由基反应,便捷地合成了8个新型的具有良好光物理性质的磺酰基吲哚萘醌化合物(6a~6h)。该系列化合物的最大紫外吸收峰波长在400~420 nm,最大荧光发射峰波长范围为462~502 nm,且可以通过不同位置的取代基的变换来调节化合物的最大紫外吸收波长和荧光发射强度。
