氢氧化钠分子结构原位漫反射一维及二维漫反射中红外光谱研究
2024-02-28于宏伟吉一帆柴嘉欣吴雨靓
于宏伟,吉一帆,柴嘉欣,李 阳,乔 静,吴雨靓
(1.石家庄学院化工学院,河北石家庄;2.河北省麻醉药技术创新中心,河北石家庄)
氢氧化物是OH-或者OH-和O2-共同与阳离子(M)相化合而成的化合物(M-OH)。 阳离子主要包括碱金属离子(例如K+、Na+、Li+),碱土金属离子(例如Ba2+、Ca2+、Mg2+), 第Ⅲ主族元素金属离子 (例如Al3+), 及部分过渡金属离子 (例如Fe3+、Fe2+、Ni2+、Zn2+、Mn2+和Co2+等)[1]。氢氧化物分子中,OH-价位低,与金属阳离子的结合力比O2-弱的多,M-OH 间距比相应的氧化物大,并具有一定的氢键作用。 氢氧化钠是最常见的一元强碱,广泛应用在轻工、冶金、地质、建筑、制药及临床医学等领域[2-7]。 而中红外(MIR)光谱(包括透射MIR 光谱、衰减全反射MIR 光谱[8-10]及漫反射MIR 光谱[11,12])具有方便快捷的优点,广泛应用于化合物结构研究领域。但氢氧化钠极容易潮解,因此透射MIR 光谱法并不适合研究(频率范围4000~400 cm-1),而衰减全反射MIR 光谱研究的频率范围则有一定的限制(频率范围4000~600 cm-1)。漫反射MIR 光谱(频率范围4000~400 cm-1)作为一种反射MIR 光谱, 不需要对样品进行特别处理,可以直接测量粉末或粗糙物质表面的样品,得到样品表面及内部的光谱信息。二维漫反射MIR 光谱的谱图分辨能力优于漫反射MIR 光谱。因此本项研究采用原位漫反射MIR 光谱及漫反射二维MIR 光谱进一步开展氢氧化钠结构研究。
1 实验
1.1 材料
溴化钾(分析纯,上海市国药集团化学试剂有限责任公司);氢氧化钠(分析纯,天津市永大化学试剂有限公司)。
1.2 仪器与设备
中红外光谱仪 (Spectrum 100 型, 美国PE 公司),漫反射中红外光谱附件(英国Specac 公司)。
1.3 实验方法
以研磨均匀的干燥后的溴化钾粉末为扫描背景,每隔5 min 测试样品(氢氧化钠-溴化钾研磨混合物,w氢氧化钠∶w溴化钾=5 ∶100), 原位连续测量16 次。漫反射中红外光谱数据采用Spectrum v 6.3.5 软件(通过K-M 转化)。
1.4 实验原理
1.4.1 漫反射MIR 光谱原理[13,14]
当一束红外光聚焦到氢氧化钠粉末样品表层时, 红外光与氢氧化钠粉末样品的作用方式有两种,一部分红外光在氢氧化钠粉末样品表面反射,这种反射和可见光从镜面反射一样, 称为镜面反射。 镜面反射没有进入氢氧化钠粉末样品颗粒内部,未与样品发生作用,所以这部分镜面反射光不负载氢氧化钠粉末样品的任何结构和组成信息。另一部分红外光会射入氢氧化钠粉末样品颗粒内部,经过透射、折射或颗粒内部表面反射后,从氢氧化钠粉末样品颗粒内部射出, 这部分漫反射红外光与氢氧化钠粉末样品分子发生了相互作用,因此负载了氢氧化钠粉末样品的结构和组成信息。
1.4.2 二维MIR 光谱原理[15,16]
二维MIR 光谱包括同步二维MIR 光谱和异步二维MIR 光谱。 同步二维MIR 光谱关于对角线对称,对角线上为自动峰,某一变量处光谱峰的变化总是与自身完全相同,所以自动峰总是正值,其强度代表了该变量处光谱随外加扰动变化的程度。 非对角线上为交叉峰,表示微扰作用下两个变量处光谱峰的变化正相关(都增强或都减弱)或负相关(一个增强而另一个减弱)。 分子内或者分子间的官能团可能存在着相互作用,因而在微扰作用下的变化具有相关性,会出现交叉峰。 异步二维MIR 代表两个变量处光谱峰变化的(相位)差异性,关于对角线反对称。 光谱峰的变化总是与自身完全相同,所以异步相关光谱不存在自动峰。 当两个变量处光谱峰位置、强度和相位的变化都相同时,即使强度变化的方向不同,也不会产生交叉峰,两个变量处光谱峰的变化不同时就会产生交叉峰。 根据同步和异步相关二维MIR 光谱交叉峰的符号,可以推测不同变量处光谱峰的变化次序。
2 分析与讨论
2.1 氢氧化钠分子结构原位一维漫反射MIR 光谱
氢氧化钠分子结构的原位一维漫反射MIR 外光谱见图1。
实验发现,氢氧化钠分子结构官能团红外吸收模式主要集中在“3700~3500 cm-1”和“450~400 cm-1”等2 个特征频率区间。
2.1.1 3700~3500 cm-1频率区间氢氧化钠分子结构原位一维漫反射MIR 光谱研究
根据文献报道[17],3638 cm-1处的吸收峰归属于氢氧化钠分子结构中OH 基团伸缩振动模式(νOHNaOH-一维),氢氧化钠分子OH 基团νOH-NaOH-一维对应的吸收峰型为尖峰,且吸收频率较高,这主要是因为固体氢氧化钠分子OH 基团之间并不容易形成氢键,更多的是游离OH 基团。氢氧化钠极容易潮解,其表面会吸附一定的水分子,而3576 cm-1处发现的吸收峰则主要归属于水分子OH 基团伸缩振动模式(νOH-H2O-一维)。 由于与水分子之间可以形成较强的分子间氢键作用,水分子结构νOH-H2O-一维对应的吸收峰型为钝峰, 且吸收频率要低于氢氧化钠分子结构νOH-NaOH-一维(差值约62 cm-1)。 水分子结构νOH-H2O-一维对应的吸收强度要大于氢氧化钠分子结构νOH-NaOH-一维对应的吸收强度, 这与氢键作用的差异性也有一定的关系,而通常较强的分子间氢键作用,其官能团对应着更大的吸收强度。氢氧化钠分子结构原位漫反射MIR 光谱数据见表1。
研究发现,与传统的透射MIR 光谱及衰减全反射MIR 光谱相比, 氢氧化钠分子结构漫反射MIR光谱的吸收强度要经过K-M 转换。
根据文献报道[19,20],漫反射MIR 光谱测量的粉末样品的相对漫反射率(R),其定义为:
式中:R—相对漫反射率;
I—粉末样品的散射光强度;
I0—背景散射光强度。
用漫反射率(R)表示漫反射中红外光谱时,其光谱的形状与透射中红外光谱形状相同。 漫反射MIR 光谱也可以用lg(1/R)表示。 lg(1/R)表示漫反射吸光度, 漫反射MIR 光谱的形状和透射MIR 光谱形状相同。
因此定义漫反射吸光度A 为:
在实际检测过程中,还需要将漫反射率转化成K-M 函数F(R)。 将漫反射率转化成K-M 函数,能够减少或消除任何与波长有关的镜面反射效应。
K-M 函数F(R)的定义为:
式中:R—漫反射率;
K—吸收系数;
S—散射系数。
当样品的浓度不高时,吸收系数K 与样品浓度c 成正比:
式中:A—摩尔吸光系数。
进一步整理为:
若散射系数S 保持不变,K-M 函数F(R)与样品浓度成正比, 即经过转换后得到的K-M 函数F(R)与样品组分浓度c 的关系符合朗伯-比尔定律。 但漫反射中红外光谱用于定量分析的时候,散射吸收(S)实际上常有较大的变化,所以定量分析结果会出现较大的误差。
研究发现, 氢氧化钠分子结构νOH-NaOH-一维及水分子结构νOH-H2O-一维对应的吸收强度(经过K-M 转化) 重复性较差。 原位测定16 次, 其Stan dard D 分别为0.08479、0.09025、0.09241、0.32702、0.32921 及0.33093。 这主要是因为漫反射中红外光谱的光路复杂,包括透射、折射及反射,虽然每次样品粒度、密度和平整度不变,但光路的细微改变均导致最后吸收强度的改变。
漫反射中红外光谱的吸光度与样品(氢氧化钠粉末样品)的组分含量(浓度)不符合朗伯-比尔定律,也就是说,样品浓度与光谱强度不构成线性关系,其主要原因是存在镜面反射。 要使样品浓度与红外谱带的强度成线性关系,必须减少或消除镜面反射,将样品与漫反射中红外光谱介质(溴化钾)粉末一起研磨,样品的浓度越低、颗粒研磨得越细,样品与溴化钾研磨越均匀,在测得的漫反射中红外光谱中,红外谱带的强度与样品浓度的线性关系越明显。
如将漫反射中红外光谱用于定量分析,还需要满足以下条件:
(1)得到高质量的漫反射中红外光谱。
(2)样品的质量浓度约1%,即样品与溴化钾的质量比为1∶99。
(3)样品的厚度至少为3 mm,样品表面应该平整。
要完成以上条件, 还需要大量实验去摸索,这也是漫反射MIR 光谱很少用于定量研究的一个主要原因。
2.1.2 450~400 cm-1频率区间氢氧化钠分子结构原位漫反射MIR 光谱研究
在450~400 cm-1区间氢氧化钠结构原位漫反射中红外光谱信息比较复杂。根据文献报道[17],氢氧化锂分子结构OH 基团面内摇摆振动模式 (ρOHLiOH-一维)的特征红外吸收频率为419 cm-1,研究认为氢氧化钠分子结构与氢氧化锂分子结构类似,其OH 基团面内摇摆振动模式(ρOH-NaOH一维)对应的吸收频率应在420~410 cm-1,相关光谱数据见表2。
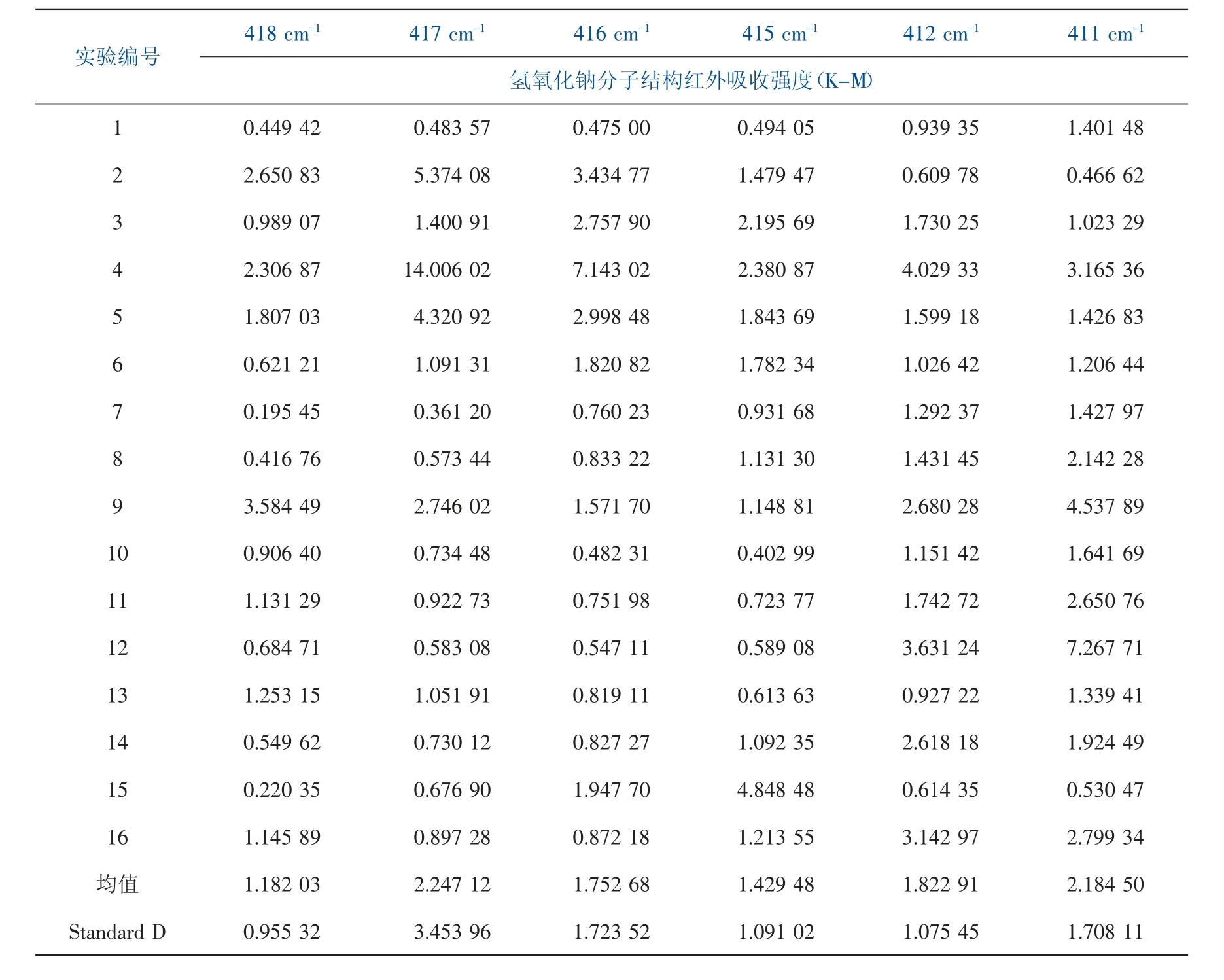
表2 氢氧化钠分子结构原位漫反射MIR光谱数据(450~400 cm-1)
由表2 数据发现, 在420~410 cm-1频率间的6个主要红外吸收峰中红外吸收频率分别为418 cm-1
(A=1.18203)、417 cm-1(A=2.24712)、416 cm-1(A=1.75268)、415 cm-1(A=1.42948)、412 cm-1(A=1.82291)和411 cm-1(A=2.1845),其中417 cm-1处对应的平均吸收峰强度最大(A=2.24712),其频率和氢氧化锂分子结构OH 基团ρOH-LiOH-一维更为接近, 因此研究认为氢氧化钠分子结构OH 基团ρOH-NaOH-一维对应的特征吸收频率为417 cm-1附近。
2.2 氢氧化钠分子结构原位漫反射二维MIR 光谱研究
原位二维漫反射MIR 光谱包括同步原位二维漫反射MIR 光谱和异步原位二维漫反射MIR 光谱。
2.2.1 3690~3610 cm-1频率区间氢氧化钠分子结构原位二维漫反射MIR 光谱研究
首先在3690~3610 cm-1频率区间开展了氢氧化钠分子结构的原位同步二维漫反射MIR 光谱研究(见图2)。
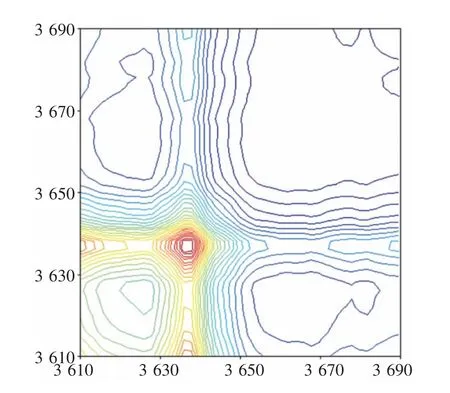
图2 氢氧化钠分子结构原位同步二维漫反射MIR光谱(3690~3610 cm-1)
实验在(3636 cm-1,3636 cm-1)处发现1 个相对强度较大的自动峰。 进一步开展了氢氧化钠分子结构的原位异步二维漫反射MIR 光谱研究(见图3)。

图3 氢氧化钠分子结构原位异步二维漫反射MIR光谱(3690~3610 cm-1)
实验在(3631 cm-1,3636 cm-1)、(3631 cm-1,3642 cm-1)、(3636 cm-1,3639 cm-1)和(3639 cm-1,3642 cm-1)处发现4 个相对强度较大的交叉峰。根据NODA 原则[21-24],氢氧化钠分子结构νOH-NaOH-二维对应的红外吸收频率包括3642 cm-1(νOH-NaOH-1-二维)、3639 cm-1(νOH-NaOH-2-二维)、 3636 cm-1(νOH-NaOH-3-二维)和3631 cm-1(νOH-NaOH-4-二维)。其中,氢氧化钠分子结构3642 cm-1(νOH-NaOH-1-二维)、3639 cm-1(νOH-NaOH-2-二维)、 3636 cm-1(νOHNaOH-3-二维)和3631 cm-1(νOH-NaOH-4-二维)对应的分子间氢键作用依次增强。氢氧化钠分子结构3642 cm-1(νOH-NaOH-1-二维)对应相对更多的游离氢键, 而氢氧化钠分子结构3631 cm-1(νOHNaOH-4-二维)则对应更多的缔合氢键,相关光谱数据见表3。

表3 氢氧化钠分子结构原位二维漫反射MIR光谱数据及解释(3690~3610 cm-1)
根据NODA 原则及表3 数据可知, 室温下,氢氧化钠分子结构νOH-NaOH-二维对应的吸收峰变化快慢信息为3631 cm-1(νOH-NaOH-4-二维)>3639 cm-1(νOH-NaOH-2-二维)>3636 cm-1(νOH-NaOH-3-二维)>3642 cm-1(νOH-NaOH-1-二维)。
室温下氢氧化钠分子间存在一定的分子间氢键作用,氢氧化钠分子缔合态结构最先改变,而氢氧化钠分子游离态结构相对稳定,当然这之间也存在一个巧妙的平衡。
2.2.2 430~410 cm-1频率区间氢氧化钠分子结构原位二维漫反射MIR 光谱研究
首先在430~410 cm-1频率区间开展了氢氧化钠分子结构的原位同步二维漫反射MIR 光谱研究(见图4)。
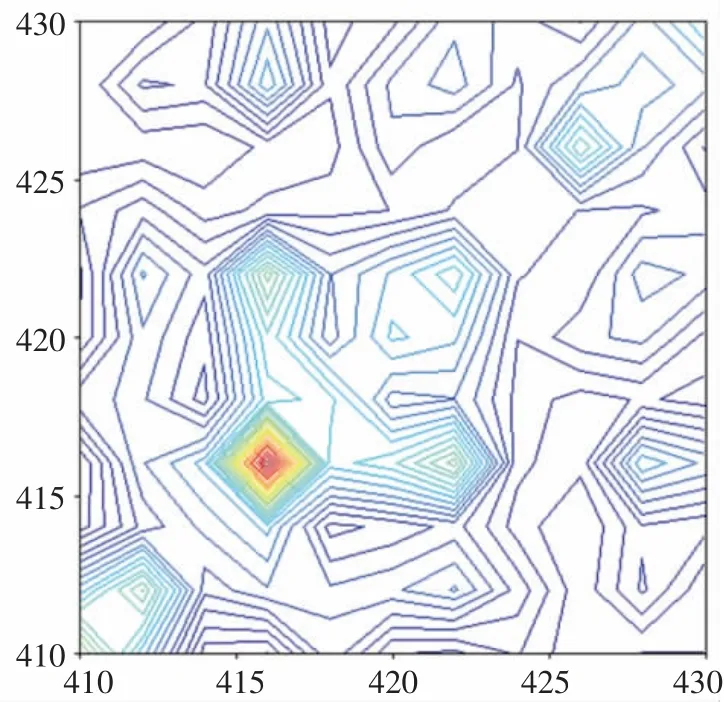
图4 氢氧化钠分子结构原位同步二维漫反射MIR光谱(430~410 cm-1)
实验在(411 cm-1,411 cm-1)、(416 cm-1,416 cm-1)和(420 cm-1,420 cm-1)处发现3 个相对强度较大的自动峰,而在(414 cm-1,418 cm-1)处发现1 个相对强度较大的交叉峰。 进一步开展了氢氧化钠分子结构的原位异步二维漫反射MIR 光谱研究 (见图5)。
实验在(411 cm-1,416 cm-1)、(411 cm-1,420 cm-1)和(416 cm-1,420 cm-1)处发现3 个相对强度较大的交叉峰。根据NODA 原则,氢氧化钠分子结构ρOHNaOH-二维对应的红外吸收频率包括420 cm-1(ρOHNaOH-1-二维)、416 cm-1(ρOH-NaOH-2-二维)和411 cm-1(ρOH-NaOH-3-二维),相关光谱数据及解释见表4。

表4 氢氧化钠分子结构原位二维漫反射MIR光谱数据及解释(430~410 cm-1)
根据NODA 原则及表3 数据可知, 室温下,氢氧化钠分子结构νOH-NaOH-二维对应的吸收峰变化快慢信息为416 cm-1(ρOH-NaOH-2-二维)>411 cm-1(ρOH-NaOH-3-二维)>420 cm-1(ρOH-NaOH-1-二维)。
3 结论
氢氧化钠分子结构的一维漫反射MIR 吸收模式主要包括νOH-NaOH-一维和ρOH-NaOH-一维。 氢氧化钠分子结构νOH-NaOH-二维对应的红外吸收频率包括3642 cm-1(νOH-NaOH-1-二维)、3639 cm-1(νOH-NaOH-2-二维)、3636 cm-1(νOH-NaOH-3-二维)和3631 cm-1(νOH-NaOH-4-二维)。 室温下,氢氧化钠分子结构νOH-NaOH-二维对应的吸收峰变化快慢信息为3631 cm-1(νOH-NaOH-4-二维)> 3639 cm-1(νOH-NaOH-2-二维)>3636 cm-1(νOH-NaOH-3-二维)>3642 cm-1(νOH-NaOH-1-二维)。 氢氧化钠分子结构ρOH-NaOH-二维对应的红外吸收频率包括420 cm-1(ρOH-NaOH-1-二维)、416 cm-1(ρOH-NaOH-2-二维)和411 cm-1(ρOH-NaOH-3-二维)。 室温下,氢氧化钠分子结构νOH-NaOH-二维对应的吸收峰变化快慢信息为416 cm-1(ρOH-NaOH-2-二维)> 411 cm-1(ρOHNaOH-3-二维)> 420 cm-1(ρOH-NaOH-1-二维)。 原位一维漫反射MIR 及原位二维漫反射MIR 光谱为研究氢氧化钠分子结构建立了一个方法学,具有重要的应用研究价值。
