右美托咪定经海马CA1区PPARγ磷酸化在大鼠体外循环脑保护中的作用*
2024-02-28黎杏梅陈燕桦钟妤卢伊芝何芳张璐
黎杏梅,陈燕桦,钟妤,卢伊芝,何芳,张璐
(广西医科大学第一附属医院 麻醉手术中心,广西 南宁 530021)
体外循环(cardiopulmonary bypass, CPB)即心脏和肺功能由心肺机代替,常用于心脏手术期间支持患者的血液循环和氧合作用。然而在CPB过程中,因人工管道与血液大面积接触,补体系统、白细胞及内皮细胞的激活,以及器官缺血再灌注损伤等刺激,导致各种促炎细胞因子释放,诱发全身包括大脑的炎症反应[1]。过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPAR)是在配体激活后调节基因表达的转录因子,由α、β/δ和γ 3种亚型组成,PPARγ的激活可参与脂质和糖代谢、单核细胞和巨噬细胞活化、炎症反应、细胞分化和凋亡等生理、病理过程[2]。右美托咪定是一种新型的α2肾上腺素受体激动剂,是临床应用最广的一种麻醉辅助用药[3]。研究报道,围手术期使用右美托咪定可降低接受心脏手术患者术后谵妄的发生率[4]。右美托咪定对神经炎症具有调节作用,其通过抑制炎症细胞因子的表达与释放对脑缺血再灌注损伤发挥神经保护作用[5]。右美托咪定对CPB相关脑损伤的保护作用的具体分子机制尚不够明确,仍有待阐明。因此本研究通过复制大鼠体外循环模型探讨右美托咪定对大鼠体外循环所致脑损伤的保护作用及可能机制,并研究PPARγ在其中的作用。
1 材料与方法
1.1 实验动物分组及用药
SPF级成年健康雄性SD大鼠36只,体重350~450 g。实验动物生产许可证号:SCXK桂2020-0003;实验动物使用许可证号:SYXK桂2020-0004。按照随机数字表法将实验大鼠分为假手术组(S组)、体外循环组(C组)、右美托咪定组(D组),每组12只。S组行右颈内静脉及双侧股动脉穿刺置管,持续2 h,不进行体外循环。C组和D组均行右颈内静脉及双侧股动脉穿刺置管,采用右颈内静脉引流、右股动脉灌注的方式复制大鼠体外循环模型,转流2 h,D组在体外循环前15 min至体外循环2 h期间经右颈内静脉以5 μg/(kg·h)的速度泵注右美托咪定注射液,C组在此期间恒速泵注等容积的生理盐水,S组恒速泵注等容积的生理盐水2 h。
1.2 主要试剂、材料及仪器
1.2.1 试剂 右美托咪定注射液(江苏恒瑞制药有限公司),兔抗大鼠GAPDH抗体、兔抗大鼠Cleaved Caspase-3抗体(武汉三鹰生物技术有限公司),兔抗大鼠PPARγ抗体、兔抗大鼠Bax抗体、兔抗大鼠Bcl-2抗体(英国Abcam公司),兔抗大鼠p-PPARγ抗体(美国Gene Tex公司),山羊抗兔Dy Light 800荧光二抗(美国Invitrogen公司),大鼠白细胞介素-6(Interleukin, IL-6)、大鼠中枢神经特异蛋白(central nervous system specific protein, S100β)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(武汉华美生物工程有限公司)。
1.2.2 材料及仪器 16 G气管导管(香港友诚生物科技有限公司),小动物呼吸机(ALC-V8S,上海奥尔科特生物科技有限公司),病理显微镜(CX21,日本奥林巴斯公司),单通道微量注射泵(浙江史密斯医学仪器有限公司),酶标仪(美国BioTek仪器公司),Odyssey扫膜仪(美国LI-COR公司),低温匀浆机(武汉塞维尔生物科技有限公司)。
1.3 大鼠CPB模型的复制
大鼠称重后用1%戊巴比妥钠腹腔注射麻醉(5 mL/kg),仰卧位固定于小动物实验台上。经口明视下插入小动物专用16 G气管导管,行机械通气,调整呼吸机参数,潮气量10 mL/kg,频率60次/min,呼吸比1∶2。颈前区、左右腹股沟处备皮消毒后切开皮肤暴露右颈内静脉、双侧股动脉,大鼠右颈内静脉置入18 G导管,并将套管尖置于右心房将静脉血引流至贮血槽;右侧股动脉穿刺置管(22 G静脉穿刺针)作为灌注端;左侧股动脉穿刺置管(22 G静脉穿刺针)接血压表监测实时动态血压并进行血气分析。预先配置18 mL无血预充液填充CPB管路:乳酸钠林格液8 mL、6%羟乙基淀粉溶液8 mL、5%碳酸氢钠1 mL、20%甘露醇1 mL、肝素150 IU/ kg。CPB转流开始前,经右颈内静脉给予肝素钠500 IU/kg,当激活全血凝固时间(ACT)≥ 480 s时,开始进行CPB转流,逐渐增加灌注流量,最终维持在100~120 mL/(kg·min)。CPB转流期间动脉血气分析维持在正常值之间,血红蛋白(Hemoglobin, Hb)保持在7.0~9.0 g/dL,红细胞压积在20%~25%。小动物膜式氧合器的气体入口端氧气流量为300~400 mL/(kg·min),用直肠温度计监测体内中心温度,维持体温保持在36.5~38.3 ℃。CPB转流2 h后实验结束。
1.4 组织标本采集
置管或转流2 h后,拆除连接管道,各组随机取6只大鼠剪开肋缘暴露肝脏,剪开胸骨充分暴露心脏,于心尖部剪一小口,插入灌胃针至主动脉根部并固定,剪开右心耳,从灌胃针灌注生理盐水直至右心耳流出的液体变清澈且肝脏变白,接着灌注4 ℃、4%多聚甲醛溶液150 mL进行固定,断头取出完整脑组织,于4%多聚甲醛溶液中固定24 h,石蜡包埋,行连续冠状面切片(5 μm厚),用于苏木精-伊红(hematoxylin and eosin, HE)染色和免疫组织化学染色。各组取剩余6只大鼠CPB转流2 h结束后,立即断头取出完整脑组织,冰上分离海马组织,用预冷生理盐水冲洗干净,置于-80 ℃冰箱冷冻保存,用于Western blotting检测。
1.5 HE染色观察海马组织病理变化
将1.4制备的各组大鼠脑组织石蜡切片置入60 ℃烤箱烘烤2 h,经二甲苯脱蜡、梯度浓度乙醇脱水,依次苏木精、伊红各染色5 min,无水乙醇脱水,二甲苯透明,中性树脂封片,在病理显微镜下观察海马组织并拍照。
1.6 酶联免疫吸附试验测定血浆TNF-α、IL-6、S100β水平
3组大鼠CPB转流2 h结束后从右颈外静脉收集静脉血,4 ℃、1 000 r /min离心15 min,取上清液,分装并于-80 ℃冰箱冷冻保存。严格按照酶联免疫吸附试验试剂盒说明书步骤检测血浆肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IL-6及S100β水平。
1.7 Western blotting检测Bcl-2、Bax、Cleaved Caspase-3、p-PPAR γ/ PPAR γ蛋白表达
取各组大鼠海马组织加入裂解液和蛋白酶抑制剂进行匀浆完全裂解,孵育离心取上清液,BCA测定蛋白总量。加入上样缓冲液,沸水浴变性后进行电泳、转膜。用5%脱脂牛奶封闭2 h,洗膜3次,分别加入一抗Bcl-2(1∶1 000)、Bax(1∶1 000)、Cleaved Caspase-3(1∶1 000)、PPARγ(1∶1 000)、p-PPARγ(1∶1 000)及内参GAPDH(1∶5 000),4 ℃孵育过夜。洗膜3次后加入山羊抗兔荧光二抗(1∶10 000),室温避光孵育2 h。Odyssey双色荧光成像系统扫膜成像,Image J软件测定灰度值,以目的蛋白与内参蛋白灰度值比值表示目的蛋白的相对表达量。
1.8 免疫组织化学染色
将1.4中制备的各组大鼠脑组织石蜡切片脱蜡至水,浸入柠檬酸钠抗原修复液,于高压锅中高压修复6 min,内源性过氧化物酶阻断剂阻断,正常山羊工作血清封闭15 min,依次加一抗、酶标二抗、显色剂,苏木精复染后脱水、晾干,中性树脂封片,于光学显微镜下观察海马CA1区并拍照。棕黄色颗粒即为阳性表达。采用Image-Pro Plus 6.0软件统计海马CA1区的总面积(area sum)和p-PPARγ阳性表达的积分光密度(integral optical density, IOD)。阳性产物的平均光密度(average optical density, MOD)=(IOD sum)/(area sum)。
1.9 统计学方法
数据分析采用SPSS 26.0和Graph Pad Prism 8.0统计软件。计量资料以均数±标准差(±s)表示,多组比较用方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠海马组织病理变化
光学显微镜下显示S组海马CA1区细胞形态完整,神经细胞数量未见减少,细胞排列整齐、致密,核仁明显,包膜完整,细胞与周围组织联系紧密。与S组相比,C、D组海马CA1区形态出现损伤改变,神经细胞数量减少,细胞排列紊乱、疏松,核固缩、深染,细胞与周围组织联系疏松,可见细胞死亡。与C组相比,D组海马CA1区形态损伤较轻,神经细胞数量轻度减少,细胞排列较整齐,可见细胞层次。见图1。
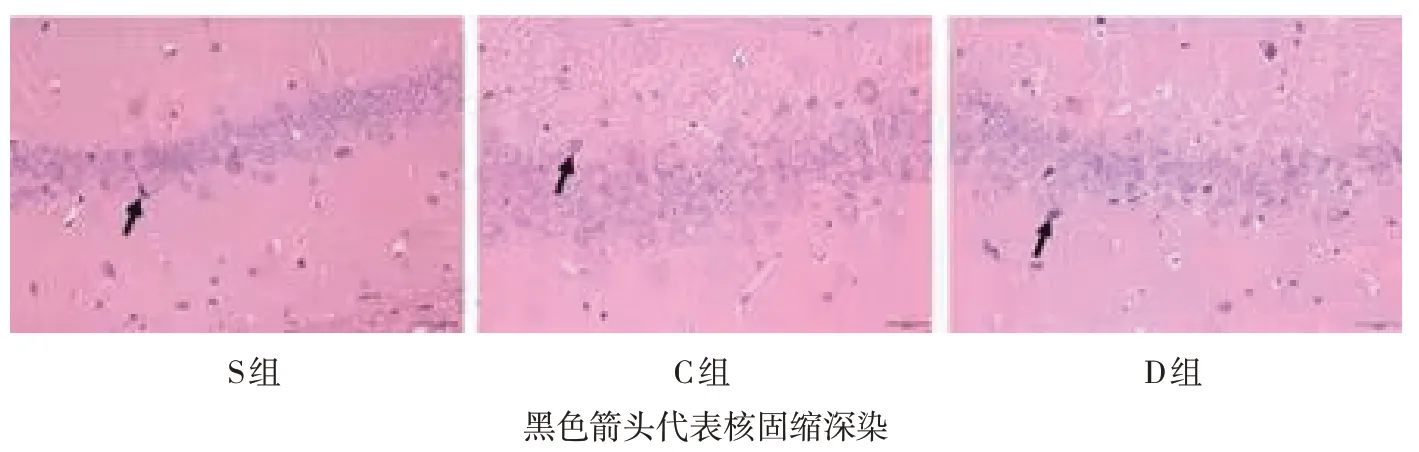
图1 各组大鼠海马组织CA1区病理变化 (HE染色×400)
2.2 各组大鼠血浆TNF-α、IL-6、S100β水平比较
ELISA检测结果显示,S组、C组和D组大鼠血浆中TNF-α、IL-6、S100β水平比较,经方差分析,差异均有统计学意义(P<0.05)。与S组比较,C组和D组血浆中TNF-α、IL-6、S100β水平升高(P<0.05);与C组比较,D组血浆中TNF-α、IL-6、S100β水平降低(P<0.05)。见表1。
表1 各组大鼠血浆TNF-α、IL-6、S100β水平比较(n =6,pg/mL,±s)

表1 各组大鼠血浆TNF-α、IL-6、S100β水平比较(n =6,pg/mL,±s)
注:①与S组比较,P<0.05;②与C组比较,P<0.05。
组别S组C组D组F 值P 值S100β 22.62±1.83 76.23±4.24①45.24±3.58①②381.916 0.000 TNF-α 1.91±0.17 6.14±0.85①3.75±0.40①②88.838 0.000 IL-6 7.66±0.30 32.82±0.88①26.53±1.00①②153 9.548 0.000
2.3 各组大鼠Bcl-2、Bax、Cleaved Caspase-3、p-PPAR γ/ PPAR γ蛋白相对表达量的比较
Western blotting检测结果显示,S组、C组和D组大鼠Bcl-2、Bax、Cleaved Caspase-3、p-PPARγ/PPARγ蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与S组比较,C组和D组海马组织中Bcl-2蛋白相对表达量降低(P<0.05),Bax、Cleaved Caspase-3、p-PPARγ/PPARγ蛋白相对表达量升高(P<0.05);与C组比较,D组海马组织中Bcl-2蛋白相对表达量升高(P<0.05),Bax、Cleaved Caspase-3、p-PPARγ/PPARγ蛋白相对表达量降低(P<0.05)。见表2和图2。
表2 各组海马组织中Bcl-2、Bax、Cleaved Caspase-3、p-PPAR γ/PPAR γ蛋白相对表达量 (n =6,±s)
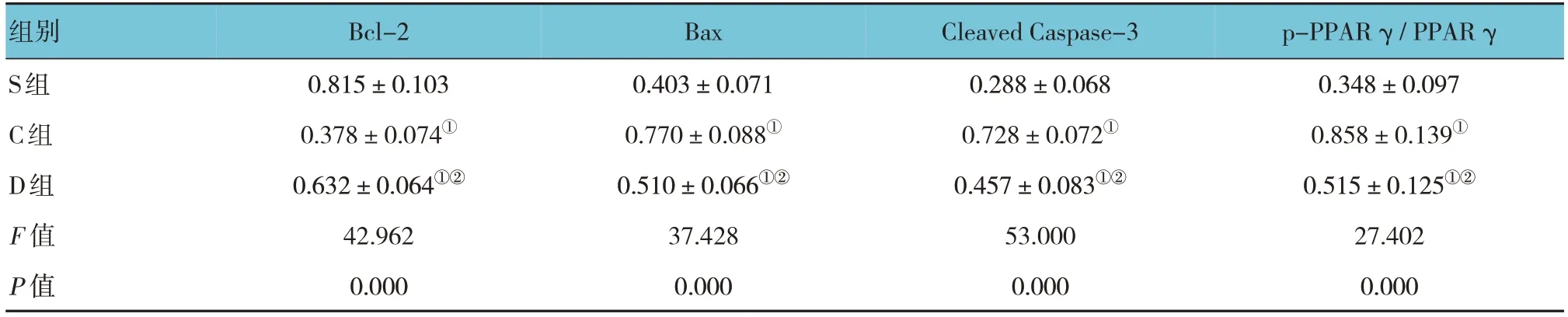
表2 各组海马组织中Bcl-2、Bax、Cleaved Caspase-3、p-PPAR γ/PPAR γ蛋白相对表达量 (n =6,±s)
注:①与S组比较,P<0.05;②与C组比较,P<0.05。
组别S组C组D组F 值P 值p-PPAR γ / PPAR γ 0.348±0.097 0.858±0.139①0.515±0.125①②27.402 0.000 Bcl-2 0.815±0.103 0.378±0.074①0.632±0.064①②42.962 0.000 Bax 0.403±0.071 0.770±0.088①0.510±0.066①②37.428 0.000 Cleaved Caspase-3 0.288±0.068 0.728±0.072①0.457±0.083①②53.000 0.000
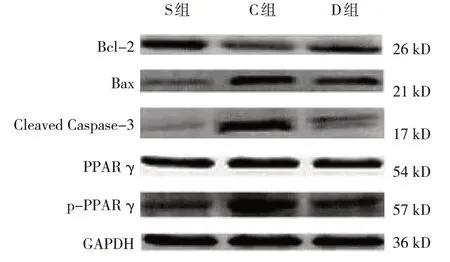
图2 各组大鼠海马组织Bcl-2、Bax、Cleaved Caspase-3、p-PPAR γ/PPAR γ蛋白的表达
2.4 各组海马p-PPAR γ蛋白表达
p-PPARγ阳性产物呈现棕黄色,主要定位在细胞核。S组、C组及D组海马CA1区p-PPAR γ阳性产物MOD值分别为(0.19±0.02)、(0.56±0.03)和(0.26±0.03),经方差分析,差异有统计学意义(F=316.224,P=0.000)。与S组比较,C组和D组海马区p-PPAR γ阳性产物MOD值升高(P<0.05),与C组比较,D组海马区p-PPAR γ阳性产物MOD值降低(P<0.05)。见图3和图4。

图3 各组海马CA1区p-PPAR γ蛋白表达(免疫组织化学染色×400)

图4 各组海马CA1区p-PPARγ阳性产物的MOD值比较(±s)
3 讨论
CPB是大多数心脏外科手术的必备手段,但是CPB是一种非生理状态,可导致脑损伤,CPB后脑损伤是心脏手术的常见并发症之一。在CPB期间,通过激活补体系统、凝血途径、白细胞及释放炎症细胞因子激活全身炎症通路,这一过程会导致大脑的局部炎症加剧、局部缺血和再灌注,以及炎症细胞的激活加剧等现象[6]。有研究表明,术后早期抑制神经系统炎症反应可以减少CPB后行为和神经源性结果的长期缺陷[7]。本研究旨在探究右美托咪定如何减轻CPB相关的脑损伤。
本研究参照文献[8]中的方法复制无血预充大鼠体外循环模型,采用右颈内静脉引流、右股动脉灌注的方式进行转流2 h,左股动脉则用来监测血压与血气分析。各组模型监测项目均稳定成功。根据本课题组以往的研究,在CPB期间经静脉以5 μg/(kg·h)的速度泵注右美托咪定具有较好的脑保护作用[9],故本研究采用5 μg/(kg·h)的速度泵注右美托咪定。
一项Meta分析显示,右美托咪定在临床研究和基础研究中具有减轻应激和炎症反应的作用[10]。右美托咪定可以通过抑制前额叶皮层和海马DG区域的炎症、凋亡及小胶质细胞活化发挥神经保护作用[11]。右美托咪定还可以通过中枢α2肾上腺素受体减轻脓毒症相关的全身炎症、神经炎症、血脑屏障损伤及认知功能障碍[12]。因此,本研究笔者首先探讨右美托咪定与CPB引起的炎症之间的关系。
以往研究表明,CPB期间几种细胞因子显著表达,如TNF-α、TGF-β、IL-1β和IL-6[6]。CPB在诱发全身炎症反应时,脑组织也发生明显的炎症反应。CPB心脏手术中,CPB诱发产生的大量炎症细胞因子随循环进入脑内,同时因脑组织缺血再灌注、降温与复温、微血栓等,脑内也产生了TNF-α、IL-6等炎症细胞因子,这些细胞因子引起脑组织缺血、缺氧和血脑屏障破坏,其中,脑组织炎症反应在CPB所致的脑损伤中起重要作用[13]。本研究通过检测血浆TNF-α和IL-6水平评估CPB期间的炎症反应状况,结果显示,CPB后的C组和D组血浆中TNF-α和IL-6水平较S组均明显升高,CPB后的D组血浆中TNF-α和IL-6水平较C组明显降低。本研究结果提示,CPB可引起血浆中TNF-α和IL-6等炎症细胞因子显著表达,而右美托咪定可降低血浆中TNF-α和IL-6等炎症细胞因子的表达、减轻CPB诱发的炎症反应。
S100β蛋白是一种酸性钙结合蛋白,可从受损神经元渗漏出来,通过血脑屏障进入外周血,是脑损伤特异且灵敏的生化标志物,升高程度与脑损伤程度密切相关[14]。本研究结果显示,CPB转流2 h后,C组和D组血浆中的S100β水平均高于S组,提示CPB过程引发的炎症反应会对脑组织造成一定的损伤。而与C组比较,D组血浆S100β水平降低,提示CPB给予右美托咪定泵注可以显著降低血浆中S100β水平。
本研究对大鼠脑组织进行HE染色,并检测海马组织中Bcl-2、Bax和Cleaved Caspase-3表达来评估右美托咪定对组织病理学变化和神经细胞凋亡的影响。Caspase-3是Caspase家族的核心成员,活化的Caspase-3(Cleaved Caspase-3)是细胞凋亡的关键执行因子,可降解DNA复制相关蛋白、凋亡抑制蛋白和细胞骨架蛋白等,从而促进细胞凋亡[15]。本研究结果显示,右美托咪定能减轻CPB大鼠海马CA1区神经细胞的损伤程度,同时有效提高抗凋亡蛋白Bcl-2的表达,下调促细胞凋亡蛋白Bax和Cleaved Caspase-3的表达,减轻神经细胞凋亡,具有脑保护作用。
PPAR γ是核激素受体家族中的配体激活受体,PPAR γ与配体结合后可同时调节炎症反应和脂质代谢,在多种炎症基因的RNA聚合酶结合位点与其他核转录因子发生交联反应,进而调节炎症反应[16]。已知的PPARγ转录后修饰有磷酸化、乙酰化、泛素化、糖基化等[17]。转录后修饰不仅可以改变蛋白构象,调控蛋白之间的相互作用,而且可以改变受体与配体间的亲和力,从而调控下游基因的转录。在多种刺激和细胞应激下,PPAR γ发生磷酸化位点各不相同,产生的生物学效应也不同[18]。PPAR γ的激活可以通过已知的丝裂原活化蛋白激酶(mitogenactivated protein kinase, MAPK)的3种途径来实现磷酸化过程,分别是细胞外信号调节激酶、p38、c-Jun氨基端激酶[19-20]。在激活功能-1功能结构域上PPAR γ在Ser112位点由MAPK介导的磷酸化可调节配体与配体结合域的结合抑制PPAR γ的活性[21]。增加PPAR γ在Ser273位点磷酸化,降低胰岛素降解酶表达,增加淀粉样蛋白裂解酶-1和淀粉样蛋白前体表达,提高β-淀粉样蛋白水平,诱导神经元凋亡[22]。本研究结果显示,右美托咪定降低了CPB大鼠海马CA1区p-PPARγ/PPARγ比值,说明右美托咪定通过抑制PPARγ磷酸化发挥脑保护作用,对CPB引发的脑损伤产生积极影响。
综上所述,右美托咪定能够有效抑制体外循环海马组织中的PPAR γ磷酸化,减少炎症因子释放及降低S100β蛋白表达,这可能是右美托咪定对CPB引发的脑损伤产生保护作用的原因之一。
