GW0742对凝血酶诱导的体外血脑屏障破坏的保护作用*
2024-02-28汪朝云陈琴王筱雅熊英张金娟张晴冯占辉叶兰
汪朝云,陈琴,王筱雅,熊英,张金娟,张晴,冯占辉,叶兰
(贵州医科大学 1.基础医学院药理学教研室,2.基础医学院多媒体机能学实验室,贵州 贵阳 550025;3.贵州医科大学附属医院 神经内科,贵州 贵阳 550025)
脑出血(intracerebral hemorrhage, ICH)是指原发非创伤性脑实质内血管破裂,是临床较为常见的脑血管疾病,其主要特点表现为病情危重、救治难度大、致残率及致死率较高[1-3]。据研究报道,全球每10万人中就有10~20人会发生ICH,中国ICH患者占所有住院脑卒中患者的18.8%~47.6%[4-5]。在ICH的病理后遗症中,因血肿引起的血脑屏障(blood brain barrier, BBB)破坏是主要问题之一,在该病的病理生理改变中起着至关重要的作用。受到外界刺激时,血脑屏障损伤的标志性蛋白基质金属蛋白酶-9(matrix metallopeptidase-9, MMP-9)表达增加,进一步降解基底膜,促使血脑屏障紧密连接相关蛋白ZO-1、Occludin表达降低,使血脑屏障受到破坏。基于该病的凶险性及目前仍缺乏有效降低病死率和残疾率的治疗方案,本研究探索新型治疗靶点和新药物,对ICH的预防及治疗具有重要的医学意义。
GW0742是一种脂溶性高易透过血脑屏障的PPARβ/δ特异性激动剂。近年来GW0742常用于多种中枢系统疾病的基础研究。有研究报道,GW0742对缺氧缺血大鼠[6-7]、孤独症小鼠[8]、ICH模型小鼠[9]均有保护作用。基于以上研究背景,本文旨在探讨GW0742对凝血酶诱导体外血脑屏障破坏产生的保护作用。
1 材料与方法
1.1 实验动物
选取新生3~7日龄的SPF级SD大鼠若干(由贵州医科大学实验动物中心提供),每提取1次原代细胞取5只,雌雄均可。实验动物生产许可证号:SCXK(湘)2019-0014,实验动物使用许可证号:SYXK(黔)2018-0001。
1.2 主要材料与试剂
胎牛血清(fetal bovine serum, FBS)(美国Thermo Fisher公司,2335473CP),DMEM/F12培养基(美国Thermo Fisher公司,8121756),牛血清白蛋白(bovine serum albumin, BSA)(北京索莱宝科技有限公司,1218Q0511),胰蛋白酶(美国Thermo Fisher公司,8122140),磷酸盐缓冲液(PBS)(北京索莱宝科技有限公司,20210821),D-Hank's缓冲液(美国Thermo Fisher公司,20210416),青霉素-链霉素(北京索莱宝科技有限公司,20211120),Ⅱ型胶原酶(北京索莱宝科技有限公司,525Z023),明胶(北京索莱宝科技有限公司),嘌呤霉素(北京索莱宝科技有限公司,1221S0435),兔抗大鼠Ⅷ因子相关抗原单克隆抗体(美国Thermo Fisher公司,337E3A24),抗兔荧光二抗(上海爱必信生物科技有限公司,A23D26),凝血酶(上海Sigma公司,SLBW2056),GW0742(美国MCE公司,20371),GFAP(美国Thermo Fisher公司,WI3380251),MMP-9抗体、ZO-1抗体、Occludin抗体(武汉爱博泰克生物科技有限公司,批号分别为:A0289、A11417、DF7504),高效RIPA裂解液(组织/细胞)(北京索莱宝科技有限公司,20210908),Pierce BCA蛋白检测试剂盒(美国Thermo Fisher公司,VK316403),PageRuler预染蛋白Marker(美国Thermo Fisher公司,00864849),PVDF微孔转移膜(美国Millipore公司,R0BB23468)。
1.3 仪器
倒置相差显微镜(日本尼康,TS100),正置荧光显微镜(苏州世达普通信设备有限公司,RX50),台式大容量离心机(常州朗越仪器制造有限公司,TDL-40B),恒温摇床(山东欧莱伯仪器有限公司,THZ-82A),细胞培养箱(美国Thermo Fisher公司,2001HY-6003)。
1.4 方法
1.4.1 脑微血管内皮细胞(brain microvascular endothelium cell, BMEC)的原代培养 取5只新生7日龄的SD大鼠,断头处死后浸泡于75%无水乙醇杀菌消毒5 min,置于超净工作台,剪开颅骨,取出大脑半球,置于装有4 ℃预冷的D-Hank's缓冲液的培养皿中,去除小脑、间脑(包括海马组织),保留大脑皮质部,并将其置于无菌滤纸上来回滚动,以除去软脑膜及脑膜大血管等杂质,保留大脑皮质,依次用预冷的D-Hank's液、含双抗的培养基、D-Hank's缓冲液洗涤1次,期间用巴氏吸管或移液枪反复吹打以除去部分血细胞、血凝块及软脑膜,再将大脑皮质部转移至5 mL离心管中剪至约1 mm×1 mm×1 mm的白色肉泥状,过100目细胞筛,收集网下滤液,1 000 r/min离心10 min,收集沉淀并滴加8 mL 0.1 % Ⅱ型胶原酶于37 ℃摇床下消化25 min,1 000 r/min离心5 min,去除上清液后,底部沉淀加入8 mL 20 % BSA,1 000 r/min离心10 min,收集上清液再次离心,离心3次,混合3次离心后所得沉淀,并用完全培养基混匀后接种于未处理的培养瓶中培养1 h,后换用1 %明胶包被的50 mL培养瓶置于37 ℃、5 %二氧化碳培养箱中培养4 d,其后全量换用含2 mg/L嘌呤霉素的培养液培养24 h,再改用不含嘌呤霉素的培养液继续培养,并每隔2 d换液1次,用倒置相差显微镜观察细胞形态,贴壁细胞为BMEC。
1.4.2 星形胶质细胞(Astrocyte, AC)的原代培养 取新生3日龄SD大鼠5只,使用酒精消毒,在超净台下取出大鼠脑组织置于D-Hank's缓冲液中,使用眼科镊轻轻去除大脑表面膜后,将大脑皮层分离出,放入DMEM/F12培养基中,使用剪刀将组织剪成1 mm×1 mm×1 mm的小组织块;将组织块转移至离心管中,加入0.125%胰酶37 ℃消化15 min,每隔5 min轻轻摇晃促进消化,消化结束后使用移液器轻轻将大脑皮层组织吹散,静置30 s,上清用100目细胞筛过滤,1 500 r/min离心5 min;使用DMEM+10% FBS重悬细胞将细胞种在0.1%明胶包被的培养瓶中,每隔3 d半量换液;培养7 d后,在摇床上200 r/min摇晃4 h,去除上清液,用倒置相差显微镜观察细胞形态,贴壁细胞为AC。
1.4.3 原代AC的鉴定 胰酶消化提取原代AC 5 min后,重悬细胞于完全培养基中,充分吹打,使之成为单细胞悬液,计数。根据需要选择合适的细胞密度种于培养板内,滴加细胞悬液时,需依据爬片大小,先在每个孔里准备放爬片的位置上滴加1滴培养基,然后将爬片置于液滴上,压紧,使爬片与培养板的张力黏合在一起,防止加细胞悬液时爬片漂起,造成双层细胞贴片。在培养板中培养好细胞后,吸出培养基,用预冷的PBS洗细胞3次,5 min/次,然后加入预冷的4 %多聚甲醛,常温固定10 min;除去多聚甲醛后,用预冷的PBS洗细胞3次,5 min/次;加入含适量Triton X-100的封闭液,封闭30 min,封闭结束后不用洗,直接上一抗;将GFAP抗体按1∶200比例稀释在一抗稀释液中,去除封闭液后,加入一抗,4 ℃孵育过夜;去除一抗,加入预冷的PBS,洗3次,5 min/次;将荧光二抗分别按照1∶400比例稀释在二抗稀释液中,去除PBS后,加入二抗,室温避光孵育1 h,加入预冷的PBS,洗3次,5 min/次;加入DAPI溶液,室温避光孵育10 min;去除DAPI,加入预冷的PBS,洗3次,5 min/次;加入防荧光淬灭溶液,于正置荧光显微镜下拍照,鉴定细胞。
1.4.4 体外BBB的构建 分别构建BMEC单层培养模型和BMEC+AC共培养模型,分为BMEC单层培养模型组、BMEC+AC共培养组及Blank组(只加培养基)。取原代培养传至第2代的BMEC胰酶消化后,于Transwell小室上室接种BMEC,接种密度为5×106个/mL,下室只加培养基,构建单层培养模型;取原代培养传至第2代的BMEC和AC胰酶消化后,于Transwell小室上室接种BMEC,接种密度为5×106个/mL,下室接种AC,接种密度为5×106个/mL,构建共培养模型;于Transwell小室上室、下室加入培养基,构建Blank组;期间每2 d换液1次,培养5~8 d后检测体外血脑屏障的通透性。
1.4.5 体外BBB通透性的检测 ①4 h渗漏试验:取构建好的体外BMEC单层培养模型、BMEC+AC共培养模型及只加培养基的Blank组,将Transwell小室上室及下室的培养基吸尽,并用PBS冲洗3次后,分别于上室和下室加入0.5和1.5 mL的完全培养基,使上室和下室存在一定的液面差,并将其放入培养箱中继续培养,于4 h后观察液面变化情况。②荧光素钠通透性试验:配置不同浓度(0、0.2、2.0和20.0 μg/mL)荧光素钠,于多功能酶标仪下536 nm波长处测定OD值,绘制标准曲线;取构建好的体外BMEC单层培养模型、BMEC+AC共培养模型及只加培养基的Blank组,将Transwell小室的上室及下室的培养基吸尽,并用PBS冲洗3次后,于BBB单层培养、共培养及Blank组的上室加入含20 μg/mL荧光素钠基础培养基0.5 mL,下室加入不含荧光素钠的基础培养基1.5 mL,并分别于培养0.5、1.0、2.0 h吸取下室培养基各100 μL备用,每组设3个复孔,实验重复3次,于多功能酶标仪下536 nm波长处测定OD值,绘制标准曲线,并根据所得标准曲线计算荧光素钠透过BBB的量。
1.4.6 体外ICH模型的构建 取体外BBB共培养模型,分为Control组与ICH组,Control组加入完全培养基处理,ICH组加入40 u/mL凝血酶处理,分别处理12 h后,检测通透性变化,方法同1.4.5。
1.4.7 给药 取体外BBB共培养模型,将其分为Control组、ICH组,以及GW0742低、中、高剂量组(1.25、2.50、5.00 μmol/L)5个组,Control组加入完全培养基,ICH组、GW0742低、中、高剂量组中均加入40 u/mL的凝血酶,各组分别培养12 h后,Control组、ICH组加入完全培养基,低、中、高剂量组给予相应剂量的GW0742,分别培养24 h后,倒置相差显微镜下观察细胞形态学变化。
1.4.8 Western blotting检测蛋白ZO-1、MMP-9、Occludin的表达 提取各组细胞总蛋白,BCA法定量各组蛋白,制胶,上样,电泳,转膜,室温下快速封闭液封闭20 min后,加入β-actin一抗(1∶1 000)、ZO-1一抗(1∶1 000)、MMP-9一抗(1∶1 000)、Occludin一抗(1∶1 000),4 ℃孵育过夜,TBST清洗3次,5 min/次,室温孵育二抗2 h,TBST清洗3次,5 min/次,使用ECL曝光显影,分析各组条带灰度值。
1.5 统计学方法
数据分析采用SPSS 24.0统计软件,用Graphpad Prism 8.0软件进行绘图。计量资料行正态性检验和方差齐性检验,符合正态分布且方差齐的计量资料,以均数±标准差(±s)表示,两组计量资料的比较用独立样本t检验,多组计量资料的比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 原代细胞的培养
2.1.1 BMEC的原代培养 原代培养的BMEC呈短梭型和多角形生长,当长至第5天后长成其典型的“铺路石”状。见图1。
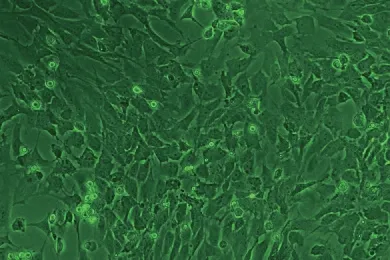
图1 原代培养BMEC的生长情况(倒置相差显微镜×100)
2.1.2 AC的原代培养及鉴定结果 原代培养AC 7 d,第7天去除小胶质细胞,原代AC的形态呈星形发散生长,从胞体发出许多突起和分支;原代培养的AC经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)免疫荧光鉴定结果显示,所提原代细胞确为AC,且其纯度达到实验要求(见图2、3)。
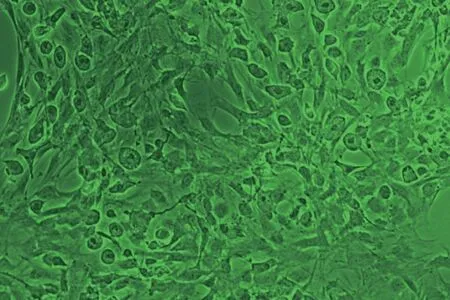
图2 原代培养AC的生长情况(倒置相差显微镜×100)

图3 原代AC的GFAP免疫荧光鉴定(正置荧光显微镜× 200)
2.2 体外BBB通透性的检测结果
2.2.1 4 h渗漏试验 与Blank组比较,BMEC单层培养组能维持一定的液面差;与BMEC单层培养组比较,BMEC+AC共培养组能维持较好的液面差。通透性为:Blank组> BMEC单层培养组> BMEC+AC共培养组。见图4。
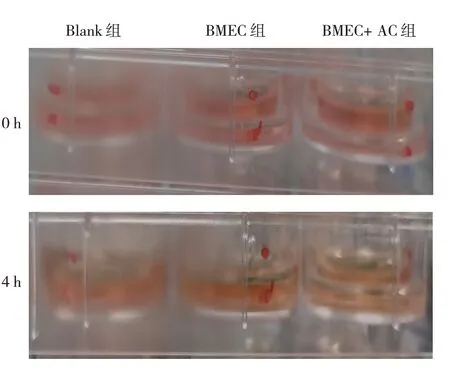
图4 4 h渗漏试验
2.2.2 荧光素钠通透性试验 Blank组、BMEC单层培养组及BMEC+AC共培养组荧光素钠渗透浓度在0.5、1.0和2.0 h时比较,经单因素方差分析,差异均有统计学意义(P<0.05)。进一步两两比较结果显示,与Blank组比较,BMEC单层培养组荧光素钠渗透浓度降低,通透性降低(P<0.05);与BMEC单层培养组比较,BMEC+ AC共培养组荧光素钠渗透浓度降低,通透性降低(P<0.05)。见表1和图5。
表1 培养0.5、1.0和2.0 h时各组荧光素钠的渗透浓度比较 (μg/mL,±s)
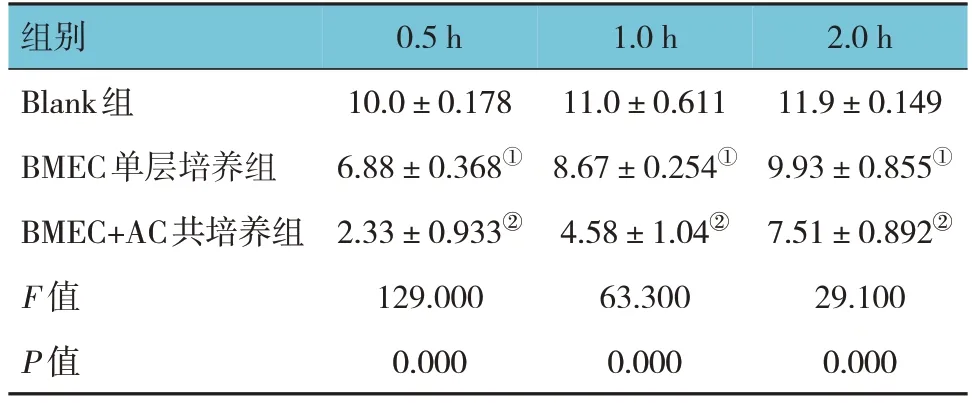
表1 培养0.5、1.0和2.0 h时各组荧光素钠的渗透浓度比较 (μg/mL,±s)
注:①与Blank组比较,P<0.05;②与BMEC单层培养组比较,P<0.05。
0.5 h 10.0±0.178 6.88±0.368①2.33±0.933②129.000 0.000组别Blank组BMEC单层培养组BMEC+AC共培养组F 值P 值1.0 h 11.0±0.611 8.67±0.254①4.58±1.04②63.300 0.000 2.0 h 11.9±0.149 9.93±0.855①7.51±0.892②29.100 0.000
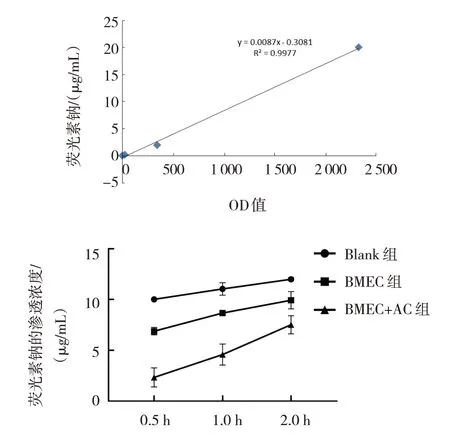
图5 荧光素钠标准曲线及荧光素钠渗透浓度比较
2.3 体外ICH模型的通透性评价
2.3.1 4 h渗漏试验 与Control组比较,ICH组液面差降低,通透性增加(见图6)。

图6 体外BBB双层模型及体外ICH模型的渗漏性试验
2.3.2 荧光素钠通透性试验 Control组的荧光素钠的渗透浓度与ICH组比较,经t检验,差异有统计学意义(P<0.05);与Control组比较,ICH组在0.5、1.0和2.0 h时,荧光素钠渗透浓度增加,通透性增加。见表2和图7。
表2 两组荧光素钠的渗透浓度比较 (μg/mL,±s)

表2 两组荧光素钠的渗透浓度比较 (μg/mL,±s)
注:†与Control组比较,P<0.05。
组别Control组ICH组t 值P 值2 h 7.51±0.89 10.3±0.61†20.100 0.011 0.5 h 2.33±0.93 4.74±0.57†14.500 0.018 1 h 4.58±1.04 9.29±0.49†50.600 0.002
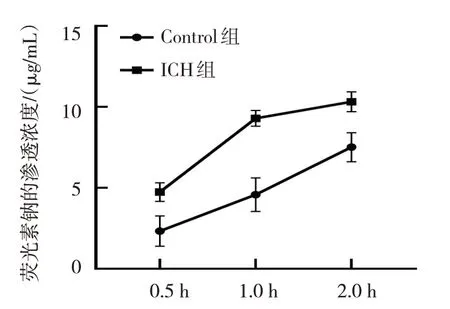
图7 Control组与ICH模型组通透性比较
2.3.3 形态学观察 培养12 h后,与Control组比较,ICH组的紧密连接结构明显被破坏,细胞形态改变(红色箭头所示)。见图8。

图8 Control组与ICH组细胞形态学观察(倒置相差显微镜×100)
2.4 药效研究结果
2.4.1 形态学观察 细胞形态学观察结果显示,与Control组比较,ICH组内皮细胞形态明显皱缩、拉长;与ICH组比较,给药组内皮细胞形态未见明显皱缩、拉长,呈剂量依赖。见图9。
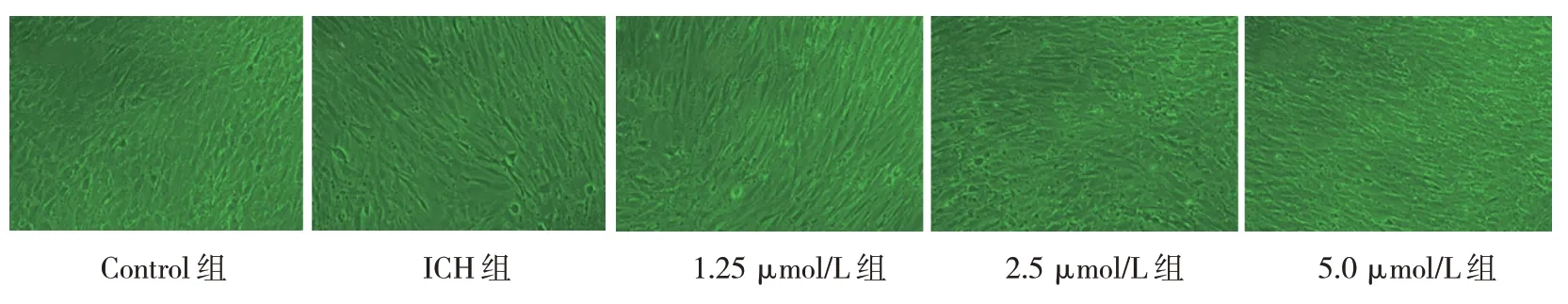
图9 给药后细胞形态学观察 (倒置相差显微镜×100)
2.4.2 各组ZO-1、MMP-9、Occludin蛋白相对表达量比较 Control组、ICH组、GW0742低、中、高剂量组的ZO-1、MMP-9、Occludin蛋白相对表达量比较,经单因素方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果显示,与Control组比较,ICH组MMP-9蛋白相对表达量升高(P<0.05),ZO-1、Occludin蛋白相对表达量降低(P<0.05);与ICH组比较,GW0742高剂量组MMP-9蛋白相对表达量降低(P<0.05),ZO-1、Occludin蛋白相对表达量升高(P<0.05)。见表3和图10。
表3 各组ZO-1、MMP-9、Occludin蛋白相对表达量比较 (±s)
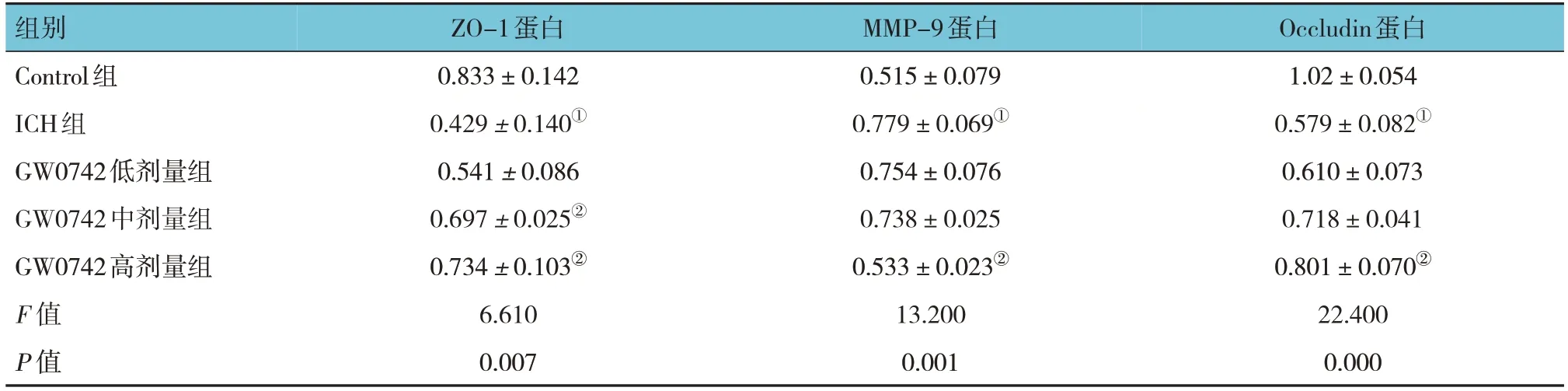
表3 各组ZO-1、MMP-9、Occludin蛋白相对表达量比较 (±s)
注:①与Control组比较,P<0.05;②与ICH组比较,P<0.05。
组别Control组ICH组GW0742低剂量组GW0742中剂量组GW0742高剂量组F 值P 值Occludin蛋白1.02±0.054 0.579±0.082①0.610±0.073 0.718±0.041 0.801±0.070②22.400 0.000 ZO-1蛋白0.833±0.142 0.429±0.140①0.541±0.086 0.697±0.025②0.734±0.103②6.610 0.007 MMP-9蛋白0.515±0.079 0.779±0.069①0.754±0.076 0.738±0.025 0.533±0.023②13.200 0.001

图10 各组ZO-1、MMP-9、Occludin蛋白表达
3 讨论
ICH是一种较为严重的脑血管疾病,致残率和致死率均较高[10]。而在ICH的几种病理后遗症中,血肿引起BBB的破坏是主要问题之一,在该病的病理生理改变中起着至关重要的作用。ICH发生后,血液成分进入大脑,激活先天和获得性免疫反应,导致各种细胞因子、趋化因子、自由基及其他潜在有毒化学物质的释放[11];在这些分子共同作用下,导致继发性脑损伤,表现为BBB完整性受损、邻近组织破坏,以及细胞死亡[12];而血脑屏障的破坏又导致组织渗出、神经元坏死和细胞凋亡,进一步加重脑水肿[13]。因此,深入探讨并研究ICH后血脑屏障破坏的继发性损伤机制及相关治疗药物可能为ICH的防治提供新的思路。
血脑屏障主要由脑微血管内皮细胞、周细胞及星形胶质细胞组成,其中脑微血管内皮细胞是血脑屏障的主要组成部分,而脑微血管内皮细胞与其他外周血管内皮细胞不同的是脑微血管内皮细胞主要由紧密连接蛋白将脑微血管内皮细胞紧密连接在一起,形成了这一特殊屏障,因此,当血脑屏障受到破坏时,血脑屏障打开,紧密连接蛋白会相应发生改变,如ZO-1、Occludin、Claudin蛋白会相应下调,血脑屏障损伤的标志蛋白MMP-9会相应上调。
凝血酶是ICH后凝血瀑布被激活所释放的一种酶,凝血酶可以参与ICH所致的损伤,同时也可作用于多种类型的细胞,包括脑内皮细胞、神经元和星形胶质细胞、小胶质细胞,并能导致血脑屏障破坏和脑水肿形成;凝血酶在ICH后除参与凝血外,同时也是一种促炎因子和神经毒性介质,体外高浓度可抑制神经元和星形胶质细胞生长繁殖,将大剂量凝血酶直接注入脑内会引起炎症细胞浸润、间充质细胞增殖、瘢痕形成、脑水肿形成和癫痫发作。因此为模拟ICH的病理生理过程,选择在体外血脑屏障模型构建成功后加入40 u/mL凝血酶来模拟体外ICH细胞模型。
GW0742是一种特异性的PPARβ/δ激动剂,近年来其在多种中枢疾病中均有研究,如缺氧缺血、孤独症、ICH动物疾病模型中均有报道。因此更为深入地研究探讨其对ICH的作用是必要的,本研究旨在利用原代提取的脑微血管内皮细胞及星形胶质细胞于体外构建血脑屏障模型,待血脑屏障模型构建成功后以40 u/mL凝血酶处理12 h模拟体外ICH模型,后给予GW0742,研究GW0742是否对ICH所致血脑屏障破坏具有保护作用,以期为后续ICH研究治疗提供依据。通过体外试验结果显示,ICH后血脑屏障损伤的标志蛋白MMP-9表达升高,紧密连接蛋白Occludin、ZO-1表达下降;给予GW0742后,血脑屏障损伤的标志蛋白MMP-9表达下降,Occludin、ZO-1蛋白表达升高,改善了由凝血酶诱导的血脑屏障破坏情况;因此推测GW0742能对ICH所致血脑屏障破坏具有保护作用,其保护作用可能与其抑制MMP-9的过度表达及促进了紧密连接蛋白Occludin、ZO-1的表达有关。
综上所述,本文通过原代脑微血管内皮细胞及星形胶质细胞构建体外血脑屏障,并以40 u/mL凝血酶模拟体外ICH模型促使血脑屏障破坏,后给予GW0742治疗,结果表明GW0742对ICH所致血脑屏障破坏具有保护作用,其保护作用可能与其抑制MMP9的过度表达及促进紧密连接蛋白Occludin、ZO-1表达有关。
