缺血性脑卒中后抑郁患者外周血CDC42、Th17细胞表达及与抑郁程度的相关性分析*
2024-02-28马海峰常青贾聚娟张耀元宋爱霞
马海峰,常青,贾聚娟,张耀元,宋爱霞
(河北北方学院附属第一医院 神经内科,河北 张家口 075000)
缺血性脑卒中是临床常见的致残性、致死性疾病。流行病学研究显示超过1/3的卒中患者可出现不同程度的卒中后抑郁,患者通常存在兴趣缺失、情绪低落等状态或表现,卒中后抑郁不仅可延缓患者认知和神经功能的恢复,还会加重家庭和社会的负担,增加致残和致死的风险[1-3]。细胞分裂周期蛋白42(cell division cycle protein 42, CDC42)是一种小谷氨酸-丙酮酸氨基转移酶,参与大部分神经细胞的发育,近些年其在神经系统疾病中的研究逐渐增多,可能成为精神分裂症、脑卒中、癫痫等疾病中潜在的治疗靶点[4-5]。研究显示,CDC42在缺血性脑卒中患者外周血淋巴细胞中的表达明显降低,因此考虑CDC42与缺血性脑卒中的发病存在一定相关性[6]。辅助性T细胞17(helper T cells 17, Th17)是T细胞的亚群之一,Th17细胞因子表达量的增加能够诱导Th1细胞分化从而促进炎症反应增强,导致神经损伤加重,其与脑卒中发病机制的关系仍是临床研究的热点[7-8]。本研究旨在观察缺血性脑卒中患者外周血CDC42、Th17细胞的表达并探究其与患者抑郁程度的相关性,期望为脑卒中焦虑、抑郁、认知障碍的诊治提供外周血生物标志和科学依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2022年1月—2023年1月河北北方学院附属第一医院收治的200例缺血性脑卒中患者为观察组,另选取同期本院200例体检健康者为对照组。纳入标准:①根据《中国急性缺血性脑卒中诊治指南2018》[9]相关诊断标准,局灶性脑神经功能缺损持续时间> 24 h,经CT或MRI检查显示有新发梗死灶;②发病后24 h内入院;③年龄18~80岁。排除标准:①合并严重感染、炎症或自身免疫性疾病;②失语、偏瘫无法配合研究;③颅内出血;④既往有精神病病史或服用抗精神病药物;⑤既往有酒精、药物依赖。两组性别构成、年龄、体质量指数(body mass index, BMI)、文化程度、吸烟史、饮酒史比较,差异无统计学意义(P>0.05)(见表1)。采用蒙哥马利抑郁评定量表[10]评估患者的抑郁状态。该量表共10个项目,采用7级评分法,每项0~6分,满分60分;得分< 12分为无抑郁,12~21分为轻度抑郁,22~29分为中度抑郁,30~34分为重度抑郁,得分≥35分为极度抑郁。根据得分将观察组分为无抑郁组116例、轻度抑郁组38例、中度抑郁组31例、重度抑郁组15例。所有研究对象均在实验前知晓本实验的目的并签署知情同意书。本研究实验流程经医院医学伦理学委员会批准,并遵循赫尔辛基宣言和相应的规章制度。
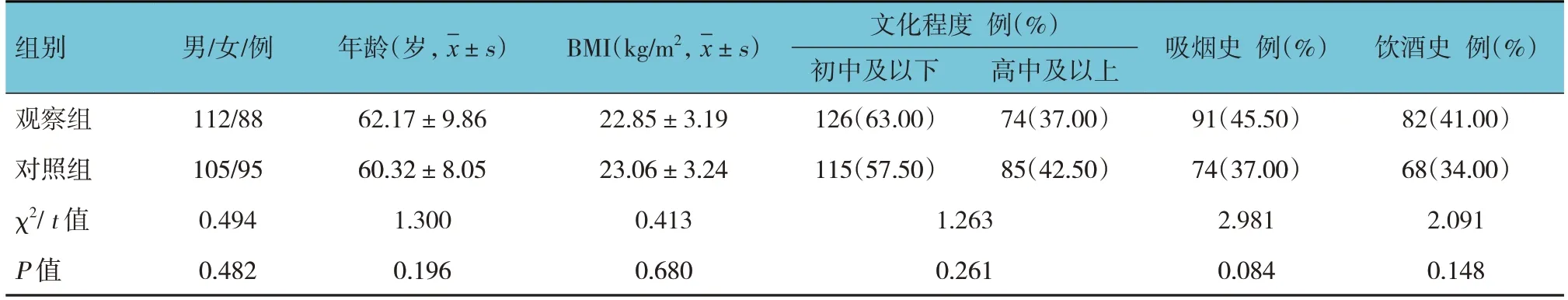
表1 两组一般资料比较
1.2 方法
1.2.1 干预方法 观察组入院后接受常规抗血小板聚集、降脂等对症支持治疗,并采用多感官刺激方案对患者进行持续干预。①触觉感觉刺激:患者清洁双手并修剪指甲,取正坐位,指导患者将手指分开呈扇形,略微弯曲并放置在前额头皮处,略微用力使用指腹按压头皮,从额头前发际往上方游走,从百会穴向颈部风府穴等穴区进行按压,行至穴位时稍微停顿并向下稍用力按压持续数秒。按压轻重程度根据患者主观感觉确定,力度以感觉肌肤松弛、头部酸胀为准。②视听感觉刺激:利用视频播放器和音乐播放器播放视频和音频,视频内容主要为森林、山川、海洋、江河、风土民俗、节日庆典等自然及人文景观,通过色彩鲜明的景象刺激患者的视觉感受器。音乐播放器播放α波音乐,音量控制为20~60分贝,患者闭眼,医护人员或家属引导患者回忆视频中的内容,α波音乐有利于调节脑波,将其控制在60~70节拍、频率8~14的α波状态,有利于缓解焦虑、抑郁等负性情绪。③嗅觉感觉刺激:使用薰衣草精油(已使用葡萄籽油稀释,比例1滴精油∶5 mL葡萄籽油),分别在患者的耳后、前额处涂抹精油,以患者面部表情舒缓、呼吸平稳为标准,患者闭眼感受、细嗅精油的特殊气味。若患者对其不耐受则改用香橙精油,两种精油均有利于放松身心、改善睡眠、改善记忆力,可缓解焦虑抑郁状态。
1.2.2 医院焦虑抑郁量表(hospital anxiety and depression scale, HADS) HADS量表分为焦虑(hospital anxiety and depression scale anxiety subscale,HADS-A)评分和抑郁(hospital anxiety and depression scale depression subscale, HADS-D)评分,每个量表均包含7个项目,采用4级评分法,每项1~4分,总分7~28分,得分越高表示焦虑、抑郁越严重[11]。
1.2.3 简易精神状态评价量表(mini-mental state examination, MMSE)评分 MMSE评分包含定向力、计算力、注意力、语言能力等19个问题,共30项,总分30分,得分27~30分为正常,< 27分为认知功能障碍[12]。
1.2.4 观察组干预前后日常生活活动能力(activities of daily living, ADL)评分 ADL评分共包含步行、上下楼梯、吃饭、洗澡、穿衣、如厕等项目,总分100分,得分越高表示患者自理能力越好[12]。
1.2.5 外周血CDC42、Th17、调节性T细胞(regulatory T-cell, Treg)、Th17/Treg检测 收集所有研究对象的外周血样本,清晨采集空腹静脉血2 mL于抗凝管中,2 mL放于非抗凝管中,4 ℃、3 000 r/min离心20 min。分离血浆并储存在-80 ℃环境下。使用血细胞分析仪(XN-350型,日本System株式会社)检测外周血Th17、Treg细胞比例,计算Th17/Treg;使用实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)检测血浆CDC42 mRNA相对表达量,正向引物:5'-GCCCGTGA CCTGAAGGCTGTCA-3',反向引物:5'-TGCTTTTAGTA TGATGCCGACACCA-3',长度分别为18和22 bp,以GAPDH为内参基因,扩增片段407 bp。使用美国Thermo公司的TRIzol试剂提取总DNA,之后逆转录合成cDNA,逆转录反应体系为2 μL 5×RT Buffer,0.5 μL Primer Mix,800 ng RNA,最后使用无核酸酶水补足体积至10 μL。先于37 ℃下进行15 min逆转录反应,98 ℃下进行5 min酶失活反应,反应结束后于-20 ℃冰箱冷冻保存。qRT-PCR反应体系按照12.5 μL SYBR Premix Ex Taq,1.0 μL Forward Primer,1.0 μL Uni-miR qPCR Primer,2.0 μL cDNA模板,8.5 μL双蒸水,总体积25 μL。反应条件:95 ℃预变性30 s,95℃变性5 s;60 ℃退火20 s,共40个循环。以2-ΔΔCt法计算CDC42 mRNA相对表达量。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,两两比较采用LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验;相关性分析用Pearson法。P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组HADS评分、MMSE评分比较
观察组与对照组HADS-A评分、HADS-D评分和MMSE评分比较,差异均有统计学意义(P<0.05),观察组HADS-A评分、HADS-D评分均高于对照组,MMSE评分低于对照组。见表2。
表2 观察组与对照组HADS评分、MMSE评分比较(n =200,±s)
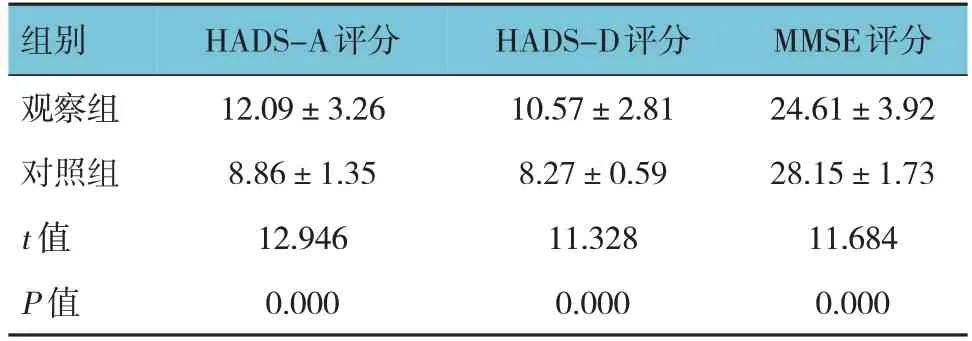
表2 观察组与对照组HADS评分、MMSE评分比较(n =200,±s)
组别观察组对照组t 值P 值HADS-A评分12.09±3.26 8.86±1.35 12.946 0.000 HADS-D评分10.57±2.81 8.27±0.59 11.328 0.000 MMSE评分24.61±3.92 28.15±1.73 11.684 0.000
2.2 不同抑郁程度患者HADS评分、MMSE评分比较
各组的HADS-A评分、HADS-D评分、MMSE评分比较,差异均有统计学意义(P<0.05)。重度抑郁组HADS-A评分、HADS-D评分高于其他组(P<0.05),MMSE评分低于其他组(P<0.05);中度抑郁组HADS-A评分、HADS-D评分高于轻度抑郁组和无抑郁组(P<0.05),MMSE评分低于轻度抑郁组和无抑郁组(P<0.05);轻度抑郁组HADS-A评分、HADS-D评分高于无抑郁组(P<0.05),MMSE评分低于无抑郁组(P<0.05)。见表3。
表3 不同抑郁程度患者HADS评分、MMSE评分比较(±s)
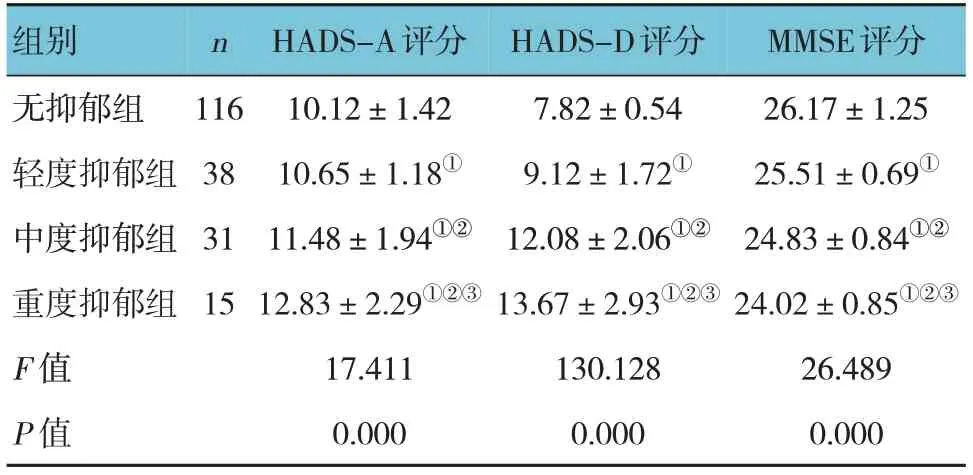
表3 不同抑郁程度患者HADS评分、MMSE评分比较(±s)
注:①与无抑郁组比较,P<0.05;②与轻度抑郁组比较,P<0.05;③与中度抑郁组比较,P<0.05。
MMSE评分26.17±1.25 25.51±0.69①24.83±0.84①②24.02±0.85①②③26.489 0.000组别无抑郁组轻度抑郁组中度抑郁组重度抑郁组F 值P 值n 116 38 31 15 HADS-A评分10.12±1.42 10.65±1.18①11.48±1.94①②12.83±2.29①②③17.411 0.000 HADS-D评分7.82±0.54 9.12±1.72①12.08±2.06①②13.67±2.93①②③130.128 0.000
2.3 观察组与对照组外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较
观察组与对照组外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较,差异均有统计学意义(P<0.05),观察组外周血CDC42 mRNA、Treg细胞表达水平低于对照组,外周血Th17细胞、Th17/Treg表达水平高于对照组。见表4。
表4 观察组与对照组外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较 (n =200,±s)
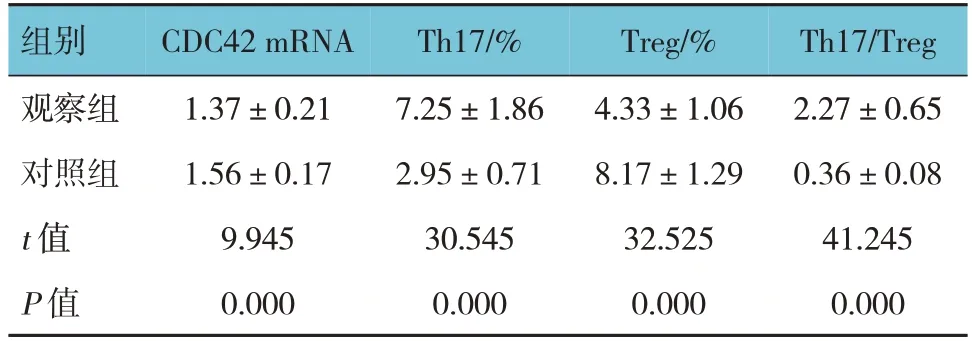
表4 观察组与对照组外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较 (n =200,±s)
组别观察组对照组t 值P 值CDC42 mRNA 1.37±0.21 1.56±0.17 9.945 0.000 Th17/%7.25±1.86 2.95±0.71 30.545 0.000 Treg/%4.33±1.06 8.17±1.29 32.525 0.000 Th17/Treg 2.27±0.65 0.36±0.08 41.245 0.000
2.4 不同抑郁程度患者外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较
各组外周血CDC42 mRNA比较,差异无统计学意义(P>0.05)。各组外周血Th17细胞、Treg细胞、Th17/Treg表达水平比较,差异均有统计学意义(P<0.05);重度抑郁组Th17细胞、Th17/Treg表达水平高于其他组(P<0.05),Treg细胞表达水平低于另外组(P<0.05),中度抑郁组Th17细胞、Th17/Treg表达水平高于轻度抑郁组、无抑郁组(P<0.05),Treg细胞表达水平低于轻度抑郁组、无抑郁组(P<0.05),轻度抑郁组Th17细胞、Th17/Treg表达水平高于无抑郁组(P<0.05),Treg细胞表达水平低于无抑郁组(P<0.05)。见表5。
表5 不同抑郁程度患者外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较 (±s)
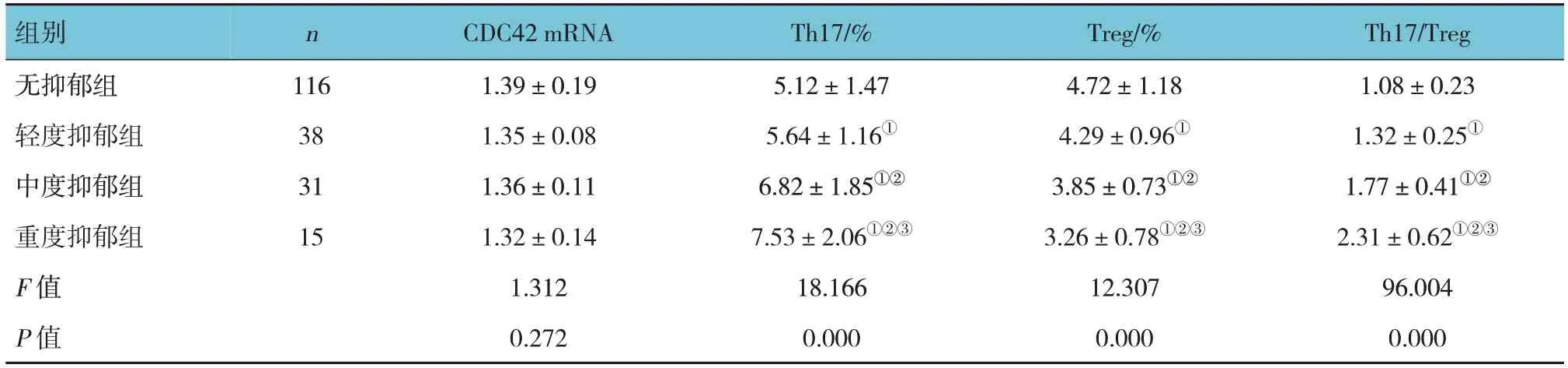
表5 不同抑郁程度患者外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较 (±s)
注:①与无抑郁组比较,P<0.05;②与轻度抑郁组比较,P<0.05;③与中度抑郁组比较,P<0.05。
组别无抑郁组轻度抑郁组中度抑郁组重度抑郁组F 值P 值Th17/Treg 1.08±0.23 1.32±0.25①1.77±0.41①②2.31±0.62①②③96.004 0.000 n 116 38 31 15 CDC42 mRNA 1.39±0.19 1.35±0.08 1.36±0.11 1.32±0.14 1.312 0.272 Th17/%5.12±1.47 5.64±1.16①6.82±1.85①②7.53±2.06①②③18.166 0.000 Treg/%4.72±1.18 4.29±0.96①3.85±0.73①②3.26±0.78①②③12.307 0.000
2.5 观察组干预前后HADS评分、MMSE评分、ADL评分比较
观察组干预前后HADS-A评分、HADS-D评分、MMSE评分、ADL评分比较,差异均有统计学意义(P<0.05),观察组干预后HADS-A评分、HADS-D评分低于干预前,MMSE评分、ADL评分高于干预前。见表6。
表6 观察组干预前后HADS评分、MMSE评分、ADL评分比较 (n =200,±s)
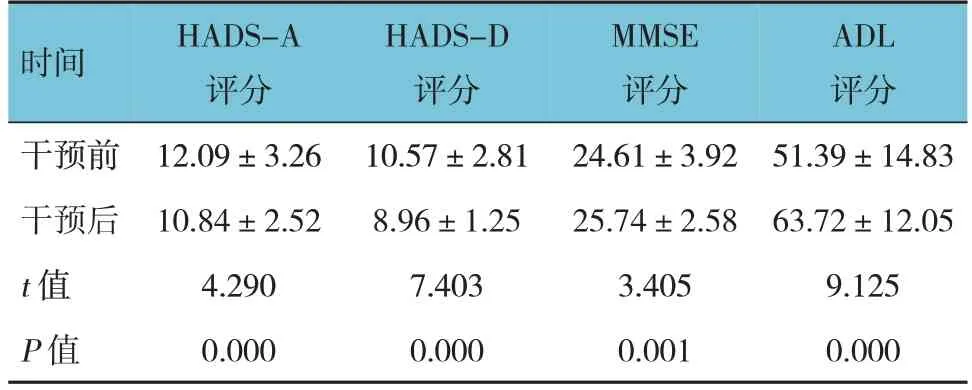
表6 观察组干预前后HADS评分、MMSE评分、ADL评分比较 (n =200,±s)
时间干预前干预后t 值P 值HADS-A评分12.09±3.26 10.84±2.52 4.290 0.000 HADS-D评分10.57±2.81 8.96±1.25 7.403 0.000 MMSE评分24.61±3.92 25.74±2.58 3.405 0.001 ADL评分51.39±14.83 63.72±12.05 9.125 0.000
2.6 观察组干预前后外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较
观察组干预前后外周血CDC42 mRNA表达水平比较,差异无统计学意义(P>0.05)。观察组干预前后外周血Th17细胞、Treg细胞、Th17/Treg表达水平比较,差异均有统计学意义(P<0.05),观察组干预后外周血Th17细胞、Th17/Treg表达水平低于干预前,外周血Treg细胞表达水平高于干预前。见表7。
表7 观察组干预前后外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较 (n =200,±s)
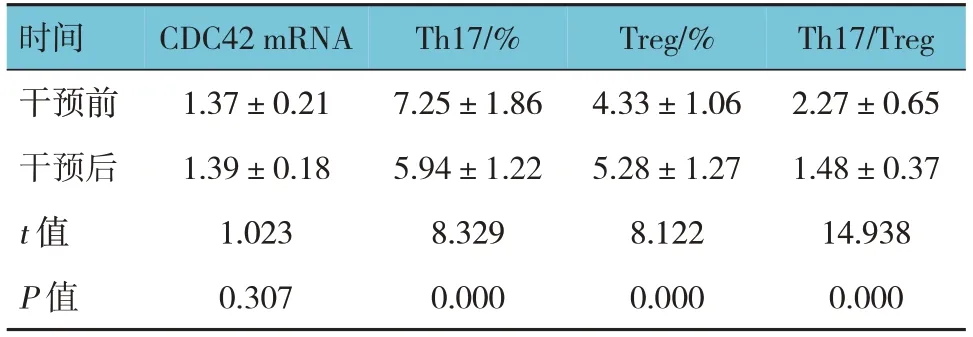
表7 观察组干预前后外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平比较 (n =200,±s)
时间干预前干预后t 值P 值CDC42 mRNA 1.37±0.21 1.39±0.18 1.023 0.307 Th17/%7.25±1.86 5.94±1.22 8.329 0.000 Treg/%4.33±1.06 5.28±1.27 8.122 0.000 Th17/Treg 2.27±0.65 1.48±0.37 14.938 0.000
2.7 观察组患者外周血CDC42 mRNA、Th17细胞、Treg细胞、Th17/Treg表达水平与HADS评分的相关性分析
观察组患者外周血Th17细胞、Th17/Treg表达与HADS评分呈正相关(r=0.673和0.603,P=0.007和0.011),外周血Treg细胞表达与HADS评分呈负相关(r=-0.586,P=0.013),外周血CDC42 mRNA与HADS评分无相关性(r=-0.375,P=0.194)。见图1~4。
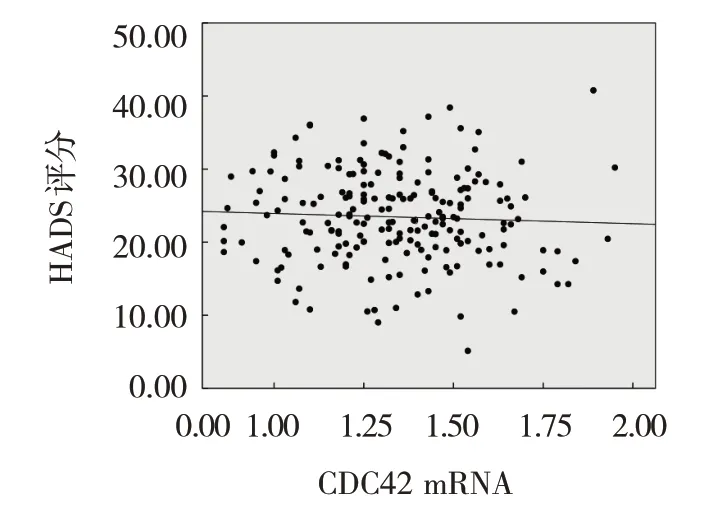
图1 外周血CDC42 mRNA与HADS评分的相关性散点图
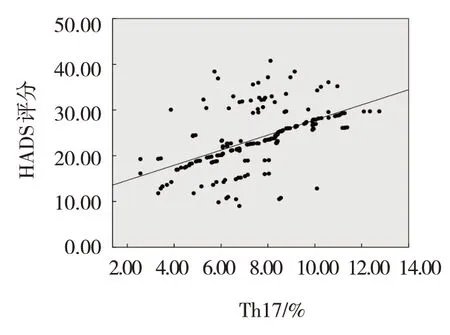
图2 外周血Th17细胞表达与HADS评分的相关性散点图

图3 外周血Treg细胞表达与HADS评分的相关性散点图
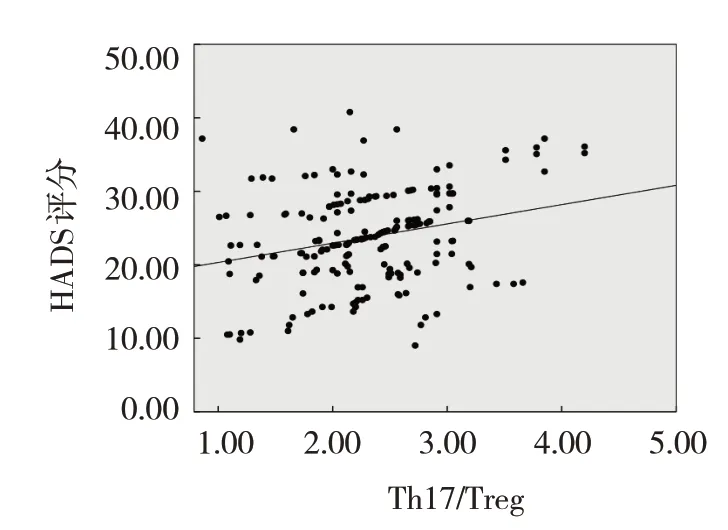
图4 外周血Th17/Treg表达水平与HADS评分的相关性散点图
3 讨论
卒中后抑郁是缺血性脑卒中患者的常见的合并症,其病理机制与多种因素有关,同时涉及精神病学领域和神经病学范畴,目前比较认同的机制包括分子生物学和社会心理学,其中分子生物学是临床研究最重要的领域[13-14]。因此,临床研究缺血性脑卒中的发病机制,对提出更优化的康复治疗方案、行为干预措施,提高患者生活质量,促进全民健康,减轻家庭、社会负担具有重要意义。随着分子生物学的发展,CDC42、Th17等生物学标志物被逐渐引入。有研究显示,卒中患者通过降低促炎细胞Th17水平,有利于降低抑郁的发生率,考虑抗炎治疗可能有利于降低卒中后抑郁发生的风险[15]。CDC42、Th17等与缺血性脑卒中的发病密切相关,有望成为脑卒中焦虑、抑郁、认知功能障碍等事件的生物指标或治疗靶点,为该病的临床诊治提供依据[16-17]。
本研究结果显示,观察组HADS评分高于对照组,MMSE评分低于对照组,提示缺血性脑卒中患者存在焦虑、抑郁等负性情绪及认知功能损伤。缺血性脑卒中患者在发病后短时间即可出现语言和肢体功能障碍,同时也可发生神经-内分泌系统损伤,而部分精神症状的发生相对滞后[18]。下丘脑作为缺血性脑卒中的好发部位,也是表达情绪的重要部位,下丘脑受损后可对下丘脑-垂体-肾上腺轴和自主神经的结构和功能造成影响,引起细胞免疫水平降低,患者精神状态的变化可能与免疫功能的变化有关[19-20]。
本研究结果显示,观察组外周血CDC42表达低于对照组,提示CDC42表达可能与缺血性脑卒中的发病机制有关,CDC42在神经细胞的生长、迁移等生理过程中均有参与,神经细胞发育时,轴突从细胞体向外延伸,并和其他细胞形成突触联系,CDC42缺失的神经细胞丝状足生长较慢、数量较少,CDC42对于轴突的生长仍有缺陷,考虑在轴突的发育和延伸过程中CDC42具有调节作用,因此CDC42的表达可在一定程度上反映缺血性脑卒中患者的神经损伤[21-22]。另有研究显示,CDC42蛋白表达水平和阳性率在缺血性脑卒中患者外周血淋巴细胞中均明显降低,缺血性脑卒中患者发病后CDC42活性受到影响,而酰基生长素释放肽对于神经功能具有保护作用,对轴突生长具有促进作用,能够缓解脑损伤[23]。既往研究通过蛋白质组学发现CDC42参与了神经突的生长过程;此外CDC42还是屏障功能和内皮细胞迁移的调节因子,经炎症作用影响血管内皮细胞的修复,对中性粒细胞迁移进行调节,参与缺血性脑卒中患者神经损伤的修复[24]。本研究结果显示,不同抑郁程度缺血性脑卒中患者CDC42 mRNA表达比较无明显差异,提示缺血性脑卒中患者的抑郁程度与其外周血CDC42表达无相关性,其原因可能是轻度抑郁组、中度抑郁组、重度抑郁组中样本量较小,对统计学结果造成一定影响。
本研究结果显示,观察组外周血Th17细胞、Th17/Treg表达水平高于对照组,Treg表达水平低于对照组,并且随着抑郁程度加重,外周血Th17细胞、Th17/Treg表达水平呈升高趋势,Treg细胞表达呈下降趋势,提示患者抑郁程度与外周血Th17细胞、Treg细胞、Th17/Treg的表达存在一定相关性。卒中后抑郁的发病机制较为复杂,可受到多种因素影响,如免疫系统激活、炎症反应、基因多态性等[25-27]。CD4+T淋巴细胞可分化为Th17细胞和Treg细胞,Th17细胞特征性分泌白细胞介素-17,与受体结合后,可促进炎症因子表达,刺激T细胞活化,增强组织炎症反应[28]。Treg细胞能起到免疫抑制作用,对于抑制性T细胞具有活化作用,能够分泌多种抗炎因子如白细胞介素-10,参与自身免疫调节[29]。两者对免疫功能起到互反的调节作用,相互拮抗,调节机体炎症和免疫炎症的动态平衡,最后可能影响到神经递质异常,从而影响卒中后抑郁的发生[30]。
另外观察组干预后HADS评分、MMSE评分、ADL评分及外周血Th17细胞、Treg细胞、Th17/Treg表达水平均有所改善,提示合理干预,有利于减轻焦虑抑郁等负性情绪,防止病情加重,提高患者生活质量。本研究通过多感官刺激方案进行干预,有利于提高患者的皮质可塑性,对于皮质功能的重塑、重组具有促进作用,能够代偿受损神经,改善患者的认知功能。另外该方案通过多个感官刺激吸引患者视听感觉的注意力,促进患者与环境的沟通交互,放松身心,减轻抑郁。
综上所述,缺血性脑卒中患者外周血CDC42表达明显降低、Th17表达明显升高,其可能参与了缺血性脑卒中的发病,并且Th17的表达与患者抑郁程度呈正相关,对于临床诊治卒中后抑郁具有一定的参考价值,临床根据患者病情采取相应的干预措施有利于减轻抑郁情绪,控制病情发展。而CDC42与患者的抑郁程度无相关性,可能与样本量较小有关,CDC42与卒中后抑郁的联系与作用机制有待进一步研究验证。
