甲酰基肽受体1 对脊髓损伤后小胶质细胞诱导的炎性反应的影响
2024-02-27魏飞龙周程沛袁一方郭时空高浩然钱济先高全有
宋 扬,钱 澍,魏飞龙,周程沛,袁一方,郭时空,高浩然,钱济先,高全有
空军军医大学第二附属医院骨科,西安 710038
脊髓损伤(SCI)是外力直接或间接作用于脊髓造成的损伤,致残率极高,给患者及其家庭带来沉重的负担[1]。SCI 主要包括原发性损伤和继发性损伤,原发性损伤往往不可逆转,继发性损伤包括神经胶质细胞活化、炎性反应、外周免疫细胞浸润、出血、缺氧和轴突脱髓鞘等,其中,炎性反应被认为是SCI 患者预后较差的重要因素,抑制炎性反应能够显著降低患者的致死率和致残率[2-3]。小胶质细胞是中枢神经系统重要的免疫细胞,其活化在SCI 相关的神经病理过程中发挥着关键作用[4-5]。病原相关分子模式(PAMP)和损伤相关分子模式(DAMP)能够与模式识别受体(PRR)结合,从而发挥免疫调控作用[6]。在中枢神经系统,PRR 主要表达于小胶质细胞、星形胶质细胞和巨噬细胞[7]。近几年,甲酰基肽受体1(Fpr1)作为被关注较多的PRR,被发现在人体固有免疫反应中扮演着重要角色,其病理机制已在多种中枢神经系统疾病模型中得到进一步研究,如脑出血[8]、脑缺血[9]、创伤性脑损伤[10]等。然而,Fpr1在SCI中的作用尚不明确。因此,本研究以Fpr1 为切入点,探究Fpr1 在SCI 发生、发展过程中的可能机制,旨在为SCI 临床治疗和功能康复提供理论支撑。
1 材料与方法
1.1 实验动物
6 ~ 8 周C57BL/6 雄性小鼠由空军军医大学实验动物中心提供,小鼠在空军军医大学唐都医院骨科实验室饲养1 周后进行后续实验,饲养条件:温度22 ~ 25℃、空气湿度50%、正常昼夜交替(12 h 光照/12 h 黑暗),并给予充足的水和食物。所有实验均严格按照动物伦理相关要求进行,本研究动物实验得到空军军医大学伦理委员委员会批准(动物伦理审批号:IACUC-20201003)。
1.2 造模与分组
将30只小鼠随机分为5组,假手术组(sham组)和SCI 造模后1、3、5、7 d 组,每组6 只。SCI 造模采用文献[11]的方法:①采用戊巴比妥钠腹腔注射麻醉小鼠,俯卧位置于解剖板上;②定位T9脊髓对应锥体,切开皮肤,暴露脊柱,切除椎板,充分暴露脊髓;③利用血管夹钳夹脊髓1 min 形成脊髓挤压伤,对动物进行钳夹的部位为半脊髓,每只动物钳夹的时间与部位均一致,钳夹完成后可见损伤部位充血,小鼠身体出现痉挛,双下肢回缩;④缝合伤口,使用碘伏消毒,术后观察切口愈合情况。Sham组仅手术暴露脊髓,不钳夹脊髓,缝合切口,使用碘伏消毒,术后观察切口愈合情况。在相应时间点对各组小鼠实施安乐死,取脊髓组织等进行后续蛋白质印迹检测和免疫荧光实验。
第一步实验后选择Fpr1 蛋白表达水平最高时间点制作小鼠模型进一步实验,将小鼠随机分为SCI 组和Fpr1 抑制剂(HCH6-1)干预组(HCH6-1 干预组),每组6 只,并与sham 组比较。SCI 组的小鼠按照上述方法施行手术。HCH6-1 干预组小鼠术后即刻接受腹腔注射HCH6-1(50 mg/kg),之后隔日进行腹腔注射1 次[8,12]。Fpr1 蛋白表达水平最高时间点对各组小鼠实施安乐死,取脊髓组织等进行后续蛋白质印迹检测和免疫荧光实验。应用免疫荧光实验评估各组小胶质细胞的活化程度,通过蛋白质印迹检测各组炎性因子[白细胞介素(IL)-1β、IL-18 和肿瘤坏死因子-α(TNF-α)]以及炎性小体(NLRP3、ASC 和Caspase-1)蛋白的表达情况。
1.3 蛋白质印迹检测
小鼠处死后,取正常脊髓组织和损伤周围脊髓组织进行蛋白提取及定量,蛋白定量采取BCA 蛋白定量测定法,实验方法参考文献[13]。取15 μg蛋白进行SDS-PAGE,然后转膜、封闭、孵育一抗:anti-Fpr1(1∶1 000,Abclonal,中国),anti-IL-1β(1∶1 000,Proteintech,美国),anti-IL-18(1∶1 000,Proteintech,美国),anti-TNF-α(1∶1 000,Proteintech,美国),anti-NLRP3(1∶1 000,Proteintech,美国),anti-ASC(1∶1 000,Proteintech,美国),anti-Caspase-1(1∶1 000,Proteintech,美国)和anti-β-actin(1∶3 000,Abclonal,中国)。4℃过夜后,室温孵育相应二抗。最后使用化学发光试剂盒和成像系统检测蛋白条带。
1.4 免疫荧光实验
免疫荧光实验步骤参考文献[14]。小鼠麻醉后,依次使用PBS 和4%多聚甲醛灌注,然后将脊髓组织依次进行10%、20%、30%蔗糖梯度脱水。根据冰冻切片常规流程进行切片,使用0.5% Triton 打孔15 min 后封闭0.5 h,然后将切片同时孵育一抗anti-Fpr1(1∶200,Abclonal,中国)和anti-Iba1(1∶200,Invitrogen,美国),4℃孵育过夜。使用PBS 对切片进行漂洗,然后加入荧光二抗避光孵育,PBS漂洗干净后,使用封片剂封片,最后使用激光共聚焦显微镜进行拍摄观察。
1.5 统计学处理
采用SPSS 22.0 软件对数据进行统计分析。符合正态分布的计量资料以±s表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析;以P< 0.05 为差异有统计学意义。柱状图采用GraphPad Prism 8.3.0 软件绘制。
2 结 果
2.1 Fpr1蛋白表达情况
与sham 组相比,Fpr1 在SCI 后第1 天开始表达增多,第3 天最高,第5 天下降,第7 天下降至与sham 组水平相当(图1)。结果提示,Fpr1 在SCI急性期表达显著增加,可能发挥重要的损伤作用。Fpr1 表达水平在SCI 后第3 天最高,后续实验采取SCI 后第3 天作为研究时间点制作模型。
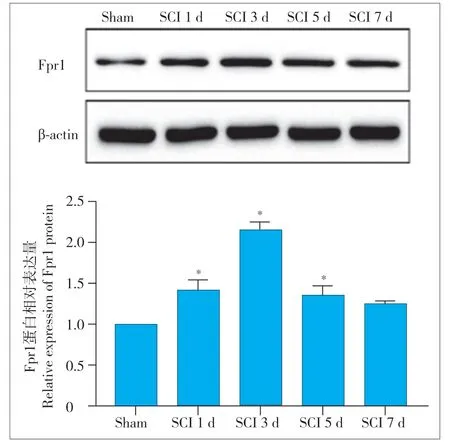
图1 Fpr1蛋白表达水平Fig. 1 Expression level of Fpr1 protein
2.2 Fpr1的细胞定位
Sham组小胶质细胞呈高度分支化,细胞间的分支基本不重叠,是未激活的状态;SCI 后第3 天,小胶质细胞发生明显活化,表现为突起回缩,胞体增大,呈巨噬细胞样,数量增多,进一步证实Fpr1 在SCI 后表达显著增加。免疫荧光染色结果示Fpr1 主要表达在小胶质细胞(图2)。以上结果提示Fpr1 可能参与小胶质细胞的活化过程。
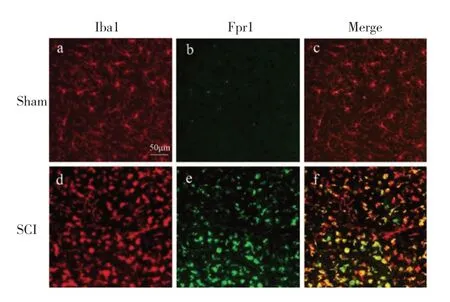
图2 Fpr1的细胞定位(×50)Fig. 2 Cell localization of Fpr1(×50)
2.3 Fpr1对小胶质细胞的影响
免疫荧光染色结果显示,与sham 组相比,SCI组小胶质细胞发生明显活化,HCH6-1 干预能显著减轻SCI 后小胶质细胞的活化,表现为胞体减小,数量减少(图3)。
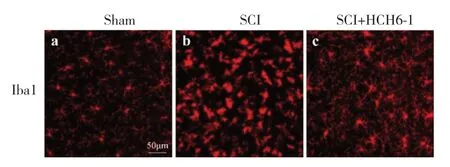
图3 小胶质细胞活化情况(×50)Fig. 3 Microglia activation(×50)
2.4 抑制Fpr1对SCI后炎性因子和炎性小体的影响
蛋白质印迹检测结果表明,与sham 组相比,SCI 组小鼠损伤部位周围脊髓组织的炎性因子(IL-1β、IL-18 和TNF-α)和炎性小体(NLRP3、ASC 和Caspase-1)的蛋白表达显著增加;与SCI 组相比,HCH6-1 干预组小鼠损伤部位周围脊髓组织的炎性因子(IL-1β、IL-18 和TNF-α)和炎性小体(NLRP3、ASC 和Caspase-1)的蛋白表达显著减少(图4、5)。

图4 脊髓组织中炎性因子蛋白水平Fig. 4 Protein levels of inflammatory factors
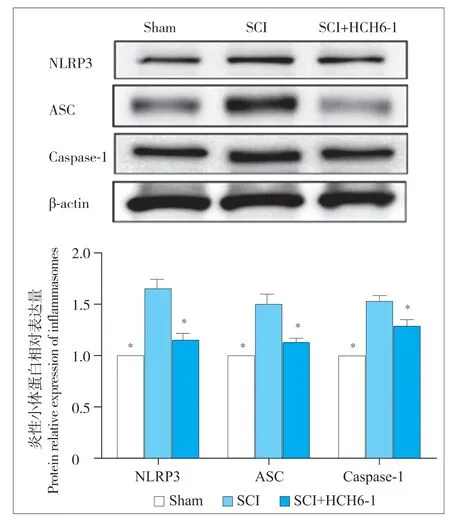
图5 脊髓组织中炎性小体蛋白水平Fig. 5 Protein levels of inflammasomes
3 讨 论
目前,SCI 的发生率逐年递增,其致残致死率高、预后差、治疗及康复费用昂贵[1]。其中,SCI 后继发性损伤(出血、水肿、炎性反应、脱髓鞘等)是导致患者致死致残的重要原因[2]。小胶质细胞是中枢神经系统重要的免疫细胞,占中枢所有细胞的5% ~ 10%,是中枢神经系统第一道免疫防线[15]。SCI 后小胶质细胞形态发生改变并向损伤灶迁移,可以发挥吞噬功能清除细胞碎片,促进神经元和突触的可塑性,但过度激活的小胶质细胞呈阿米巴样(球形)状态,诱导炎性级联反应,对机体产生炎性损伤作用[4]。因此,抑制小胶质细胞的过度活化对于预防SCI 后的神经炎性反应至关重要。既往研究发现,PRR 参与小胶质细胞在SCI 后的炎性和免疫反应。Bell 等[16]的研究显示,toll 样受体4(TLR4)在SCI 后表达升高,抑制TLR4 能够显著抑制小胶质细胞的激活并减轻炎性反应。Hao 等[17]在缺血性脑损伤后,通过使用TLR4 拮抗剂Stepharine,证实了抑制TLR4 能够抑制小胶质细胞的激活。髓系细胞触发受体1(TREM-1)是TREM家族的一员,与多种中枢神经系统疾病相关,如脑出血[18]、脑缺血[19]、阿尔兹海默病[20]等。在SCI 中,抑制TREM-1 能够显著减轻机体氧化应激和小胶质细胞的激活[21]。上述研究均表明,PRR 在小胶质细胞的活化中起着关键作用,因此,明确PRR 在SCI 中的作用对于减轻继发性损伤具有重要意义。
Fpr1 是G 蛋白偶联的趋化受体,也是PRR 的一种,最初在吞噬相关白细胞(如中性粒细胞、单核细胞)中被发现,主要介导细胞趋化和激活,Fpr1的激活能够启动PI3K、PKC、MAPKs、NF-κB等信号通路,参与宿主对微生物的防御过程[22]。Li等[8]的研究表明,在脑出血疾病模型中,循环线粒体N-甲酰基肽是Fpr1 的内源性配体,甲酰基肽与Fpr1 的相互作用促进小胶质细胞激活、中性粒细胞趋化以及神经功能恶化,通过使用Fpr1 抑制剂,证实了抑制Fpr1 能够减轻脑出血后小胶质细胞的活化和脑水肿等继发性损伤,提示Fpr1 在中枢神经系统疾病中扮演着重要角色。在创伤性脑损伤模型中,Fpr1可以激活MAPKs、NF-κB 等信号通路,促进炎性小体的激活,加重机体的氧化应激[10]。在胶质母细胞瘤患者中,Fpr1 高表达,并与AKT 和ERK 等通路密切相关[23]。对于Fpr1 的细胞定位,有研究[24]指出,通过对人神经组织进行单细胞测序发现,Fpr1 是特异性表达在小胶质细胞的标志基因。Li 等[8]在脑出血疾病模型中证实Fpr1 主要表达在小胶质细胞。Schröder 等[25]在阿尔茨海默病的相关研究中发现,抑制Fpr1 能够减轻小胶质细胞的激活,而对星形胶质细胞无影响,也侧面证实了Fpr1 主要表达在小胶质细胞。因此,本研究组猜测Fpr1 可能参与SCI 后小胶质细胞的激活,抑制Fpr1 能够减轻SCI 后的炎性反应。Xia 等[26]的研究表明,NLRP3 炎性小体作为固有免疫的重要组分,在机体先天性免疫反应和炎性反应发生过程中具有重要作用,其介导的Caspase-1 激活能够切割IL-1β 和IL-18 的前体,进而产生相应的成熟细胞因子,诱导细胞调亡。Jiang等[27]的研究表明,在SCI 急性期,抑制NLRP3 炎性小体的激活和小胶质细胞的活化,有利于减轻机体继发炎性反应和胶质瘢痕的产生,并促进轴突生长。因此,NLRP3 可作为治疗SCI 的潜在靶点。本研究组通过蛋白质印迹检测以及免疫荧光染色等实验验证了Fpr1 在SCI 后小胶质细胞中表达显著增加,抑制Fpr1 能够减少小胶质细胞的激活以及炎性因子的产生,并减少NLRP3 炎性小体的形成,推测Fpr1可能是SCI 治疗的重要靶点。
综上所述,本研究以Fpr1 为出发点,利用小鼠SCI 模型,为SCI 后减轻小胶质细胞诱导的神经炎性反应提供了一个新的治疗途径,也为HCH6-1 的临床应用转化提供了理论支持。
