面向汗液的可穿戴柔性电化学传感器研究进展
2024-02-27李嘉夕
陈 晨,李嘉夕,聂 磊
(湖北工业大学 机械工程学院 现代制造质量工程湖北省重点实验室,武汉 430068)
汗液作为实时健康监测的重要生物流体,携带大量传递人体生理信息的物质,如代谢物(葡萄糖、乳酸)、电解质(Na+,Cl-,K+)、激素(皮质醇、多巴胺(DA))等[1]。汗液中各生理指标参数可有效反映个人的身体健康状况,如葡萄糖传感可监测血糖浓度(空腹血糖>7 mmol/L 表明可能患糖尿病)[2];钠离子检测可及时预警低钠症(血清钠<135 mmol/L)[1];皮质醇可反映压力状况[3]等。相较于人体其他生物液(血液、组织液、泪液、尿液、唾液等),汗液因易获取且无创监测,在体温调节、免疫防御、电解质和pH 平衡等方面发挥着重要的生理作用,被确认为人体健康检测的重要指标。汗液分析技术主要有光学[4-5]和电化学[6]两种常用的检测方法。其中基于光学的汗液检测方法是通过对比颜色或荧光强度变化来测量被测生理指标,可有效直观筛选及分析生理指标状态,然而在记录精确化数值、建立个性化医疗数据库上仍然存在局限性。基于电化学的检测方法则是通过测量功能化电极上的电流或电位变化分析各生理指标,其集成度高,便于实现微型化、轻量化设计,使其在可穿戴健康监控领域被广泛研究[7-8]。
据普查,我国60 岁以上的老年人占全国总人口的18.7%,人口老龄化日益严重,并且在过去十年我国糖尿病患者人数增幅高达56%,慢性病患病率快速增长[9],因此医疗保健的需求逐渐加重。传统的血检方法需要经过培训的专家在复杂的医疗仪器设备中进行离体检测,而可穿戴式汗液传感器[10-13]无创、非侵入式的原位测量及长期实时快速地反馈各生理指标,可实现个性化、柔性化、智能化发展,在预防性护理、慢性疾病长期监测、及时地诊断和治疗等医疗健康领域具有潜在的应用价值,在个性化远程医疗平台建立上展现出巨大应用前景。目前在市面上可穿戴传感器中,FreeStyle Libre(Abbott)[14]作为新型的微针式可穿戴葡萄糖传感器,通过检测人体组织液中葡萄糖含量反映人体血糖浓度变化,其监测准确度较高,然而该产品未能采用非侵入的方式检测葡萄糖含量的变化。因此,基于汗液的可穿戴式传感器深受国内外研究者广泛关注,对汗液中的多生物指标进行实时、连续、非侵入式监测,对于运动表现、疾病预防以及健康管理具有广泛应用。
随着汗液电化学传感器微型化、集成化、智能化的发展,在个人健康实时、无创监测方面具有重大潜力。目前汗液传感器研究方向主要为敏感材料、柔性电极、微型化设计、集成结构等方面,其中敏感材料是传感的关键因素,具有高的比表面积以及多活性位点的金属基复合材料和碳基复合材料因其可再生性、结构多样化、高电子迁移率、热稳定性和机械强度等特性,可有效增加传感器与靶标分子的接触面积,提高传感器的检测性能,成为了研究热点。
本文阐述了可穿戴汗液传感器的基底、集汗模块、传感单元、电源模块以及决策单元等集成结构,着重强调了金属基、碳基纳米结构在电化学传感敏感材料中的应用,讨论了可穿戴汗液传感器存在的挑战以及解决思路,为进一步研究提供参考方向。
1 面向汗液的可穿戴柔性电化学传感器集成结构
近年来,研究者们通过对可穿戴柔性汗液传感器的基底、集汗、传感、电源和决策五大模块集成设计,逐步优化了汗液收集机制、多模态传感以及数据分析与传输等功能,其集成结构如图1 所示[15-18]。
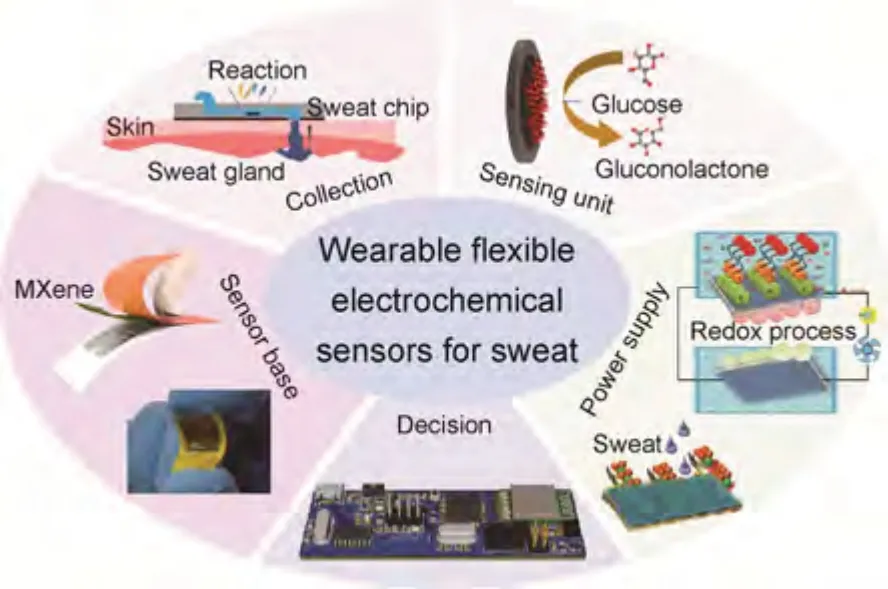
图1 面向汗液的可穿戴柔性电化学传感器集成结构[15-18]Fig.1 Wearable flexible electrochemical sensor integration structure for sweat[15-18]
1.1 传感基底
目前常用的柔性传感器材料为纺织物[19-20]、纸[21-23]、纤维素[24-27]、弹性体(如聚二甲基硅氧烷(PDMS)[28-31]、共聚酯(ecoflex)[32]、聚氨酯(PU)[33-34]、水凝胶[35])等。纺织基底柔顺透气,且具有一定的弹性,可适应人体对舒适度的要求,其多样化的纤维和编织图案、较低的成本、生物相容性为可穿戴式汗液传感器提供了更广泛的基材选择,如图2(a)所示[20]。另外,纸基结构因其液体传输特性且与许多化学和生化部分兼容,常同其他材料进行结合(如基于微流控纸基芯片或与棉线和滤纸相结合)以改善纸基器件强度不足的缺点,如图2(b)所示[23]。而纳米纤维素具有优异的机械强度、高比表面积、高透气性、良好的亲水性、稳定的化学性能、良好的生物相容性,为可穿戴式汗液传感器提供了更广泛的基材选择,如图2(c)[27]所示。此外,弹性体具有薄、低模量、生物相容性好等特点,通过仿生可控制备使其更符合人体皮肤贴合度,其良好的透气性、优异的拉伸性能以及易与微流控等单元进行集成,为可穿戴传感器的发展提供了保障,如图2(d)~(g)所示[31-32,34-35]。可穿戴式传感器基底通常为柔软、可变形且不易从皮肤表面脱落的材料,以应对身体活动带来的机械拉伸和变形,提高穿戴者的移动性和舒适性。为避免基底弯曲或变形而破裂,产生信号的剧烈变化,往往需对电极油墨成分和电极进行优化和预处理。

图2 汗液传感器的传感基底(a)带有铜电极的织物传感器[20];(b)纸基传感贴片[23];(c)纳米纤维素基传感器[27];(d)PDMS 基可穿戴传感器[31];(e)基于ecoflex 硅酮/多壁碳纳米管(MWCNT)的可穿戴传感器[32];(f)超薄柔性热塑性聚氨酯/炭黑纤维薄膜传感器[34];(g)基于离子水凝胶的超灵敏、可变形、透明摩擦电触觉传感器[35]Fig.2 Sensor base of sweat sensor(a)fabric sensor with copper electrode[20];(b)paper-based sensor patch[23];(c)nanocellulose-based sensors[27];(d)PDMS-based wearable sensor[31];(e)ecoflex silicone/multi-walled carbon nanotube (MWCNT)-based wearable sensors[32];(f)ultra-thin flexible thermoplastic polyurethane/carbon black fiber film sensor[34];(g)ultra-sensitive,deformable,transparent triboelectric tactile sensor based on ionic hydrogels[35]
1.2 集汗模块
人体皮肤表面积约1.8 m2,每天损失的不感汗量为0.6~2.3 L[36]。据报道,单位面积汗液分泌速率不规则,其中手脚不感汗量最多,约为0.075~0.15 μL·min-1·cm-2,难以满足电化学传感测试需求(>1 μL)[37],因此汗液的采集和收集对于可穿戴汗液传感设备监测结果的准确与可靠至关重要,微流控技术被广泛应用于汗液收集。
为实现微量汗液的高效收集,学者们借鉴自然生物优异的集水结构(如仙人掌的针状叶、蜘蛛丝的特殊表面结构),开展了仿生微流控技术[38]的研究。2019 年,Reeder 等[39]引入了可以连续、实时地监测汗液流失量、汗液流失速率和汗液生物标记物的微流控系统,如图3(a)所示。Reeder 利用汗腺本身作为压力源制备了微流控汗液装置,通过集成可逆流体指示器、可重复使用的负压泵、化学喷射泵和软夹紧阀,实现了手动清除旧汗液。2021 年,Son 等[40]受仙人掌启发提出了一种可以有效收集汗液以进行快速和持续医疗保健监测的汗液收集贴片,如图3(b)所示。该贴片结合分层的微纳米超疏水/超亲水表面材料形成楔形通道,可实现自发的汗液定向收集(集汗速率为2 μL·min-1·cm-2),有效提高了集汗能力及集汗效率。然而,微流控技术在一些方面仍存在挑战,如表面挥发、浸润性等。
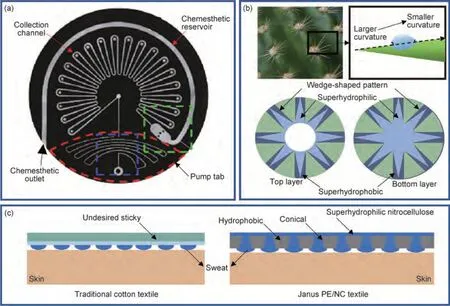
图3 汗液传感器的集汗模块(a)微流体装置[39];(b)仙人掌脊椎仿生结构微流控汗液收集装置[40];(c)用Janus PE/NC 纺织品覆盖的人体汗液输出路径示意图[41]Fig.3 Sweat collection module of sweat sensor(a)microfluidic devices[39](;b)cactus spine bionic structure microfluidic sweat collection device[40];(c)schematic diagram of human sweat output path covered with Janus PE/NC textiles[41]
Janus 技术为微流控技术提供了一种新的补充和解决方案,其双重性质如亲水/疏水、极性/非极性使其具有独特的定向操控能力。2019 年,Dai 等[41]报告了一种超疏水/亲水的Janus 聚酯/硝化纤维素纺织品,嵌入具有亲水内表面的锥形微孔阵列,可实现定向液体传输(1246%)并保持人体温度,如图3(c)所示。当具有大开口亲水锥形微孔的疏水性聚酯层与液体接触时,Janus 聚酯/硝化纤维织物可通过毛细力驱动的亲水性锥形微孔将其泵送至超亲水性硝化纤维层。2020 年,He 等[42]提出了一种基于智能Janus 的集成式微量汗液收集及电化学传感器,通过静电纺丝在超亲水纱布上制备超疏水PU 纳米纤维阵列形成Janus 膜,实现对葡萄糖、K+和Na+等多种生物指标的灵敏检测。目前汗液往往通过体育锻炼、暴露于温暖潮湿环境(桑拿、沐浴)或电流刺激来进行收集,然而这些方法不能有效地适用于婴儿或老年患者,也不能更普遍地用于日常活动中人们健康状态实时监测[43]。因此仍需进一步探明亲疏水结构的影响机制及Janus 膜/微流控机理研究,以解决微量汗液收集难的问题。
1.3 传感单元
电化学传感,通过被测物质传递到工作电极(WE)表面发生的电化学反应,产生响应信号实现对被测物含量的检测,由于其较高的选择性和灵敏度、微型化、可集成等特性而被广泛应用于可穿戴传感器件中。电化学传感器通常是由三电极系统(WE、对电极(CE)、参比电极(RE))、电解液组成,其中WE 为实际发生反应的电极,一般使用贵金属、碳、过渡金属氧化物等纳米结构;CE 为辅助电极,与WE 形成回路使WE 上电流畅通,可保证反应在WE 上发生,通常使用铂/碳电极;RE 作为基础参照,不受电解液成分变化的影响,使用饱和甘汞/银-氯化银电极(Ag/AgCl)。常见的电化学测试方法可分为电位型、电流型、伏安型以及电化学阻抗谱(EIS)。电位型传感器通过输出电位随目标分析物浓度变化的趋势实现对被测物的检测;电流型传感器则是通过施加电位到WE,以测量WE 上发生氧化还原反应而产生的电流;伏安型传感器通过WE 与RE 之间的电压扫描,提取所得峰电流特征以确定反应物浓度,与电流型相比,可以实现更高的检测限度;而EIS 通过测量电化学反应中阻抗的变化,并对复杂阻抗的奈奎斯特图进行分析来实现被测物的检测,具有灵敏度高、检测限低的优势,但是通常需要较长的测量周期以及后期处理。
汗液中包含电解质(Na+,Cl-,Ca2+等)、代谢物(乳酸、葡萄糖等)、激素(DA、皮质醇等)、pH 等多模态生理指标,可反映个人健康状况,如Na+可对低钠血症进行预警;高浓度Cl-被用作囊性纤维化(CF)诊断指标[1];Ca2+含量可用来检测骨髓瘤、肾功能衰竭以及肝硬化[44];乳酸可用于监测呼吸衰竭、组织缺氧、败血症和乳酸性酸中毒[45];葡萄糖含量是判断糖尿病的关键指标[46];DA 在运动控制、药物成瘾等方面发挥着重要作用[47];皮质醇水平升高可反映情绪压力指数[48];pH可反映个人伤口痊愈情况。因此,可穿戴汗液传感器可根据汗液成分的不同生物亲和机制,选择合适的测试方法研究电化学行为以实现对生理状态的无创、持续、非侵入式监测。
1.3.1 电解质传感
Na+,Cl-,Ca2+等电解质因其在汗液中的浓度为毫摩尔级,通常选择电位法利用离子膜电位测定溶液中离子活度/浓度。2016 年,Nyein 等[44]研究了一种可穿戴的电化学装置,分析了生物流体中游离钙的稳态对人体生物功能和器官系统的影响。结果表明,该传感器对Ca2+具有高的重复性和选择性,Ca2+浓度随着pH 值的降低而增加。2017 年,Emaminejad 等[49]研究了一种用于检测Cl-的电位型传感器,集成了在可穿戴汗液分析平台中的电化学增强离子电渗界面,该界面可通过各种分泌曲线诱发汗液以进行实时分析,能够检测到CF 患者与健康对照受试者相比时汗液电解质含量的升高。2022 年,Ghoorchian 等[50]提出了一种可穿戴电位型传感器,该传感器可完全集成到头带织物中无创分析人体汗液中的Na+并实现医疗保健和疾病诊断。以上研究者采用电化学电位型传感,通过电极电位信号表征分析了汗液中电解质离子含量及多指标参数间的影响。
1.3.2 代谢物传感
为了更好地表征电化学传感特性,一般使用多种测试方法检测汗液代谢物。2019 年,Amin 等[51]研究了一种用于定量测试乳酸的循环伏安法(CV)电化学传感平台,通过氧化镍纳米颗粒(NiONPs)修饰玻碳电极(GCE)有效提高了对乳酸传感的灵敏度,该传感器的检测限(LOD)为5.7 μmol/L,具有良好的稳定性。2020 年,Choi 等[52]提出了一种利用MWCNT-聚吡咯核壳纳米线对人体汗液中乳酸进行选择性非酶电流检测方法。研究发现,该材料具有良好的传感性能,其灵敏度为2.9 μA·(mmol/L)-1·cm-2,LOD 为51 μmol/L。2020 年,Hovancová 等[53]提出了钛金属包覆二氧化钛(Ti/TiO2)非酶葡萄糖传感器,并使用EIS 法进行测试。结果表明该传感器具有较宽的线性范围、良好的选择性及LOD。2020 年,Chen 等[54]研究了一种基于葡萄糖-硼酸双齿络合物形成的夹心型电化学传感器,用于葡萄糖的选择性测定。利用EIS、CV 和差分脉冲伏安法(DPV)研究该传感器的电化学特性,显示出该传感器在半乳糖、果糖、甘露糖和其他生理环境中常见干扰(如尿素(UA)、抗坏血酸(AA)和多巴胺(DA))共存的情况下的良好选择性,且具有高灵敏度、良好的稳定性和再现性以及良好的生物相容性。研究者们采用电流型、伏安型以及EIS 等不同测试方法,通过优化纳米结构实现对代谢物的快速、高灵敏实时监测,展现了电化学在汗液传感中的应用前景。
1.3.3 激素传感
激素检测一般使用伏安法和EIS。例如汗液皮质醇传感过程中阻抗发生连续变化,通常采用EIS 测试方法。2019 年,Nankya 等[55]研究了一种介孔石墨烯(MG)生物分子的电化学传感,用于AA 存在的条件下检测DA。采用CV 和微分脉冲伏安法(DPV)研究了MG 在铂(Pt)电极上的电化学行为,DPV 有助于在高浓度AA 存在情况下有选择性和灵敏地检测DA,该传感器表现出良好的灵敏度、LOD、选择性和与浓度的线性关系。2020 年,Mounesh 等[56]开发了乙酰氨基酚(PA)和DA 敏感检测的电化学传感器,通过CV、DPV、计时安培法和EIS 对制备的传感器进行了研究。研究表明,该传感器在50~750 nmol/L 的线性范围内对PA 和DA 的检测表现出优异的性能,LOD 分别为17 nmol/L 和19 nmol/L(S/N=3),重现性的相对标准偏差为5.1%,回收率为97.4%~103.3%。以上研究表明,利用伏安法和EIS 等电化学方法,结合特定的传感器结构设计和材料优化选择,可以实现对激素的高灵敏监测。
1.3.4 pH 传感
目前对汗液pH 的常用测量方法为基于聚苯胺膜(PANI)的电位法。2017 年,Rahimi 等[57]分析了用于可穿戴的高度可拉伸电化学pH 传感器,使用PANI 作为导电填料、结合材料和pH 敏感膜渗透。结果表明,该传感器可以承受高达135% 的拉伸,并且在超过12000 次拉伸和释放循环测试中电阻没有明显变化,表现出高灵敏度和优异的稳定性。2019 年,Manjakkal等[58]提出了一种用于可穿戴纺织基电位pH 传感器,通过电位分析所制备的传感器,在pH 值为6~9 的范围内具有4 mV/pH 的灵敏度,响应时间为5 s,即使在自来水中清洗后,所制传感器仍具有(47±2) mV 的长时间(2000 s)稳定响应。2020 年,Wang 等[59]报道了一种基于弹性体结合金纳米线涂层技术的可拉伸金纤维电化学pH 传感器。通过在金纤维上电沉积PANI和Ag/AgCl,实现在离子选择电极设计中基于开路电势选择性地检测pH,具有高灵敏度(60.6 mV/pH)、选择性和拉伸性。pH 的检测可为汗液多参数监测提供有效解决方案,对于基于PANI 的汗液pH 值传感,需要进一步研究pH 值与电极之间的潜在响应来校准检测数据的准确性。
1.3.5 温度传感
人体排汗量与温度密切相关,探究汗液成分与体温之间的关系是实现多参数监测、个性化医疗的有力途径。2016 年,Gao 等[10]提出了一个完全集成(即不需要外部分析)用于多路原位汗液分析的传感器阵列,该传感器可同步并选择性地检测汗液代谢物、电解质以及长时间室内外体育活动期间的皮肤温度。采用Cr/Au 金属微细线基于电阻的温度传感器,以校准传感器的响应、确保数据的可靠性。2016 年,Baldwin 等[60]设计了一种用于生理液体的新型电化学热流量传感器。该传感器由Pt 电阻加热器和Pt 传感电极构成,位于聚对二甲苯碳基板上,使其具有柔性和完全生物相容性。在加热过程中,使用传感电极上的EIS 变化来检测温度,并且在过热温度仅为1 ℃的情况下实现了高度灵敏的流量测量。2021 年,Xuan 等[61]报道了一种乳酸生物传感器,其中使用MWCNT 连接两个碳电极研究了用于体温监测的传感模块。该传感器表现良好的重复性、再现性和可逆性,适用于在进行运动时或通过离子导入的出汗刺激后人体汗液乳酸、pH 和温度监测。仍需要进一步探究温度对监测数据的影响机制并进一步校准,以提高传感器的准确度。
综上所述,仍需深入分析pH、温度等生化参数之间的影响机制,结合汗液传感机制对多模态生化标记进行实时校准,深入研究血液与汗液分析物含量之间的相关性,进一步提高汗液传感的准确度。
1.4 电源模块
对人体健康状态进行长期持续监测的可穿戴式传感器,能量供应至关重要。目前,可穿戴设备的供电方式大致可分为可持续供电和非持续供电。传统供电方式是在可穿戴传感器上安装纽扣电池或小型锂电池,实现对传感单元的非持续供电。为建立个性化医疗健康数据库,需满足可穿戴设备长期监测的需求[62],然而传统电池供电方式难以提供持续供电,因此,许多从环境中收集能量实现持续自供电方式如生物燃料电池[23,63-64]、太阳能电池[65]、压电[66]和摩擦发电[67-68]等成为学者们的研究热点。其中汗液含有大量生物电解质,可作为生物燃料电池满足可穿戴传感器的持续性供电,而被广泛研究。
2017 年,Yu 等[63]引入了一种基于单个光电生物燃料电池的新型可穿戴传感自供电器件,它不仅可以从佩戴者的代谢产物中提取电子能,还可以从环境照明中提取光能,实现对汗液乳酸的准确监测。2017年,Cho 等[23]研究了一种纸基自供电传感器贴片,用于检测汗液中的葡萄糖水平,利用将垂直堆叠的纸基葡萄糖/氧酶燃料电池集成到标准创可贴贴片中,通过将汗液中化学能转换为电能,实现对汗液中葡萄糖监测的自供电,如图4(a)所示。2019 年,Ortega 等[64]研究了一种用于测量汗液电导率的自供电皮肤贴片,将吸收的汗液作为纸基电池电解质,输出功率和电压可直接反映汗液中电导率,实现汗液电导率传感的自供电,如图4(b)所示。可穿戴设备的供能需求取决于测量的复杂程度,往往决策单元决定。因此,需根据传感器件所需能量对生物燃料电池进行设计。
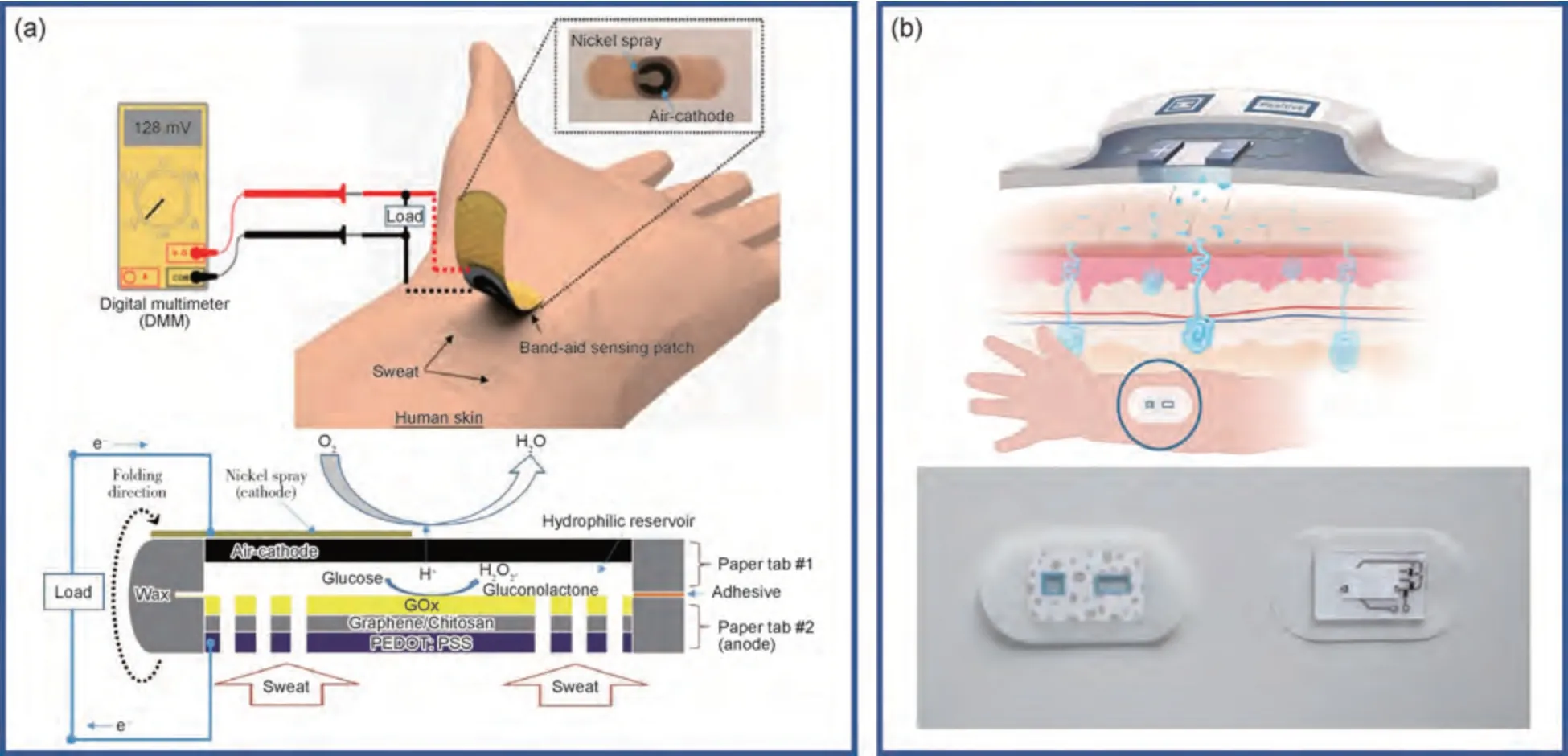
图4 汗液传感器的电源模块(a)纸基自供电葡萄糖传感系统示意图[23];(b)自供电皮肤贴片设计方案与实现装置[64]Fig.4 Power supply module of sweat sensor(a)schematic diagram of paper-based self-powered glucose sensing system[23];(b)self-powered skin patch design scheme and realization device[64]
1.5 决策单元
可穿戴设备通过传感机制获取个人生理状态信息,创建个性化医疗数据库实现远程医疗。决策单元可将原始数据转化为易读模式,主要包括数据传输以及数据分析两个部分。可穿戴汗液传感器通过佩戴或与皮肤紧密贴合的方式持续监测,由于佩戴位置不同、导线连接造成的不便等因素,通过无线通信技术实现数据传输的优势表现得尤为突出。数据传输方式的选择取决于传感器的预期功耗以及传输距离,常用的数据传输方式有蓝牙[69]、近场通信[70]、射频识别[71]以及LoRa[72]等。蓝牙、近场通讯技术传输速度较快、安全性较高,射频识别技术因其适用性和简易性被广泛应用于医疗领域或是提供电力的接近设备,而LoRa 可实现低功耗的远距离传输,其传输距离为射频识别的3~5 倍。
汗液传感获取的生理数据通过数字信号阵列转换为数字信号(如电流、电压),随后将其传入数据分析部分,通过相应的算法转换为预处理信号(如pH、离子浓度等),预处理信号通过特征工程进行数据处理(包括异常值和异常检测、输入数据的聚类、降噪、缺失特征的处理、数据归一化、降维和基线校正等方法),决策单元根据二次处理数据对个人生理信息做出决策。决策单元是可穿戴汗液传感器的重要组成部分之一,在数据优化、电源管理、信息安全等方面具有发展潜力。
2 纳米材料在可穿戴柔性电化学传感中的应用
对于电化学传感而言,敏感材料是传感器电极的关键组成部分之一。随着纳米技术的发展,特别是功能化纳米结构的出现,为电化学传感提出了新的测试原理和检测技术。纳米结构具备优异的物理、化学、电催化等性能,加之其量子尺寸和表面效应,因此被广泛应用于航天、医疗、能源、传感等领域。基于纳米结构的电化学传感器呈现出体积更小、速度更快、检测灵敏度更高和可靠性更好等优异性能。纳米结构因其具有极高的比表面积和良好的生物相容性,有利于提高敏感分子的吸附性能、生化反应的速率,因此,功能化纳米结构在电化学生物传感器中的应用可以显著提高传感器的性能。近年来,学者们对不同纳米结构在电化学传感中的应用展开了大量的研究,将贵金属、过渡金属氧化物、碳以及复合纳米结构用于电化学传感研究,显示了不同纳米结构的检测范围、灵敏度、导电及催化性能的差异性。
2.1 金属基纳米材料
金属基纳米结构能够将金属的物化性质与纳米结构的特殊性能结合起来,有其他纳米结构不具备的独特性质。贵金属(如Au,Pt 等)及过渡金属氧化物(如Ag,Cu,Co 等)纳米结构具有较好生物相容性、电催化等性能,将其应用于电化学传感可以更好地展示其电化学特性,如提高电子传输能力、增加电化学传感的活性位点以及改善电极材料的导电性。
2.1.1 贵金属
贵金属纳米结构具有优异的电化学性能,其中Au,Pt 等贵金属纳米结构因其高催化活性、高耐蚀性和特殊的电学性质使其在工业催化、燃料电池、电化学传感器等领域具有重要地位,日益受到科学家们的关注。2017 年,Jolly 等[73]通过表面化学法将AuNPs附着在金平面上建立了一种无标记双模式阻抗和电流适体传感器平台,该传感平台通过检测前列腺特异性抗原(PSA)实现对前列腺癌的及时预警。与标准的二元自组装单层适体传感器相比,AuNPs 可以显著提高阻抗检测的极限,在10 pg/mL~10 ng/mL 的动态范围内实现了低至10 pg/mL 的PSA 检测,符合临床相关值范围要求的同时保持了高分析特异性。2020 年,Alafeef 等[74]研究了一种使用AuNPs 的快速(<5 min)、低成本、易实现和定量的纸基电化学传感器芯片,可实现SARS-CoV-2 遗传物质的数字检测,如图5(a)所示。实验表明,该传感器能够成功将COVID-19 阳性样本与阴性样本区分开来,其LOD 为6.9 copies/μL、灵敏度为231 (copies/μL)-1并且特异性接近100%,具有良好的准确性与选择性。2021 年,Mazzotta 等[75]引入了尺寸可调的PtNPs 用于过氧化氢(H2O2)的电催化检测。因PtNPs 的高比表面积表现出更强的传感能力,所制备的系统表现出优异的性能,如LOD 为10 μmol/L、灵敏度、选择性、重现性、重复性和时间稳定性。贵金属纳米结构在电化学传感领域的应用,对提高电化学传感性能的具有重要意义。
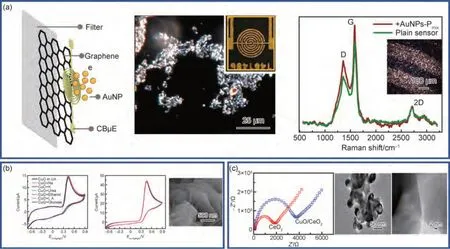
图5 金属基传感材料(a)Au NPs 纸基电化学传感器芯片[74];(b)基于CuO 纳米结构的电化学传感器[78];(c)基于CuO/CeO2纳米复合材料非酶葡萄糖生物传感器[79]Fig.5 Metal-based sensing materials(a)Au NPs paper-based electrochemical sensor chips[74](;b)electrochemical sensor based on CuO nanostructure[78];(c)non-enzymatic glucose biosensor based on CuO/CeO2 nanocomposites[79]
2.1.2 过渡金属氧化物
过渡金属氧化物作为金属纳米材料研究的一个重要分支种类繁多(如Cu,Co,Ni,Fe 等氧化物),相较于贵金属材料,过渡金属氧化物性质更加稳定,具有更好的催化性能,在电化学传感、储能、化学催化等方面都有着非常广阔的应用前景。由于过渡金属氧化物纳米结构对生物小分子等具有优良的电催化活性,因此常被用于制备非酶传感器,常用于电化学传感器的过渡金属氧化物主要分为单金属、双金属以及多金属。2018 年,Tian 等[76]使用三种不同的金属氧化物(氧化铜(CuO)、四氧化三钴(Co3O4)、NiO)探究其对葡萄糖的传感能力。结果表明,由于CuO,Co3O4,NiO对葡萄糖的电子电导率、电化学活性和催化行为不同,所以对葡萄糖的性能有所不同,其中CuO 对葡萄糖表现出最高的灵敏度(168.7 μA·(mmol/L)-1·cm-2)和选择性。2020 年,Buledi 等[77]基于CuO 纳米结构修饰GCE 研究了一种可同时测定氢醌(HQ)和AA 的电化学传感器。采用CV 研究CuO/GCE 对硼酸盐缓冲溶液(pH=8.0)中HQ 和AA 的氧化表现出优异的电催化活性,电化学信号表现为两个分辨良好的氧化峰并且具有显著峰电位差。当分析物浓度发生改变时,测定的HQ 和AA 的线性响应范围分别为0.0003~0.355 mmol/L 和0.0001~0.30 mmol/L。2021 年,Buledi 等[78]引入了一种有效的传感探针,通过特殊的CuO 结构检测UA,如图5(b)所示。基于CuO 纳米结构的电化学传感器实现了在较宽的UA 范围内表现出良好的线性响应。测定的线性UA 的动态范围是0.001~351 mmol/L,检测极限低至0.6 μmol/L,CuO结构在检测UA 时表现出惊人的电催化行为。
相较于单个过渡金属氧化物纳米粒子,双、多过渡金属由于金属的协同效应,表现出优异的电化学性能,最大程度发挥材料优势,能够更好地提高电化学传感器的活性位点与灵敏度。2016 年,Guan 等[79]引入了一种基于CuO/CeO2纳米复合改性氧化铟锡(ITO)的非酶葡萄糖生物传感器,如图5(c)所示。Cu-ONPs 主导葡萄糖的氧化还原反应,而CeO2NPs 则可加速电极的电子转移。结果表明,CuO/CeO2纳米复合生物传感器具有2.77 μA·(mmol/L)-1·cm-2的极好灵敏度,估计的检测极限为10 μmol/L,该传感器对葡萄糖表现出较好的选择性及稳定性。2018 年,Su等[80]基于在GCE 电极表面修饰Au@Cu2O 纳米复合材料,开发了一种新型灵敏的非酶葡萄糖传感器(Au@Cu2O/Nafion/GCE)。结果表明,与Cu2O/Nafion/GCE 和Au/Nafion/GCE 电极相比,Au@Cu2O/Nafion/GCE 电极在碱性介质(pH=12.6)中对葡萄糖氧化的电催化活性增强;在优化条件下,电化学传感器在0.05~2.0 mmol/L 葡萄糖浓度范围内具有线性相关性,灵敏度为715 mA·(mmol/L)-1·cm-2,表现出良好的稳定性、重现性和选择性。2020 年,Qian 等[81]提出了一种新型的非酶电化学葡萄糖检测器,由ZnO NPs 修饰的CeO2晶须组成。通过CV 和DPV 对ZnOCeO2葡萄糖传感器进行了电化学分析,其电位窗口为0~1 V。结果表明,该纳米复合材料检测葡萄糖线性范围为0.5~300 μmol/L,LOD 为0.224 μmol/L,DPV 结果显示电流信号强度和葡萄糖浓度之间的良好线性关系(R2=0.99944)。
2019 年,Bhardwaj 等[82]利用(Ni,Co,Fe)-tin 氧化物纳米复合传感电极制造了一种基于混合电位的传感器,用于检测NO2气体。结果表明,该传感器在650 ℃的工作温度下对NO2的检测表现出良好的传感特性、44 mV/dec 的高灵敏度、21 s 的快速响应、58 s 动态恢复以及对NO2表现出出色的重复性和选择性。2019 年,Annalakshmi 等[83]研究了一种使用三金属NiFeCo(NFC)纳米球作为优异电催化剂的电化学传感器,用于检测肼(HY)。研究发现,纳米粒子排列成均匀的球形且没有任何团聚,由于低阻抗、纳米球状结构和金属纳米粒子之间的协同效应,NFC 制造的电极对HY 表现出极好的电化学传感性能。该电化学传感器具有低LOD(6.4 nmol/L)、宽动态范围(0.020~3080 μmol/L)和快速响应时间(2 s)。过渡金属氧化物纳米结构使电化学传感器得到了更加广泛的应用,提高了电化学传感速率与灵敏度。与单金属相比,双、三金属合金由于金属的协同效应具有更高的比表面积,能够显著改善电催化性能,并且多价金属的存在可以适度地降低活化能使物质传递更加快速。
2.2 碳基纳米材料
碳基纳米结构因其具有导电性好、结构稳定、比表面积大、碳来源丰富的优点,已作为一类修饰电极材料受到了学者们的广泛关注,并在电化学传感方面取得了丰硕的成果。常见的碳结构分为碳量子点(CQDs)、石墨烯(GA)、氧化石墨烯(GO)、还原氧化石墨烯(rGO)、石墨烯量子点(GQDs)等,因其结构多样性也常与其他金属基材料进行复合,使其同时具备多种材料的特殊性能。
2.2.1 碳
近年来,碳纳米结构成为了学者们研究电化学传感的热点。2017 年,Li 等[84]使用组氨酸功能化GQDs-石墨烯微气凝胶(His-GQD-GMA)伏安传感器测定DA。研究表明,基于His-GQD-GMA 的传感器对DA的电化学检测具有超高的灵敏度,其DPV 信号在1.0×10-9~8.0×10-5mol/L 的范围内随着DA 的增加线性增加,检测极限为2.9×10-10mol/L(S/N=3)。2020 年,Huang 等[85]制备了基于GQDs-MWCTNS 的用于检测DA 的超灵敏电化学传感器,如图6(a)所示。结果表明,该传感器在其他干扰生物分析物中具有对DA 的出色选择性。在最佳条件下,该传感器在0.005~100 μmol/L 的宽线性范围表现出良好的线性,LOD 为0.87 nmol/L(S/N=3)。2021 年,Zhao等[86]报道了一种简单高效的埃洛石纳米管(Hal)/MWCNTs 纳米复合材料(Hal-MWCNTs)的电化学传感器,用于测定甲基对硫磷(MP)。由于Hal 和MWCNTs 的协同作用,制造的具有Hal 和MWCNTs的GCE 传感器对MP 测定显示出优异的性能。结果表明,该传感器在0.5~11 μmol/L 的线性范围内显示出相对较低的0.034 μmol/L 的检测极限且具有较好的标准偏差(2.46%~3.08%)与回收率(98.8%~101.8%)。碳纳米结构因其自身优异的物理化学性质,提高了电化学传感的灵敏度与LOD。
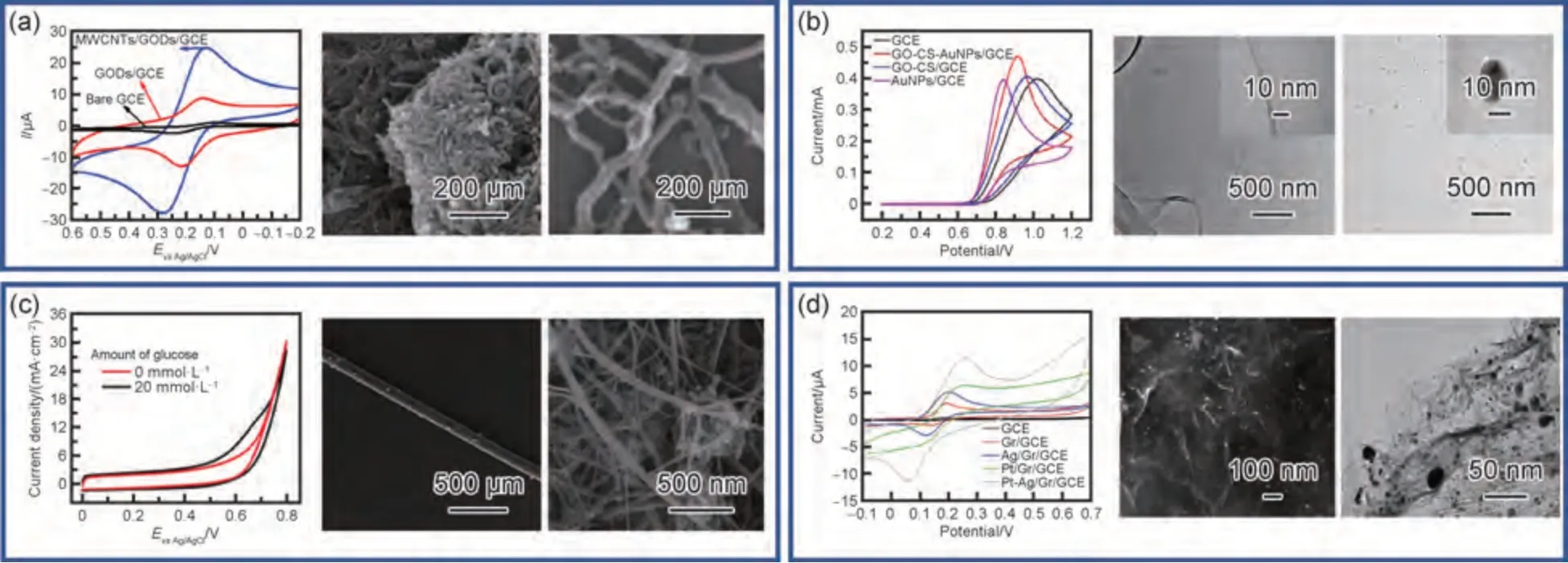
图6 碳基传感材料(a)基于GQDs-MWCTNS 的用于检测DA 的超灵敏电化学传感器[85];(b)基于MWCNTs 和GO 的Pt CNC 纳米复合材料修饰电化学传感器电极[88];(c)CuO NPs 修饰的CNT 纤维柔性电极[92];(d)Pt-Ag/Gr 纳米复合改性电极[94]Fig.6 Carbon-based sensing materials(a)ultrasensitive electrochemical sensor based on GQDs-MWCTNS for detecting DA[85];(b)Pt CNC nanocomposites based on MWCNTs and GO modified electrochemical sensor electrodes[88];(c)CuO NPs modified carbon nanotube fiber flexible electrode[92];(d)Pt-Ag/GA nanocomposite modified electrode[94]
2.2.2 碳与贵金属
单一的碳纳米结构存在一定的局限性,研究者通过将碳纳米结构与贵金属材料进行复合,使其具备所需的特殊性能。2017 年,Kangkamano 等[87]使用AuNPs修饰MWCNTs 和壳聚糖(CS)冷冻凝胶的组合制备了具有高灵敏度和稳定性的电化学非酶传感器。结果显示该传感器的线性范围为0.001~1.0 mmol/L,具有低LOD 和高稳定性,并且对血液样本中常见的生理水平干扰没有影响。2018 年,Mo 等[88]利用AuNPs 和GO 改性的GCE 制备了一种高灵敏度的亚硝酸盐(NO-2)电化学传感器,如图6(b)所示。结果表明,该传感器在0.1 mol/L 磷酸盐缓冲液(PBS)(pH=5.0)中对NO-2具有较好的电催化活性。在0.9~18.9 μmol/L 范围内,氧化峰电流与NO-2浓度呈正相关,LOD 为0.3 μmol/L。此外,还研究了一些常见离子和亚硫酸钠、AA 等可氧化化合物对亚硝酸盐检测的干扰作用。结果表明,该传感器对NO2-更为敏感和选择性。2020 年,Low 等[89]研究了一种基于智能手机的生物传感系统,用于电化学检测唾液中循环的microRNA-21(miR-21)生物标志物。该生物传感器由rGO/Au 复合材料改性而成。miR-21 靶和ssDNA 探针在rGO/Au 修饰电极上的杂交导致峰值电流随miR-21 靶浓度的增加而降低。结果表明,生物传感系统在1.0×10-4~1.0×10-12mol/L 的浓度范围内检测miR-21 表现出与商用电化学工作站相当的性能(R2=0.99)。碳与贵金属纳米复合材料因其之间的相互作用、物理化学性质等,在电化学传感中展现出优异的传感性能,具有良好的发展前景。
2.2.3 碳与过渡金属
2019 年,Chen 等[90]报道了一种CuO NPs 修饰的功能化多壁碳纳米管(f-MWCNTs)组成的超活性电催化剂,如图6(c)所示。高活性CuONPs 和高导电性f-MWCNTs 薄膜的快速检测结合,使该纳米杂化物对麻醉药物表现出优异的电化学性能。CuONPs@f-MWCNTs 薄膜修饰的SPCE 表现出优异的电化学活性、良好的重现性、0.05~346.6 μmol/L 宽线性范围和纳摩尔级的FTM 检测极限。2021 年,Zhong 等[91]使用MXene@Ag 纳米簇(NC)和氨基官能化多壁碳纳米管(MXene@AgNCs/NH2-MWCNTs)研究了一种用于多菌灵(CBZ)检测的新型比率电化学传感器。研究发现,NH2-MWCNTs 的引入可以进一步改善CBZ和Ag 的电化学信号,从而增强信号放大和更高的灵敏度,该传感器在0.3 nmol/L~10 μmol/L 范围内表现出良好的线性关系,检测限为0.1 nmol/L。2023年,Muqaddas 等[92]通过无黏合剂的电沉积法在碳纳米管(CNT)纤维表面沉积CuONPs,由于CuONPs 的电催化活性以及CNT 纤维优异导电性的协同作用,该电极对葡萄糖表现出3000 μA·(mmol/L)-1·cm-2的优异灵敏度、1.4 μmol/L的低检测限以及高达13 mmol/L的宽线性范围。将碳材料与过渡金属进行复合,能够提高所修饰电极的灵敏度以及生物活性。
2.2.4 碳与贵金属、过渡金属
近年来,将碳材料与金属过渡金属复合是学者们研究电化学传感的热门方向。2019 年,Ayranci 等[93]报道了一种用于检测葡萄糖的电化学非酶传感器,该传感器基于超声氢氧化物辅助还原方法合成的rGO上修饰的单分散Pt/Ni 纳米复合材料修饰的电极(Pt/Ni@rGO)。这种基于Pt/Ni@rGO 纳米复合材料的单分散电极在碱性溶液中对葡萄糖的电催化氧化表现出高电化学活性。安培分析显示葡萄糖灵敏度为171.92 μA·(mmol/L)-1·cm-2、LOD 为6.3 μmol/L、线性范围为0.02~5.0 mmol/L,具有高选择性、长期稳定性和良好的重现性。2020 年,Anuar 等[94]制备了一种Pt-Ag/Gr 纳米复合改性电极,用于DA 的电化学检测,如图6(d)所示。由于Pt-Ag NPs 与GA 之间的协同作用,Pt-Ag/Gr/GCE 增强了对DA 氧化的电催化活性。结果表明,改进后的传感器检测范围在0.10~60 mmol/L 之间,LOD 为0.012 mmol/L。Pt-Ag/Gr/GCE 在重现性、稳定性和选择性方面均有令人满意的效果。2020 年,Karimi-Maleh 等[95]报道了Pd-Ni@f-MWCNT 的合成并将其用作非酶电化学葡萄糖传感器。结果表明,制备的电极对葡萄糖氧化成葡萄糖酸内酯表现出高的电催化活性,显示了0.01~1.4 mmol/L 的宽线性范围、0.026 μmol/L 的极低LOD、71 μA·(mmol/L)-1·cm-2的极高灵敏度以及对样品分析的良好再现性、高稳定性和适用性。
综上所述,金属基和碳基纳米结构由于其高比表面积、多活性位点等自身优异特性在电化学汗液传感中展现出巨大潜力,将其进行复合不仅能表现出单一纳米结构的特点,更展现了复合材料的特有性能。功能化纳米结构提高了电化学传感器灵敏度、稳定性、选择性等问题,但可能会对纳米结构与电极之间粘连的牢固性产生影响。因此,对于纳米结构的合成和功能化及其在汗液传感中的应用机理还需要更多研究。
3 结束语
汗液传感器作为新一代可穿戴传感器,可实现物理参数和生化标记的多模态实时、无创、非侵入式检测,有望成为一种革命性的诊断技术。尽管用于实时健康监测的可穿戴柔性电化学汗液传感器取得了重大进展,但在其实际使用之前,必须解决由于人体日常状态下的汗液微量,收集能力弱,难以满足检测需求等问题;同时多参数间校准及与血液间缺乏进一步相关性研究,是限制可穿戴汗液传感进一步发展的关键。探明微量汗液收集机制,引入仿生微流控技术、优化亲疏水结构,将有效提高传感器的汗液采集与收集能力、降低新旧汗液堆积以及汗液蒸发引起的不准确性。此外,深入分析pH 和温度对其他模态生化参数的影响机制,结合汗液中多模态生化标记进行实时校准,深入研究汗液与血液中各生理指标之间的相关性,提高监测准确度,将推动汗液传感器分子水平上对人体各生理特征参数有效、实时电化学监测。近年来,非侵入式汗液传感器逐步向着便携式、无创化、微型化、集成化、智能化的趋势发展,在慢性疾病监测、重大疾病预警、远程化医疗等方面具有重大发展前景。
