小麦TaSPX1 基因的克隆、表达及耐低氮逆境的功能研究
2024-02-27张宝华刘佳静田旭钊武郁洁凯李小娟
张宝华 刘佳静 田 晓 田旭钊 董 阔 武郁洁 肖 凯李小娟,*
1 河北农业大学生命科学学院, 河北保定 071001; 2 河北省植物生理和分子病理学重点实验室, 河北保定 071001; 3 河北农业大学农学院, 河北保定 071001
土壤中的有效氮含量通常无法满足作物需求,使得氮素缺乏经常成为生长的主要限制因素[1]。为解决氮素短缺问题, 人们通过施加化肥增加土壤氮含量以确保作物生长和产量, 但作物只能从土壤中吸收部分氮素, 多余的氮除会引起环境问题外, 长期过量的氮肥输入还可改变植物根际土壤微生物群落结构和土壤氮循环进而影响植物的氮素利用效率[2-3]。因此, 揭示植物应答低氮胁迫的分子机制培育氮高效作物种质具有重要的理论和实践意义。
植物根系主要以无机氮NO3-和NH4+的形式从土壤中获取氮素, 对于大多数植物尤其是旱生植物来说, NO3-是主要氮素来源[4]。植物根系对硝酸盐的获取主要通过高亲和力转运蛋白系统(high-affinity transporter system, HATS)和低亲和力转运蛋白系统(low-affinity transporter system, LATS)两个氮素吸收系统进行[5]。前者由硝酸盐转运蛋白 2 (Nitrate Transporter 2, NRT2)家族组成并介导植株对低浓度硝酸盐的吸收; 后者为硝酸盐转运蛋 1 (Nitrate Transporter 1, NRT1)/肽转运蛋白(Peptide Transporter,NPF)家族, 主要在硝酸盐充足时发挥作用, 此外部分成员可感知外界不同硝酸盐浓度作为双亲和转运蛋白参与根对NO3-的吸收[6-9]。上述NRT 家族成员受到NLP7[10]、NRG2[11]、NAC[12]、DREB[13]、BT[14]、LBD[15]和ATG[16]等转录因子和相关蛋白的调节, 其中NLP7 作为核心转录因子也可与其他转录因子相互作用进而调控植物对氮素的吸收转运过程[10]。植物通过根系吸收的硝酸盐在硝酸还原酶(nitrate reductase, NR)、亚硝酸还原酶(nitrite reductase, NIR)和谷氨酰胺合成酶(glutamine synthetase, GS)催化下合成氨基酸和蛋白质等含氮化合物[17]。研究表明大麦基因HvNLP2[18]、番茄的自噬蛋白基因ATG6[19]、狐尾粟SiMYB30基因[20]以及甘蔗miR156[21]通过调控植株体内上述酶活性或者基因表达进而改变氮同化能力来抵御低氮胁迫。可见, 植物利用氮素的机制精细且复杂, 硝酸盐转运蛋白的调节及氮同化过程在作物氮素吸收转运和同化中发挥重要功能。
SPX 结构域存在于多种真核生物的N 端, 其命名来源于酵母抑制剂gpa1 (Syg1)、酵母磷酸酶81(Pho81)和人类多垂体逆转录病毒受体1 (Xpr1)的首字母。植物中, SPX 蛋白家族N 端均包含SPX 结构域, 根据C 端含有的不同保守域EXS、RING 和MFS被分为SPX-EXS、SPX-RING 和SPX-MFS 亚族以及只在N 端含SPX 结构域的SPX 亚族[22]。植物SPX基因家族成员已被证明在调节磷稳态和传递磷信号中发挥重要作用。研究表明SPX-EXS 亚家族成员中拟南芥AtPHO1、AtPHO1;H1和番茄SIPHO1;1介导磷从根部向地上部的转运, 基因突变后导致植株根系磷含量升高, 而地上部磷含量降低[23-24]。拟南芥中SPX-MFS 亚家族成员VPT1 (液泡磷酸转运蛋白1)也称为PHT5;1 (磷酸转运蛋白5;1)主要参与磷素由细胞质向液泡的运输[25]。在水稻中过表达SPX-MFS 亚家族成员OsSPX-MFS1-3后植株液泡内的磷含量增加, 表明该家族成员主要负责磷素在液泡和细胞质间的转运[26]。NLA 为SPX-RING 亚族成员, 研究发现其可通过与miR827 相互作用介导对磷的吸收以及磷从根部向地上部的转运[27]。而水稻OsNLA1 通过降解磷转运蛋白OsPT2 和OsPT8 来抑制磷吸收过程[28]。SPX 亚族成员拟南芥AtSPX1、水稻OsSPX1和OsSPX2作为磷信号转导的负调节因子,磷酸盐存在下, 其与转录因子PHR 相互作用进而抑制下游的磷酸盐响应过程[29-30]。
近年来的研究发现, 植物SPX 亚族成员除了调控磷信号转导途径, 还参与了其他非生物逆境的调控。水稻OsSPX1基因的过表达不仅增强了植株耐寒性, 还可能在应答氧化胁迫中发挥重要作用[31-32]。据报道SPX 亚族部分成员还参与氮磷代谢过程。水稻的OsSPX4在硝酸盐存在下, 可与NRT1.1B 相互作用后被泛素化降解, 导致转录因子NLP3 和PHR2被释放并激活下游的氮响应信号通路和磷利用途径[33]。与水稻相似, 拟南芥SPX1 与硝酸盐诱导的转录因子NIGT1 相互作用进而调节PHR1 的表达来响应磷信号途径[34]。研究表明巨型浮萍SpSPX1和SpSPX2基因在磷和氮缺乏时显著上调表达, 共同调控氮磷代谢过程[35]。此外SPX 还参与氮信号途径的应答。大豆中GmSPX8与bHLH 转录因子GmPTF1相互作用共同调节植物根部结节发育和固氮作用[36]。对马铃薯低氮处理下的转录组进行分析发现SPX4基因对低氮胁迫显著应答, 然而对其作用机制尚不清楚[37]。
小麦是我国重要的粮食作物, 已有研究发现小麦(Triticumaestivum)的部分SPX 家族成员的表达在磷胁迫下发生了变化, 但对其功能尚不明确[38-39]。本研究前期从小麦中鉴定了一个 SPX 亚族成员TaSPX1, 发现该基因对低氮胁迫有明显应答, 利用遗传转化技术获得过表达转基因烟草株系, 结合表型分析、生理生化参数、活性氧清除系统和氮素吸收及转运等方面研究该基因抵御低氮胁迫的功能,旨在丰富对小麦SPX 基因家族成员抵御营养逆境的认识, 为创制营养高效的作物品种提供理论依据。
1 材料与方法
1.1 试验材料
供试烟草种子“本氏烟草” (NicotianabenthamianaDomin)和普通烟草“威斯康辛38” (Nicotiana tabacumcv. Wisconsin 38)提供瞬时转化和遗传转化的外植体、小麦种子“中国春” (TriticumaestivumL.)、大肠杆菌“DH5α” (EscherichiacoliDH5α)、农杆菌“EHA105” 和“GV3101” (Agrobacteriumtumefaciens)、亚细胞定位载体pCAMBIA1300 和过表达载体pCAMBIA3301 均由河北农业大学生命科学学院植物生理与分子病理学重点实验室保存留用。
1.2 小麦TaSPX1 的分子特征和系统进化分析
本研究前期从小麦基因家族中分离出一个SPX基因, 命名为TaSPX1(GenBank 登录号为Ak332300), 获得全长cDNA 序列1333 bp。使用ExPasy 软件对其开放阅读框ORF、编码氨基酸数量、分子量和等电点进行分析。应用DNAMAN 和Pfam 软件分析该基因编码蛋白的保守结构域位置。利用 NCBI(http://www.ncbi.nlm.nih.gov/)在线网站查找并下载水稻、拟南芥和小麦的SPX 蛋白家族成员, 应用MEGA 软件进行ClustalW 方法的多序列比对, 选用邻近法(Neighbor-Joining)和bootstrap 分析1000 次后构建小麦TaSPX1 与上述植物种属的SPX 蛋白系统进化树[40]。
1.3 TaSPX1 基因启动子的顺式作用元件分析
1.4 小麦TaSPX1 的表达特征分析
将小麦种子在室温下黑暗处理至萌芽后转移到MS (Murashige & Skoog)营养液中培养, 培养条件为: 光照周期14 h/10 h (明/暗), 温度为25℃。待小麦生长至三叶期进行低氮处理, 于0、3、9、12 和27 h 和MS 下恢复24 h 的各处理时间点分别收取小麦的叶和根保存在-80℃冰箱。使用M5 Quickspin植物RNA 快速提取试剂盒(Mei5bio, 中国)提取上述材料的总RNA 后利用M5 Super plus RT-qPCR RT kit with gDNA remover (Mei5bio, 中国)试剂盒进行合成cDNA 并测定浓度。以各cDNA 为模板, 小麦Tubulin基因为内参, 使用实时定量PCR (RT-qPCR)方法扩增TaSPX1基因。RT-qPCR 反应体系总体积为20 μL, 包括10 μL 2× M5 HiPer Realtime PCR Supper Mix with Low Rox (Mei5bio, 中国), 上下游引物各0.5 μL, 2 μL cDNA 和7 μL 无核酸水。含3个生物学重复。使用2-ΔΔCT法计算表达量[41]。
1.5 TaSPX1 亚细胞定位特征分析
通过PCR 方法, 以1.4 中0 h 的叶片cDNA 为模板, 扩增TaSPX1基因的编码阅读框(ORF)序列。产物回收后连接pUCM-T 克隆载体(Mei5bio, 中国),重组质粒经单酶切验证后送华大基因生物公司测序验证, 测序正确的菌液保存于-80 ℃, 为后续亚细胞定位载体提供模板。
构建pCAMBIA1300-35S-TaSPX1-GFP 载体完成后, 将含有35S::TaSPX1-GFP 重组质粒和35S::GFP质粒的GV3101 农杆菌注射本氏烟草的下表皮。采用瞬时表达法[42]对烟草培养 48 h 后, 以注射含有35S::GFP 质粒的农杆菌的烟草叶片为对照, 并结合DAPI 核染料在荧光显微镜下观察亚细胞定位情况。
1.6 转基因烟草植株的遗传转化和鉴定
同1.5 中方法扩增TaSPX1基因, 使用DNA 重组技术, 构建基因表达质粒。利用农杆菌EHA105介导的遗传转化技术, 得到过表达烟草威斯康38 转基因植株并完成转基因植株的鉴定[42]。
1.7 转基因烟草在低氮和低磷胁迫下的表型鉴定
采用MS (Murashige & Skoog)营养液水培法培养野生型(wild type, WT)和过表达TaSPX1(overexpression lines, OE)的烟草株系幼苗[42]。WT 和OE 烟草种子在蛭石中萌发并生长至三叶期, 选取长势一致的幼苗, 转移至MS 全营养液培养1 周后, 再挑选一致的WT、OE3 和OE4 烟草植株转移至MS、低氮营养液(20 μmol L-1)和低磷营养液(10 μmol L-1)中,每组3 个重复, 于处理后7 d 和21 d 观察生长情况并照相记录。称量植株鲜重和根重并计算叶面积,测量植株叶绿素含量和光合参数(Pn、Gs、Ci和Tr)、可溶性糖和可溶性蛋白含量, 最后分别收取WT、OE3 和OE4 的根和叶, 于-80℃冰箱保存, 为后续试验提供材料。
1.8 低氮胁迫下保护酶活性和丙二醛含量测定
以WT、OE3 和OE4 的烟草叶片为材料。以1.7营养液培养的 WT 和过表达株系OE3 和OE4 的烟草叶片为材料。测定包括超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)和过氧化氢酶(catalase, CAT)的保护酶活性以及MDA含量[43]。
1.9 低氮胁迫下氮吸收同化参数分析和氮含量测定
以1.7 营养液培养的WT 和过表达株系OE3 和OE4 的烟草叶片为材料。利用凯氏定氮法测定WT、OE3 和OE4 植株地上部的氮含量[44]。测定硝酸还原酶(NR)、亚硝酸还原酶(NIR)和谷氨酰胺合成酶(GS)的活性[45-47]。
在作品设计阶段,需要紧紧围绕赛题的基本要求,对各个模块的功能进行设计。首先要确定系统应该具备的功能模块,各功能模块应该围绕题干,重点突出需要完成的功能要求。其次,要进一步设计各个功能模块应采用什么方法去做,采用哪些算法来解决问题,此阶段分析的越细,开发阶段越轻松。在作品设计阶段,各组的学生可以相互交流,相互提出自己的观点,然后大家一起分析讨论,指导老师可以在分析过程中给学生一些必要的指导建议,保证作品设计的方向符合作品的要求。
1.10 下游相关基因的表达分析
以1.7 中低氮胁迫下处理的WT、OE3 和OE4的根为材料, 使用1.4 中的方法进行提取总RNA 和反转录cDNA。以烟草的Ntactin基因作为内参, 利用RT-qPCR 对包含5 个SOD、11 个POD 和6 个CAT在内的保护酶基因以及氮吸收转运途径的6 个NR、5 个NIR、6 个NRT 和7 个GS 基因的表达量进行分析。使用的基因特异性引物见表1。RT-qPCR 的反应体系、程序和计算方法见1.4。

表1 用于RT-qPCR 的引物Table 1 Primers used for RT-qPCR analysis
1.11 数据分析
使用Microsoft Excel 和SPSS 21.0 软件进行数据统计分析。
2 结果与分析
2.1 TaSPX1 的分子特征和系统进化分析
本实验室前期从小麦基因家族中获得一个SPX 基因成员TaSPX1(Ak332300), 其ORF 为888 bp, 编码295 个氨基酸, 分子量为33.39 kD, pI 5.20。TaSPX1 蛋白只在N 端1~167 位氨基酸残基处含有一个SPX 结构域, 属于SPX 亚族成员。为探究小麦TaSPX1 与拟南芥、水稻和小麦等植物种属其他SPX 蛋白的亲缘关系, 从NCBI (http://www.ncbi.nlm.nih.gov/)下载相关SPX 蛋白序列, 利用MEGA7 软件分析并构建系统进化树。结果显示, 上述3个物种的SPX蛋白依据结构域序列特征分为4 个组, 分别为SPX、SPX-EXS、SPX-MFS 和SPXRING 亚族, 小麦TaSPX1 与同属于SPX 亚族的水稻OsSPX1 亲缘关系较近(图1)。
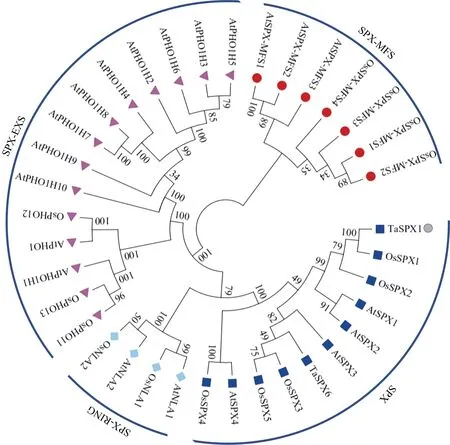
图1 TaSPX1 与小麦、水稻和拟南芥SPX 家族同源蛋白的系统进化分析Fig. 1 Phylogenetic analysis of TaSPX1 and homologous from wheat, rice, and Arabidopsis thaliana
2.2 TaSPX1 的亚细胞定位特征分析
应用瞬时表达法, 将验证正确的包含35S::TaSPX1-GFP 质粒和包含35S::GFP 质粒的农杆菌分别注射到本氏烟草叶片中, 并培养至48 h 后选用叶片下表皮,结合DAPI 染液侵染在荧光显微镜下观察。结果显示, 瞬时表达GFP 蛋白的对照组烟草叶片细胞中荧光信号分布在整个细胞; 而表达TaSPX1-GFP 融合蛋白的叶片细胞仅在细胞核中观察到荧光信号, 结合DAPI 染色结果进一步确定TaSPX1 定位于细胞核中发挥相应功能(图2)。

图2 转化烟草表皮细胞的TaSPX1-GFP 亚细胞定位Fig. 2 Subcellular location of the TaSPX1-GFP fusion in epidermis cells of transformed tobacco (50 μm)
2.3 TaSPX1 在低氮胁迫下的时空表达特征
为探究TaSPX1在小麦中的表达特征, 以低氮处理0、3、9、12 和27 h 和恢复24 h 的小麦老叶、新叶和根为材料, 使用RT-qPCR 技术, 以小麦Tubulin为内参基因进行TaSPX1的表达量分析。结果表明,TaSPX1在老叶、新叶和根中的表达均上调, 其在不同组织中的表达特征有所不同。低氮处理后3 h, 老叶中的表达量达到最高值, 之后下降直至27 h 与处理前无显著差异; 新叶中TaSPX1的表达随着处理时间的延长有所增加, 至27 h 达到最高值; 根中表达量在胁迫9 h 达到最高, 27 h 仍保持较高表达量。在恢复正常供氮水平24 h 后, 老叶、新叶和根系样本的TaSPX1表达量回落至与处理前无显著差异(图3)。可见, 小麦不同组织中的TaSPX1基因均对低氮胁迫产生了明显应答。
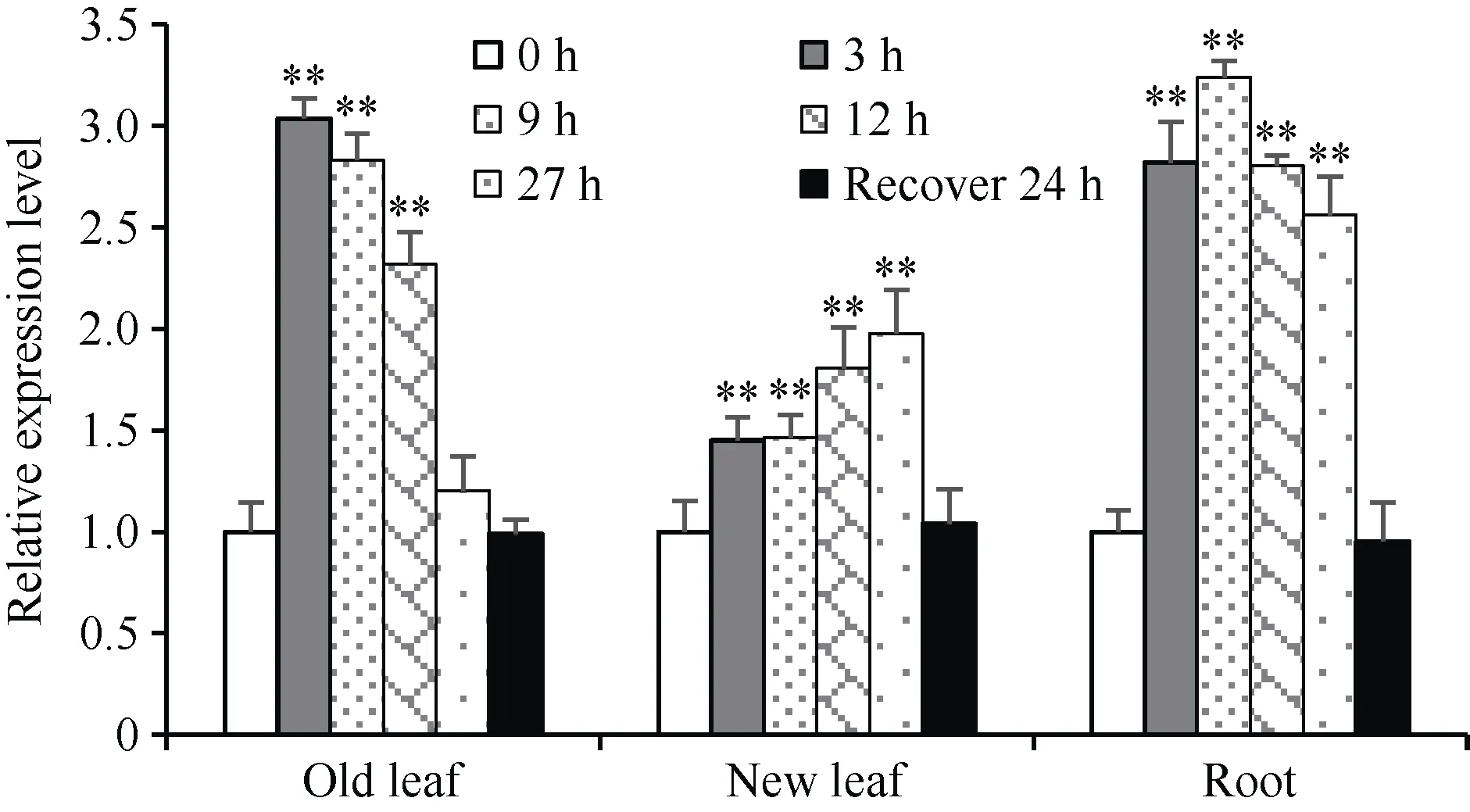
图3 小麦TaSPX1 基因在低氮胁迫下的表达特征Fig. 3 Relative expression pattern of TaSPX1 of wheat seedlings under low-N stress
2.4 TaSPX1 启动子顺式作用元件分析
使用Plant care (http://bioinformatics.psb.ugent.be/webtools/plantcare/)获取TaSPX1起始位点ATG 上游2000 bp 启动子区, 分析该区域顺式作用元件发现, 其除了含有应答ABA、盐和干旱逆境等元件外,还包含6 个应答低氮胁迫的顺式作用元件(表2)。
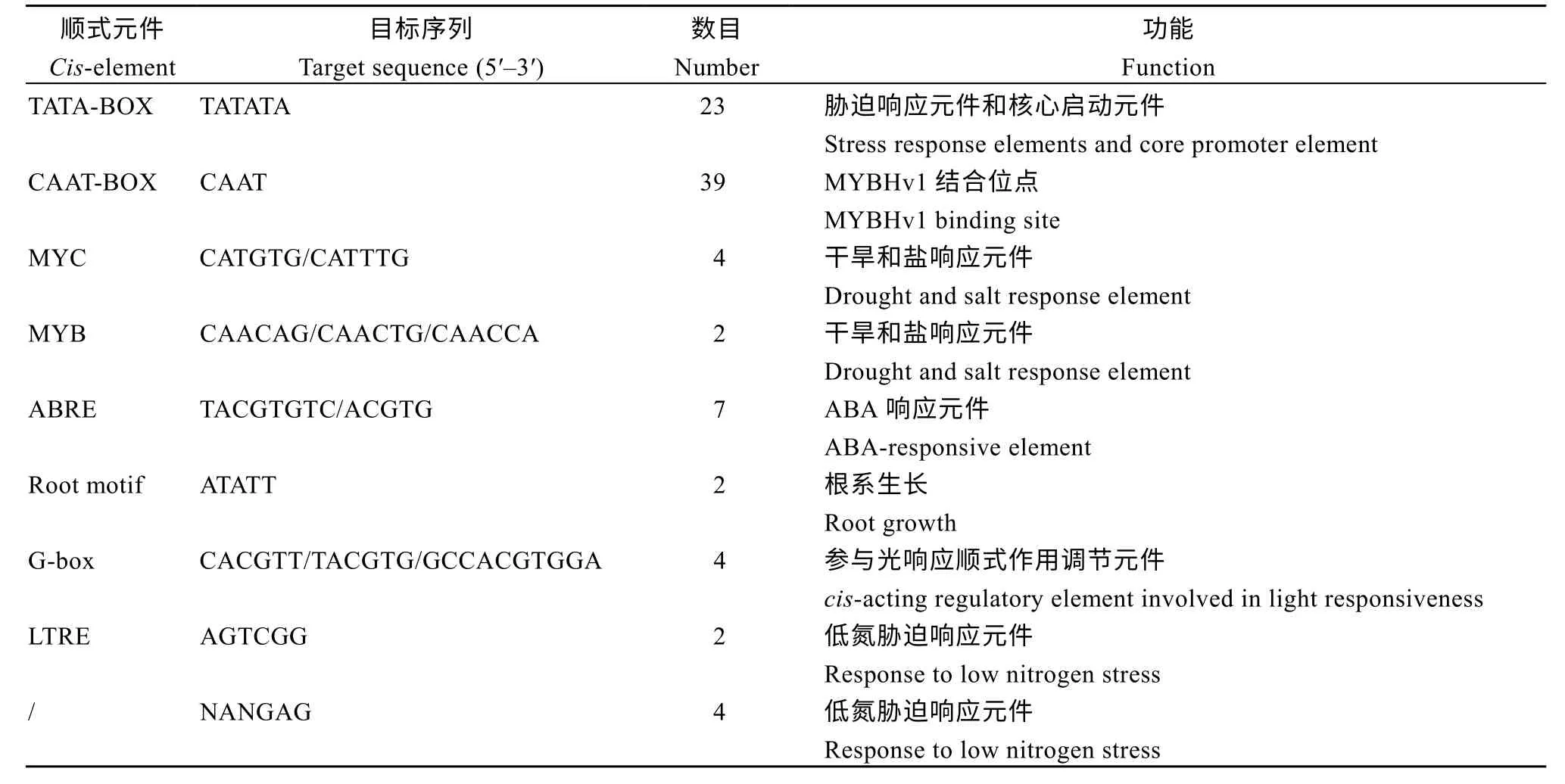
表2 TaSPX1 基因启动子的顺式作用元件分析Table 2 Analysis of putative cis-acting elements in the promoter region of TaSPX1
2.5 TaSPX1 基因的功能分析
2.5.1 过表达转基因株系的阳性鉴定 利用农杆菌遗传转化重组质粒获得转基因烟草株系, 提取WT 和各OE 植株的叶片总RNA, 反转录为cDNA。以cDNA 为模板, 使用特异性引物进行RT-qPCR 检测, 结果显示OE 中TaSPX1基因表达量较WT 显著增加, 表明TaSPX1基因遗传转化烟草植株成功, 得到5 个阳性烟草转化株系OE1~OE5 (图4)。

图4 过表达烟草植株中TaSPX1 的表达分析Fig. 4 Relative expression level of TaSPX1 in overexpression tobacco lines
2.5.2 过表达转基因烟草的表型特征及低氮胁迫下的生物量、叶绿素含量和光合参数测定 选取2.5.1 中表达量较高的烟草株系OE3 和OE4 与野生型(WT)为材料, 在MS 营养液、低氮和低磷处理下进行水培培养分析表型特征。结果表明, 在MS 营养液正常条件和低磷处理下, OE3 和OE4 与WT 的长势没有明显差异。而在低氮处理21 d 后, OE3 和OE4相较于WT 有明显的生长优势, 主要表现为地上部增大、根系较长、叶片较多和叶色更绿等特点(图5-A,B)。可见, 过表达TaSPX1没有增强植株耐低磷特性,却促进了对低氮胁迫的抵御。
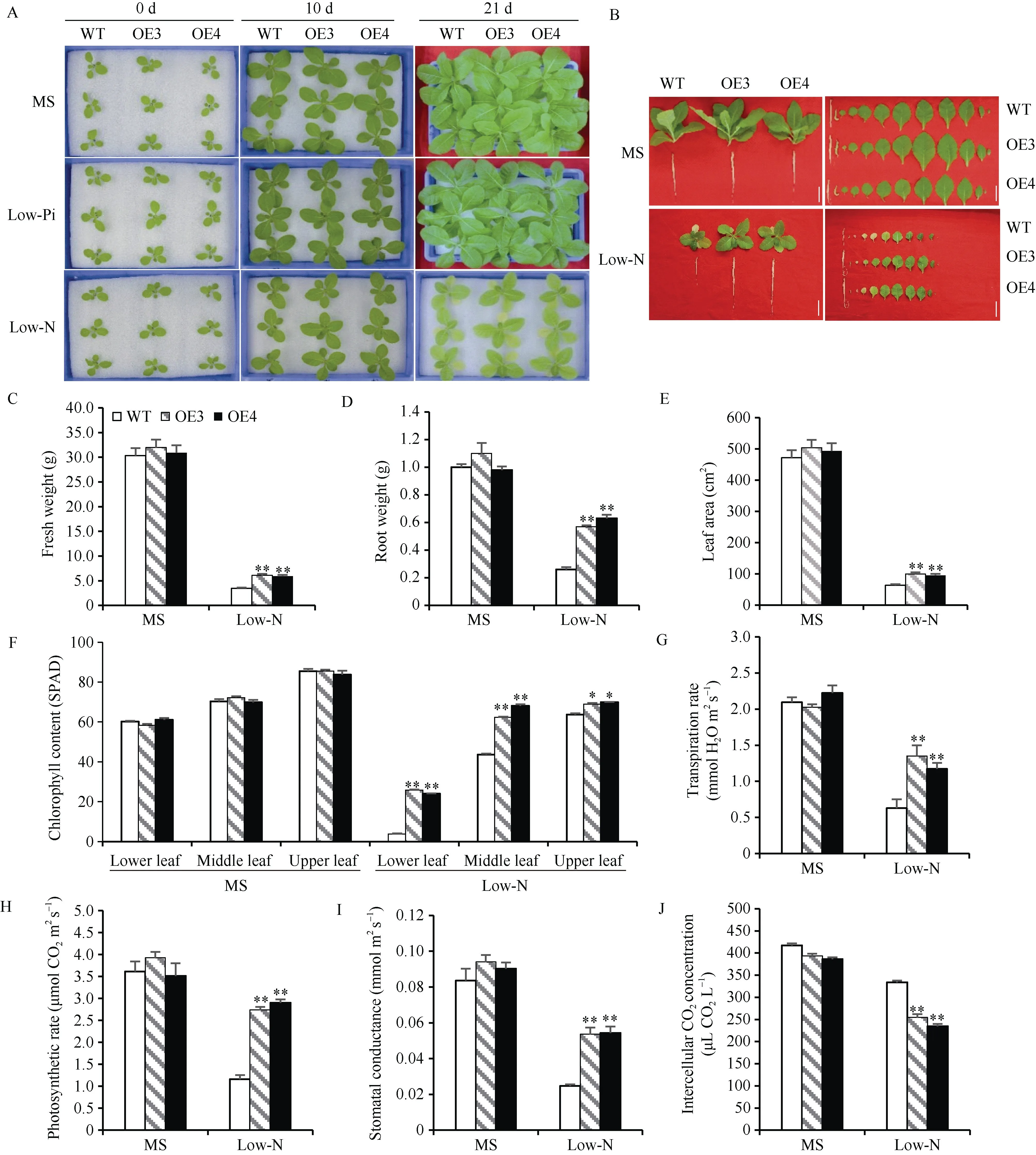
图5 WT、OE3 和OE4 在低磷和低氮下的表型特征及低氮处理下的生理生化特征Fig. 5 Phenotype of WT, OE3, and OE4 plants under low-Pi and low-N treatments and physiological and biochemical characteristics under low-N treatment
为了进一步探究TaSPX1对低氮胁迫的抵御能力, 测定了WT、OE3 和OE4 烟草植株的生物量、叶绿素含量和光合参数。结果显示, 与WT 相比,OE3 和OE4 植株的鲜重、根重和总叶面积均明显增加(图5-C, D, E)。与WT 相比, 过表达植株下叶位、中叶位和上叶位的叶绿素含量均增加明显(图5-F)。对光合参数测定发现, 叶片蒸腾速率(Tr) (图5-G)、净光合速率(Pn) (图5-H)以及气孔导度(Gs)升高(图5-I), 而胞间CO2浓度(Ci)下降(图5-J)。可见, 超表达TaSPX1改善了烟草植株低氮胁迫下的光合和生理性能, 表现出了明显的生长优势。
2.6 过表达烟草植株氮含量和可溶性糖及蛋白含量测定
对WT 和过表达烟草植株OE3 与OE4 地上部的氮含量进行分析。结果显示, MS 条件下, WT 和OE 植株中氮素含量无明显变化; 低氮胁迫下,OE3 和OE4 植株体内的含氮量显著高于WT (图6-A)。另外, 与WT 相比, OE3 和OE4 可溶性糖和可溶性蛋白的含量也明显增加(图6-B, C)。可见,烟草植株中过表达TaSPX1基因增强了低氮处理下植株氮素的吸收利用效率及合成含氮化合物的能力。

图6 低氮处理下WT、OE3 和OE4 植株氮含量(A)、可溶性糖(B)和可溶性蛋白(C)Fig. 6 Contents of nitrogen (A), soluble sugar (B), and soluble protein (C) in WT, OE3, and OE4 under low-N treatment
2.7 氮吸收同化参数及相关基因的表达特征分析
植物通过氮吸收同化途经获得并利用外界环境中的氮素。对WT 和过表达烟草植株OE3 与OE4叶片的氮同化相关参数亚硝酸还原酶(NIR) (图7-A)、硝酸还原酶(NR) (图7-B)和谷氨酰胺合酶(GS)(图7-C)的活性进行分析。结果显示, MS 条件下, WT和OE 植株中NIR、NR 和GS 的活性无明显变化; 低氮胁迫下, OE3 和OE4 植株中3 种酶的活性较WT明显增加。又对上述材料根中的亚硝酸还原酶(NIR)基因、硝酸还原酶(NR)基因、氮转运蛋白(NRT)基因和谷氨酰胺合成酶(GS)基因的表达进行分析。结果发现, 低氮处理下与WT 相比, OE3 和OE4 的氮吸收相关基因NtNRT1.1-s和NtNRT2;1(图7-D)以及氮同化相关基因NtNIR1和NtNIR4(图 7-E),NtNR2和NtNR3(图7-F),NtGS2、NtGS4和NtGS6(图7-G)表达量均明显增加。表明过表达TaSPX1转基因烟草株系增强了N 吸收和同化酶活性及部分基因的表达, 可能由此提高了植株低氮胁迫下对N素的吸收利用。

图7 低氮胁迫下WT、OE3 和OE4 株系的氮吸收同化酶活性和基因表达Fig. 7 Activities of nitrogen anabolases and relative expression of NIRs, NRs, NRTs, and GSs in WT, OE3, and OE4 lines under low-N treatment
2.8 保护酶活性和基因表达分析及丙二醛含量的测定
对WT、过表达烟草株系OE3 和OE4 叶片保护酶和MDA 的含量进行测定。结果显示, 在正常MS条件下, WT、OE3 和OE4 的保护酶活性和MDA 没有明显差异; 而在低氮处理下与WT 相比, OE3 和OE4 的SOD (图8-A)、POD (图8-B)和CAT (图8-C)活性都显著增加, 而MDA 含量下降(图8-D)。进一步对上述材料根中的保护酶基因表达量进行分析表明, 在低氮处理下与 WT 相比, OE3 和 OE4 的NtFeSOD(图8-E),NtPOD1;5、NtPOD4和NtPOD9(图8-F),NtCAT1;1和NtCAT1;3(图8-G)的表达量明显增加, 供试其他相关保护酶基因成员的表达量则变化不明显。可见, 过表达TaSPX1烟草株系增强了清除活性氧的能力。
3 讨论
迄今, 继第一个具SPX 结构域的蛋白在酿酒酵母中发现后, 已在不同植物种属中鉴定出包含SPX、SPX-EXS、SPX-MFS 和SPX-RING 四个亚族的SPX家族成员[22]。其中, 在拟南芥和水稻中的功能研究较多, 上述成员已被证明在传递磷信号和调节磷稳态中发挥重要作用, 但结构域的不同赋予了上述亚族在应答磷信号过程中吸收和转运等具体功能的差异[22]。此外, 研究还发现SPX 亚族的部分成员参与了其他环境信号的应答。水稻OsSPX1除参与磷应答外, 还参与植株抵御低温和氧化胁迫的功能[31-32];水稻OsSPX4则通过NRT1.1B-SPX4-NLP3 组成的调控模块触发硝酸盐应答反应, 并调控磷信号的核心转录因子PHR2, 实现氮磷应答的协同激活[33]; 拟南芥AtSPX1也可通过NIGT1-AtSPX1-PHR1 信号转导途径来激活下游的磷利用途径[34]; 另外巨型浮萍的SpSPX1和SpSPX2以及大豆GmSPX8也参与了氮磷信号的调节[35-36]; 转录组分析发现马铃薯SPX4对氮信号有应答[37]。目前在小麦中SPX 家族基因的研究尚少, 转录组分析发现部分成员的基因表达在磷胁迫下发生了改变[38-39]。本研究从小麦中获得的TaSPX1基因编码蛋白仅在N 末端含有一个SPX 结构域, 对其系统进化关系的研究发现TaSPX1 与水稻中同为SPX 亚族的OsSPX1 亲缘关系较近, 属于SPX 亚族。TaSPX1基因启动子区含有6 个已知应答低氮胁迫的顺式作用元件, 结合RT-qPCR 研究发现其对低氮逆境发生明显应答, 过表达植株具有明显的生长优势, 其生物量和光合参数等均显著增强,表明TaSPX1增强了植株抵御低氮逆境的功能。以上研究结果丰富了对小麦SPX 亚族功能以及该亚族成员参与磷信号之外其他非生物逆境功能的认识, 并拓宽了对氮信号调控网络的理解。
硝酸盐是植物主要的氮源之一, 植物通过高亲和力运输系统(HATs)和低亲和力运输系统(LATs)调节硝酸盐的吸收和运输。研究表明水稻中过表达AP2/ERF (APETALA2/ethylene-responsive factor)家族基因OsDREB1C[13]以及拟南芥中过表达茶树脂质转运蛋白基因CsATG3a[16](AuTophaGy-related genes)可以通过分别正调控NRT 家族成员OsNRT1.1B、OsNRT4.1、AtNRT1.1、AtNRT2.1和AtNRT2.2的表达进而提高植株对氮素的吸收转运和利用。而苹果的MdBT2(BTB and TAZ domain protein 2)则对NRT家族基因负调控, 降低植株对氮素的利用效率[14]。另外, 氮同化相关酶NR、NIR 以及GS 等在植株体内氮素利用的过程中也扮演着重要角色。据报道大麦基因HvNLP2突变后导致植物体内相关基因如硝酸盐同化基因HvNR1、HvNIR、HvGS1.2和HvGS2的表达量降低, 导致氮同化减少从而增加了硝酸盐的含量[18]。低氮胁迫下过表达SiMYB30的水稻激活氮同化相关基因OsGOGAT1、OsGOGAT2和OsNIA2,从而提高了植株籽粒和茎中的氮含量[20]。本研究发现, 低氮胁迫下过表达TaSPX1的烟草叶片中的氮吸收同化酶NIR、NR 与GS 的活性较WT 明显增加。另外过表达TaSPX1的烟草植株根中氮转运蛋白NtNRT1.1-s和NtNRT2;1, 氮同化相关基因亚硝酸还原酶基因NtNIR1和NtNIR4, 硝酸还原酶NtNR2和NtNR3, 以及谷氨酰胺合成酶基因NtGS2、NtGS4和NtGS6的基因表达水平与WT 相比上调, 这也与植株的含氮量在过表达株系中增加的结果一致。表明TaSPX1基因可通过调节上述基因的表达增强植株对氮素的吸收转运和同化过程来提高植株的氮素利用率, 对其抵御低氮胁迫的分子机制还有待进一步研究。
植物遭受非生物胁迫后会导致细胞自由基代谢失衡, 对细胞造成毒害和损伤, 引起过氧化氢(H2O2)和单分子氧(O2-)的积累[48]。已有研究表明,活性氧清除系统在植株抵御非生物胁迫中发挥重要作用。 在拟南芥中过表达VvWRKY30和GmWRKY49后通过提高ROS 清除系统相关POD、CAT 和SOD 酶活性或基因表达水平, 增强了植株对盐的耐受性[49-50]。对大麦的研究发现, 耐低氮型比敏感型野生大麦SOD、POD 和CAT 酶活性增强,加强了细胞内活性氧清除能力, 表现出更强的耐低氮能力[51]。本研究表明, 低氮胁迫下, 过表达TaSPX1烟草株系的保护酶活性明显高于野生型。另外发现保护酶相关基因NtFeSOD、NtCAT1;1、NtCAT1;3、NtPOD1;5、NtPOD4和NtPOD9等的表达量高于WT。保护酶活性水平的增强和基因表达水平的提高与MDA 含量下降的结果一致, 暗示了TaSPX1可能通过增强植株保护酶活性和基因表达两个层面加强活性氧清除能力实现了对植株更有力的保护来抵御低氮胁迫。
迄今, 对成员众多的SPX 家族基因功能与机制的研究主要集中在磷信号应答中, 本研究丰富了对该家族成员功能的新认识, 初步探究了TaSPX1应答低氮逆境的功能, 研究结果为作物抵御低氮营养逆境的遗传改良提供了理论依据。
4 结论
从小麦中鉴定得到一个SPX 家族基因TaSPX1,该基因对低氮胁迫产生明显应答, 编码蛋白定位于核内。其与水稻SPX 亚族的OsSPX1 亲缘关系较近。构建烟草过表达转基因株系, 发现低氮胁迫下, 与野生型相比, 过表达株系增强了抗低氮胁迫的能力。进一步的分析表明TaSPX1可能通过加强保护酶系统、增强氮吸收和转运以及改善光合能力等在介导植株抵御低氮胁迫中发挥重要作用。
