温度对过氧化氢抑制前成骨细胞MC3T3-E1细胞增殖和成骨分化的影响
2024-02-27耿卢婧孙智欣李俞辰史培培
耿卢婧,孙智欣,李俞辰,张 瑜,史培培
(新乡医学院生命科学技术学院,河南 新乡 453003)
随着人口老龄化的持续加速,骨质疏松症已成为公共卫生健康的热点问题之一。老年骨质疏松症诱发的脆性骨折1 a内病死率高达14%[1]。研究表明,在骨质疏松症发病过程中,氧化应激[2]、肠道微生物[3-4]、自噬[5-6]、铁代谢[7]、细胞衰老[8]等均发挥重要作用,而氧化应激是导致骨质疏松症中成骨细胞和破骨细胞功能失衡的关键因素之一[9]。此外,随着年龄的增加,机体的体温调节能力自然衰退[10]。温度不仅可以调节机体的免疫能力[11],改变肠道微生物的功能[12],还会增加机体患癌风险,影响癌症的免疫治疗效果[13],甚至影响生物体的寿命[14]。然而,目前温度与骨质疏松的关系尚不清楚。基于此,本研究选用小鼠胚胎成骨细胞前体细胞MC3T3-E1为研究对象,观察温度对过氧化氢(hydrogen peroxide,H2O2)诱导的氧化损伤抑制前成骨细胞增殖和成骨分化的影响,旨在揭示温度对骨重建的影响,为骨质疏松症的治疗提供实验基础和新思路。
1 材料与方法
1.1 细胞、主要试剂与仪器
小鼠胚胎成骨细胞前体细胞MC3T3-E1由河南省温度应激分子基础与疾病防治创新团队赠予并保存。MEMα培养液、胎牛血清(fetal bovine serum,FBS)、100×青霉素-链霉素溶液、2.5 g·L-1胰蛋白酶购自武汉普诺赛生命科技有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)、引物购自生工生物工程(上海)股份有限公司,H2O2溶液购自西格玛奥德里奇(上海)贸易有限公司,RNAiso Plus、反转录试剂盒、荧光定量试剂盒购自宝日医生物技术(北京)有限公司,聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶快速制备试剂盒、三色预染蛋白Maker购自上海雅酶生物医药科技有限公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)、骨桥蛋白(osteopontin,OPN)和骨钙素(osteocalcin,OC)一抗和二抗均购自英国Abcam公司;NanoDrop 2000微量分光光度计购自美国Thermo Fisher Scientific公司,电泳仪和电泳槽购自美国Bio-Rad公司,7500荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪购自美国Applied Biosystems公司,Amersham Imager 600化学发光仪购自美国GE公司。
1.2 细胞培养及分组处理
将MC3T3-E1细胞接种于含体积分数20%FBS、体积分数1%100×青霉素-链霉素溶液的MEMα培养液中,置于37 ℃、含体积分数5%CO2的培养箱中培养,待细胞生长至汇合度为80%~90%时进行传代。传代时,先去除所有培养液,然后加入1 mL 胰蛋白酶(2.5 g·L-1)消化细胞,1 000 r·min-1离心5 min,收集细胞;取对数生长期MC3T3-E1细胞,以每孔1×104接种于96孔板,随机分为0、450、500、550、600、650 μmol·L-1H2O2干预组,分别给予0、450、500、550、600、650 μmol·L-1H2O2溶液干预2 h。依据参考文献[15-17]和预实验结果,选择32 ℃、37 ℃、40 ℃温度作为实验温度条件。取对数生长期MC3T3-E1细胞,以每孔3×105接种于6孔板,随机分为对照组、模型组、低温组和高温组。对照组细胞置于37 ℃、含体积分数5%CO2培养箱中孵育24 h;模型组细胞置于37 ℃、含体积分数5%CO2培养箱中孵育24 h,并给予H2O2刺激2 h;低温组细胞置于32 ℃、含体积分数5%CO2培养箱中孵育24 h,并给予H2O2刺激2 h;高温组细胞置于40 ℃、含体积分数5%CO2培养箱中孵育24 h,并予H2O2刺激2 h。
1.3 CCK-8法检测MC3T3-E1细胞增殖能力
取0、450、500、550、600、650 μmol·L-1H2O2干预组细胞,以及对照组、模型组、低温组和高温组细胞,滴加新鲜含体积分数10% CCK-8工作液的完全培养液,继续在37 ℃、含体积分数5%CO2的培养箱中培养1 h;然后,使用酶标仪检测各孔在450 nm处的光密度值(optical density,OD)。计算细胞增殖率,细胞增殖率=(OD处理组-OD空白组)/(OD对照组-OD空白组)×100%。实验重复3次,取均值。
1.4 实时荧光定量PCR 法检测 MC3T3-E1 细胞中RUNX2、OPN和OC mRNA表达水平
取对照组、模型组、低温组和高温组细胞,使用 RNAiso Plus提取细胞总RNA,反转录为cDNA,进行荧光定量PCR检测。根据不同目的基因的mRNA序列,设计荧光定量PCR引物:β-actin上游引物序列为5′-TATGCTCTCCCTCACGCCATCC-3′,β-actin下游引物序列为5′-GTCACGCACGATTTCCCTCTCAG-3′;RUNX2上游引物序列为5′-GATGATGACACTGCCACCTCTGAC-3′,RUNX2下游引物序列为5′-TGAGGGATGAAATGCTTGGGACTG-3′;OPN上游引物序列为5′-ATGGACGACGATGATGACG-ATATG-3′,OPN下游引物序列为5′-ATGGACGACGATGATGACGATATG-3′;OC上游引物序列为5′-CAAGCAGGAGGGCAATAAGGTAGTG-3′,OC下游引物序列为5′-CGGTCTTCAAGCCATACTGGTCTG-3′。反应体系为:SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)10.0 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,ROX Reference Dye Ⅱ(50 ×)0.4 μL,灭菌水 6.0 μL。反应条件为:第1阶段,95 ℃ 30 s;第2阶段 95 ℃ 5 s,60 ℃ 31 s,重复 40 个循环;第3阶段,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。以β-actin为内参,采用2-ΔΔCt法计算RUNX2、OPN、OC mRNA相对表达量。实验重复3次,取均值。
1.5 Western blot法检测 MC3T3-E1 细胞中RUNX2、OPN和OC蛋白表达
取对照组、模型组、低温组和高温组细胞,加入80 μL RIPA裂解液,置于冰上裂解30 min;4 ℃下10 000×g离心10 min,收集细胞裂解液上清液;使用二辛可酸蛋白浓度测定试剂盒测定上清液蛋白浓度后,调整不同样品的蛋白浓度一致,按比例加入5×蛋白上样缓冲液,100 ℃加热15 min,冷却至室温后10 000×g离心5 min,取上清液;使用PAGE凝胶快速制备试剂盒(12.5%)配制凝胶进行电泳,上样量为每孔20 ng蛋白,电泳条件为80 mV 30 min,然后调整电压为120 mV继续电泳90 min。电泳结束后,将样品转移至0.45 μm聚偏氟乙烯膜上;然后,用脱脂奶粉室温摇床封闭2 h后,滴加GAPDH小鼠源一抗、RUNX2兔源一抗、OPN兔源一抗、OC兔源一抗(滴度均为11 000),摇床孵育过夜;洗膜3次后,添加对应种属来源的羊抗鼠二抗或羊抗兔二抗(滴度均为11 000),室温摇床孵育50 min。使用增强化学发光试剂盒进行显影,Amersham Imager 600化学发光仪采集蛋白条带照片;使用 ImageJ 软件分析目的蛋白条带灰度值,计算目的蛋白相对表达量,以GAPDH为内参,以目的蛋白灰度值与内参蛋白灰度值比值表示目的蛋白相对表达量。实验重复3次,取均值。
1.6 统计学处理

2 结果
2.1 不同浓度H2O2诱导MC3T3-E1细胞增殖率比较
0、450、500、550、600、650 μmol·L-1H2O2干预组细胞增殖率分别为(100.00±6.49)%、(95.10±5.69)%、(88.50±4.46)%、(76.00±2.02)%、(51.20±6.87)%、(39.50±4.46)%。0、450、500 μmol·L-1H2O2干预组细胞增殖率比较差异无统计学意义(P>0.05);550、600、650 μmol·L-1H2O2干预组细胞增殖率显著低于0、450、500 μmol·L-1H2O2干预组,且随H2O2浓度增加细胞增殖率显著降低(P<0.05)。为保证后续实验有足够的细胞,选择 550 μmol·L-1为H2O2干预浓度。
2.2 对照组、模型组、低温组和高温组细胞增殖率比较
对照组、模型组、低温组和高温组细胞增殖率分别为(100.0±1.73)%、(77.7±2.28)%、(54.3±1.99)%、(96.2±4.56)%。模型组和低温组细胞增殖率显著低于对照组和高温组,低温组细胞增殖率显著低于模型组,差异有统计学意义(P<0.05);对照组与高温组细胞增殖率比较差异无统计学意义(P>0.05)。
2.3 对照组、模型组、低温组和高温组细胞中RUNX2、OPN和OC mRNA相对表达量比较
模型组和高温组细胞中RUNX2 mRNA相对表达量显著高于对照组和低温组,低温组细胞中RUNX2 mRNA相对表达量显著低于对照组,差异有统计学意义(P<0.05);模型组和高温组细胞中RUNX2 mRNA相对表达量比较差异无统计学意义(P>0.05)。模型组、低温组和高温组细胞中OPN mRNA相对表达量显著高于对照组,低温组和高温组细胞中OPN mRNA相对表达量显著高于模型组,低温组细胞中OPN mRNA相对表达量显著高于高温组,差异有统计学意义(P<0.05)。模型组、低温组和高温组细胞中OC mRNA相对表达量显著高于对照组,低温组和高温组细胞中OC mRNA相对表达量显著高于模型组,差异有统计学意义(P<0.05);低温组与高温组细胞中OC mRNA相对表达量比较差异无统计学意义(P>0.05)。结果见表1。
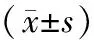
表1 对照组、模型组、低温组和高温组细胞中RUNX2、OPN和OC mRNA相对表达量比较Tab.1 Comparison of relative expression levels of RUNX2,OPN and OC mRNA in the cells among the control group,model group,low-temperature group and high-temperature group
2.4 对照组、模型组、低温组和高温组细胞中RUNX2、OPN和OC蛋白相对表达量比较
模型组、低温组和高温组细胞中RUNX2、OPN和OC蛋白相对表达量显著低于对照组,差异有统计学意义(P<0.05)。低温组细胞中RUNX2、OPN蛋白相对表达量显著低于模型组和高温组,OC蛋白相对表达量显著低于高温组,差异有统计学意义(P<0.05);低温组与模型组细胞中OC蛋白相对表达量比较差异无统计学意义(P>0.05)。高温组细胞中RUNX2、OPN和OC蛋白相对表达量显著高于模型组,差异有统计学意义(P<0.05)。结果见图1和表2。

1:对照组;2:模型组;3:低温组;4:高温组。
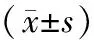
表2 对照组、模型组、低温组和高温组细胞中RUNX2、OPN和OC蛋白相对表达量比较Tab.2 Comparison of relative expression levels of RUNX2,OPN,and OC protein in cells among the control group,model group,low-temperature group,and high-temperature group
3 讨论
骨质疏松主要是由于骨量丢失增加与骨细胞生成减少所致,过量自由基导致的氧化应激是骨质疏松症发生和进展的主要因素之一。H2O2常用于模拟自由基引起的细胞氧化损伤模型,包括骨质疏松模型[9]。本研究结果显示,模型组细胞增殖率显著低于对照组,RUNX2、OPN和OC mRNA相对表达量显著高于对照组,RUNX2、OPN和OC蛋白相对表达量显著低于对照组;说明,H2O2可抑制MC3T3-E1细胞的增殖和RUNX2、OPN和OC的蛋白翻译,从而抑制成骨分化,导致骨质疏松。与文献报道H2O2抑制间充质干细胞[18]、成骨细胞[19]和血管平滑肌细胞[20]成骨分化的作用一致。
温度是生物体不可避免的应激因子之一,适度应激可为机体抵御不良因素的损伤建立保护机制[21]。此外,温度可以通过积极的基因调控策略对机体产生影响,而不仅仅是被动的热力学效应。有研究报道,36 ℃或15 ℃的低温能够激活人源细胞和线虫体内的蛋白酶体,降解无用蛋白质,从而使人源细胞和线虫的寿命显著延长;但线虫在4 ℃孵育12 h并没有延长寿命的效果[14]。正确认识环境温度对机体的影响,有助于更好地进行健康管理,甚至可能有助于发现退行性骨病的治疗新方法和新思路。冷休克蛋白和热休克蛋白分别是哺乳动物体内受到低温或高温刺激后产生的特征性的蛋白。冷休克蛋白普遍具有RNA结合能力,可稳定mRNA,促进蛋白翻译[22]。热休克蛋白具有分子伴侣活性,可以维持蛋白稳态从而使细胞在应激条件下存活[23]。有研究报道,热休克蛋白70经39~42.5 ℃刺激后高表达可能抑制破骨细胞增殖[24]。本研究结果显示,低温组细胞增殖率显著低于模型组,高温组与对照组细胞增殖率比较差异无统计学意义;说明,32 ℃低温处理可促进H2O2对MC3T3-E1细胞增殖抑制作用;而40 ℃高温处理对于H2O2导致的MC3T3-E1细胞增殖率下降具有较好的缓解作用。
RUNX2是转录因子runx家族成员,可调控成骨细胞的基因表达,对成骨细胞分化和骨骼形态发生至关重要。OPN是成骨细胞分化成熟的标志。OC在调节骨钙代谢中起到重要作用。RUNX2、OPN、OC蛋白均是研究骨分化、骨代谢的重要标志物。本研究结果显示,与对照组相比,模型组、低温组和高温组细胞中RUNX2、OPN和OC蛋白的相对表达量显著减少;与模型组相比,低温组RUNX2、OPN蛋白的相对表达量均显著下降,OC蛋白的相对表达量无显著变化;高温组细胞RUNX2、OPN和OC蛋白的相对表达量显著高于模型组。这说明,低温处理对H2O2引起的MC3T3-E1细胞的成骨分化抑制具有增强作用,而高温处理可有效缓解H2O2造成的成骨分化抑制,推测其机制可能是低温抑制了RUNX2、OPN蛋白的表达,而高温促进了RUNX2、OPN和OC蛋白的表达。低温组中OC蛋白表达量的变化不同于RUNX2和OPN,可能是由于基因对不同刺激的敏感度不同造成的,需要进一步的实验验证。
本研究结果显示,mRNA的表达量变化和蛋白质并不完全一致,H2O2可抑制RUNX2、OPN和OC蛋白相对表达量,但RUNX2、OPN和OC mRNA相对表达量并未受到H2O2的抑制,其相对表达量显著增加;与对照组相比,高温组同样出现RUNX2、OPN和OC的基因表达量增加、蛋白表达量减少的现象;低温组细胞中RUNX2 mRNA表达量和蛋白显著下降,OPN和OC呈现基因表达量增加、蛋白表达量减少;与模型组相比,低温组OPN mRNA表达量上调,RUNX2、OC mRNA表达量和RUNX2、OPN、OC的蛋白表达量均显著下降;高温组细胞中OPN mRNA表达量显著高于模型组,OC的基因表达量显著低于模型组,RUNX2、OPN和OC蛋白表达量高模型组。出现这一现象,可能是因为mRNA浓度只能部分解释蛋白质浓度的变化,复杂而多样的调控机制导致转录组和翻译组之间定量关系的差异[25]。此外,本研究中仅检测了蛋白质和mRNA的相对表达量,并不能用来直接比较蛋白质和mRNA水平[26]。在特定稳态条件下,影响蛋白质表达水平的翻译和蛋白质降解的基因特异性调控仍需要进一步的研究。
4 结论
H2O2可抑制MC3T3-E1细胞增殖和成骨分化,低温可促进H2O2对MC3T3-E1细胞增殖和成骨分化的抑制作用,高温则可缓解H2O2对MC3T3-E1细胞增殖和成骨分化的抑制作用。RUNX2、OPN和OC蛋白可能在温度调控成骨分化的过程中有重要作用,然而其具体的信号通路还需要进一步研究。
