肺真菌性病变7例临床病理学观察
2024-02-27郑垚
郑垚
随着医学的不断进展,抗生素的应用越发广泛,免疫抑制剂、激素和抗肿瘤药物的多方面应用导致肺真菌性病变呈现逐年上升趋势[1],而该类疾病症状不典型,临床表现及影像学改变缺乏特异性,常被肺部基础疾病所掩盖,极易造成误诊或漏诊,已成为临床诊断及治疗的一大难题。通过病理检查与常规HE 染色+特殊染色+免疫荧光染色方法的联合应用,可以明确真菌的种、属,对临床肺真菌感染的诊断与鉴别诊断具有重要意义。
1 材料与方法
1.1 一般资料
1.1.1 病例1 男性,25 岁,急性髓系白血病化疗及骨髓移植期间,反复肺部细菌、真菌感染,CT 示右肺上叶斑片状磨玻璃影增大。
1.1.2 病例2 男性,27 岁,急性髓系白血病5 年,造血干细胞移植术后1 年5 个月,可疑肺部感染2 个月,治疗效果不佳,CT 示左肺下叶背段空洞性病变,考虑感染性病变。
1.1.3 病例3 男性,12 岁,慢性肉芽肿骨髓移植术后可疑肺真菌感染7 个月,CT 示左肺上叶下舌段实变影,可见空洞,洞壁光滑,内见球形高密度灶,考虑感染性病变。
1.1.4 病例4 女性,20 岁,因慢性粒细胞性白血病行造血干细胞移植术后2 年,CT 示左肺上叶实变并空洞形成,双肺多发斑片影。
1.1.5 病例5 男性,49 岁,骨髓增生异常综合征2年,骨髓移植术后1 年,肺部感染9 个月,咯血2 个月。CT 示左肺上叶丘状密度增高影,与肺组织边缘呈钝角,左侧第2、3 肋骨骨折。
1.1.6 病例6 男性,21 岁,结核性胸膜炎、大叶性肺炎2 年,无诱因咳嗽、咳痰、发热伴胸痛10 天入院。胸部增强CT 示右中下肺可见大片状类圆形密度增高影;胸腔可见低密度的分隔,并可见钙化影。
1.1.7 病例7 男性,71 岁,新型冠状病毒感染1 月余,胸闷、气短加剧,CT 示右肺多发片状实变影及结节。
1.2 方法收集肺叶切除标本及经皮肺组织穿刺标本,格林环保固定液固定,常规取材,包埋制片,3mm 连续切片,常规HE 染色(染液为格林环保试剂),光学显微镜下观察,加做特殊染色及免疫荧光染色,特殊染色试剂为贝索生物技术有限公司产品,免疫荧光试剂为诺鬲生物科技有限公司诺立清免疫显色试剂。
2 结果
2.1 临床特点7 例患者中,男性多于女性,比例6:1,年龄12~71 岁,平均32.1 岁。除2 例为明确肺炎感染治疗后患者,其余5 例均为血液系统疾病治疗后患者,其中3 例为骨髓移植术后、2 例为造血干细胞移植术后。这5 例患者反复肺内感染,抗感染治疗效果不佳。CT 示肺内多发实变、斑片影或密度增大影,3 例可见空洞性病变,均提示感染性病变可能。
2.2 肉眼所见6 例肺叶切除标本中,大部分肺组织内可见多个大小不等的灰白结节,直径0.4~3.0cm。病例2、3、4、5 肺内可见明显空腔样结构,腔内可见灰黄、灰褐色黏稠状物。病例5 送检肺组织与肋骨间组织,见空腔样结构。病例6 肺内见一巨大结节状肿物,大小为14.5cm×11.5cm×11.5cm,结节中心有不规则坏死,多彩状。病例7 为CT 引导下经皮肺穿刺组织3 条。
2.3 显微镜下观察
2.3.1 病例1、2、3 为曲霉菌感染。肺炎症性病变,伴慢性支气管炎、支气管扩张及机化性肺炎,局灶细支气管周围淋巴细胞浸润,周边肺泡腔内见大量组织细胞聚集。送检肺实质内见多个大小不等的真菌团,部分真菌团内菌体呈放射状排列、纤维包裹形成(见图1a)。病例2、3 病灶中央为凝固性坏死、空洞形成,伴周边菌群围绕,菌群外围为中性粒细胞及淋巴细胞构成的肉芽肿性炎(见图1b)。病例2、3 部分区域可见散在的巨噬细胞和异物巨细胞性肉芽肿性炎,巨噬细胞内可见吞噬的菌丝(见图1c)。真菌结构为透明、有隔菌丝,约45°分枝,鹿角样(见图1a~c)。

图1 曲霉菌感染病变HE 染色镜下所见
2.3.2 病例4、5、6 为毛霉菌感染。肺炎症性病变,多个化脓性肉芽肿及脓肿灶形成,病变中见凝固性坏死,坏死组织内可见真菌菌团,真菌结构为透明、无隔或少隔菌丝,菌丝宽大,≥90°分枝,局部可见菌团侵犯血管,菌栓形成,病例4、5 可见空洞形成(见图2a)。局部可见细支气管周围炎(见图2b)。炎症细胞在病变周边以淋巴单核细胞为主要成分,中心中性粒细胞较多,掺杂多少不等嗜酸性粒细胞,部分区域嗜酸性粒细胞较明显,并形成嗜酸性小脓肿。部分区域可见散在的吞噬细胞和包涵异物的巨细胞(见图2c)。

图2 毛霉菌感染病变HE 染色镜下所见
2.3.3 病例7 为隐球菌感染。该病例为CT 引导下肺组织穿刺活检,显微镜下HE 染色切片可见纤维结缔组织及肉芽组织中大量组织样细胞及上皮样细胞聚集,其间散在大量透明且大小不等的圆形、空泡状结构,大小接近组织细胞核,中央空亮,边缘肥厚,并见凝固性坏死及小脓肿灶形成(见图3)。
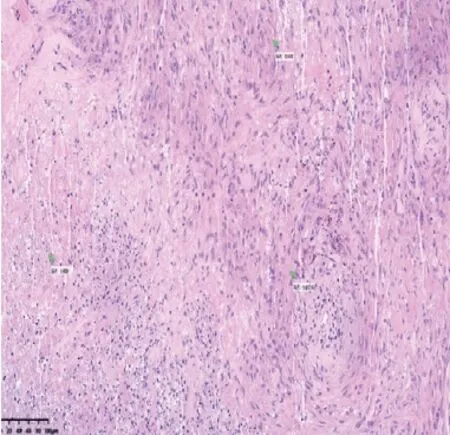
图3 隐球菌感染病变HE 染色镜下所见(×40)
2.4 特殊染色及免疫荧光结果
2.4.1 病例1、2、3 中特殊染色 抗酸染色(-),PAS染色(菌丝及孢子呈浅紫红色)(见图4a),六胺银染色(菌丝及孢子呈黑色)(见图4b);免疫荧光真菌染色:镜下可见透明、有隔菌丝,约45°分枝,鹿角样,提示曲霉菌阳性(见图4c)。

图4 曲霉菌感染病变特殊染色镜下所见
2.4.2 病例4、5、6 特殊染色 抗酸染色(-),PAS 染色(菌丝及孢子呈浅紫红色)(见图5a),六胺银染色(菌丝及孢子呈黑色)(见图5b);免疫荧光真菌染色:镜下可见透明、无隔或少隔菌丝,菌丝宽大,≥90°分枝,提示毛霉菌阳性(见图5c)。

图5 毛霉菌感染病变特殊染色镜下所见
2.4.3 病例7 特殊染色 抗酸染色(-),PAS 染色(菌体空亮,荚膜轻微着淡紫色)(见图6a),六胺银染色(菌体空亮,荚膜黑色)(见图6b),AB-PAS(-);免疫荧光真菌染色:菌体中央亮白,折光性强,周边蓝白色荚膜包裹,轮廓清晰,提示隐球菌阳性(见图6c)。
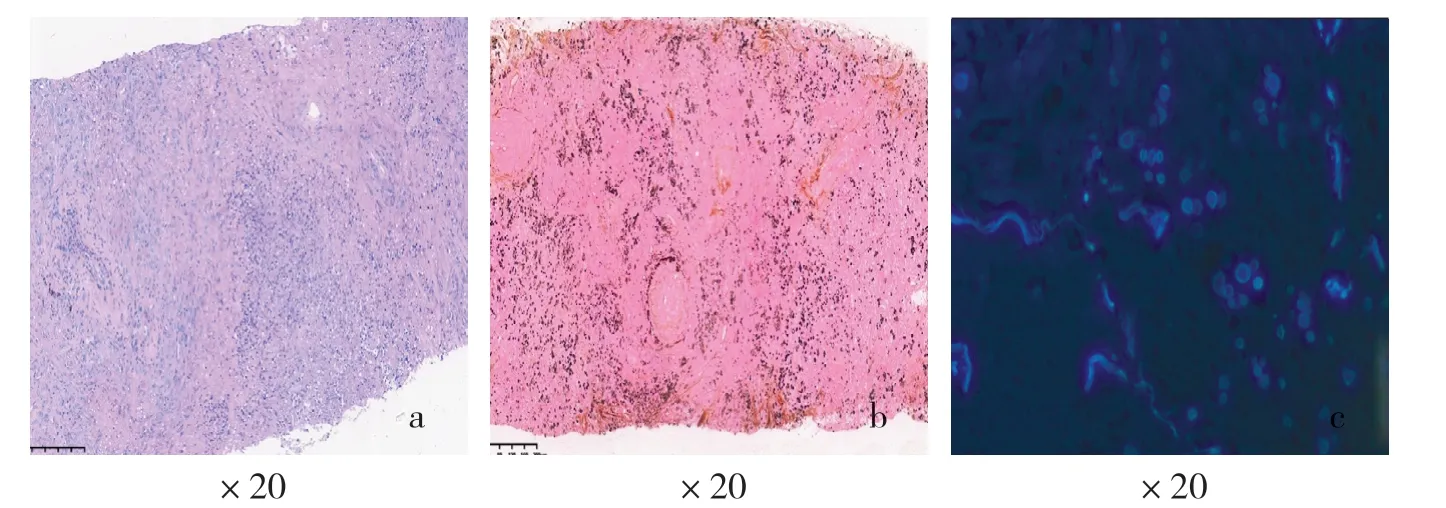
图6 隐球菌感染病变特殊染色镜下所见
3 讨论
3.1 概述肺部真菌感染性疾病是由不同真菌感染肺深部引起的一类疾病,分为两种,其中继发性肺真菌病是免疫功能低下导致的疾病。常见于长期使用激素类药物、广谱抗生素、免疫抑制剂的患者;接受过器官移植、骨髓移植的患者;因放疗、化疗、特殊感染引起免疫功能下降的人群[2]。肺部真菌性病变常见的菌种主要是曲霉菌、念珠菌、毛霉菌、隐球菌和肺孢子菌。该类疾病发生率有逐年增长的趋势。
3.2 临床及影像特点7 例中男性多于女性,年龄偏低,2 例为急性髓系白血病,1 例慢性肉芽肿,1 例慢性粒细胞性白血病,1 例骨髓增生异常综合征,均进行过骨髓或造血干细胞移植手术,1 例为结核性胸膜炎、大叶性肺炎愈后,1 例为新冠感染转阴后,均是因特定疾病导致的免疫功能低下人群,白血病患者因反复肺内感染导致发热、咳嗽、咳痰、咳血等症状,反复抗炎治疗后效果越来越差。新型冠状病毒感染患者因出现胸闷、气短加剧的症状来院就诊,但病毒核酸检测阴性,考虑肺内病变与新型冠状病毒无明确关联。CT 示肺内多发实变影或密度增高影,3 例可见空洞性病变,均提示感染性病变可能。以上病例临床及影像学没有明显特异性,临床根据影像及相关检查均考虑感染性病变,可能为细菌性、结核、真菌感染,因此为进一步确诊和治疗,做肺叶切除和肺穿刺送病理进一步检查。
3.3 病理诊断
3.3.1 HE 染色特点 7 例患者均为炎症性病变,部分区域可见散在的巨噬细胞和异物巨细胞[3]。曲霉菌感染以淋巴细胞为主,局灶细支气管周围可见淋巴细胞浸润,周边肺泡腔内见大量泡沫样组织细胞聚集。毛霉菌感染的肺部炎症细胞以中性粒细胞为主,部分区域嗜酸性粒细胞较多并形成嗜酸性小脓肿。6 例肺叶切除标本均可见凝固性坏死,且病灶大者现中央空洞形成。曲霉菌感染除大的凝固性坏死周边有菌群外,其余肺内可见小菌团,外围纤维包裹形成,而毛霉菌感染的肺组织内则是凝固性坏死中心菌团显著,周围肺内散在菌体。肺毛霉菌病的病变主要为急性化脓性炎性改变,毛霉菌攻击性极强,很快向周围播散,并常见血管内菌栓形成;毛霉菌侵犯血管比曲霉菌严重,造成血管阻塞和梗死者也较多,坏死和脓肿也较常见;有的病变转为慢性后,其间有大量中性和嗜酸性粒细胞浸润,间质纤维结缔组织增生,毛细血管壁增厚。曲霉菌菌丝为透明、有隔菌丝,约45°分枝,鹿角样[4];毛霉菌菌丝较曲霉菌和念珠菌菌丝大而粗,壁厚,不分隔,或少隔,分支少而无规则,常呈钝角或直角分支。巨噬细胞和异物巨细胞胞浆内可见吞噬的菌丝。隐球菌为透明的大小不等的圆形、空泡状结构,中央空亮,边缘肥厚[5,6]。
3.3.2 特殊染色特点 PAS 染色效果示毛霉菌不及曲霉菌,呈紫红色,着色均较淡,如果真菌量少则不易辨别。六胺银染色呈黑色,但组织染色中弹力纤维染色也呈黑色,故如果真菌量少亦不易明确分辨,要结合病理常规HE 染色及免疫荧光染色镜下所见。
3.3.3 免疫荧光染色特点 该方法是通过免疫荧光技术,与样本中相应抗原结合后在荧光显微镜特定波段激发光下呈现特异性荧光成像,UV 波段下真菌呈现亮白色,B 波段下细菌呈现橘黄色,极易分辨,因此真菌菌丝、孢子都呈现出亮白色,其他组织不显色或着色暗淡,故可明显区分真菌与周围组织。在荧光显微镜下,根据菌体的形态、大小,很容易区分真菌的种、属。曲霉菌菌丝为透明、有隔菌丝,约45°分枝,鹿角样;毛霉菌菌丝宽大,壁厚,不分隔,或少隔,分支较少,常≥90°;隐球菌菌体呈现为中央亮白,折光性强,周边蓝白色荚膜包裹,轮廓清晰。
3.4 鉴别诊断肺部真菌性感染性疾病需要与血管炎和其他肉芽肿性病变相鉴别。著名病理学家Liebow 提出把肺血管炎和肉芽肿病作为一类疾病,他认为这些病变具有相当的同源性,因为其具有相似的组织学特点,即肉芽肿形成和血管炎[7]。这类病变常见以下病变。
3.4.1 Wegener 肉芽肿(WG)典型WG 是由坏死性血管类、累及上呼吸道和肺的非化脓性坏死以及局灶性肾小球肾炎组成的三联征[8]。影像学表现为多发的、有边缘的、大小不一的不透光结节或团块,常伴空洞形成,洞壁厚而不规则。病变大多发生于下叶。病理以血管弥漫性坏死性肉芽肿性炎为特征。有的患者会出现镜下血尿,临床表现与真菌性肺炎不同,病理镜下无真菌结构检出。
3.4.2 犬恶丝虫肉芽肿 寄生虫亦可引起肺部反应,在肺组织内产生伴血管炎的坏死性肉芽肿性炎性反应。这种血管炎中可见类似坏死性结节病样肉芽肿(NSG)或WG 中的巨细胞,经常在坏死性肉芽肿内见到着色不佳的、弱嗜酸性的死亡虫体轮廓,为主要鉴别之处[8]。这种疾病在人体为自限性,多数患者无明显症状,只是在X 线检查时发现肺周边区孤立性结节状影。
3.4.3 NSG 组织学上可见多发的非干酪样坏死性肉芽肿,可互相融合形成大的结节。有些病例可见典型的结节病样肉芽肿形成,伴有血管炎和大片凝固性坏死,有的形成以血管为中心的梗死[9],罕见肺外病变。影像学缺乏特异性,可见大片实变影及空洞形成,肺内单发或多发的结节影。PAS 及抗酸染色阴性。NSG 是一种排除性诊断,均须仔细排除其他诊断。
3.4.4 淋巴瘤样肉芽肿病(LYG)目前有人认为LYG 是淋巴瘤的变形,表现为坏死性肉芽肿和血管炎,伴有异形性淋巴样细胞浸润。浸润的淋巴细胞为具有浆细胞样特征的非典型性淋巴网状细胞及少量中性粒细胞或嗜酸性细胞[9]。部分患者有皮肤损害。该病变主要累及结外器官,以肺部为主。真菌性肺炎的淋巴细胞无异形性,这是两者最重要的鉴别之处。
3.4.5 肺结核病 典型病变为干酪样坏死性肉芽肿性炎[6],抵抗力强的患者会出现增生性病变,形成大而扁平的巨细胞(Langerhans 细胞),与巨噬细胞、淋巴细胞形成结核性肉芽肿;抵抗力弱者、结核杆菌数量过多者则出现干酪样坏死,坏死组织排出体外后肺内会形成空洞。鉴别要点为抗酸阳性,而真菌性肺炎为非干酪样坏死性肉芽肿性炎,抗酸阴性。
总之,肺深部真菌感染的病例在临床比较少见,但有不断增长的趋势,临床及影像学缺乏明显特征,而常规HE 染色+特殊染色+免疫荧光染色方法的联合应用可以明确真菌的种、属,尤其是免疫荧光染色将组织内的真菌形态清晰的显现在镜下,为病理医生作出明确诊断及临床针对性治疗提供了可靠依据。
