LY294002通过PI3K/Akt通路对结直肠癌RKO细胞增殖及凋亡的影响
2024-02-27张恒李康宁董海峰郑英斌
张恒 李康宁 董海峰 郑英斌
结直肠癌(Colorectal cancer,CRC)是最常见的消化道肿瘤之一,其发病率和死亡率均较高,目前仍缺乏有效的治疗方法来改善患者预后[1]。我国CRC 的发病率和死亡率也逐年上升,给社会及患者带来了巨大的负担[2]。CRC 的临床治疗方式主要是手术治疗、药物治疗及放射治疗等,对于早期CRC 一般采用手术治疗,为防止术后出现复发、再发、转移等,通常于术后周期性使用药物治疗;而对于中晚期患者,采取手术治疗或在术前通过新辅助治疗缩小肿瘤,以为进一步手术提供可能,或是通过一系列药物治疗来减缓、控制病情发展[2,3];因此,药物在CRC 的治疗中有极其重要的作用,而通过研究更有效的药物制剂对于临床诊疗意义重大。大量研究已证实PI3Ks 信号级联反应的过度激活是癌症发展的标志,尤其是I 类PI3Ks,当I 类(p110α、p110β、p110γ 和p110δ)催化亚基与P85 调节亚基结合时,它们的激活导致Akt 的苏氨酸(Thr308)和丝氨酸(Ser473)磷酸化,从而激活mTOR,进而在肿瘤的发生和发展中发挥重要作用[4,5]。因此,PI3K/Akt 通路在CRC 的研究中是不可忽视的;Bcl-2/Bax 是调控细胞凋亡的重要基因,而PI3K/Akt通路与Bcl-2/Bax 的表达关系密切[6],需要进一步探究CRC 中该通路是否显著改变了Bcl-2/Bax 的表达量。本研究在CRC RKO 细胞中,采用LY294002抑制PI3K/Akt 通路的激活发现RKO 细胞的增殖能力削弱,基于此,作者对相关机制进行研究,为LY294002 在人CRC 的治疗应用方面提供实验基础和理论依据,并为其他药物治疗的可能性提供方向和指引。
1 材料与方法
1.1 材料本研究收集了2019 年1 月~2020 年12月期间我院收治并确诊的CRC 并进行手术的患者的癌组织(71 例)及癌旁组织(48 例)蜡块标本。本研究经我院医学伦理委员会批准,患者均签署知情同意书。购买人CRC RKO 细胞(中国科学院上海细胞研究所),DMEM 细胞培养液(Gibco 公司),10%胎牛血清(FBS,杭州四季青生物材料有限公司),LY294002(Gibco 公司),CCK-8 试剂盒(碧云天生物技术研究所公司),p-Akt、Akt、Bax、Bcl-2、GAPDH 一抗(Cell Signaling 公司),过氧化物酶标记山羊抗兔IgG 及ECL 高灵敏度化学发光试剂盒(碧云天生物技术研究所);凝胶成像仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 HE 染色 标本均经福尔马林液固定,常规脱水、石蜡包埋,5μm 厚切片,将切片放置65℃烘烤30min。放置于二甲苯中脱蜡,5min/次,共操作3 次,依次放置于无水乙醇、95%乙醇、85%乙醇、75% 乙醇中,最后用清水冲洗,30s/次,时间控制在10min 内进行苏木精染液染色,自来水洗,采用1%盐酸乙醇分化液分化数秒,自来水冲洗,0.6%氨水反蓝,15min 以上流水冲洗,细胞核颜色变为蓝色,放置伊红液(1%)染色60s,自来水略洗,依次放置于85%乙醇、95%乙醇、95%乙醇、无水乙醇中进行脱水,30s/次,二甲苯透明,1min/次,共操作3 次,盖片封片后于显微镜下观察。
1.2.2 免疫组化 标本均经福尔马林液固定,常规脱水、石蜡包埋,5μm 厚切片,将切片放置65℃烘烤30min。放置于二甲苯中脱蜡,5min/次,共操作3次,依次放置于无水乙醇、95%乙醇、85%乙醇、75%乙醇中,最后用清水冲洗,30s/次。经抗原修复后,置于3%过氧化氢室温孵育20min 以消除内源性过氧化物酶的活性。清洗后,将切片置于5%BSA中,37℃,封闭2h。一抗、二抗及DAB 染色剂均按说明书配置。苏木精染液染色采用1%盐酸乙醇分化液分化数秒,自来水冲洗,0.6%氨水反蓝,15min以上流水冲洗,细胞核颜色变为蓝色后,再次透明化,树胶封存。免疫组化评估:阳性细胞百分比评分:无阳性细胞为0 分,阳性细胞1%~25%为1 分,26%~50%为2 分,51%~75%为3 分,76%~100%为4 分。染色强度评分:无染色为0 分,弱染色为1 分(+),中等强度染色为2分(++),强染色为3分(+++)。总评分=阳性细胞百分比×染色强度评分,0~4 分为p-Akt 低表达,5~12 分为p-Akt 高表达。
1.2.3 细胞培养与传代 采用DMEM 完全培养基培养RKO 癌细胞株(含10% 胎牛血清和1% 青霉素-链霉素溶液),待RKO 细胞在生长到大约90%后传代。
1.2.4 细胞分组 取对数生长期细胞1×105个/mL接种于细胞培养瓶。参照细胞学预实验结果选取药物浓度及分组,将实验细胞分为3 组:①空白对照组(Blank 组),仅有DMEM 完全培养基培养;②阴性对照组(DMSO 组):向DMEM 完全培养基中加入二甲基亚砜(DMSO);③阳性对照组(LY294002 组):向DMEM 完全培养基中加入终浓度为20μmol/L的LY294002。
1.2.5 对细胞增殖的影响 将RKO 细胞(3×103细胞/孔)接种于96 孔板,根据实验分组处理或不处理24、48、72h。每孔加入10μL CCK-8 溶液至96 孔板,细胞培养箱内继续孵育2h,于入射光波长450nm 处测定吸光度值,实验重复3 次。
1.2.6 凋亡实验 取处于对数生长期细胞,按实验分组进行不同处理,将各组的RKO 细胞消化离心(1 000r/min,4℃,10min)后收集至15mL 离心管中。每管加入约2mL PBS 缓冲液轻轻洗涤管内细胞,洗去杂质,再次离心,弃去上清,每管加入500μL 结合液,于避光条件下加入FITC 和PI 染料混匀后立即上机进行检测。采用Flowjo 10.0 软件进行统计分析。
1.2.7 Western blot 检测Akt、p-Akt、Bax 和Bcl-2 表达 将各组细胞置于细胞培养箱中培养48h 后分别收集细胞,提取细胞总蛋白,以GAPDH 为内参,BCA 定量分别得出样品蛋白浓度。配制分离胶和浓缩胶,调整蛋白上样浓度一致,先将电压调至80V使蛋白样品下沉至分离胶起始部,随后调整电压至120V(观察电泳时确认电压是否稳定,条带是否整齐下压),当样品临近底部时终止电泳,将PVDF 膜浸泡在含5%脱脂奶粉的TBST 中,在小摇床中封闭1h 后,加一抗4℃孵育过夜,按说明书比例室温孵育二抗2h,随后用凝胶成像仪进行显影曝光并记录灰度值,蛋白相对含量=目的蛋白灰度值/内参蛋白灰度值。
1.3 统计学分析采用 SPSS 16.0 统计学软件分析数据,计量资料组间比较采用t检验,连续变量的多组间比较采用重复测量的方差分析,非连续变量的多组间比较采用单因素方差分析,用表示;计数资料组间比较采用χ2检验,用率表示。P<0.05表示差异具有统计学意义。
2 结果
2.1 p-Akt 在人CRC 组织中的表达情况我们对纳入的CRC 患者的组织进行HE 染色和免疫组化分析。p-Akt 阳性定位在CRC 细胞细胞质中,结果如图1 所示,71 例CRC 患者RKO 细胞中p-Akt 蛋白高表达者60例(84.51%),低表达者1例(15.49%);48 例CRC 患者癌旁组织细胞中p-Akt 蛋白高表达者10 例(20.83%),低表达者38 例(79.17%);患者CRC 组织中p-Akt 高表达率较癌旁组织显著升高,差异具有统计学意义(χ2=47.937,P<0.0001)。
2.2 LY294002 对CRC RKO 细胞增殖的影响CCK-8法对各组进行细胞增殖实验。结果如表1 所示,LY294002 组RKO 细胞的增殖较其他两组受限,活力下降,且随着LY294002 作用时间的延长,LY294002 组的RKO 细胞活力持续低下,且差异均具有统计学意义(P<0.05)。

表1 各组中RKO 细胞的增殖情况
2.3 LY294002 对CRC RKO 细胞凋亡的影响根据细胞凋亡实验结果如图2,与Blank 组及DMSO组相比,LY294002 组的RKO 细胞凋亡数量明显增多,差异具有统计学意义(P<0.0001)。

图2 LY294002 对CRC RKO 细胞凋亡的影响注:与Blank 组和DMSO 组比较,****P<0.0001
2.4 LY294002 对CRC RKO 细胞PI3K/Akt 信号通路的影响为了进一步验证各组RKO 细胞的PI3K/Akt 信号通路的表达情况,采用 Western blot法检测各组细胞中p-Akt、Akt、Bax 和Bcl-2 的蛋白表达变化,结果显示,LY294002 组与其他两组相比,Akt 的总蛋白无明显变化,差异无统计学意义(P>0.05);p-Akt、Bcl-2 明显降低,Bax 表达水平显著增高,且差异均具有统计学意义(P>0.05)。见图3。
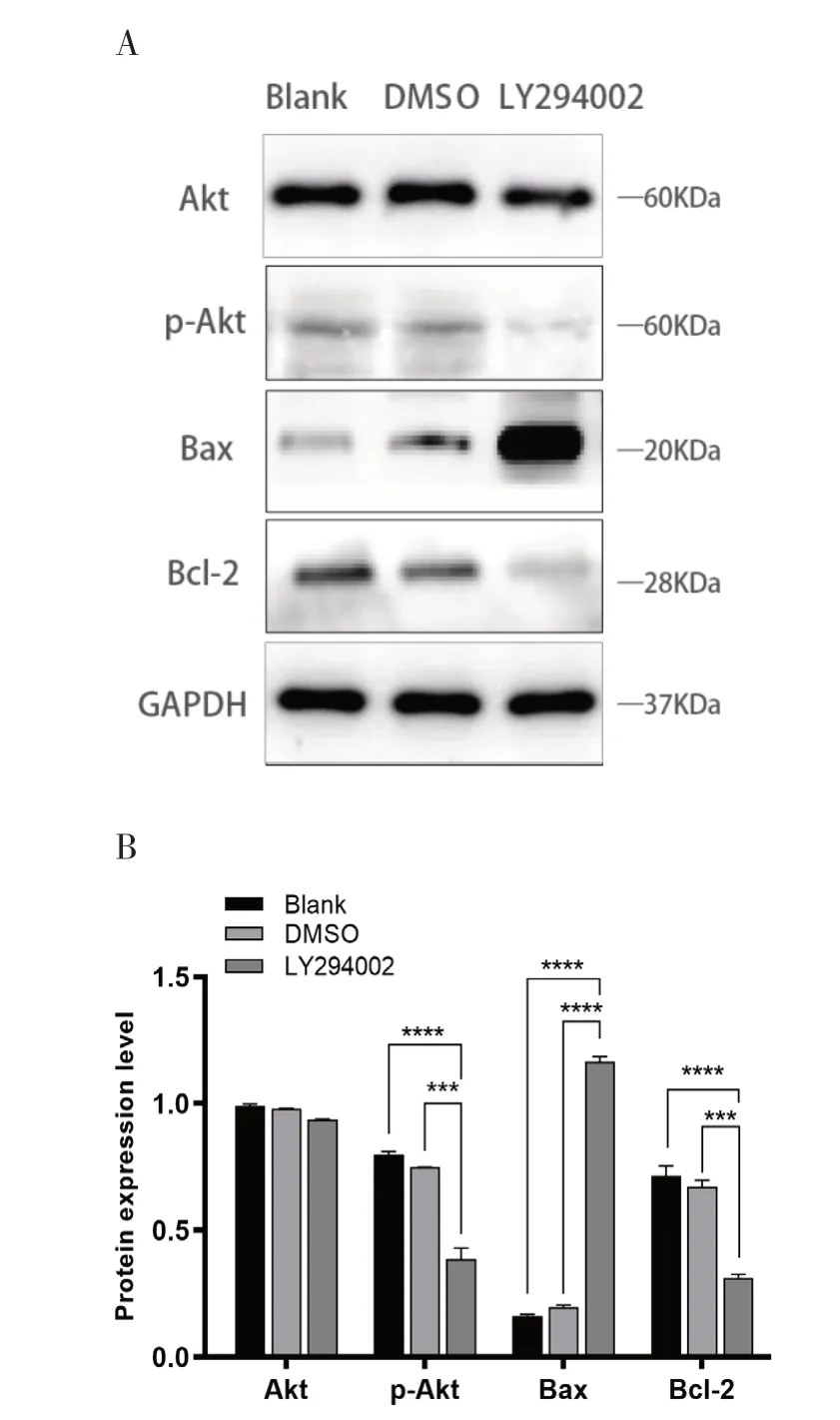
图3 各组RKO 细胞Akt、p-Akt、Bax、Bcl-2 蛋白表达检测结果
3 讨论
CRC 发病率居全球恶性肿瘤第3 位,且不断提高。近年来,虽然临床医学水平发展迅速,CRC 的早期筛查及临床治疗方案多样化并快速发展,但CRC 患者的生存率却未得到显著提高;现今CRC 临床治疗以手术及化学治疗为主,据相关研究显示,CRC 患者对相关化学药物耐药是生存率降低的主要因素之一[7~9];相关药物治疗在CRC 治疗方案中扮演着重要角色,这些药物大多通过调控癌细胞生物学行为而发挥作用,因此关于某些生物学标志物和治疗靶点的研究就显得尤为重要[10]。LY294002是第一种人工合成的PI3K/Akt 通路特异性抑制剂,通过竞争性抑制PI3K 的ATP 结合位点来阻碍PI3K 表达[11],其作为PI3K 的广谱抑制剂,许多研究表明其对食管癌、肿瘤相关血管内皮细胞及干细胞,卵巢癌、肝细胞癌、乳腺癌、结肠癌等肿瘤细胞有抑制及减灭作用[12~16]。对某些临床联合用药(降糖药物,化疗药物、靶向药物等抗肿瘤药物)及一些提取物(从某些植物、动物、细菌等中提取)研究发现,与单独使用各种药物相比,联合用药能够增强对肿瘤细胞生长抑制及促进肿瘤细胞凋亡等作用。在CRC 方向的LY294002 与PI3K/Akt 通 路相关研究中,少有关于PI3K/Akt 通路与其密切相关的Bcl-2/Bax 蛋白表达情况相联合的研究与思考,本研究探索LY294002 通过PI3K/Akt 通路抑制CRC RKO 细胞增殖并促进其凋亡的机制。
PI3K/Akt 通路是重要的细胞内信号传导通路,已被广泛证明参与细胞生长、增殖、凋亡和分化调控等多种代谢过程。PI3K 作用于Akt,使其发生磷酸化从而被激活,磷酸化的Akt 能够调控c-myc 等促进细胞增殖,也能促进细胞成熟、肿瘤血管生成等;此外,PI3K/Akt 是多条信号通路中的中心位点之一,还可被EGFR、RAS、IRS1、JAK、FAK、c-met等多种上游分子激活[17,18]。这种信号的异常激活已在包括食管癌、肿瘤相关血管内皮细胞及干细胞,卵巢癌、肝细胞癌、乳腺癌、结肠癌等在内的人类癌症中广泛报道[19,20];且有报道称,一些抗癌药物可以通过阻断PI3K/Akt 通路抑制肿瘤细胞增殖[21]。Bcl-2/Bax 为人体内各种细胞凋亡因子,调控着细胞的凋亡过程,线粒体是人体细胞中一个细胞器,也是内在凋亡途径的中心,其受Bcl-2/Bax 的调控;Bax 是促凋亡因子,在调控细胞凋亡方面有极其重要的作用,是Bcl-2 基因家族的一种,其编码翻译的Bax 蛋白为凋亡启动程序的一个上游蛋白,促使细胞凋亡;Bcl-2 是抗凋亡因子,可与Bax 拮抗,从而抑制细胞凋亡;蛋白Bax 可结合Bcl-2 蛋白并拮抗Bcl-2 蛋白,Bcl-2 与Bax 在调控凋亡方面相互拮抗,相互制约,共同维护细胞正常更替、凋亡的过程,故可通过调整两者强弱关系打破平衡,控制凋亡进程[22,23]。本研究发现CRC 组织较癌旁组织的p-Akt 水平显著升高;根据细胞增殖实验,LY294002 影响下的RKO 细胞活力较另外两组明显降低,差异具有统计学意义;根据细胞凋亡实验,LY294002 影响下的RKO 细胞凋亡数量较对照组明显增多,差异具有统计学意义;同时,根据Western blot 检测结果,各组Akt 总蛋白结果无明显差异,LY294002 组p-Akt 蛋白较另外两组明显降低,表明LY294002 抑制了PI3K/Akt 通路,LY294002 组Bax 表达水平显著增高,Bcl-2 表达水平显著降低,并抑制了CRC RKO 细胞的增殖,促进其凋亡;因此,LY294002 是通过促进Bax、抑制Bcl-2 的表达,从而诱导细胞凋亡。本研究中Bcl-2/Bax 所受调控唯一性以及力度大小还无法完全确认,LY294002是否通过其他途径影响CRC RKO 细胞的增殖、凋亡也无法确认;对于药物敏感强弱的机制也仍不清楚,有待于进一步的研究探索。
综上所述,本研究探讨了LY294002 作用于CRC RKO 细胞后其增殖与凋亡表现,发现LY294002 明显抑制CRC RKO 细胞的增殖,促进其凋亡,显著杀灭了CRC RKO 细胞,这与其能抑制PI3K/Akt 通路有关,也体现了Bcl-2/Bax 的重要性,表明LY294002 用于CRC 治疗具有一定的价值,为CRC 的临床用药及药理方向研究提供了思路。
