羊肉后熟过程中肌肉纤维结构变化及氧化特性
2024-02-27刘冠绪刘永峰
刘冠绪,肖 宇,张 瑞,刘永峰*
(1 陕西师范大学 食品工程与营养科学学院,陕西 西安 710119;2 新疆师范大学 生命科学学院,新疆 乌鲁木齐 830054)
肉制品在生产和加工过程中,不可避免会发生品质变化,而宰后成熟是上述过程对肉品质产生影响的关键因素之一。宰后成熟是指动物在屠宰后,通过一定的处理和贮存方式,使肉品在一定时间内获得更好的嫩化和口感。适当的宰后成熟可以使肉品口感更加鲜嫩,肉质更加松软,味道更加浓郁。李荣等[1]探究了羊肉在宰后成熟过程中脂多糖对细胞线粒体凋亡信号通路的影响。陈雪妍等[2]研究了氯化钙处理对宰后成熟期间羊肉能量水平和品质的影响。然而,羊肉在宰后成熟过程中肌原纤维结构及性质的变化尚不明确,亟待研究。
肉类品质特性包括色泽、口感和营养价值等方面,其中肌肉纤维完整度是反映肉质特性的重要方面,对肌肉纤维的微观结构进行研究是分析肉质变化的策略之一。在宰后短期的肉品成熟过程中,蛋白酶的降解可能造成肌肉纤维完整度下降,氧化(包括蛋白质氧化和脂质氧化)也可能是导致肌肉纤维结构发生变化的重要诱因。在宰后较短时间内肌肉细胞仍具有较高的活性,其中对细胞具有修复功能的大分子如热休克蛋白等较为活跃[3-5]。Gatellier等[6]研究发现,蛋白质在加工和储存过程中极易发生氧化,导致其功能特性改变和营养品质下降,在肉品中主要体现为消化率下降。当前,已有大量研究揭示脂质氧化对肉品质的影响[7],而宰后短期内蛋白质氧化对肌肉特性的影响有待深入探索。
肌肉组织中的蛋白质主要包括肌浆蛋白和肌原纤维蛋白两大类。其中,肌原纤维蛋白是肌肉组织中占主导地位的蛋白质,其含量超过肌肉组织总蛋白质的50%,很大程度上决定着肉品的风味特性、营养价值和加工性能[8]。氧化反应会引起肌原纤维蛋白结构变化,进而改变肌原纤维蛋白的功能特性并影响肉品质。探究肉类组织中肌原纤维蛋白的氧化情况,了解蛋白氧化对肉品质的影响机理,对保障肉类营养和安全具有重要意义。本课题组前期研究发现,宰后48 h内肌原纤维蛋白发生了降解[9],但其降解机理尚有待探究。
新疆山羊分布于整个新疆维吾尔自治区,主要集中在阿尔泰山、天山南坡、昆仑山北麓及阿克苏等地区,是以产肉为主的兼用型地方山羊品种。本研究以新疆山羊肉为研究对象,通过对宰后4 ℃条件下不同贮藏时间(0、12、24、48 h)的羊肉进行扫描电子显微镜(scanning electron microscope,SEM)观察,测定其硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)含量,同时提取肌原纤维蛋白并进行溶解度、羰基含量、巯基含量、表面疏水性及傅里叶变换红外吸收光谱(Fourier transform infrared spectroscopy,FT-IR)分析,深入探究宰后成熟过程中羊肉肌肉纤维蛋白结构及氧化特性的变化。
1 材料与方法
1.1 材料与试剂
选取的9只1.5周岁健康雄性新疆山羊(未阉割,体重35±2 kg),按照商业屠宰标准进行屠宰,屠宰后立即收集两侧的背最长肌,去除可见脂肪和结缔组织后,将背最长肌置于冰盒(-2~1 ℃)中空运至实验室。将12份100 g肉样放置于4 ℃冰箱冷藏,经0、12、24、48 h成熟后测定肉质特性。每组样品包含3个重复。
实验中所用的磷酸氢二钠、磷酸二氢钠、无水乙醇、三氯乙酸(TCA)、乙二胺四乙酸(EDTA)、2-硫代巴比妥酸(TBA)、氯仿、乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)、磷酸钾、碘化钾、戊二醛、氯化钠、氯化镁、EDTA-2Na、盐酸、2,4-二硝基苯肼、乙酸乙酯、盐酸胍、2-硝基苯甲酸、尿素、溴化钾、溴酚蓝(BPB)均为分析纯,购自天津科密欧试剂有限公司。
1.2 仪器与设备
FE28 pH计,上海梅特勒-托利多测量仪器有限公司;TM3030台式扫描电子显微镜,日本日立公司;FJ200-S均质机,上海索映仪器设备有限公司;Synergy LX多功能酶标仪,美国Thermo Fisher Scientific公司;Nicolet iS10傅里叶变换红外光谱仪,美国Thermo Fisher Scientific公司;Fjeltec 2300凯氏定氮仪,丹麦FOSS公司。
1.3 实验方法
1.3.1 羊肉微观结构观察
采用SEM观察羊肉肌肉纤维。将肉样切成0.5 cm×0.5 cm×0.3 cm的小块,在体积分数为2.5%的戊二醛溶液中固定2 h。使用蒸馏水冲洗肉块,然后利用不同体积分数的乙醇溶液(30%、50%、70%、80%、90%、95%、100%)按体积分数由低到高进行脱水,每次15 min。脱水完成后的样品放置隔夜,将双面导电胶黏于铜片上,样品摊开于双面胶上,喷金60 s。利用扫描电子显微镜观察纵切方向的肌肉纤维,放大倍数为400倍,自动对焦拍照。
1.3.2 羊肉TBARS值测定
TBARS值测定参考刘占东等[10]的方法并进行适当修改。取4 g待测肉样,剪碎后置于50 mL离心管中,加入16 mL体积分数为7.5%的TCA溶液(含体积分数0.1%的EDTA),水平放置于振荡器震荡30 min,使用双层滤纸过滤。将5 mL滤液与5 mL 0.02 mol/L的TBA溶液混合,沸水浴30 min后室温冷却1 h。5 000 r/min条件下离心5 min得到上清液,加入5 mL氯仿,摇匀。静置30 min后取上清液,分别在532 nm和600 nm处测定吸光度,根据公式(1)计算TBARS值:

72.6×1 000。
(1)
式中:72.6为常数,用于将吸光度转换为单位mg/kg,该常数是在特定实验条件下,由标准硫代巴比妥酸溶液进行光谱测定后确定。
1.3.3 蛋白质溶解度测定
蛋白质溶解度测定参考Bowker等[11]的方法并进行适当修改。
肌浆蛋白溶解度:取1 g待测肉样,加入10 mL预冷过的25 mmol/L磷酸钾缓冲液中,均质后置于摇床上,4 ℃振摇提取20 h后,在7 500 r/min条件下离心30 min。取上清液采用凯氏定氮法测定肌浆蛋白含量。肌浆蛋白溶解度=离心后肌浆蛋白含量/离心前肌浆蛋白含量。
总蛋白溶解度:取1 g待测肉样,加入含有10 mL 1.1 mol/L碘化钾和10 mL 0.1 mol/L磷酸钾的缓冲液(pH 7.2)中,均质后置于摇床上,4 ℃振摇提取20 h后,在7 500 r/min条件下离心30 min。取上清液采用凯氏定氮法测定总蛋白含量。总蛋白溶解度=离心后总蛋白含量/离心前总蛋白含量。肌原纤维蛋白溶解度=总蛋白溶解度—肌浆蛋白溶解度。
1.3.4 肌原纤维蛋白提取
肌原纤维蛋白提取参考Han等[12]的方法并进行适当修改。背最长肌在去除脂肪和结缔组织后切碎,取一定量的碎肉,加入4倍体积的缓冲液(0.1 mol/L KCl、2 mmol/L MgCl2、1 mmol/L EGTA、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0),均质后置于摇床上,4 ℃振摇20 min,然后在4 ℃条件下7 500 r/min离心20 min。离心后取沉淀,重复上述步骤2次。最后1次离心后取沉淀加入4倍体积的0.1 mol/L NaCl,均质1 min,4 ℃条件下7 500 r/min离心20 min。重复上述步骤2次,在最后1次离心前将溶液用4层纱布过滤,并使用0.1 mol/L盐酸溶液调节滤液pH值至6.0。取沉淀,得到肌原纤维蛋白,置于碎冰(-1~1 ℃)中并在12 h内使用。
1.3.5 肌原纤维蛋白中羰基含量的测定
羰基含量采用2,4-二硝基苯肼法进行测定,具体操作参考张莉等[13]的方法并进行适当修改。对照组在开始时加入2 mL缓冲液代替蛋白溶液,其他操作相同。使用多功能酶标仪测定370 nm波长处的吸光度值,根据公式(2)计算羰基质量摩尔浓度b(nmol/mg):
(2)
式中:A为370 nm波长处的吸光度值;n为稀释倍数;ε为摩尔吸光系数,此处取值为22 000;ρ为蛋白质质量浓度。
1.3.6 肌原纤维蛋白中巯基含量的测定
巯基含量采用5,5′-二硫代双-2-硝基苯甲酸法进行测定,具体操作参考瞿丞等[14]的方法并进行适当修改。测定样品在412 nm波长处的吸光度值,取摩尔吸光系数为13 600计算巯基含量。
1.3.7 肌原纤维蛋白表面疏水性的测定
疏水性测定参考Wang等[15]的方法并进行适当修改。将肌原纤维蛋白稀释至5 mg/mL,取1 mL肌原纤维蛋白溶液加入0.2 mL质量浓度为1 mg/mL的BPB溶液,充分混匀,离心取上清液,测定595 nm波长处的吸光度值。肌原纤维蛋白表面疏水性用BPB结合量(μg)表示,根据公式(3)进行计算:

(3)
1.3.8 FT-IR测定
参考Wang等[15]的方法对处理后的肌原纤维蛋白溶液进行FT-IR测定,具体操作如下:将肌原纤维蛋白在-50 ℃冷冻干燥,然后以1∶100的质量比与充分干燥的溴化钾混合研磨。每个样品的红外光谱在4 000~400 cm-1范围内扫描32次,分辨率为2 cm-1。其中,波段1 700~1 600 cm-1(酰胺Ⅰ区)是对蛋白质二级结构变化最敏感的区段。使用PeakFit软件4.12版本处理样品的酰胺Ⅰ区光谱数据,进行去卷积处理、基线校正、平滑和曲线拟合,以确定峰位的初始值,并计算吸收峰的位置和百分比。通过将每个二级结构的峰面积除以所有峰面积之和,计算各种二级结构的含量比例。
1.4 数据处理与分析
每个实验重复3次,数据采用Excel 2019和SPSS 24进行计算和显著性方差分析,利用Duncan多重检验进行差异显著性分析,数据以平均值±标准差进行表示。采用Origin 2018进行可视化作图。
2 结果与分析
2.1 羊肉后熟过程中肌肉纤维结构的变化
SEM可用于观察肌肉纤维微观结构的变化[16],新疆山羊背最长肌在宰后成熟48 h过程中的肌肉纤维微观结构如图1所示。在后熟0 h时,山羊背最长肌的肌肉纤维结构较为松散,边缘清晰,纤维之间具有规则光滑的缝隙;12 h时,肌肉纤维出现聚合,更加紧密,部分纤维相互靠近使得纤维条块宽度增加,纤维条之间的缝隙大小不一;24 h时,肌肉纤维条块宽度与12 h时相差不大,缝隙较为均一且表现出变宽趋势,纤维条块之间的紧密度下降;48 h时,肌肉纤维条块间距明显增大,紧密度继续下降,纤维边缘变粗糙,完整度也下降。以上变化与本课题组前期测定的肌肉硬度、剪切力指标的变化相对应,表明山羊肌肉纤维在宰后48 h成熟过程中,紧密度和完整度的变化对肉的质构特性产生了影响[17]。肉在后熟过程中,肌肉纤维发生降解、收缩及蛋白结构变化,影响了其结构特性,同时,成熟过程中的氧化反应及酶活性也可能会对肌肉纤维结构产生影响。
以此为线索,笔者对《十日谈》中70个带有女性角色的故事进行梳理,最终确定女性形象最具代表性的30个故事。表1是所做整体分析的一个节选。以文本维度为基准,进行“由外到内,由社会到个人”的三组跨维度比较:第一,是文本与社会的平行比较,分析《十日谈》中女性角色的选取是否与社会现实差别过大,承载了作者的过度偏见;第二,是文内的平行比较,意在考察“爱情”和“智慧”两大主题是否贯穿了所有女性为主角的故事;第三,是作者意图的解析,判断女性正、负面角色如何划分以及女性角色结局如何。结论如下:

图1 羊肉后熟48 h内肌肉纤维结构的变化
2.2 羊肉后熟过程中脂质氧化程度的变化
进一步探究宰后成熟48 h过程中羊肉脂质的氧化特性,以TBARS值进行表示。图2a展示了宰后成熟48 h过程中山羊背最长肌TBARS值的变化。TBARS值从0 h的0.523 mg/kg持续上升至48 h的0.773 mg/kg,上升幅度达到47.8%。相比于0~12 h期间的上升速率,12~24 h与24~48 h期间的TBARS值上升速率增大。在宰后初期脂质氧化发生较为缓慢,这与Nakyinsige等[18]在兔肉宰后成熟过程中对氧化指标的研究结果一致。Nieto等[19]研究表明甲硫氨酸和半胱氨酸可能具有抗氧化能力,肌球蛋白中丰富的半胱氨酸残基使其在受到氧化应激时具有自由基清除剂的功能。此外,肌肉的宰后变化还包括在自由基作用下抗氧化防御系统的减弱[20]。以上过程部分解释了山羊背最长肌TBARS值上升速率先慢后快的变化趋势。
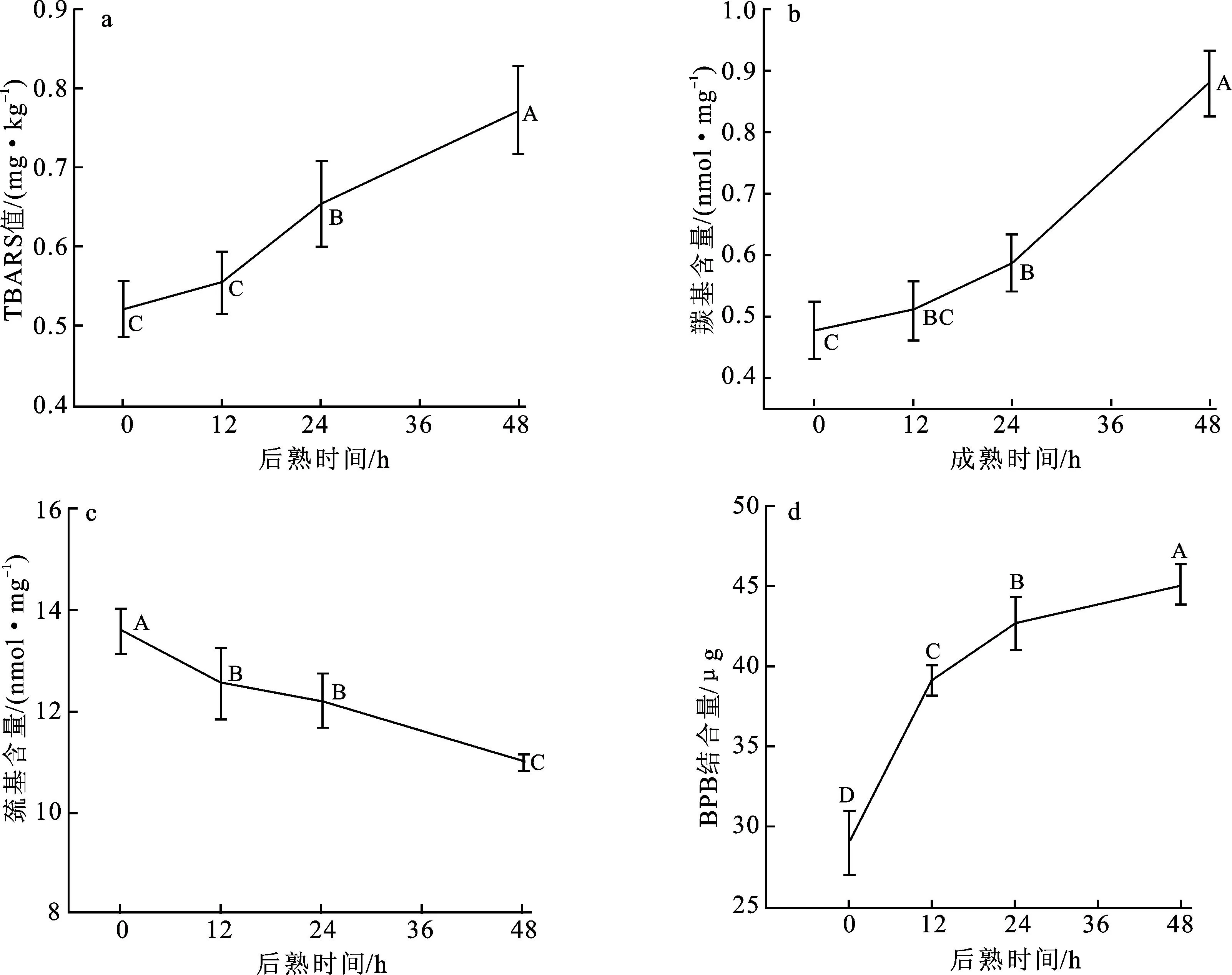
图2 羊肉后熟48 h过程中TBARS值(a)、肌原纤维蛋白羰基含量(b)、巯基含量(c)及疏水性(d)的变化
2.3 羊肉后熟过程中蛋白质溶解度的变化
蛋白质溶解度反映了蛋白质在水中的分散程度,可用于表征蛋白质的变性情况并能在一定程度上体现蛋白质的氧化状态。本研究测定了山羊背最长肌中总蛋白的溶解度、肌原纤维蛋白的溶解度以及肌浆蛋白的溶解度,宰后成熟48 h过程中各蛋白质溶解度的变化如图3所示。可以看出,在48 h羊肉后熟过程中,总蛋白溶解度从0 h的209.07 mg/g下降到48 h的189.89 mg/g,肌原纤维蛋白溶解度从0 h的141.14 mg/g下降到48 h的128.63 mg/g,肌浆蛋白溶解度从0 h的67.93 mg/g下降到48 h的61.26 mg/g。3种蛋白质溶解度都在0~12 h后熟过程中出现大幅下降(P<0.05),该阶段总蛋白、肌原纤维蛋白和肌浆蛋白溶解度的下降幅度分别为12.4%、15.1%和9.6%。肌原纤维蛋白溶解度的下降速率大于肌浆蛋白溶解度,表明肌原纤维蛋白在羊肉氧化过程中受到的影响更为显著,因此在后续研究中选择肌原纤维蛋白作为蛋白质氧化研究的主体。
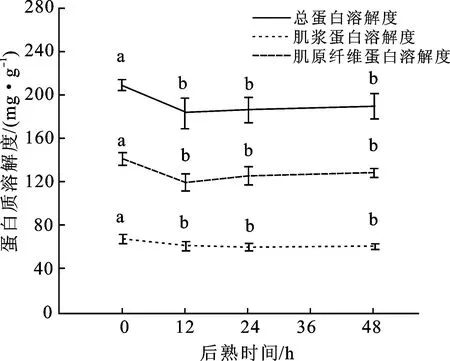
图3 羊肉后熟48 h内蛋白质溶解度的变化
后熟12 h后蛋白质溶解度的变化较小,各时间点之间无显著差异。蛋白质溶解度受到多种因素的影响,包括温度、离子强度、pH值、溶剂类型等。其中,pH值的下降会影响蛋白质的电荷数量,使蛋白质-水相互作用发生变化,肌原纤维蛋白通过弱蛋白质-蛋白质疏水相互作用发生聚集,进而导致蛋白质沉淀程度改变,且这种疏水相互作用在蛋白质等电点达到最大[19]。在宰后0~48 h成熟过程中,肌肉pH值保持下降趋势,且不同蛋白质的等电点不同,其溶解度受pH值变化的影响较大[17]。因此,12 h后较小的溶解度差异对蛋白质氧化情况可能并不具有代表性。
2.4 羊肉后熟过程中肌原纤维蛋白羰基含量的变化
山羊背最长肌在宰后成熟48 h过程中肌原纤维蛋白羰基含量的变化如图2b所示。在48 h后熟过程中,肌原纤维蛋白的羰基含量呈上升趋势,由0 h的0.48 nmol/mg上升至48 h的0.88 nmol/mg。羰基含量在0~24 h阶段的上升速率较为缓慢,上升幅度为22.9%;24~48 h期间上升速率增大,增幅达到50%。这可能与肌肉在宰后成熟过程中发生的氧化反应和蛋白质水解有关,这些反应能使氨基酸残基发生羰基化,蛋白质在氧化和水解过程中还会产生多种氨基酸、肽类和氮氧化物等,部分氨基酸会形成羰基化合物,最终导致羰基含量升高[21]。
2.5 羊肉后熟过程中肌原纤维蛋白巯基含量的变化
图2c展示了山羊背最长肌在宰后成熟48 h过程中肌原纤维蛋白巯基含量的变化。巯基为分布在蛋白质表面和内部的SH基团,后熟过程中其在肌原纤维蛋白中的含量呈下降趋势,由0 h的13.58 nmol/mg下降至48 h的10.97 nmol/mg,下降幅度为19.2%。后熟前12 h巯基含量下降速率较大,此后巯基含量下降速率减缓。通常情况下,部分巯基可能隐藏于蛋白质内部进而防止了被氧化[18],单从巯基变化来判断蛋白质的氧化程度是不全面的,可结合羰基含量的变化综合判断肌原纤维蛋白的氧化程度。在羊肉后熟48 h过程中,肌原纤维蛋白中巯基含量下降,羰基含量上升。羰基含量增加反映出肌原纤维蛋白中氧化产物增加[22],说明后熟过程中肌原纤维蛋白受到氧化损伤,尤其是后熟前12 h,部分巯基被氧化成羰基,降低了肌原纤维蛋白的还原性能。
2.6 羊肉后熟过程中肌原纤维蛋白表面疏水性的变化
图2d展示了山羊背最长肌在宰后成熟48 h过程中肌原纤维蛋白疏水性的变化。蛋白质疏水性是通过反映疏水基团的暴露程度而对蛋白质表面活性进行评估的重要指标。BPB结合量越大,蛋白质表面疏水性越强。在48 h后熟过程中,BPB结合量呈上升趋势,上升速率随后熟时间的延长而放缓。由图可知,BPB结合量从0 h的29.07 μg上升至48 h的45.15 μg,其中0~12 h阶段的上升速率最快,上升幅度达到34.7%。通常情况下,疏水基团可能埋藏在蛋白质内部,并存在于蛋白质和蛋白质之间的疏水结合腔中,疏水性的增加可能反映了后熟过程中肌原纤维蛋白的展开[18]。
2.7 羊肉后熟过程中肌原纤维蛋白构象的变化
在肌肉纤维膨胀和收缩过程中,蛋白质分子三级结构的变化与二级结构的变化直接相关,本研究采用FT-IR[23]监测山羊背最长肌在宰后成熟48 h过程中肌原纤维蛋白二级结构的变化,结果如图4所示。后熟4个时间点的FT-IR图谱(图4a)高度一致。波数在1 700~1 600 cm-1的酰胺Ⅰ区是FT-IR光谱中蛋白质二级结构信息量最大的部分,对1 700~1 600 cm-1的曲线进行拟合(图4b~e),并分析该波数范围内的二级结构所对应的峰图。在后熟0、12、24、48 h的FT-IR图谱中都存在4个波峰,其中,0、12、24 h图谱反映出肌原纤维蛋白中存在α-螺旋结构(1 650~1 580 cm-1)、β-折叠结构(1 680~1 620 cm-1)、β-转角结构(1 690~1 650 cm-1)以及无规则卷曲结构(1 710~1 640 cm-1);而在48 h的FT-IR图谱中,无规则卷曲未被检出,但出现2个对应β-转角的波峰。

图4 羊肉后熟48 h过程中肌原纤维蛋白二级结构的变化
各蛋白质二级结构所占比例如图4f所示。在后熟0、12、24 h时,肌原纤维蛋白中α-螺旋、β-折叠、β-转角以及无规则卷曲结构平均所占比例分别为29%、19%、21%、31%。α-螺旋比例在0~24 h期间出现小幅下降,β-折叠和β-转角比例在0~24 h期间出现小幅增加;无规则卷曲比例在0~12 h期间出现小幅下降,而在24~48 h期间大幅下降至0。48 h时,无规则卷曲消失,α-螺旋、β-折叠、β-转角比例显著增加,该结果与张文刚等[24]研究结果中挤压膨化处理后藜麦蛋白质所表现出的现象一致。徐志雨[25]在对植物组织吸水和聚合反应机理的探究中,发现水分子会使α-螺旋结构中的分子内氢键逐渐转换为分子间氢键,进而使α-螺旋结构向β-折叠结构转变。Abrosimova等[26]利用FT-IR对牛血清蛋白和卵清蛋白进行研究,发现冻干伴随着α-螺旋结构的减少和分子间β-折叠结构的增加。Güler等[27]对蛋白水解过程中的牛血清白蛋白二级结构进行研究,发现牛血清白蛋白在消化过程中转化为肽段时会失去其二级结构。推测48 h时无规则卷曲未检测到的原因可能与无规则卷曲结构本身不稳定及蛋白酶的作用有关。
3 讨论
肉中富含脂肪和蛋白质,具有极高的营养价值,而肉类氧化变质的主要原因之一就是脂质和蛋白质的氧化作用[28]。在这一复杂的体系中,脂质氧化和蛋白质氧化不是孤立发生的,而是具有一定的联系[29]。蛋白质氧化对肉制品品质影响极大,会对蛋白质的分子结构造成破坏,引起蛋白质氨基酸侧链被修饰、蛋白质多肽链断裂、蛋白质分子间的交联聚合等,从而改变蛋白的凝胶、持水、消化、营养等特性,并最终影响肉品的品质[30]。脂质过氧化反应和非酶糖基化反应能间接诱导蛋白质发生氧化[31],且脂质氧化会使肉品产生不愉悦气味以及一些有毒物质如丙二醛、胆固醇氧化物等[32]。
本研究对新疆山羊背最长肌在后熟48 h过程中的氧化特性变化进行探究。结果显示,后熟过程中山羊背最长肌的TBARS值随着后熟时间的延长而上升,这与Sabow等[33]对波尔羊肉氧化研究的结果一致。扫描电镜结果显示随着后熟时间的增加,肌肉纤维间隙增加,肌肉纤维的紧密度与完整度下降,考虑这是由于蛋白质中的氨基酸侧链受到氧化应激而发生修饰,致使结构蛋白之间发生交联、部分蛋白发生变性等,改变了肌肉纤维的微观结构。同时,微观结构的变化可能会促进氧气和内层肌肉纤维的接触,并反过来进一步加速氧化进程。Rowe等[34]通过对牛背最长肌的后熟过程进行研究,证实后熟早期肌肉蛋白质氧化过程的加剧会对新鲜牛肉的颜色和嫩度产生负面影响。本研究通过FT-IR技术对蛋白质的二级结构进行测定[35-36],结果表明肉纤维三级结构的变化与蛋白质分子的二级结构变化相关。对后熟48 h过程中傅里叶红外光谱曲线1 700~1 600 cm-1之间的酰胺Ⅰ区进行拟合,得到二级结构与后熟时间的关系,结果显示随着后熟时间的增加,肌原纤维蛋白结构的稳定性下降,后熟48 h时肌原纤维蛋白中的无规则卷曲结构消失,推测相比于α-螺旋、β-折叠、β-转角等二级结构,无规则卷曲结构具有不稳定性,且可能与蛋白酶等对蛋白质具有消化功能的酶作用有关。
基于本研究结果,未来可通过调控宰后成熟过程中的氧化反应等手段来优化肉品质;此外,了解不同肉类在宰后成熟过程中的特异性变化也是未来的研究方向之一,这将有助于开发针对性的肉成熟技术和策略,以满足消费者对不同种类高品质肉制品的需求。
4 结语
山羊背最长肌在48 h后熟过程中,肌肉纤维结构出现聚合、条块边缘变粗糙、纤维间距增大现象;TBARS值从0 h的0.523 mg/kg持续上升至48 h的0.773 mg/kg,上升幅度达47.8%;肌原纤维蛋白的溶解度下降8.9%,疏水性增加55.3%;羰基含量增加83.3%,巯基含量减少19.2%。以上结果表明脂质氧化和肌原纤维蛋白氧化水平随着成熟时间的延长而加剧。后熟0、12、24 h时,肌原纤维蛋白中α-螺旋、β-折叠、β-转角以及无规则卷曲结构平均所占比例分别为29%、19%、21%、31%;48 h时无规则卷曲结构未被检出。研究结果反映出,羊肉后熟过程中肌肉纤维条块在聚合后出现降解,后熟前12 h肌原纤维蛋白中含巯基蛋白质更容易被氧化,12 h后脂质氧化加速。
