硫化氢介导的S-巯基化修饰及其化学检测技术
2024-02-27全心雨唐志书
张 珍, 全心雨, 唐志书,2)*
(1)陕西中医药大学陕西省中药资源产业化协同创新中心,陕西 咸阳 712046;2)中国中医科学院研究生院, 北京 100700)
H2S是一种无色有臭鸡蛋气味的气体。1996年,Kimura等人首次发现产生H2S的酶-胱硫醚-γ-裂解酶(cystathionine gamma-lyase,CSE),由此开启了H2S研究的新纪元,人们对H2S的认识也从环境毒物转变为继一氧化氮和一氧化碳之后的第3种内源性气体信号分子[1,2]。随后,相继发现参与H2S生成的酶,包括硫醚-β-合成酶(cystathionine β-synthase,CBS)和3-硫基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase, 3-MST)。这些酶的发现和研究进一步揭示了H2S在机体内的生物学作用。研究表明,H2S广泛存在于细胞内和细胞外,组织与器官,并与蛋白质、DNA和其他活性基团发生反应(例如:氧和氮的衍生氧化剂和自由基),通过影响细胞信号通路调节心血管、神经元、免疫、呼吸、胃肠、肝、肾和内分泌系统等,具有广泛的生理和病理作用[3, 4]。
研究发现,在缺血再灌注损伤[5]、动脉粥样硬化[6]、癌症[7]、肾纤维化/慢性肾病[8]及其他形式的血管疾病[9,10]等疾病中,H2S水平显著降低。相反,在各种炎症[11]和唐氏综合症[12]等疾病中,H2S水平明显升高。研究表明,通过给予H2S供体或抑制产生H2S酶的活性,相应地升高或降低体内H2S水平,可以达到一定的治疗作用[13]。因此,调节H2S水平有望成为治疗这些疾病的新途径,而H2S相应的分子机制研究也至关重要。
2009年,Mustafa等人首次提出H2S通过S-巯基化修饰蛋白质的Cys残基参与调控生理功能[14]。随后,大量研究证明,H2S介导的S-巯基化修饰通过改变靶蛋白的结构和功能,在细胞内信号通路中发挥着重要的调控作用[1]。本文主要综述了H2S介导的S-巯基化修饰及其化学检测方法,为H2S相关生理病理分子机制的研究提供参考。
1 S-巯基化修饰
1.1 S-巯基化修饰研究现状
S-巯基化修饰是指H2S修饰靶蛋白中Cys巯基(-SH)或二硫键,从而产生-SSH基团,是继磷酸化、泛素化、乙酰化和S-亚硝基化等之后新发现的一种蛋白质翻译后修饰方式[15,16]。目前,已有大量研究表明,S-巯基化修饰在多种生理和病理过程中发挥着重要作用。例如:S-巯基化修饰参与了细胞信号传导、蛋白质稳定性、氧化应激反应、免疫调节、代谢调节等多个方面的生物学过程。此外,S-巯基化修饰还与多种疾病的发生和发展密切相关,例如心血管疾病、神经系统疾病和肿瘤等[17,18]。因此,对S-巯基化修饰的研究已成为当前生命科学领域的热点之一。
目前,通过PubMed检索关键词“sulfhydration”发现,与S-巯基化修饰相关的研究论文共计290篇。自2009年以来,论文发表数量逐年递增,2021年达到最高峰,共有49篇,2022年则有31篇。S-巯基化修饰在各种疾病的机制研究中越来越受到关注,但大部分研究仅揭示了S-巯基化修饰的水平,而未进一步阐明S-巯基化修饰的具体Cys位点。本文总结了目前已揭示S-巯基化修饰及其修饰的具体Cys位点的研究(Table 1)。
1.2 S-巯基化修饰与S-亚硝基化修饰之间的关系
S-亚硝基化修饰是一种在生物界中广泛存在的氧化还原修饰类型,是由一氧化氮对蛋白质中Cys巯基(-SH)氧化而产生的。尽管S-巯基化修饰和S-亚硝基化修饰是通过不同的反应途径形成的,但它们都涉及到Cys残基的修饰,并且都可以影响蛋白质的结构和功能。多项研究发现,S-巯基化和S-亚硝基化修饰通常出现在同一Cys残基上的相同位点,而这两种修饰对蛋白质功能的影响显示出截然相反的作用,S-亚硝基化的结果是“覆盖”Cys残基,S-巯基化修饰增加Cys的亲核性和反应性,因此,S-亚硝基化修饰通常抑制蛋白质的功能,而S-巯基化修饰激活酶的活性[49,50]。例如:甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase; GAPDH)的Cys150位点,可同时发生S-巯基化和S-亚硝基化修饰,S-巯基化修饰增强GAPDH的糖酵解活性高达7倍,而S-亚硝基化修饰抑制其活性[51]。E3泛素连接酶parkin的同一Cys位点能同时被S-巯基化和S-亚硝基化修饰,S-巯基化修饰增强Parkin促进泛素化和毒蛋白的清除活性,而在帕金森病中发现,Parkin的Cys残基被S-亚硝基化,抑制了这种催化活性,并导致了引起神经毒性的相关蛋白质的聚集[22]。在TNF-a处理细胞后,H2S对P65的S-巯基化修饰先出现,引起相应的启动子的激活,发挥抗凋亡的作用,随后,iNOS产生的NO对P65进行S-亚硝基化修饰,并逆转S-巯基化修饰引起的激活作用[21]。除此之外,S-巯基化和S-亚硝基化修饰均会被硫氧还蛋白系统逆转,这种可逆性在体内研究中已经得到证实。
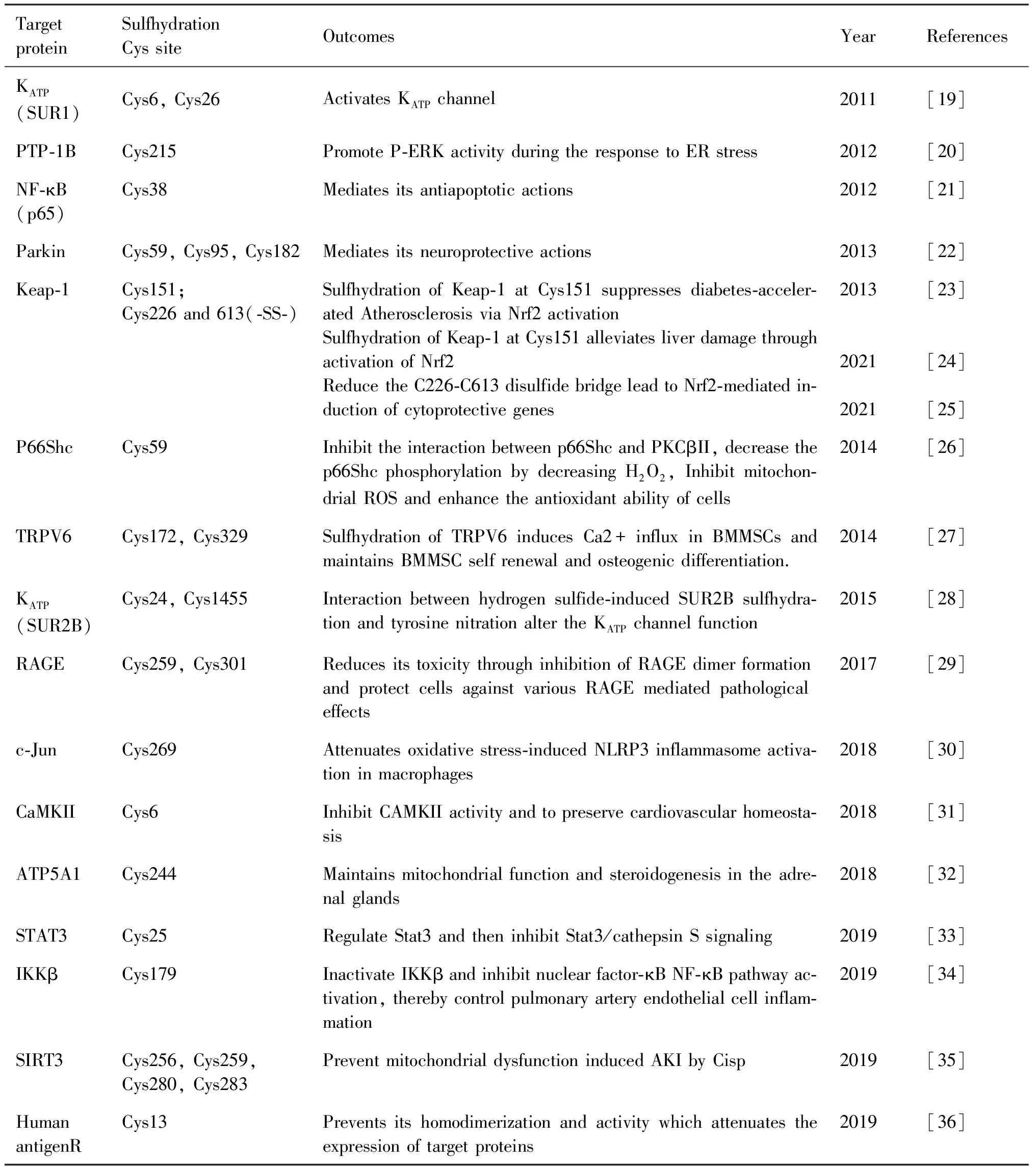
Table 1 Involvement of protein sulfhydration in regulating different proteins
研究表明,S-巯基化比S-亚硝基化水平更高,在肝中有10%~25%的蛋白质被S-巯基化修饰,而被S-亚硝基化修饰的只有1%~2%[49]。H2S对蛋白质的S-巯基化修饰发生时,除了调节S-亚硝基化修饰外,也影响其他几种翻译后修饰的水平,例如羰基化修饰,亚磺酰化修饰和S-谷光甘肽化修饰等,这些修饰共同调节机体生理或病理过程[17][52]。
2 S-巯基化修饰反应
近年来,随着H2S S-巯基化修饰关键蛋白质随着研究的不断深入,其反应机制也逐渐清晰。总的来说,H2S S-巯基化修饰主要有以下5个类型的反应:(1)H2S不能直接和蛋白质巯基发生S-巯基化修饰反应;(2) H2S可与Cys二硫键(-S-S)发生S-巯基化修饰反应;(3) H2S可与被氧化的Cys巯基发生S-巯基化修饰反应;(4) H2S可与Cys次磺酸发生S-巯基化修饰反应;(5)H2S可与S-氮化的Cys发生S-巯基化修饰反应生成HSNO或HNO[53](Fig.1)。
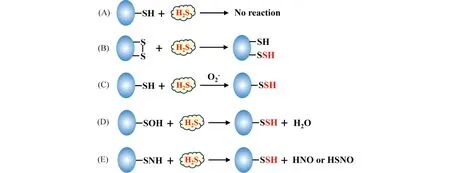
Fig.1 The reactions of sulfhydration (A) H2S can’t directly react with protein Cysteine. (B) H2S can react with Cys disulfide bonds (-S-S). (C) H2S can react with oxidized Cys thiols. (D) H2S can react with Cys sulfonic acid. (E) H2S can react with S-nitrosated Cys to generate HSNO or HNO
3 S-巯基化修饰的化学检测方法
目前,检测S-巯基化的化学方法主要有:马来酰亚胺法(Maleimide assay),改良生物素转换法(Modified biotin switch assay)和标记转换法(Tag-switch assay)等。3种方法检测S巯基化修饰的共同原理是基于-SH和-SSH基团的物理和化学性质的不同,将这3种方法的特点比较详见下表(Table 2)[53]。
3.1 马来酰亚胺法
马来酰亚胺法是由约翰霍普金斯大学的Snyder教授及其团队在2012年提出,其为一项较为灵敏的用于测定蛋白质S-巯基化的技术。当H2S对靶蛋白进行S-巯基化修饰后,形成的-SSH,由Alexa Fluor 680结合C2 N-乙酰马来酰亚胺荧光探针标记靶蛋白中Cys上的-SH后,二硫苏糖醇(dithiothreitol,DTT)处理可崩解二硫键,使-SSH中的-SH脱落,导致荧光信号减弱,通过凝胶电泳分离蛋白质转印或点印迹法直接转印到PVDF膜上,凝胶成像仪对红色荧光条带进行检测,最终根据荧光条带是否减弱来判断H2S是否对靶蛋白进行了S-巯基化修饰(Fig.2)[21]。
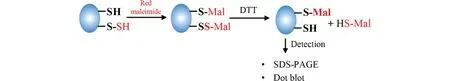
Fig.2 Schematic diagram of malamide assay for detecting sulfhydration In this assay, sulfhydrated (-SSH) and unsulfhydrated (-SH) protein Cys is immunoprecipitated and allowed to react with Alexa Fluor® 680 C2 maleimide. After remove the excess maleimide, DTT split the disulfide bonds in sulfhydrated (-SSH) but not unsulfhydrated protein, thus resulting in a loss of the fluorescent signal from sulfhydrated (-SSH) protein, The samples were separated by SDS-PAGE, dot-blot or transferred to PVDF membrane, and the fluorescent signal in the membrane was detected. Finally, determination of target protein sulfhydration based on the weakening of fluorescence bands
该方法使用不同颜色的荧光探针同时检测S-巯基化和S-亚硝基化,但是由于S-亚硝基化的存在和H2S与含亚磺酸蛋白质等的非特异性反应,削弱了其检测S-巯基化的可信度。此外,马来酰亚胺会与胺类反应,因此,当S-巯基化修饰水平过低时,广泛的标记会产生较高的背景,从而淹没其信号强度的变化,使检测灵敏度降低[53]。另外,该方法在最后的信号检测环节,需要用到检测荧光的凝胶成像系统,而一般实验室配备的凝胶成像系统只有检测紫外和化学发光信号的功能,建议进行实验前检查仪器配备是否符合要求。
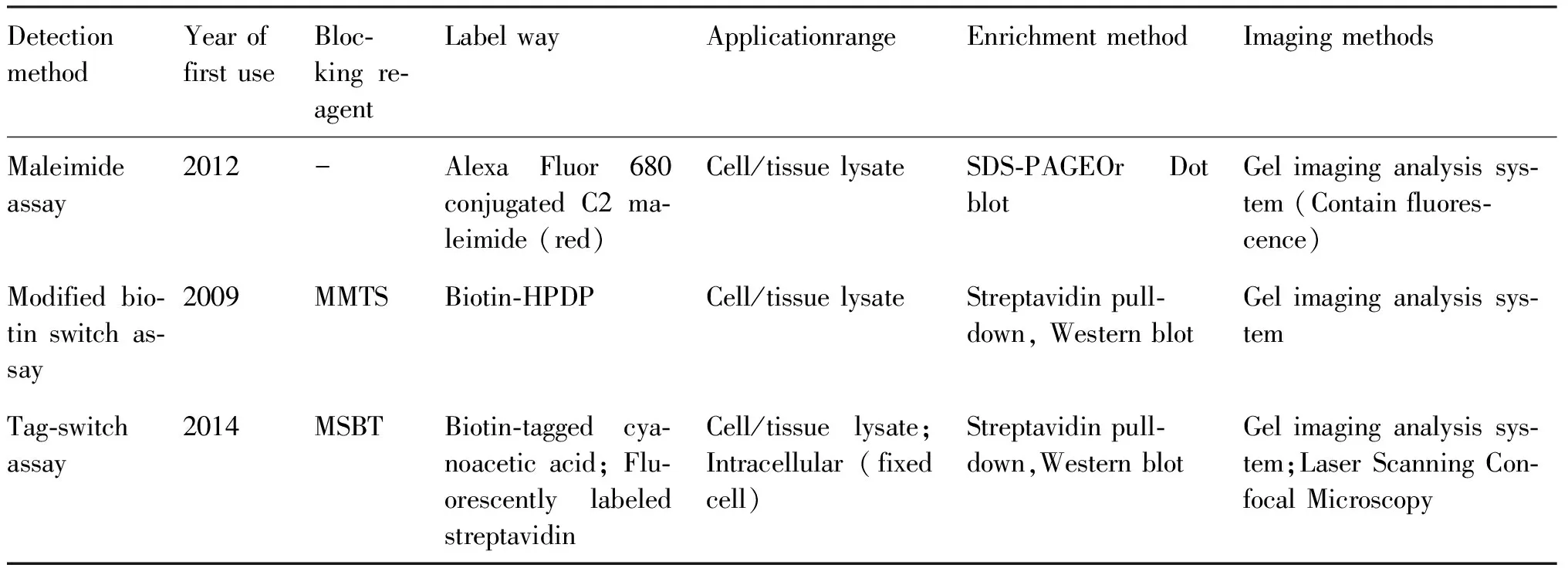
Table 2 Comparison of three detection methods of sulfhydration
本文先前的研究揭示,H2S通过S-巯基化抗体调节抗体补体介导的免疫反应,研究发现,H2S通过S-巯基化修饰切断免疫球蛋白(IgG)结构中的二硫键,使其丧失功能,进而抑制IgG介导的免疫反应, 提示H2S可能用于某些体液免疫疾病的治疗(Fig.3)[54]。作者在S-巯基化修饰方法积累了一些的经验,总结方法步骤见Fig.4。
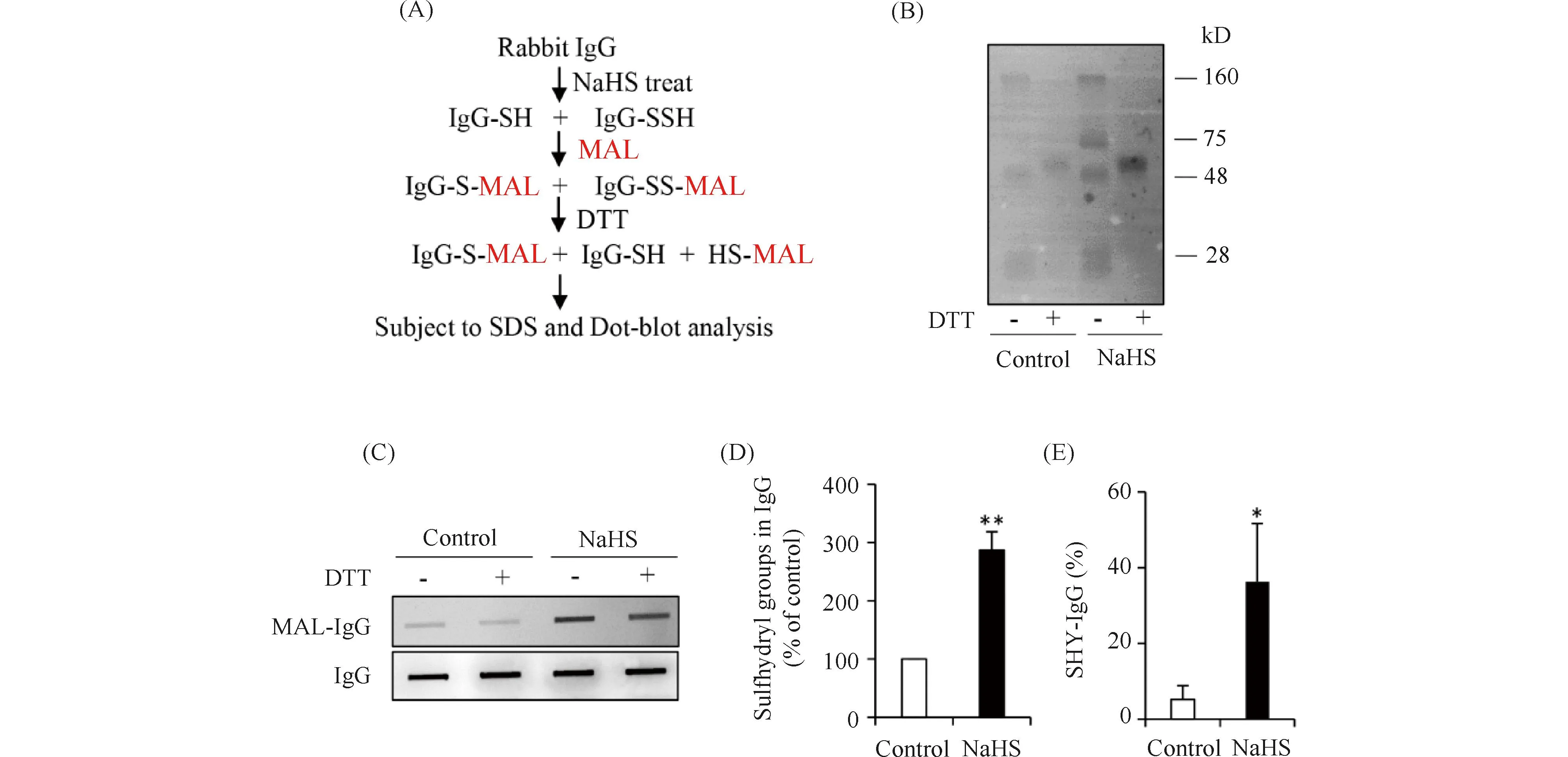
Fig.3 The S-sulfhydrationof IgG[54](Zhang Z, et al.Int Immunopharmacol.2019) (A) Schematic diagram of the method used for detection of IgG sulfhydration. (B) Maleimide-labelled IgG samples analyzed by SDS-PAGE. (C) Dot blot analysis of Maleimide-labelled IgG samples. (D) Densitometric analysis of the intensity of bands between IgG samples treated with or without NaHS. (E) Quantitative calculation of sulfhdrated IgG by H2S. Data are representative of four independent experiments and values are expressed in mean ± SE. *P < 0.05, ** P <0.01 vs. control
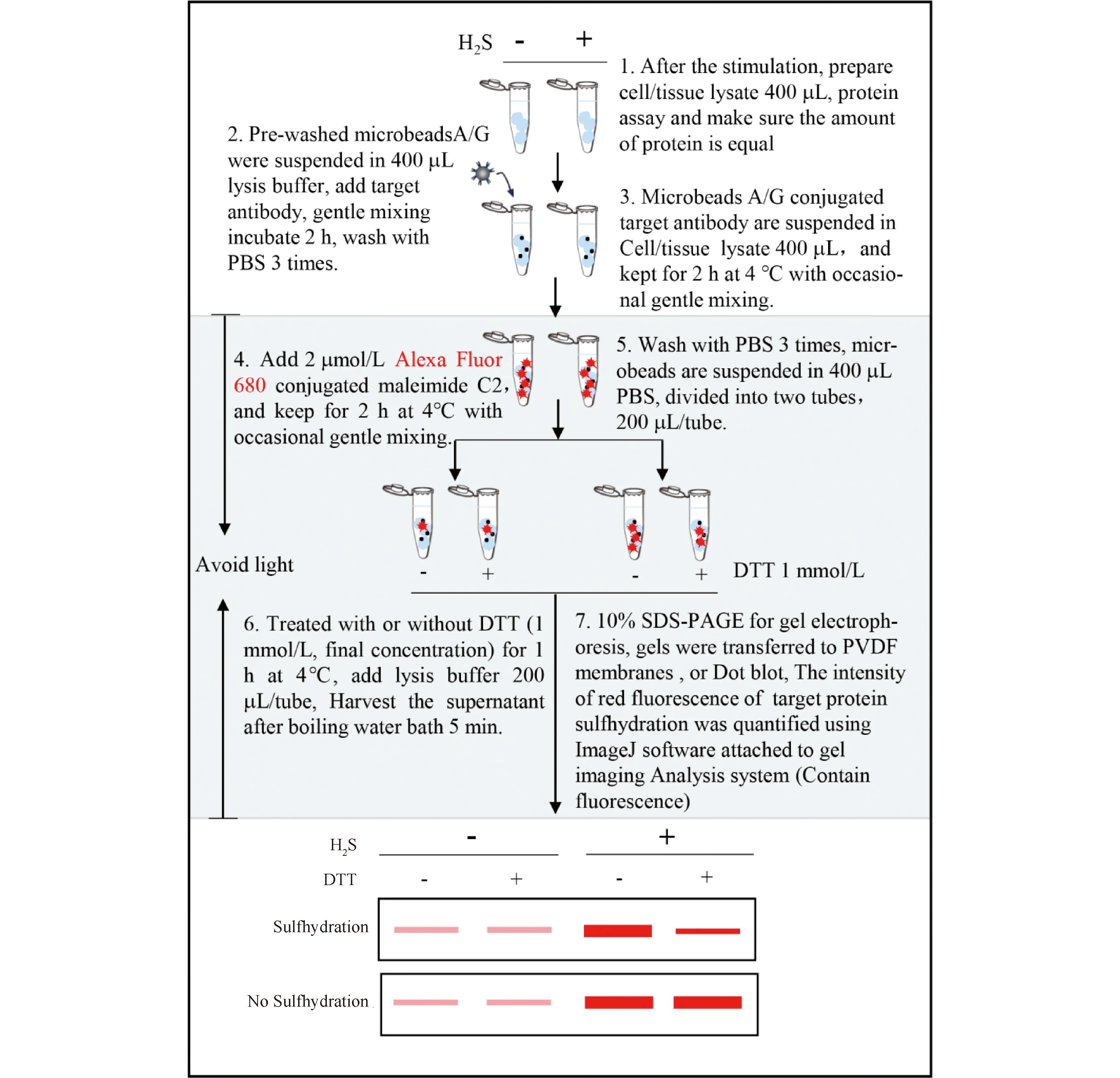
Fig.4 Detection of sulfhydration by Malamide assay The author’s detailed steps and experience summarized during their research relate to sulfhydration detection by Malamide assay
3.2 改良生物素转换法
生物素转换法起初被用于S-亚硝基化的检测,2009年经Mustafa等改良后被用于S-巯基化检测,并命名为改良生物素转化法[55]。检测原理及方法:(1)采用烷化剂S-甲基甲硫代磺酸盐(methyl methanethiosulfonate,MMTS)封闭未被修饰的Cys巯基,随后用丙酮移除MMTS;(2)应用生物素-HPDP ( N-[6-(biotinamido)hexyl]-3’-(2’-pyridyldithio)propionamide, Biotin-HPDP) 标记S-巯基化修饰过的Cys残基-SSH;(3)利用相应的生物素抗体识别被生物素-HPDP标记的S-巯基化修饰蛋白质,通过使用链霉亲和素偶联物与被生物素标记的蛋白质特异性结合,富集S-巯基化蛋白质;(4)Western 印迹检测蛋白质的S-巯基化水平(Fig.5)[56]。
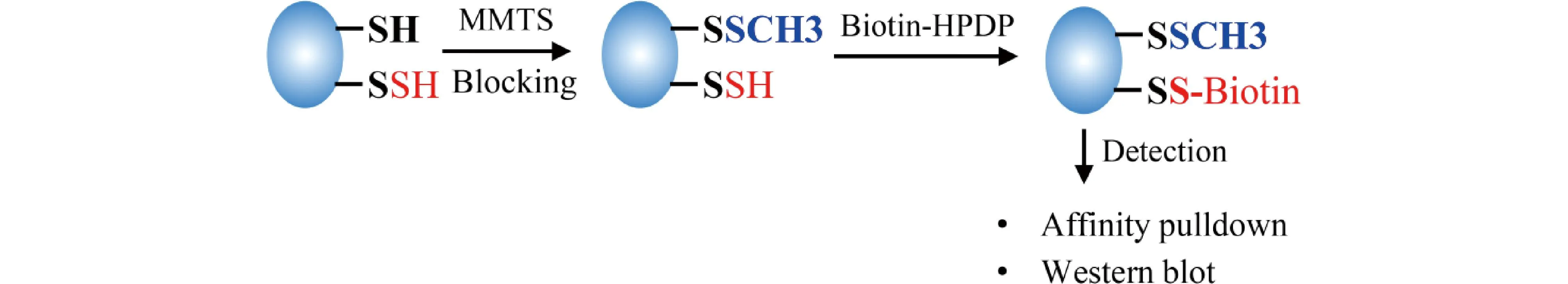
Fig.5 Schematic diagram of modified biotin switch assay for detecting sulfhydration MMTS was firstly applied to block the unsulfhydrated (-SH) protein Cys, then MMTs was removed by acetone and the sulfhydrated (-SH) protein Cys was labeled with Biotin-HPDP. These labeled Cys are recognized by the corresponding biotin antibodies and enriched using streptavidin-conjugated agarose. Finally, the sulfhydration levels of the proteins are detected by Western blot
一开始MMTS被认为只封闭-SH,而不与-SSH发生反应,但是,2013年Carroll及同事发现,MMTS不仅可以与小分子含-SSH的蛋白质发生反应(例如GSSH),而且可以与大分子-SSH的蛋白质发生反应[57]。尽管存在这些问题,生物素改良方法仍旧被用于S-巯基化修饰的检测,并发现敲除CSE[47]和CBS[29]可以降低生物素-HPDP标记/S-巯基化修饰水平,而给予H2S处理则升高生物素-HPDP标记/S-巯基化修饰水平。那么,MMTS与-SH和-SSH均发生反应,却还能检测到S-巯基化修饰水平的变化?目前并不清楚,一种可能的解释认为MMTS与-SSH的反应比-SH快,生成R-S-S-S-Me,进一步与游离-SH发生反应再次生成原始的-SH,最终的结果还是蛋白质上的-SH被封闭,而-SSH被生物素-HPDP标记,S-巯基化修饰得以被检测。鉴于该方法的设计中涉及的化学反应及选择性较差等问题,加上S-巯基化修饰的背景高达25%,其中大部分容易产生假阳性结果[52]。因此,使用该方法还应谨慎考虑。建议配合使用质谱法有助于提高分析的可靠性,除此之外,可以通过使用敲除CSE/CBS来进一步确定S-巯基化修饰水平。
3.3 标记转换法
标记转换法是基于被S-巯基化修饰的Cys(含-SSH)被巯基封闭剂-甲基磺酰基苯并噻唑(methylsulfonyl benzothiazole,MSBT)烷基化,并形成的二硫键要比蛋白质中存在的二硫键显示出更强的亲核性这一原理,通过应用一个同时具有亲核性和生物素报告分子作为标记转换试剂,只标记被S-巯基化修饰的蛋白质,不与被封闭的-SH基团发生结合反应,选择性的检测S-巯基化修饰。简单的反应步骤为:第一步,MSBT或者它的水溶性类似物MSBT-A先用来封闭-SH和-SSH;第二步,应用被生物素化的氰基乙酸甲酯衍生物作为亲核试剂标记与封闭剂结合的二硫键;第三步,采用链霉亲和素磁珠与被标记的二硫键上的生物素发生结合反应并富集,最终利用Western 印迹技术分析该蛋白质的S-巯基化修饰水平(Fig.6)[58, 59]。
该方法对S-巯基化修饰(-SSH)选择性已经被证明,研究初步表明,标记转换法对S-巯基化修饰的检测是具备一定特异性的,由于该方法并不与谷胱甘肽化、亚磺酰化、未被修饰的牛血清白蛋白质等修饰发生反应。次磺酸与氰基乙酸甲酯的反应性是一个潜在干扰检测的问题,解决这个问题可以通过在MSBT封闭-SH之前,用二甲酮封闭次磺酸来防止该非特异性反应的发生。也有研究者建议,用双甲酮提前处理细胞裂解物能避免潜在的交叉反应[58]。
一些研究者提出MSBT不能穿透细胞膜,不能检测出活细胞内S-巯基化修饰的水平。为提高检测的灵敏性,Wedmann等人在2016年合成了2种氰基乙酸甲酯的衍生物,用BODIPY moiety (CN-BOT) 标记细胞,Cy3-dye (CNCy3) 标记细胞裂解物,进一步改进了标记转换法[57]。该方法为未来研究阐明H2S信号通路的真实分子机制和S-巯基化修饰的检测开启了一个新的起点。然而,该方法是否具有更高的特异性和灵敏性,仍需要更多的大量研究进行验证。
4 问题与展望
尽管有多种检测S-巯基化的方法用来研究S-巯基化修饰发挥的作用,但是S-巯基化修饰的研究仍处于初级阶段,该领域需要研发特异性更高、选择性更强并且能够达到动态实时检测S-巯基化修饰的方法。
H2S介导的S-巯基化修饰靶蛋白广泛存在于各组织/细胞中。但是,(1)是否存在更多未知的蛋白质被S-巯基化修饰?(2)已经研究发现的S-巯基化修饰蛋白质的具体Cys位点以及相应的生理和病理作用是什么?(3)S-巯基化修饰蛋白质的动态变化规律是什么?(4)在临床中,有关S-巯基化修饰在疾病中有什么作用及意义?有待阐明。相信未来随着S-巯基化修饰研究的逐步推进,S-巯基化修饰关键蛋白质可能成为潜在的新靶点,用于治疗性干预和药物设计,将有助于促进H2S相关药物的发展和应用。
