腐烂阿克苏红富士苹果中毒素的检测方法与迁移规律的研究
2024-02-27吴思雅韦迪哲庞学群
吴思雅,姜 楠,韦迪哲,庞学群, 朱 璇
(1.新疆轻工职业技术学院食品与生物技术分院,新疆乌鲁木齐 831499;2.北京市农林科学院农业质量标准与检测技术研究中心,北京 100097;3.华南农业大学生命科学学院,广东广州 510642;4.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
苹果被誉为世界四大水果之一,其主要特点是富含多种微量元素,营养价值高,属蔷薇科(Rosaceae)苹果属(Malus)。红富士苹果自引入我国以来,在多地得到广泛种植,目前已经成为我国主要栽培和出口品种,其中以新疆阿克苏红富士果肉脆而多汁、味道芳香爽口较为著名。阿克苏位于新疆天山南麓,地处塔里木盆地北缘,土地肥沃、日照时间长、昼夜温差大,因此新疆阿克苏红富士苹果含糖量高、果品优质[1],同时阿克苏也被誉为“中国红富士之乡”。目前,我国苹果产业的发展已经从世界苹果生产大国转变为苹果产业强国,其中以红富士种植为代表的阿克苏地区苹果年产量超5 000 万t,种植面积约13.33 khm2。同时,进一步提高产量、稳定规模、提高果品仍是急需解决的现实课题,当前还存在技术落后的问题,一是对苹果上市时间控制不足、出现供需不一致现象,导致时常出现淡季苹果供应不足、旺季滞销的现象;二是对病原微生物的防治不力,从苹果生长、采收到贮藏的各个过程,都容易出现果品受到病原微生物污染的现象,尤其是在贮藏期间,这种现象最为严重。有研究发现,受到病原菌侵染的果蔬在贮藏过程中腐烂程度最为严重,并且危害人类健康。其中,链格孢和青霉是引起苹果腐烂的主要病原菌,随着采后贮藏期的延长,二者的代谢产物:链格孢霉毒素(Alternaria toxin,AT),展青霉素(Patulin,PAT)[2-3],会加剧果实腐烂程度,并同时产生毒素[4-5]。
真菌毒素的检测方法众多,但各方法侧重不一,传统方式以薄层色谱法(Thin layer chromatography,TLC)为主,而目前主要以现代色谱法为主,如高效液相色谱法(High performance liquid chromatography,HPLC)、色谱-质谱联用法(Gas chromatography-mass spectrometry,GC-MS)及免疫分析方法(Enzyme linked immunosorbent assay,ELISA)等,同时还有其他多种技术并存。根据阿克苏红富士主要感染霉菌类别,采用超高效液相色谱-串联质谱法(UPLC-MS/MS)和高效液相色谱(HPLC)2 种方法,对苹果中常见的6 种真菌毒素进行联合检测,这种方式具有操作简便、检测快速、成本较低及精确度高的特点,是未来真菌毒素检测方法的发展方向。
1 材料与方法
1.1 材料与仪器
使用苹果为2015 年11 月采摘于阿克苏红旗坡乡红富士;链格孢毒素(AOH、AME、TeA、ALT、TEN)标准品,Sigma 公司提供;展青霉素(PAT),Romer 公司提供;乙腈、甲酸、乙酸铵(色谱纯),美国Fisher 公司提供;SPE 型自制柱管,北京市农林科学院提供。
AcquityTM型超高效液相色谱仪-串联质谱仪(TQS);Water 1260 型高效液相色谱仪;电喷雾电离(ESI)接口,美国Waters 公司产品;通用台式高速离心机,德国Sigma 公司产品;氮吹仪,美国Organomation 公司产品;涡旋混合器,德国IKA 公司产品;Mil li-Q A10 型超纯水器,美国Millipore 公司产品。
1.2 试验方法
1.2.1 样品前处理
挑选表面无机械损伤、无虫害、大小均匀的苹果果实,先用体积分数为75%乙醇溶液喷施苹果表面后,无菌水擦拭,采用针刺法给已处理好的苹果接种链格孢霉和扩展青霉(孢子浓度为10-6mol/L),将接种后的苹果果实置于常温和低温(温度4 ℃,相对湿度95%)让其发病,分别取病斑大小为0.5,1,2,3,4,5,6 cm 的果实组织和距离病斑1,2,3 cm 处的果实组织,液氮速冻成块状后分装存放于-40 ℃超低温冰箱中保存,测前取出研磨至粉末状。
1.2.2 毒素样品提取[6]
称取苹果样品冻干粉5 g(精确到0.01 g)于50 mL离心管中,加入柠檬酸2.5 mL,水2.5 mL,涡旋混匀,加入乙腈20 mL,以转速150 r/min 常温振荡提取30 min 后,取出加入NaCl 2 g,涡旋混匀,随后低温离心(-10 ℃下以转速10 000 r/min 离心10 min),取上清液1.5 mL 润洗SPE 柱,取4 mL(2 次)自然通过SPE 柱到10 mL 离心管中,流出液于60 ℃条件下氮吹至近干,残渣用乙腈300 μL,水700 μL 进行溶解,混匀后过0.22 μm 微孔滤膜,供超高效液相色谱-串联质谱仪(UPLC-MS/MS)测定。
1.2.3 仪器条件
(1)AT 色谱条件。色谱柱:Acquity CORTECS UPLC C18(100 mm×2.1 mm,1.6 μm);柱温40 ℃,进样体积为5 μL,流动相A 为水,流动相B 为乙腈;梯度洗脱条件为A 在99%保持1 min 后,3 min内降至10%,保持0.5 min 后在0.1 min 内升至99%,保持1.4 min,流速0.3 mL/min,总运行时间6 min。
(2)质谱条件。离子源模式为正负离子模式(ESI+和ESI-),毛细管电压2.5 kV(ESI+)和-1.5 kV(ESI-),气化温度400 ℃,去溶剂气流速700 L/h,其余参数通过仪器自动调谐至最优。
(3)PAT 色谱条件。色谱柱为Waters Symmetry C18(4.6 mm×250 mm,5 μm),柱温40 ℃,二极管阵列检测器(PDA)检测波长280 nm,进样量20 μL,流动相A 为水,流动相C 为乙腈;流动相洗脱条件为A 保持90%,C 保持10%,流速1 mL/min,总运行时间12 min。
1.2.4 毒素含量的测定
(1)标准贮备液。用乙腈准确定容链格孢霉毒素1 mg 和展青霉素标准品于10 mL 容量瓶,配成质量浓度100 μg/mL 的标准储备液,密封冷冻储存于-20 ℃冰箱中。
(2)标准工作液。分别配制50,100,200,500,1 000,5 000,10 000 μg/L 的AT(5 种)和PAT 标准液,密封保存于-20 ℃冰箱中。
(3)基质空白标准工作溶液。以不含真菌毒素的苹果果实为材料,利用试验前处理方法制备苹果的基质空白溶液。用基质空白溶液将标准工作液按相同比例稀释至1,2,5,10,50,100,200 μg/L,分别得到苹果基质空白标准工作溶液。
用乙腈准确定容1 mg 链格孢毒素和展青霉素标准品于10 mL 容量瓶,配成质量浓度100 μg/mL 的标准储备液,分别稀释为50,100,200,500,1 000,5 000,10 000 μg/L 的AT(5 种)和PAT 标准液,以标准溶液的质量浓度(X)为横坐标,色谱峰面积(Y)为纵坐标绘制标准曲线。
1.3 数据处理
Excel 统计分析所有数据,计算标准误差并制图;利用DPS 多重比较对差异显著性进行分析,p<0.05 表示差异显著。
2 结果与分析
2.1 检测方法
2.1.1 色谱条件
比较了水-甲醇、水-乙腈、乙酸铵溶液-甲醇、乙酸铵溶液-乙腈4 种流动相体系。结果表明,以水-乙腈作为流动相体系时6 种真菌毒素的离子信号值增强,且峰形得到明显改善。
采用流动注射泵连续进样方式进行质谱条件的优化,分别在ESI+模式和ESI-模式下进行全扫描,确定链格孢酚甲醚(AME)和展青霉素(PAT)在负离子模式下的响应值高,链格孢烯(ALT)、细交链格孢酮酸(TEA)、腾毒素(TEN)和链格孢酚(AOH)在正离子模式下的响应值显著高于负离子模式。
2.1.2 方法回收率及精密度
试验样品进行加标回收率和精密度试验,分别取一定量的苹果冻干粉样品,添加10,50 μg/L 水平的标准溶液。样品经预处理后上机,每个加标水平进行6 次平行测定。
苹果中6 种真菌毒素的添加回收率和精密度(n=5)见表1。

表1 苹果中6 种真菌毒素的添加回收率和精密度(n=5)
由表1 可知,AT 和PAT 的平均加标回收率范围为90%~105%,RSD 为1.0%~5.0%,该方法的准确度和精密度都较为可行。
2.2 毒素含量的测定
按照优化后的色谱条件进行测定,由1.2.4 的方法所得回归方程、线性范围及相关系数分别为:AT(5 种)在50~10 000 μg/L 范围内有良好的线性关系,Y=0.099 78X+16.221(R2=0.999 8);PAT 在50~10 000 μg/L 范围内有良好的线性关系,Y=0.121 9X-0.805(R2=1)。由结果可知,方法的精密度良好、检出限低,能满足苹果中AT(5 种)和PAT 毒素检测的需要。
6 种真菌毒素的混合标准溶液(100 μg/L)定量离子质谱图见图1。

图1 6 种真菌毒素的混合标准溶液(100 μg/L)定量离子质谱图
2.2.1 链格孢霉毒素
(1)常温条件毒素变化。损伤接种链格孢霉后置于常温下,待其发病分别取病斑1~6 cm 及距离病斑1,2,3 cm 处果实组织分别测定AME、ALT、AOH、TEN、TEA 产毒含量。
低温0.5~6.0 cm 链格孢霉毒素的产毒含量见图2。

图2 低温0.5~6.0 cm 链格孢霉毒素的产毒含量
由图2 可知,整个过程中TEN 均不产毒,而TEA 在整个发病过程中,不仅病斑本身产毒,距离病斑1,2,3 cm 也均产毒,且离病斑的距离越远毒素含量越低;在病斑1 cm 时达到病斑产毒量的最大值33.056 9 mg/kg;当病斑为0.5 cm 时,AME 只有病斑本身产毒,为120.636 4 μg/kg,ALT 和AOH 也只有病斑本身产毒,毒素含量分别为26.579 47,41.161 6 μg/kg ;当病斑为4 cm 时,AME 和AOH除病斑本身产毒外距离病斑1 cm 处也开始产毒,但毒素含量相对较低;当病斑为5 cm 时,ALT 除病斑本身产毒外距离病斑1 cm 处也开始产毒,但毒素含量相对较低为18.361 4 μg/kg。
(2)低温条件毒素变化。损伤接种链格孢霉后置于低温下,待其发病分别取病斑1~3 cm 及距离病斑1,2,3 cm 处果实组织分别测定AME、ALT、AOH、TEN、TEA 产毒含量。
常温0.5~3.0 cm 链格孢霉毒素的产毒含量见图3。
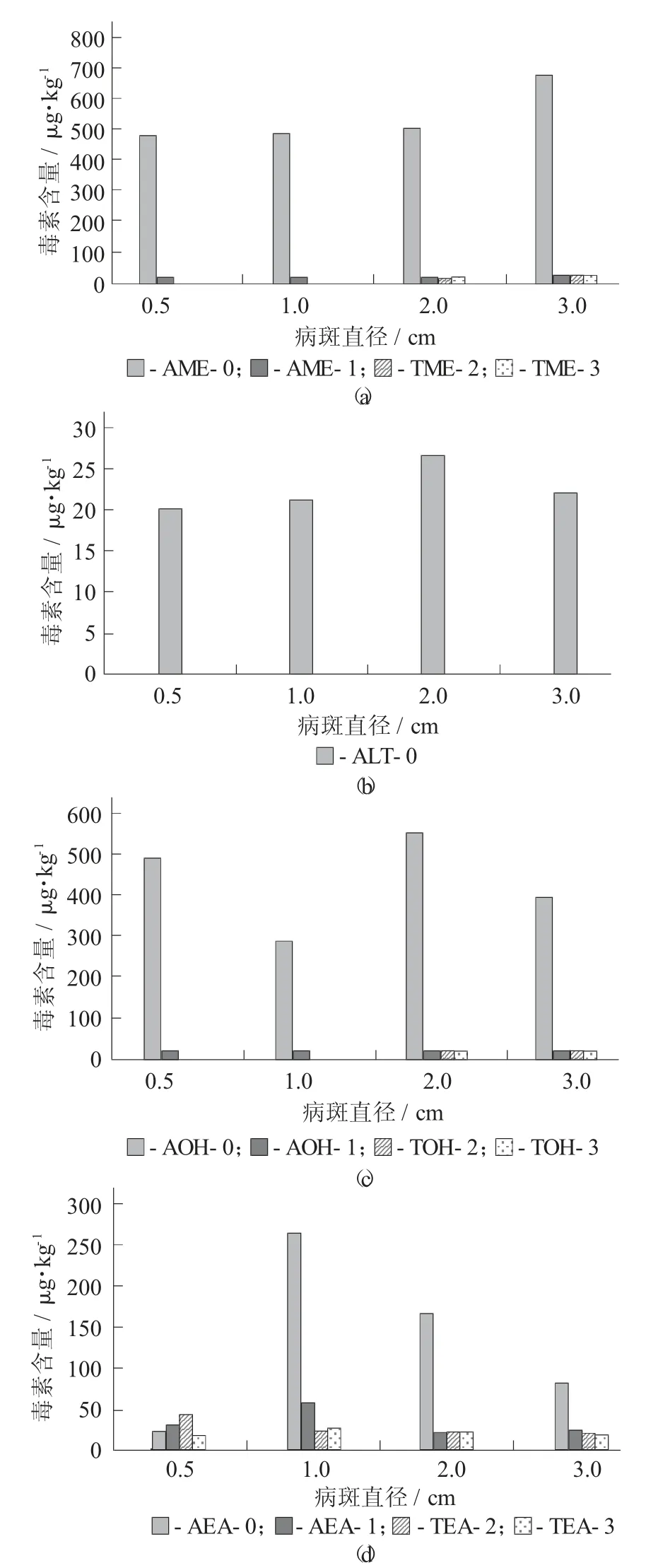
图3 常温0.5~3.0 cm 链格孢毒素的产毒含量
由图3 可知,整个过程中,TEN 不产毒,ALT 只有病斑本身产毒,且毒素含量最大为26.679 7 μg/kg;而TEA 在整个发病过程中,不仅病斑本身产毒,距离病斑1,2,3 cm 也均产毒,且随离病斑的距离越远毒素含量越低;在病斑1 cm 时达到病斑产毒量的最大值264.763 5 μg/kg;当病斑为0.5 cm 时,AME除病斑本身产毒外,距离病斑1 cm 处也产毒,为16.160 92 μg/kg;当病斑为1 cm 时,AME、AOH 除病斑本身产毒外距离病斑1 cm 处也产毒;当病斑为2 cm 时,AME 除病斑本身产毒外距离病斑1,2,3 cm处也开始产毒,但毒素含量相对较低;AOH 除病斑产毒外,距离病斑1,2 cm 处也开始产毒,毒素含量较低,当病斑为3 cm 时,AME、AOH 除病斑本身产毒外距离病斑1,2,3 cm 处也产毒。
(3)链格孢霉毒素。无论是低温还是常温条件,交链孢霉毒素广泛存在于霉变的苹果中,大多数链格孢霉毒素的急性毒性较低,TEA 在整个过程中都产毒,与TEA 作为最重要的链格孢霉毒素被美国国家职业安全及健康组织列入有毒化学物质登记册中[7]相符合,尽管TEA 检出率及检出值都较高,但其单独存在时健康风险较低,Melo F T 等人[8]发现霉变苹果中的AOH 的最高含量可达160 μg/kg,Pfeiffer E等人[9]在研究高粱中链格孢霉属代谢产物的毒性时发现,只产AOH、AME 和ALT 的培养物对大鼠和雏鸡均无毒性作用,而加入29 mg/kg 的TEA 后,对其却是致命的。而产生同等水平的急性毒性,单独添加TEA 的剂量远远超过29 mg/kg;这表明TEA 能与其他链格孢霉毒素协同作用,产生急性毒性。AME和AOH 已被证明具有强致癌性,苹果在低温贮存时也可产生AME 和AOH,与吴春生等人[10]研究了链格孢霉污染的苹果在不同温度条件下产生AME 和AOH 的能力,随着贮藏时间的延长,毒素逐渐累积,AME 和AOH 已被证明具有强致癌性,且存在协同效应[11]相符合。
2.2.2 展青霉毒素
(1)常温条件毒素变化。损伤接种展青霉素(PAT)后至于常温下,待其发病后分别取病斑及距离病斑1,2,3 cm 处果实组织测定PAT 产毒含量。
常温0.5~6.0 cm 展青霉素的产毒含量见图4。

图4 常温0.5~6.0 cm 展青霉素的产毒含量
由图4 可知,当病斑为0.5 cm 时开始产毒,含量为0.512 4 μg/kg,距离病斑1,2,3 cm 处均不产毒;病斑为1 cm 时产毒,病斑本身毒素含量较大为2.919 9 μg/kg,但距离病斑1 cm 处毒素含量较小为0.059 9 μg/kg,距离病斑2,3 cm均不产毒;病斑2 cm产毒量为6.802 0 μg/kg,距离病斑1,2 cm 处毒素含量分别为0.198 9,0.023 8 μg/kg,距离病斑3 cm处不产毒;当病斑达到3 cm 后除病斑本身产毒外,距离病斑1,2,3 cm 处均产毒,当病斑6 cm 时产毒量高达16.590 2 μg/kg,并且距离病斑1,2,3 cm处毒素含量分别为0.695 6,0.491 3,0.326 1 μg/kg。
(2)低温条件毒素变化。损伤接种展青霉后置于低温(4 ℃)下,待其发病后分别取病斑及距离病斑1,2,3 cm 处果实组织测定PAT 产毒含量。
低温0.5~6.0 cm 展青霉素的产毒含量见图5。
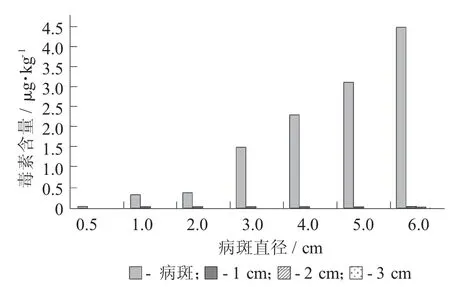
图5 低温0.5~6.0 cm 展青霉素的产毒含量
由图5 可知,当病斑为0.5 cm 和1.0 cm 时只有病斑本身产毒,分别为0.029 6,0.315 412 μg/kg,距离病斑1,2,3 cm 处均不产毒;当病斑为2,3,4,5 cm 时,不仅病斑本身产毒,产毒量分别为0.371 2,1.503 1,2.307 7,3.109 5 μg/kg,距离病斑1 cm 处也产毒,但毒素含量较低;病斑6 cm 时,病斑本身产毒量高达4.464 034 μg/kg,并且距离病斑1,2,3 cm处均产毒,毒素含量分别为0.036 95,0.016 855,0.014 805 μg/kg。
(3)展青霉素。结果发现,扩展青霉产生展青霉素的最适温度为20~25 ℃,且随着培养时间的延长,产毒量呈现增加的单峰性变化趋势;同时高湿条件有利于展青霉素的产生[10]。此外,有研究表明不同环境pH 值对扩展青霉菌体生物量和展青霉素产量的影响。结果表明,酸性环境比碱性环境更利于展青霉素合成,pH 值4~5 是展青霉素合成的最适pH值[11]。刘华峰等人[12]在富士、小国光、黄香蕉苹果中均检测到展青霉素的存在,且随着霉心病病斑直径的增大,展青霉素含量在增加。
3 结论
采用超高效液相色谱-质谱技术(UPLC-MS/MS)和超高效液相色谱(HPLC),测定苹果样品中6 种真菌毒素(Alternaria toxin;PAT)的含量。方法的加标回收率为90%~105%,RSD 为1.0%~5.0%,能满足苹果样品中真菌毒素痕量分析的要求。
果蔬的腐烂、霉变主要是由真菌毒素引起的,常见的真菌毒素以交链孢毒素(Alternaria toxin,AT)、展青霉素(Patlin,PAT)[15]为主,尤其针对深加工产品中的剔除腐烂部分后继续使用果蔬的剩余组织。研究结果表明,交链孢毒素(Alternaria toxin,AT)在常温和低温均可产生毒素,其中TEA 产毒量的最大值33.056 9 mg/kg;AME 产毒量最大为120.636 4 μg/kg,ALT 和AOH 毒素含量分别为26.579 47,41.161 6 μg/kg;TEA 与其他毒素产生协同作用后产生较大的毒素,TEA 在整个过程均产毒,使得与其他毒素的协同作用几率会大大提高,因此随膳食摄入的链格孢毒素对公众健康存在潜在风险[16-20]。展青霉素(Patlin,PAT)不仅腐烂组织本身会产生毒素外,距离病斑较近的未腐烂的果实组织也含有一定量的毒素,随着腐烂面积的增大未腐烂果实中的毒素含量也在增加。研究结果表明,产毒量最高达16.590 2 μg/kg,较国家的规定相对安全,但PAT 具有急性毒性[16],对动物的肺、脑、肝脏、脾脏、肾的损害和免疫系统的毒害作用[17];具有慢性毒性,表现在对动物的细胞毒性、基因毒性和免疫毒性[18]。
