急性间歇性卟啉病伴可逆性后部脑病综合征MRI表现
2024-02-26伊泽茜许敬博曹一民李晓童卜静英周立霞
伊泽茜,许敬博,曹一民,李晓童,卜静英,周立霞
(河北医科大学第二医院医学影像科,河北 石家庄 050000)
急性间歇性卟啉病(acute intermittent porphyria, AIP)为罕见常染色体显性遗传病,为羟甲基胆素合酶(recombinant hydroxymethylbilane synthase, HMBS)基因突变导致卟胆原脱氨酶( porphobilinogen deaminase, PBGD)活性缺乏所致。PBGD失活致前体物质如胆色素原(porphobilinogen, PBG)和5-氨基乙酰丙酸(5-aminolevulinic acid, 5-ALA)体内蓄积,其毒性可影响多个系统[1];累及神经系统时,可出现中枢神经、周围神经和自主神经病变。AIP可伴发可逆性后部脑病综合征(posterior reversible encephalopathy syndrome, PRES)[2]。本研究结合文献观察AIP伴PRES MRI表现。
1 资料与方法
1.1 研究对象
1.1.1 病例1,女,20岁,间断腹痛、腹胀10个月,加重伴呕吐、乏力2个月;其母为卟啉病患者。入院血压165/110 mmHg,查体:血糖1.9 mmol/L。实验室检查:钠135.5 mmol/L,钾2.59 mmol/L,镁0.33 mmol/L;pH 6.8,PCO213.6 mmHg;尿卟胆原定性试验(+),尿卟啉定性试验(+)。基因检测:与AIP相关性较高的1个HMBS基因发生变异。
1.1.2 病例2,男,16岁,间断腹痛4个月,加重伴间歇性癫痫3天。入院血压160/109 mmHg,查体:反应稍迟钝,颈抵抗。实验室检查:钠121.0 mmol/L,钾2.82 mmol/L,氯55.0 mmol/L,二氧化碳16.2 mmol/L,钙1.54 mmol/L;尿卟胆原定性试验(+),尿卟啉定性试验(+)。脑电图:脑电图广泛明显异常,脑地形图广泛明显异常。
2例临床均诊断为AIP,予限制入液量等对症治疗;住院期间病例1在安静状态下突发癫痫2次、间断出现低血糖和低钠血症,病例2未再出现腹痛、癫痫等。本研究经医院伦理委员会批准(2024-P001),检查前患者及家属均知情同意。
1.2 仪器与方法 于癫痫发作期采用GE Signa EXCTTE 3.0T HD MR仪、头部线圈采集颅脑MRI,包括T1WI、T2WI、液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR)序列成像、弥散加权成像(diffusion weighted image, DWI)、MR血管成像(MR angiography, MRA)及增强T1WI(病例2接受增强扫描),并于治疗后复查。由具有6年及20年工作经验的影像科医师各1名共同观察病变MRI表现,包括病变范围、信号及强化程度等。
2 结果
2例癫痫发作期间颅脑MRI均证实存在伴发PRES。
病例1癫痫发作期颅脑MRI显示轻度脑萎缩,双侧大脑半球皮层下白质多发T1WI低、T2WI及FLAIR高信号,以额顶叶为著,部分累及皮层(图1A、1B);MRA显示大脑前和中动脉主干较细伴分支减少,大脑前、中、后动脉见散在局限性狭窄(图1C、1D)。治疗2周后复查颅脑MRI见双侧大脑半球病变范围较前明显缩小,FLAIR信号较前明显减低(图1E、1F)。
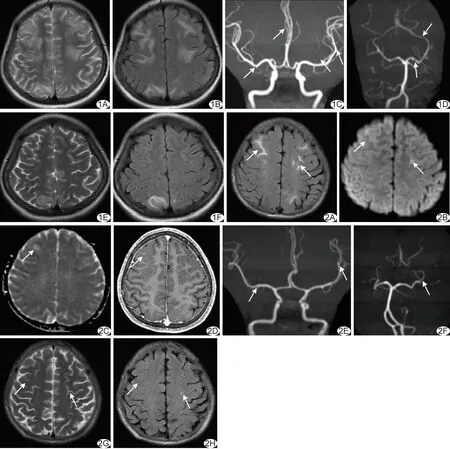
图1 病例1,女,20岁,AIP伴PRES A、B.癫痫发作期颅脑轴位MR T2WI(A)及FLAIR图(B); C、D.颅脑MRA原始图像(箭示狭窄); E、F.治疗2周后复查颅脑轴位T2WI(E)及FLAIR图(F) 图2 病例2,男,16岁,AIP伴PRES A.癫痫发作期颅脑轴位MR FLAIR图(箭示病变); B、C.颅脑轴位DWI(B)及ADC图(C)(箭示病变); D.颅脑增强T1WI; E、F.颅脑MRA图(箭示狭窄); G、H.治疗1周后复查颅脑轴位T2WI(G)及FLAIR图(H)(箭示病变)
病例2癫痫发作期颅脑MRI显示轻度脑萎缩,双侧大脑半球皮层下白质多发病变,呈T1WI低、T2WI及FLAIR高信号(图2A)、DWI等或稍高、表观弥散系数(apparent diffusion coefficient, ADC)图高信号(图2B、2C),边界模糊,增强T1WI见右侧额叶皮层下病变内斑片状轻度强化、其余病变无强化(图2D);MRA显示双侧大脑前及中动脉主干较细,双侧大脑前动脉A2段近端和双侧大脑中、后动脉远端局限性轻度狭窄(图2E、2F),呈枯树枝样(考虑血管痉挛)。治疗1周后复查颅脑MRI见幕上脑实质部分病变消失或缩小(图2G、2H)。
3 讨论
AIP多于20~40岁发病,女性多于男性,诱因包括月经、妊娠、应激、酒精及药物等。10% AIP可累及中枢神经系统,多见于20岁左右女性,发生时间与病程无明显相关,可伴自主神经和周围神经受累[3-4]。对AIP伴PRES的病理生理机制尚不清楚,可能PRES发作破坏血脑屏障,而5-ALA对大脑有毒性作用[5]。AIP累及中枢神经系统临床表现包括癫痫发作、晕厥、意识障碍及行为改变等。
PRES典型病理改变为血管源性水肿,MR T1WI呈等或低信号,T2WI和FLAIR图呈高信号,DWI呈等或稍高信号,ADC图呈高信号。随病情进展,PRES可并发细胞毒性水肿,表现为DWI高信号及ADC图低信号[6]。
AIP伴PRES典型影像学表现包括双侧大脑多发、对称可逆性血管源性水肿,最常累及顶叶、枕叶、额叶皮质及皮质下白质,其他如小脑、胼胝体压部、桥脑和中脑等亦可受累[2];病变呈斑片状T1WI低、T2WI及T2-FLAIR高信号,部分病变可相互融合;AIP所致脑水肿多为血管源性,DWI多呈等或低信号、ADC图呈高信号[4],可与细胞毒性脑水肿相鉴别[2];增强后病变无强化或轻度强化,推测与血管长时间收缩出现缺血性坏死,导致血脑屏障受损[7]有关。本组病例2治疗后复查MRI显示病变强化较前基本消失,提示血脑屏障受损所致影像学表现可逆,或缓解期血脑屏障可自行修复。
AIP急性发作期患者可出现脑血管痉挛、收缩等异常表现。AIP伴PRES典型颅脑MRA及数字减影血管造影异常表现包括可逆性的局灶性或弥漫性血管收缩或颅内远端动脉血管分支减少;本组2例MRA均见类似改变。此外,本组2例均属青年,而MRI均见轻度脑萎缩,推测5-ALA及PBG具有神经毒性作用,可损伤脑血管,且PRES发作导致脑血管收缩、神经细胞损伤。虽治疗后症状消失,但反复发作可致部分神经元或胶质细胞损伤难以逆转,有待进一步观察。
综上,AIP伴PRES MRI表现具有一定特征性,有待后续进一步观察。
利益冲突:全体作者声明无利益冲突。
作者贡献:伊泽茜查阅文献、撰写文章;许敬博图像分析;李晓童图像处理;曹一民和卜静英修改文章;周立霞指导、审阅文章。
