超声矢量血流成像联合奇异值分解滤波检测肝脏深部微血管内血流速度
2024-02-26叶华容雷炳松胡海曼
叶华容,田 怡,2,王 琦,余 靖,雷炳松,胡海曼,张 舸*
(1.武汉科技大学附属华润武钢总医院超声医学科,湖北 武汉 430080;2.武汉科技大学医学院,湖北 武汉 430065;3.湖北工业大学电气与电子工程学院,湖北 武汉 430068)
肝脏疾病的发生、发展与微循环障碍密切相关,且微循环障碍可早于病理及血清等相关指标变化而存在。血流速度是反映微循环功能的重要参数,可为早期诊断肝脏疾病提供重要依据。CDFI是临床最常用的检测血流技术,但用于检测微血管存在成像角度依赖等局限性[1]。矢量血流成像(vector flow imaging, VFI)是基于平面波的快速超声成像技术,无角度依赖性,且可直观显示ROI内的血流速度及方向[2],但其信噪比(signal-to-noise ratio, SNR)及检测红细胞的敏感度均随成像深度增加而下降,常致低估深部血管流速[3]。奇异值分解(singular value decomposition, SVD)是图像后处理技术,可根据声学反馈的时空特征分离微泡造影信号和组织背景信号;通过将具有图像数据的时空信息放入Casorati矩阵并进行重新组合,可显著提高图像SNR及对比组织比(contrast-to-tissue ratio, CTR),进而有望克服传统VFI的局限性,改善原始图像质量[4]。本研究观察VFI联合SVD滤波对于检测肝脏深部微血管流速的价值。
1 资料与方法
1.1 研究对象 以2021年11月武汉科技大学附属华润武钢总医院1例因疑诊肝血管瘤而拟接受超声检查的32岁男性患者为前瞻性观察对象。本研究获院伦理委员会批准(CRWG2023R002);检查前患者签署知情同意书。
1.2 仪器与方法 采用Mindray Resona R9T超声诊断仪、频率1.2~6.0 MHz的凸阵探头,成像深度10 cm,机械指数0.1,帧频41 Hz。嘱患者仰卧,充分暴露腹部;以二维超声扫查肝脏,观察其内血管走行,选取可显示血管的切面并保持固定;经肘静脉团注2.4 ml声诺维造影剂及5 ml生理盐水,切换至高帧率超声造影(contrast-enhanced ultrasound, CEUS)模式,于注入造影剂后8~30 s采集动脉期图像。
1.3 图像处理 于肝脏CEUS数据集中选取150帧无明显呼吸运动干扰的动脉期图像,采用Matlab R2021b进行SVD滤波处理。分别将未经处理的灰阶声像图、原始CEUS图像及SVD滤波处理后的CEUS图像导入Matlab内置开源软件PIVlab(2.56,MathWorks)进行算法分析,获取经SVD滤波处理前、后肝脏微血管VFI。
1.3.1 SVD滤波处理 选取肝脏CEUS原始数据构建Casorati矩阵并记为S;获取其中的时空信息并对其进行组合,使每帧图像变形成为矩阵S中的一列;最后对S进行分解,过程如公式(1)所示:
S=UΔV*
(1)
其中,U为空间奇异向量矩阵,Δ为奇异值矩阵,V为时间奇异向量矩阵,*为转置矩阵。
设置组织信号阈值T1为3、噪声信号阈值T2为150;舍弃
(2)
(3)
其中,Asignal、Anoise和Atissue分别表示CEUS中的微泡、噪声及残留组织对应的信号值。
1.3.2 VFI 采集经SVD滤波处理后肝脏CEUS数据中的2帧连续图像,在2帧图像对应位置选取大小为32×32像素的参考窗f及目标窗g,其互相关函数为:
Rfg=∬f(x,y)·g(x+Δx,y+Δy)dxdy
(4)
其中,∬为函数积分,f(x,y)、g(x,y)分别为f及g在位置(x,y)处的灰度分布函数,Δx、Δy分别为微泡沿x、y方向的位移。
根据互相关平面上的最高峰值得出微泡在2帧图像间隔时间(Δt,即0.024 s)内的位移;根据公式(5)和(6)获得流场速度矢量信息[5]。具体流程见图1。
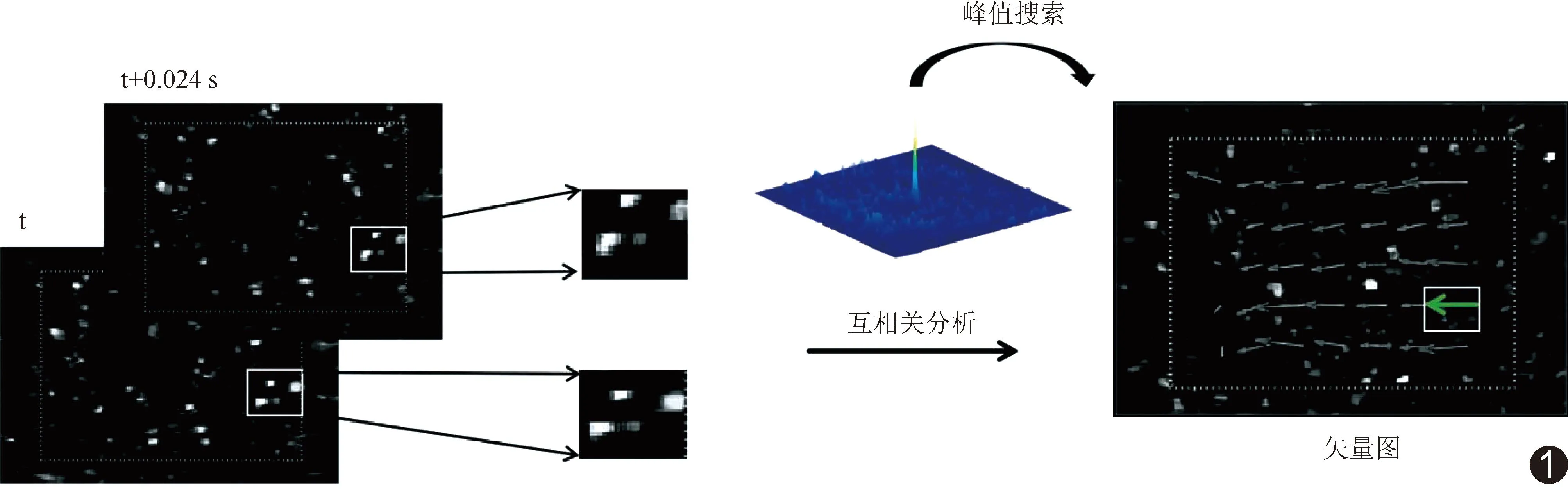
图1 VFI流程图 以互相关算法对连续2帧CEUS图像进行分析,得到矢量VFI;第n帧图像采集时间为t,第n+1帧图像采集时间为t+0.024 s(绿箭示对2帧图像所选取区域进行互相关分析后形成的速度矢量信息)
(5)
(6)
其中,U′、V′分别为微泡沿x、y方向的瞬时速度。
1.4 统计学分析 采用Matlab R2021b统计分析软件。以中位数(上下四分位数)表示计量资料,采用ranksum函数Mann-WhitneyU检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 SVD滤波处理 肝脏灰阶超声、原始CEUS及经SVD滤波处理后CEUS图的SNR分别为7.56、17.65及 22.43 dB,其CTR分别为1.12、7.56及16.34 dB。
原始CEUS和经SVD滤波处理后CEUS图均可见CDFI未能显示的深部微血管。相比原始CEUS图,经SVD滤波处理后的CEUS图在深度为5~10 cm处的背景组织信号降低、微泡信号增强,显示微血管网络更为全面、清晰。见图2。
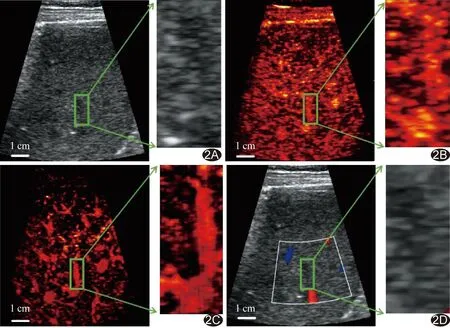
图2 肝脏图像对比 A.灰阶声像图; B.原始CEUS图; C.经SVD滤波处理后CEUS图; D.CDFI [右图为左图中绿框区域(即肝脏ROI)的局部放大图]
2.2 VFI 基于灰阶超声的VFI检出血流均为低速血流,且血流方向为左侧和下方;基于原始CEUS的VFI检出血流多为低速血流、仅少数为高速血流,且其方向各异;基于经SVD滤波处理后CEUS的VFI检出血流多为高速、仅少数为低速血流,且方向均为上方。相同ROI内,基于经SVD滤波处理后CEUS的VFI检出的血流矢量信息明显多于基于灰阶超声及原始CEUS的VFI。见图3。
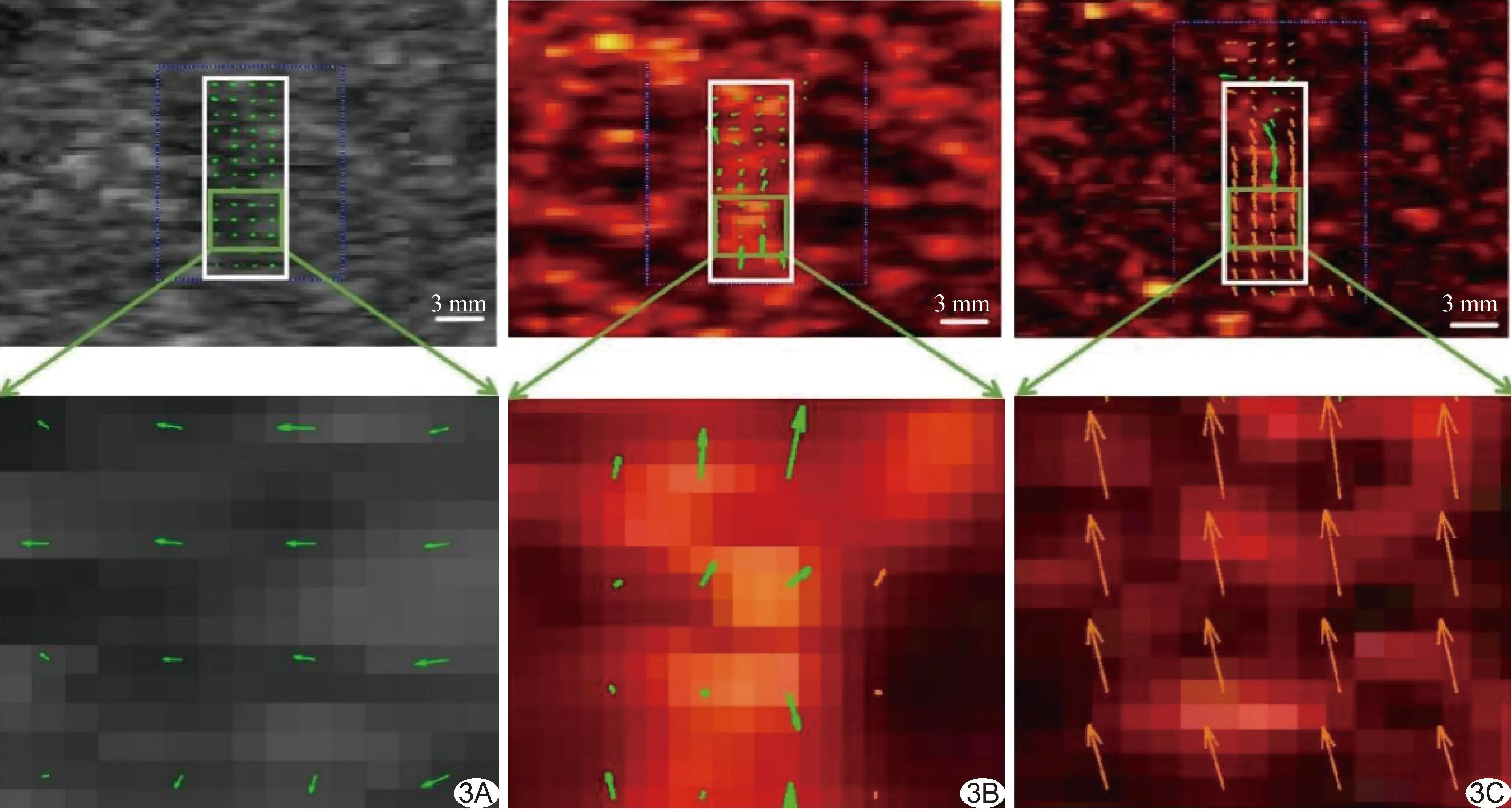
图3 基于不同图像的肝脏VFI A.灰阶超声图; B.原始CEUS图; C.经SVD滤波处理后CEUS (白框区域为肝脏ROI,下图为绿框区域放大图;绿箭为低速血流、红箭为高速血流)
2.3 对比分析 经SVD滤波处理前、后,VFI所测同帧CEUS图相同ROI内肝脏微血管血流速度范围分别为0.37~9.85及1.16~13.79 mm/s,其中位数分别为1.91(0.81,4.11)及6.83(4.25,9.41)mm/s,差异有统计学意义(Z=-10.671,P<0.001)。见图4。
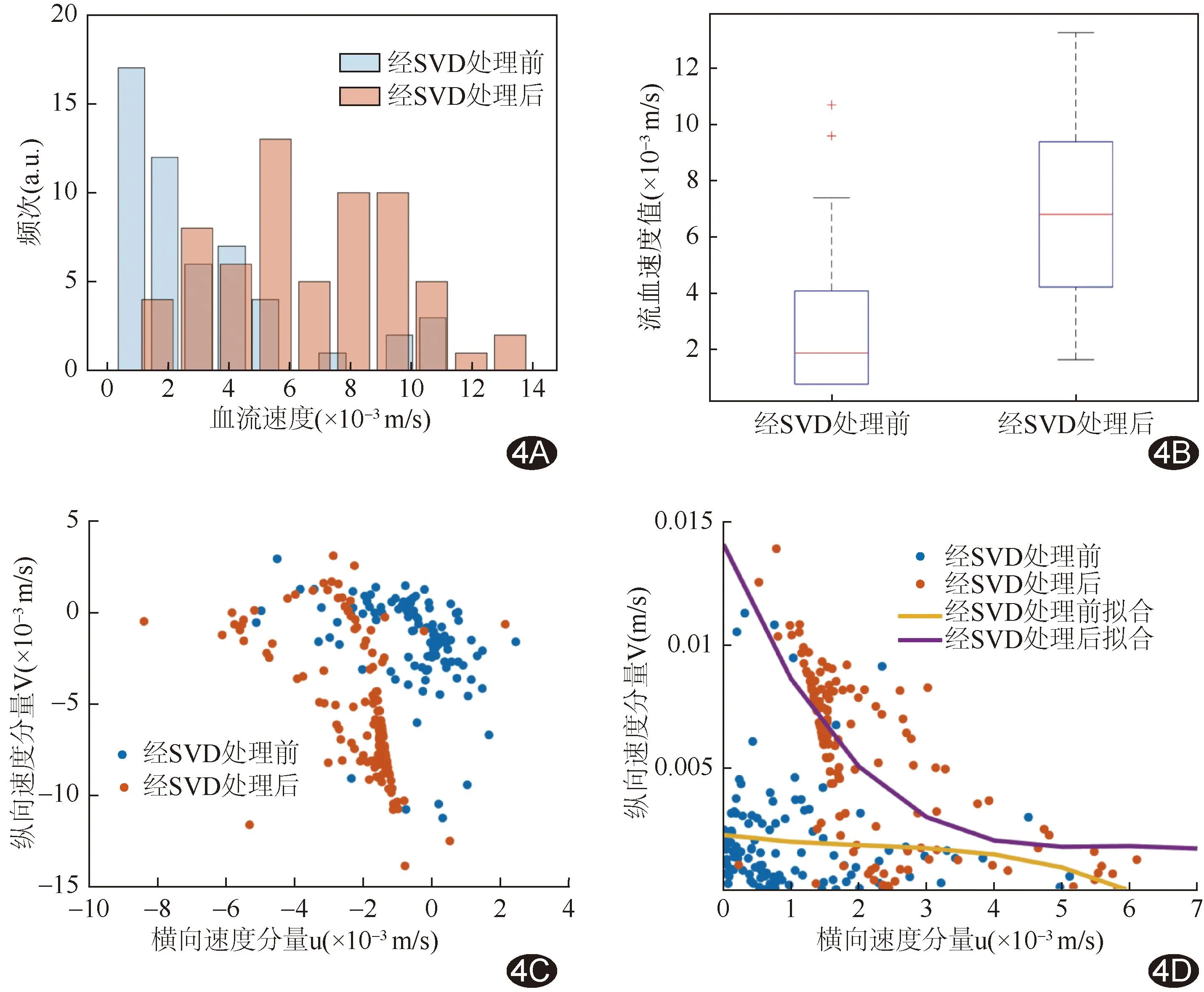
图4 经SVD滤波处理前、后肝脏ROI内微血管血流速度图 A.柱状图; B.箱式图; C.散点图; D.拟合曲线图
3 讨论
VFI有助于检测大血管的血流动力学指标[6-7],但用于检测深部微血管血流速度时存在局限性[3];对声像图进行优化可提高VFI检测精度[8]。本研究采用SVD滤波处理提升原始CEUS图像的SNR及CTR[9],并基于处理后图像进行VFI检测,结果显示此法可有效弥补该技术检测深部微血管流速的不足。
SVD滤波处理可在提高微泡造影检测敏感度的同时抑制背景噪声、改善图像质量。章希睿等[10]发现,不同噪声阈值索引下,SVD滤波处理均能提升CEUS图的SNR及CTR:相比原始CEUS图,二者均值分别提高了3.07及7.43 dB。DEMENÉ等[11]报道,SVD滤波处理可显著提高血流成像技术显示小血管血流信号的敏感度,使其识别精度达毫米级别。MOZUMI等[12]指出,基于经SVD滤波处理后的VFI可显示有限脉冲响应滤波器未能检出的左心室涡流。本研究结果显示,相比原始CEUS图,经SVD滤波处理后CEUS图的SNR及CTR分别提高4.78及8.78 dB,且可显示更丰富的微血管信息;而基于经SVD滤波处理CEUS的VFI所示肝脏微血管流速显著高于基于原始CEUS,且所获血流方向信息更为均一。这主要是当声像图质量较差时,受低SNR及红细胞弱散射的影响,VFI无法完全检出深部微血管血流信号而致低估血流速度;而SVD滤波处理可抑制杂波信号,使微泡回波信号增强,从而有助于获取更准确的微血管血流信息。
综上所述,联合SVD滤波可显著提高VFI检测肝脏深部微血管流速的效能。但本研究仅针对1例患者进行分析,且目前对于VFI测量血流速度尚无明确标准,有待后续进一步观察。
利益冲突:全体作者声明无利益冲突。
作者贡献:叶华容撰写和审阅文章、指导、经费支持;田怡图像分析和处理、数据分析、撰写和修改文章;王琦、雷炳松研究实施、审阅文章;余靖图像分析、修改和审阅文章;胡海曼图像分析和处理;张舸研究设计、指导、图像和数据分析、审阅文章。
