清解化攻方调控NLRP3/TLR4/NF-κB信号通路对重症急性胰腺炎小鼠模型胰腺组织的保护作用
2024-02-26冯敏超秦百君陈国忠唐曦平
冯敏超, 秦百君, 罗 芳, 李 凯, 王 宁, 陈国忠, 唐曦平
1 广西中医药大学第一临床医学院, 南宁 530000
2 广西中医药大学第一附属医院消化内科, 南宁 530023
3 广西医科大学附属肿瘤医院内镜中心, 南宁 530021
急性胰腺炎(acute pancreatitis,AP)是一种与胰腺组织损伤、水肿和坏死有关的炎症性疾病。随着时间的推移,全球AP的发病率不断上升,中国的发病率为27/10万,发达国家则高达每34/10万[1]。AP引发炎症介质和细胞因子的释放,可加剧全身炎症反应和多器官功能障碍,最终导致潜在的致命后果,临床中20%~30%患者进展为重症急性胰腺炎(severe acute pancreatitis,SAP),病死率达30%[2]。目前SAP的临床治疗方式包括补液疗法、抗生素和抑制剂、引流感染及手术干预[3]。然而,最近研究[4]表明,早期积极的液体复苏有较高的液体超负荷概率,预防性抗生素治疗的临床疗效不佳。因此,迫切需要可靠和有效的补充与替代疗法来治疗SAP。中医治疗与SAP类似的疾病有数千年历史,《中国急性胰腺炎诊治指南(2021)》明确指出中医可以有效改善胰腺的病理状态。
清解化攻方在广西中医药大学第一附属医院已被广泛用于治疗SAP,并获得国家发明专利(批号:ZL201811021893.2)。在笔者的临床研究[5-6]中,初步观察到清解化攻方具有较强的抗炎作用,能促进AP患者淀粉酶、脂肪酶的降低,并能减少并发症的发生。在机制研究方面,笔者前期研究[7-9]证明清解化攻方可抑制细胞凋亡和炎症反应,有效地改善胰腺损伤,降低坏死程度,可能是通过Toll样受体(TLR)、TNF-α/NF-κB等经典通路实现。然而,清解化攻方治疗SAP 的详细机制尚不清楚。研究[10]表明,TLR4/NF-κB 信号通路调控多种炎症介质和细胞因子的表达,从而激活NOD 样受体蛋白3(NODlike receptor protein3,NLRP3)途径释放一系列炎症介质再度激活TLR4/NF-κB 信号通路来放大炎症级联反应。因此,本研究采用逆行胰胆管注射牛磺胆酸钠构建了SAP 小鼠模型,以探索清解化攻方调控NLRP3/TLR4/NF-κB信号通路对胰腺组织的保护作用。
1 材料与方法
1.1 实验动物 SPF 级C57BL/6J 雄性小鼠36 只,8 周龄,体质量20~25 g,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004。饲养于广西中医药大学第一附属医院医学分子生物学实验中心实验室,实验动物使用许可证号:SYXK(桂)2019-0001。小鼠在24~26 ℃、12 h 光照昼夜循环的室内环境中,适应性喂养1周后进行实验。
1.2 实验药材 柴胡(批号:17010267),黄芩(批号:16182144),厚朴(批号:16060431),丹参(批号:16060117),大黄(批号:16060431),枳实(批号:16080375),甘草(批号:17010163)。由广西仙竹中药科技有限公司提供,并经广西中医药大学中药鉴定技术中心鉴定为正品。
1.3 药品与试剂 牛磺胆酸钠(美国Sigma公司,批号:S0900000);苏木精和伊红(HE)染色试剂盒(北京索莱宝公司,批号:G1120);通用二步法试剂盒、DAB显色试剂盒(北京中杉金桥公司,批号:PV-9000、ZLI-9018);逆转录试剂盒(北京全式金生物技术股份有限公司,批号:AE301-02);脂肪酶、α-淀粉酶、IL-18 ELISA 试剂盒(美国CUSABIO 公司,批号:CSB-E16930m、CSB-EL001689MO、CSB-E04609m);IL-1β、IL-6 和TNF-α ELISA 试剂盒(武汉三鹰生物技术有限公司,批号:KE10003、KE10007、KE10002);IL-8 ELISA 试剂盒(上海爱必信公司,批号:abs520017);RIPA 裂解液(上海碧云天公司,批号:P0013)。NLRP3 抗体、NF-κB 抗体、TLR4 抗体、IL-1β 抗体、IL-6 抗体、GAPDH 内参(武汉赛维尔公司,批号:GB114320、GB11997、GB11519、GB11113、GB11117、GB11002);注射用乌司他丁(广东天普生化药业公司,批号:032005103)。
1.4 仪器设备 高速离心机、PCR 仪(珠海黑马公司,型号:TGL-16R、GeneAmp PCR System 2400);酶标仪[赛默飞世尔(上海)仪器有限公司,序列号:3530910449];组织切片机(德国Leica 公司,型号:RM2016);电泳仪(北京百晶生物技术有限公司,型号:BG-Power 600i);垂直电泳槽(上海天能科技有限公司,型号:VE180);光学显微镜(日本Olympus公司,型号:BX43)。
1.5 实验方法
1.5.1 清解化攻方的制备 清解化攻方含有7 种中药材,即柴胡12 g,黄芩10 g,厚朴8 g,丹参9 g,大黄6 g,枳实10 g,甘草5 g。按照中医煎药的方法制备清解化攻方:(1)加入600 mL蒸馏水浸泡30 min,大火煮沸后再小火煮沸30 min,滤出药液,保留药渣;(2)加入300 mL 蒸馏水,再次煎煮0.5 h;(3)将两次煎煮的药液混合,过滤后用旋转蒸发仪浓缩,制备1 g/mL的原药溶液(100%浓度)。
1.5.2 动物造模及干预分组 按随机数字表法,小鼠被分为以下6 组:正常组,模型组,清解化攻方低、中、高剂量组和西药组(每组6只)。SAP模型建立方法参考相关文献[11]。根据小鼠和人类体表面积的换算,清解化攻方低、中、高剂量组分别用1、2、4 g/kg的清解化攻方灌胃7 d。西药组小鼠腹腔注射乌司他丁(5×104U/kg)[12]。其余组小鼠用等量生理盐水处理。药物干预后,通过吸入3%的异氟醚对小鼠进行麻醉。在无菌条件下,收集血液,分离并储存在-20 ℃环境中。取出小鼠胰腺组织,用4%多聚甲醛固定或在-80 ℃下冷冻保存。
1.5.3 HE 染色观察胰腺组织病理变化 取小鼠胰腺组织,用4%多聚甲醛固定并包埋在石蜡中,然后制备切片(厚5 μm)。后用二甲苯和无水乙醇脱蜡和水合,根据试剂制造商说明,使用HE 染色。在光学显微镜下观察SAP小鼠胰腺组织的病理变化。
1.5.4 ELISA法检测小鼠血清α-淀粉酶、脂肪酶、IL-1β、IL-6、IL-8、IL-18、TNF-α水平 小鼠眼球取血,血液样本在室温下静置2 h,然后在高速离心机中以3 000 r/min、4 °C下离心15 min。去除血清上层,并根据制造商的说明,使用酶标仪在450 nm处测量α-淀粉酶、脂肪酶、IL-1β、IL-6、IL-8、IL-18、TNF-α的光密度值(OD值),绘制样品标准曲线并换算浓度。
1.5.5 免疫组化检测胰腺组织NLRP3、TLR4、NF-κB蛋白表达 取胰腺组织切片、脱蜡、水化,高压柠檬酸钠溶液100 ℃修复,室温下用10%牛血清白蛋白封闭30 min,加入NLRP3(1∶100)、TLR4(1∶100)、NF-κB(1∶100)一抗孵育4 ℃过夜,二抗孵育20 min,PBS溶液洗涤3次后,用苏木精复染,封片后,在400倍放大率的光学显微镜下观察胰腺组织切片。ImageJ Toolbox 软件对阳性结果进行半定量分析。
1.5.6 RT-qPCR 法检测胰腺组织NLRP3、TLR4、NF-κB mRNA 表达 按照说明书,使用TRIzol 试剂从每组小鼠胰腺组织中提取总RNA。根据操作说明,使用逆转录试剂盒生成cDNA。反应条件如下:95 ℃预变性5 min,95 ℃变性40个循环15 s,60 ℃退火延伸34 s。使用2-ΔΔCt方法计算相对基因表达水平(GAPDH 作为参考基因)。引物由广州德威佳生物科技有限公司合成,详细信息见表1。

表1 引物序列Table 1 Primer sequence
1.5.7 Western Blot 法检测NLRP3、TLR4、NF-κB、IL-1β、IL-6 蛋白表达 RIPA 缓冲液提取小鼠胰腺组织总蛋白,BCA试剂盒检测蛋白浓度,电泳分离蛋白质后,转移到聚偏氟乙烯膜上,用5%的脱脂牛奶溶液封闭1 h,NLRP3、TLR4、NF-κB、IL-1β、IL-6(1∶1 000)一抗孵育(4 ℃过夜),二抗室温孵育1 h,采用ECL 试剂盒对条带进行显影,用AIWBwellTM软件分析条带的灰度值。
1.6 统计学方法 使用SPSS 25.0 和GraphPad Prism 9.0软件进行统计分析。计量资料以±s表示,多组间比较采用方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 清解化攻方对小鼠胰腺组织病理变化的影响HE 染色结果显示,与空白组相比,SAP 模型组胰腺组织结构的弥漫性破坏、胰腺小叶间隔的局灶性扩张、腺泡萎缩和炎症细胞浸润更多。此外,西药组与清解化攻方各剂量组处理的SAP 模型小鼠胰腺组织更紧密、完整,胰腺腺泡细胞排列有序,炎症细胞浸润和水肿较少,胰腺小叶出血灶较少,清解化攻方中剂量组改善情况稍优于其他剂量组(图1)。
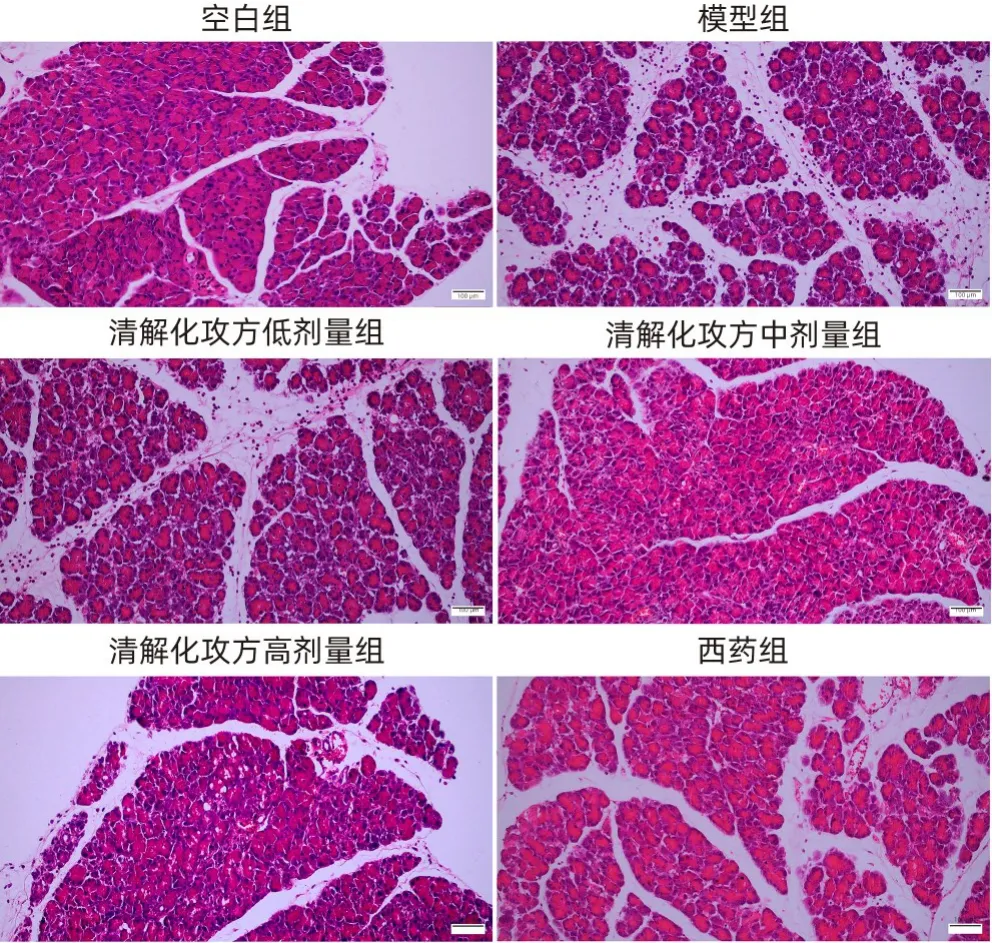
图1 各组小鼠胰腺组织的病理变化(HE染色,×200)Figure 1 Pathological changes of the pancreatic tissue of mice in each group(HE,×200)
2.2 清解化攻方对小鼠血清α-淀粉酶、脂肪酶、IL-1β、IL-6、IL-8、IL-18、TNF-α的影响 各组小鼠血清炎症因子表达水平详见表2。与空白组比较,SAP 模型组α-淀粉酶、脂肪酶、IL-1β、IL-6、IL-8、IL-18、TNF-α 的含量均升高(P值均<0.05);与SAP 模型组比较,清解化攻方各剂量处理组不同程度地降低了α-淀粉酶、脂肪酶、IL-1β、IL-6、IL-8、IL-18、TNF-α 的表达(P值均<0.05),其中清解化攻方中剂量组的抑制效果最显著;西药组的抑制效果与清解化攻方中剂量组相仿。

表2 各组小鼠血清炎症因子表达水平比较Table 2 Expression levels of serum inflammatory factors in different groups of mice
2.3 清解化攻方对小鼠胰腺组织NLRP3、TLR4、NF-κB蛋白表达的影响 经免疫组化染色后,光镜下显示胰腺组织中NLRP3、TLR4、NF-κB蛋白阳性表达为大量棕黄色的颗粒。与空白组相比,SAP 模型组的NLRP3、TLR4、NF-κB蛋白表达更高(P值均<0.05);与SAP模型组相比,清解化攻方和西药治疗组均抑制NLRP3、TLR4、NF-κB蛋白的表达(P值均<0.05),西药组胰腺组织NLRP3蛋白表达水平较清解化攻方中剂量组有降低趋势,但差异无统计学意义(P>0.05),清解化攻方中剂量组对TLR4、NF-κB蛋白表达的抑制作用比西药组稍强(P值均<0.05);在清解化攻方各剂量组中,中剂量组比低、高剂量组降低NLRP3、TLR4、NF-κB 蛋白表达的效果更明显(P值均<0.05)(图2,表3)。
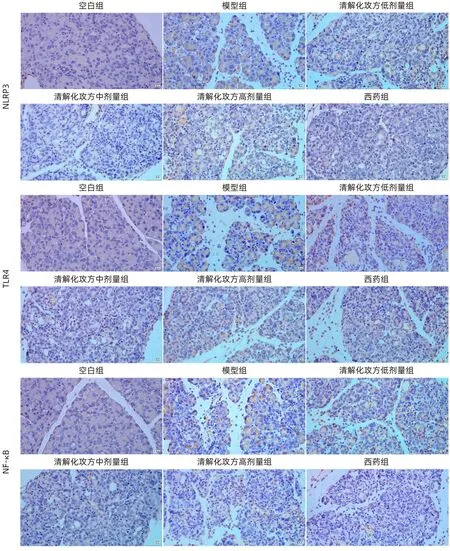
图2 各组小鼠NLRP3、TLR4、NF-κB蛋白表达水平 (免疫组化染色,×400)Figure 2 NLRP3, TLR4, and NF-κB protein expression in each group of mice (immunohistochemistry, ×400)

表3 各组小鼠胰腺组织中NLRP3、TLR4、NF-κB蛋白表达平均光密度Table 3 Average optical density of NLRP3, TLR4, and NF-κB protein expression in the pancreatic tissue of mice in each group
2.4 清解化攻方对小鼠胰腺组织NLRP3、TLR4、NF-κB mRNA的影响 与空白组相比,SAP模型组NLRP3、TLR4、NF-κB mRNA 的表达均明显上调(P值均<0.05);与SAP模型组比较,清解化攻方各剂量组和西药组NLRP3、TLR4、NF-κB mRNA 均有不同程度的降低(P值均<0.05),其中清解化攻方中剂量组与西药组发挥的抑制效果类似(P>0.05);清解化攻方各剂量组对比,低剂量组与高剂量组对NLRP3、NF-κB mRNA 的抑制效果一致,而中剂量组降低NLRP3、TLR4、NF-κB mRNA 表达的效果最明显(P值均<0.05)(表4)。
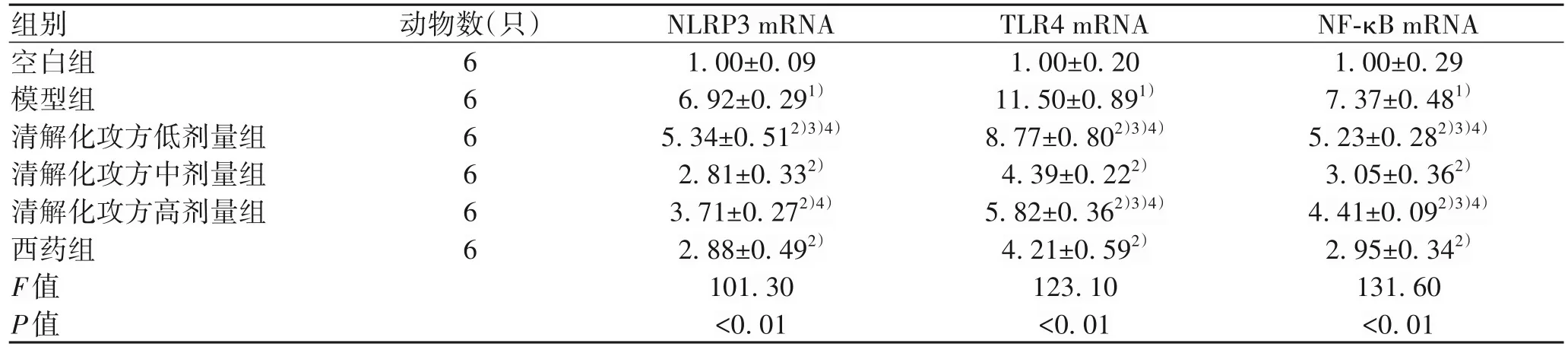
表4 各组小鼠NLRP3、TLR4、NF-κB mRNA表达情况比较Table 4 Expression of NLRP3, TLR4 and NF-κB mRNA in different groups of mice
2.5 清解化攻方对小鼠胰腺组织NLRP3/TLR4/NF-κB信号通路相关蛋白的影响 胰腺组织NLRP3、TLR4、NF-κB、IL-1β、IL-6 在SAP 模型组表达较空白组升高(P值均<0.05);与SAP 模型组比较,清解化攻方各剂量组NLRP3、TLR4、NF-κB、IL-1β、IL-6 表达水平均降低(P值均<0.05);清解化攻方各剂量组对比,低剂量组与高剂量组降低NLRP3、NF-κB蛋白表达的效果相近,而中剂量组降低NLRP3、TLR4、NF-κB、IL-1β、IL-6 表达水平最明显(P值均<0.05);西药组抑制TLR4、NF-κB、IL-1β、IL-6表达的效果与清解化攻方中剂量组一致,两者差异无统计学意义(P值均>0.05);与西药组比较,清解化攻方中剂量组明显降低NLRP3表达(P<0.05)(图3)。
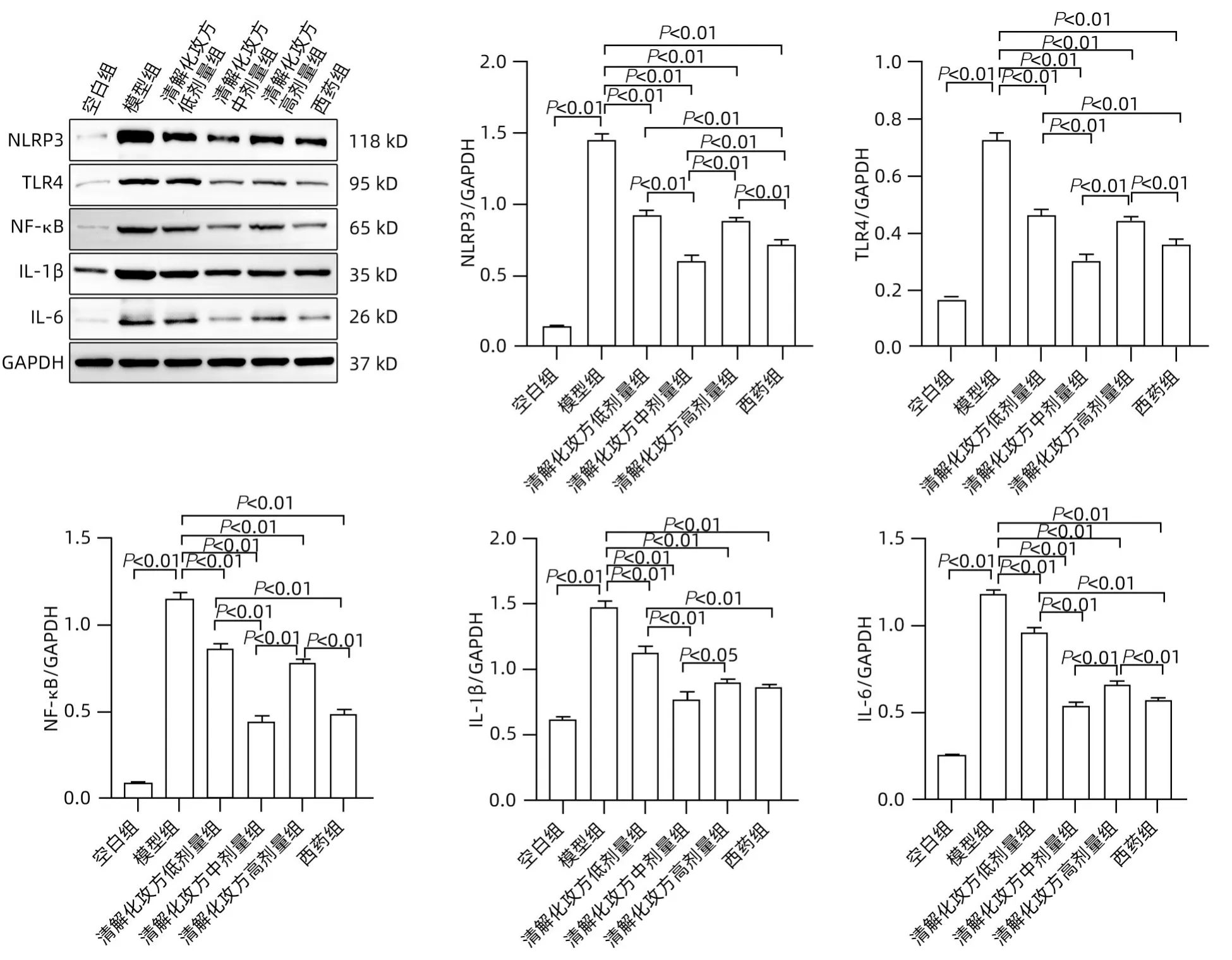
图3 各组小鼠NLRP3/TLR4/NF-κB信号通路相关蛋白的表达Figure 3 Expression of NLRP3/TLR4/NF-κB signaling pathway related proteins in each group of mice
3 讨论
许多研究表明,SAP 发病机制与炎症反应、胰酶自身消化、Ca2+失调、线粒体功能障碍等相关,其中促炎细胞因子,如IL-1β、IL-6 和TNF-α 等的释放程度是影响SAP 病情发展的关键,可触发、扩大和延续SAP 中的炎症反应[13-15]。促炎与抗炎失衡导致大量炎症介质浸润胰腺组织,甚至可能导致患者因多器官功能衰竭而死亡,抑制炎症级联反应可降低死亡率。中医认为SAP 的病机关键为“湿、热、毒、瘀”,并呈动态性变化过程,治以清热解毒,化湿攻下,活血化瘀。清解化攻方是遵从病机、治则在承气汤基础上创立,长期广泛使用且确有疗效的临床协定处方。清解化攻方由柴胡、黄芩、厚朴、丹参、大黄、枳实、甘草组成,方中以大黄、枳实、厚朴互配为小承气汤荡涤肠胃,泻热通腑予邪有出路;配柴胡、黄芩疏通少阳气机,清泄湿热,辅承气汤同解少阳、阳明之邪气蕴结;丹参合大黄,一破一化,精于通畅,推陈致新;柴胡、黄芩、丹参、甘草同用调气活血止痛,气血同调;全方共奏清热解毒,活血化瘀,攻下存阴之功效。据现代研究[16]表明,清解化攻方具有抗炎,改善肠黏膜屏障损伤,降低胰腺及胰周感染率等作用。
在本研究中,逆行胰胆管注射牛磺胆酸钠构建了SAP小鼠模型,模型组小鼠胰腺组织病理结构明显发生变化,血清α-淀粉酶、脂肪酶、IL-1β、IL-6、IL-8、IL-18、TNF-α处于高表达水平。在清解化攻方处理后明显减轻炎性介质释放入血并抑制了炎症级联反应,有效改善了胰腺组织损伤。这些结果表明清解化攻方具有保护胰腺组织和抗炎的作用,与前期研究结果一致。据报道[17-18],NLRP3作为NOD 样受体家族成员,在SAP 促炎与抗炎平衡过程中起关键媒介,抑制NLRP3的激活,能降低小鼠胰腺组织中性粒细胞浸润,可能是SAP 的潜在治疗靶点。TLR4/NF-κB的激活先前被证明是诱导NLRP3表达的传统起始信号之一,但最近研究[19]表明NLRP3 炎症小体激活释放IL-1β、IL-6、IL-18等细胞因子可导致TLR4/NF-κB 信号通路再度激活,促进炎症因子瀑布式的释放或诱发细胞炎性程序性死亡-细胞焦亡。研究[20]表明,TLR4广泛分布在胰腺组织中,与炎症造成胰腺组织损伤有关,TLR4通过外部信号的级联扩增来介导NF-κB激活。NF-κB是一种促炎转录因子,活化的NF-κB从细胞质进入细胞核,并启动促炎基因的转录和表达,如TNF-α、IL-6,激活或放大炎症反应[21]。在本研究中,模型组小鼠胰腺组织的NLRP3/TLR4/NFκB处于激活状态,说明SAP的发生可能与NLRP3/TLR4/NF-κB 的激活有关,而清解化攻方治疗组与之相反,可一定程度降低NLRP3、TLR4、NF-κB、IL-1β、IL-6的表达,减轻炎症反应,尤以清解化攻方中剂量组效果最明显,故后续实验可采用此剂量作为中药治疗组的干预剂量。此外,在一定的剂量范围内,清解化攻方各剂量组治疗SAP 的效应尚未出现明显的线性量效关系,未来将深化清解化攻方量效关系的研究,更好服务于临床应用。
综上所述,SAP 可能与NLRP3/TLR4/NF-κB 炎症信号通路的激活有关,清解化攻方能改善SAP 小鼠胰腺组织损伤,抑制炎症介质的释放,防止炎症级联反应增强,其机制可能是通过抑制NLRP3/TLR4/NF-κB 信号通路发挥作用,本实验为清解化攻方在炎症级联反应方面提供了重要的实验基础。令人遗憾的是,本实验没有涉及NLRP3/TLR4/NF-κB 与细胞焦亡的相互作用,此外,亦没有探索与SAP 相关的肺损伤,有待开展进一步相关研究。
伦理学声明:本研究方案于2022 年1 月23 日经由广西中医药大学实验动物福利伦理委员会审批,批号:DW20220310-020,符合实验室动物管理与使用准则。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:冯敏超、罗芳负责设计论文框架,起草论文;秦百君、王宁负责实验操作和研究过程的实施;李凯负责数据收集,统计学分析,绘制图表;唐曦平负责论文修改;陈国忠负责拟定写作思路,指导撰写文章并最后定稿。
