猪去氧胆酸对脂肪变性肝细胞活性的影响及其机制
2024-02-26汪远远刘朝霞阳学风
汪远远, 邹 艳, 刘朝霞, 阳学风
1 南华大学附属南华医院 a. 消化内科, b. 手足外科, 湖南 衡阳 421002
2 湖南省代谢相关脂肪性肝病临床研究中心, 湖南 衡阳 421002
目前,代谢相关脂肪性肝病(metabolism-associated fatty liver disease,MAFLD)已成为我国慢性肝病的第一大原因,患病率高达30%,且预计仍会进一步升高[1]。MAFLD 与代谢性疾病发病密切相关,如肥胖、高血压、2型糖尿病以及心血管疾病等[2]。
脂质代谢异常是MAFLD 的关键问题之一[3],肝脏的脂肪酸大多来自脂肪中甘油三酯分解,通过血液循环至肝脏吸收[4]。胆汁酸由胆固醇代谢产生,可以通过激活肝脏内的法尼醇X 受体(farnesoid X receptor,FXR),调节脂肪酸合成、氧化和运输等过程,从而影响脂肪代谢[5]。笔者预实验通过质谱分析发现猪去氧胆酸(hyodeoxycholic acid,HDCA)在MAFLD 患者的血液和粪便样本中含量明显高于健康人,但HDCA 在MAFLD 发病中的作用及机制尚不清楚。本课题组采用棕榈酸(palmitic acid, PA)诱导L02 细胞构建脂肪变性肝细胞模型,分析HDCA 对脂肪变性肝细胞活性的影响;并构建FXR 低表达肝细胞株,研究HDCA 是否通过FXRPI3K/AKT 途径对脂肪变性肝细胞的活性发挥作用,从而探讨HDCA 在MAFLD 发生发展中的作用及其机制,为MAFLD的预防和治疗提供新途径。
1 材料与方法
1.1 细胞培养 L02 细胞(HL7702)购自上海佰晔生物科技公司。DMEM 高糖完全培养基包含10%胎牛血清(FBS)和1%青链霉素混合液(×100),L02 细胞接种于25 cm2底面积的培养瓶中,置于37 ℃、5% CO2的细胞培养箱内培养。0.2 mmol/L的PA诱导L02细胞脂肪变性。
1.2 PA 的配置 取25.642 mg PA 加入至1 mL 无水乙醇中水浴加热,配得浓度为100 mmol/L 的PA 溶液①。另取50 mg 无脂肪酸牛血清白蛋白(BSA)加入至10 mL 1640 培养基中并混匀,配得BSA 浓度为0.5%。PA 溶液①取0.2 mL 加入至9.7 mL 的BSA 与1640 培养基的混合液中,配得浓度为2 mmol/L 的PA 溶液②。然后将PA溶液②置于55 ℃水浴锅中水浴30 min。细菌滤过器过滤除菌两次。过滤后的PA 溶液②与完全培养基按照体积比1∶9 混合稀释10 倍配置成0.2 mmol/L 的PA 混合液。剩余的PA 溶液②按照每次实验预估用量分装,-20 ℃冰箱储存。
1.3 HDCA 的配置 20 mg 的HDCA 溶于100 μL 的二甲基亚砜(DMSO),震荡混匀直至完全溶解,配置成浓度5×106μmol/L 的HDCA 溶液①。HDCA 溶液①取8 μL,加入992 μL 含10% FBS 的DMEM 高糖完全培养基,配置成浓度为4 000 μmol/L 的HDCA 溶液②。HDCA 溶液②与完全培养基按照体积比1∶9 稀释10 倍配置成浓度400 μmol/L 的HDCA 溶液③。100、200、300 μmol/L 的HDCA 溶液从HDCA 溶液③逐步稀释。400 μmol/L 的HDCA 溶液中DMSO 的含量为0.08%,低于DMSO 对细胞安全界限0.1%,故本实验不设立DMSO 对照组。剩余的HDCA 溶液③,标记时间和药品名称,密封放入-20 ℃冰箱冻存,避免反复冻融。
1.4 细胞活性测定 用CCK8 试剂测定细胞活性,每100 μL DMEM 完全培养基加入10 μL CCK8 试剂混匀。吸弃原液,每孔加入100 μL 的混合液,将96 孔板置于37 ℃细胞培养箱中孵育0.5~2 h,酶标仪测量450/620 nm处的光密度(OD)值。细胞活性计算公式如下:细胞活性(%)=[OD(加药组)-OD(空白组)]/[OD(正常组)-OD空白组)]×100%。
1.5 实时荧光定量PCR (qRT-PCR) 将L02 细胞接种于6 孔板,PA 诱导24 h 后,HDCA 处理24 h。通过qRTPCR 检测L02 细胞中FXR、增殖细胞核抗原(PCNA)、周期蛋白D1(Cyclin D1)、磷脂酰肌醇-3-激酶(PI3K)和蛋白激酶B(AKT)的mRNA 表达。引物(表1)大部分源于Primer Bank[6],部分引物参考的编码序列设计来源于NCBI 基因(存在多个转录本时,可对各转录本的保守区域进行引物设计),并以GAPDH 作为内参基因。所有引物均在Primer-Blast 中验证了其特异性。合成由长沙鼎国生物科技有限公司完成。

表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
1.6 Western Blot 处理后的L02脂肪变性肝细胞用含有蛋白酶抑制剂复合物的冷RIPA 缓冲液裂解。收集上清液,12 000×g离心15 min,使用BCA 检测试剂盒测定总蛋白浓度。主要使用的抗体包括FXR(1∶1 500)、PCNA(1∶2 000)、Cyclin D1(1∶2 000)、PI3K(1∶2 000)、p-PI3K(1∶1 500)、AKT(1∶2 000)、p-AKT(1∶1 500)和GAPDH(1∶2 000)。条带采用Image J软件进行密度分析。
1.7 FXR siRNA FXR siRNA 依据其基因序列(序列来源参考NCBI GeneBank数据库[7])在广州市锐博生物科技有限公司设计并合成3条特异性干扰链。细胞密度达到50%,进行转染。配置混合转染试剂:5 μL Lipofectamine 3000 转染试剂+5 μL FXR siRNA 混匀,室温静置30 min。混合的转染试剂加入L02 细胞,转染时间24~48 h。弃去原有的培养液,PBS 洗涤并更换新的不含双抗的培养基。提取6 孔板细胞的总RNA,qRT-PCR 方法检测3 条FXR siRNA 干扰链作用下,FXR mRNA 的表达情况并分析表达差异。选择FXR mRNA 降低最明显的一条作为实验干扰组。
1.8 统计学方法 所有实验数据均使用仙桃学术进行统计分析。计量资料以±s表示,服从正态分布且方差齐时多组间比较采用单因素方差分析,进一步两两比较采用Tukey HSD 检验;服从正态分布但方差不齐时采用Welch 方差分析,进一步两两比较采用Games-Howell 检验。两组间比较采用成组t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 脂肪变性肝细胞模型的构建及PA 对肝细胞活性的影响 采用甘油三酯含量测定和油红O 染色方法观察肝细胞脂肪变性模型是否构建成功。结果显示油红O染色后,显微镜下观察到L02 细胞组细胞质中没有大的红色脂滴,在细胞膜上存在小而均匀的红色脂滴;PA 诱导的L02 细胞组中细胞质内存在明显的大而深红色的脂滴(图1);与0 h 比较,L02 细胞在PA 诱导后不同时间段甘油三酯水平有不同程度的升高(图2),表明模型构建稳定,将构建成功的脂肪变性肝细胞定义为M 组进行后续研究。CCK8 实验检测显示,PA 诱导L02 细胞24 h后细胞活性明显下降(1.000±0.084 vs 0.668±0.022,t=-18.663,P<0.001)。

图1 油红O染色结果(×20)Figure 1 Results of the oil red O staining

图2 PA诱导L02细胞后甘油三酯水平随时间的变化Figure 2 Changes in triglyceride levels over time after PA induction in L02 cells
2.2 HDCA 对正常肝细胞及脂肪变性肝细胞活性的影响 为了研究HDCA 对脂肪变性肝细胞的影响,将不同浓度的HDCA 加入L02 细胞和脂肪变性肝细胞。CCK8实验检测结果显示,与L02细胞组相比,L02+100 μmol/L HDCA 组和L02+200 μmol/L HDCA 组中L02 细胞活性没有改变,L02+300 μmol/L HDCA 组和L02+400 μmol/L HDCA 组中L02 细胞活性明显下降(P值均<0.001)(图3a)。与M 组相比,M+100 μmol/L HDCA 组和M+200 μmol/L HDCA 组细胞活性无明显改变,M+300 μmol/L HDCA 组和M+400 μmol/L HDCA 组细胞活性均显著降低(P值均<0.001)(图3b)。以上实验证明300 μmol/L的HDCA抑制了L02细胞和脂肪变性肝细胞活性。为了观察随着300 μmol/L HDCA 处理时间的延长,脂肪变性肝细胞的活性是否发生改变,通过CCK8检测结果显示,M+300 μmol/L HDCA 组细胞活性随时间的变化而发生改变(P值均<0.001)(图3c)。后续实验HDCA浓度均采用300 μmol/L。

注:a,不同浓度HDCA对L02细胞活性的影响;b,不同浓度HDCA对PA诱导的脂肪变性肝细胞活性的影响;c,HDCA(300 μmol/L)不同时间对PA诱导的脂肪变性肝细胞活性的影响。
2.3 HDCA 对脂肪变性肝细胞FXR-PI3K/AKT 通路关键分子及PCNA 和Cyclin D1 表达的影响 为了进一步研究HDCA(300 μmol/L)抑制脂肪变性肝细胞活性的机制,通过Western Blot 检测发现,M+HDCA 组中FXR 蛋白的表达高于M 组(t=4.492,P<0.05)(图4)。qRT-PCR 检测M 组和M+HDCA 组的FXR、PCNA、Cyclin D1 以及PI3K/AKT 通路关键分子mRNA 的表达变化,结果显示,相比于M 组,M+HDCA 组中FXR mRNA 表达升高,PCNA、Cyclin D1、PI3K 和AKT mRNA 表达均明显下降(P值均<0.05)(表2)。

图4 HDCA对脂肪变性肝细胞FXR表达的影响Figure 4 Effect of HDCA on the expression of FXR in steatotic hepatocytes

表2 HDCA对脂肪变性肝细胞FXR、PI3K、AKT、PCNA和Cyclin D1 mRNA表达的影响Table 2 Effect of HDCA on the mRNA expression of FXR,PI3K, AKT, PCNA, and Cyclin D1 in steatotic hepatocytes
2.4 FXR低表达肝细胞株的构建及HDCA对脂肪变性肝细胞FXR mRNA表达的影响 为了验证HDCA(300 μmol/L)是否通过FXR 抑制脂肪变性肝细胞活性,选择干扰FXR受体,在3 条FXR siRNA(FXR siRNA 1、2、3)中筛选出干扰效果最强的干扰链。结果如图5a 所示,相比于M 组,M+FXR siRNA 3的干扰效果最好(P<0.01)。qRT-PCR检测FXR siRNA 3 干扰链对HDCA 刺激脂肪变性肝细胞FXR mRNA表达的干扰效果,结果显示,相比于M+HDCA组,M+FXR siRNA 3+HDCA 组的FXR mRNA 表达水平明显降低(P<0.05)(图5b)。
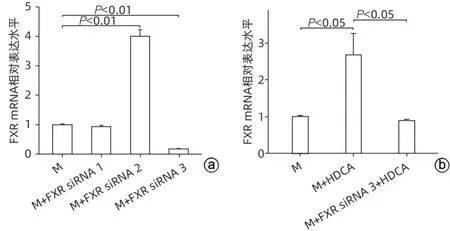
图5 FXR siRNA干扰效果及HDCA对脂肪变性肝细胞FXR表达的影响Figure 5 Effect of FXR siRNA interference and the effect of HDCA on FXR expression in lipid-denatured hepatocytes
2.5 低表达FXR 脂肪变性肝细胞中FXR-PI3K/AKT 通路关键分子及PCNA 和Cyclin D1 蛋白表达的变化 应用Western Blot 检测FXR、PCNA、Cyclin D1、PI3K、p-PI3K、AKT 和p-AKT 的蛋白表达水平。结果显示,相比于M+HDCA 组,M+FXR siRNA 3+HDCA 组中FXR 蛋白表达下降,PCNA、PI3K、p-PI3K、AKT 和p-AKT 蛋白表达增加,差异均有统计学意义(P值均<0.05)(图6)。

图6 抑制FXR表达后脂肪变性肝细胞FXR-PI3K/AKT通路关键分子及PCNA和Cyclin D1蛋白表达的变化Figure 6 Changes in the expression of key molecules of FXRPI3K/AKT pathway and PCNA and Cyclin D1 proteins in steatosis hepatocytes after inhibition of FXR expression
3 讨论
MAFLD 发展包括单纯脂肪肝(以往称非酒精性脂肪肝)、脂肪性肝炎(以往称非酒精性脂肪性肝炎)、脂肪性肝纤维化、肝硬化及肝癌等阶段[8]。MAFLD 一旦进入脂肪性肝炎阶段,肝细胞脂毒性损伤以及炎症因子的大量浸润,会加快肝纤维化、肝硬化和肝癌的进展速度[9-10],因此脂肪性肝炎阶段早期防治尤为重要。
胆汁酸是由肝脏合成的双性分子。在肝细胞胞质和微粒体中,胆固醇通过经典和替代两种途径生成初级胆汁酸[11]。初级胆汁酸分泌进入肠道后,在肠内细菌的作用下,转化为次级胆汁酸。HDCA是一种次级胆汁酸,存在于猪、鼠和人的胆汁中,在猪和鼠的胆汁中含量较高[12],其对动物机体的脂质代谢有着重要的调控作用[13]。Sehayek 等[14]发现在野生型C57BL/6 小鼠中,饲喂HDCA可以减少饮食中胆固醇从肠道吸收,对治疗小鼠血浆胆固醇升高和动脉粥样硬化有较好的效果。Shih等[15]研究显示,饲粮中添加1.25%的HDCA 可通过改善高密度脂蛋白功能来抑制低密度脂蛋白受体基因敲除小鼠动脉粥样硬化的形成。目前,HDCA 对MAFLD 发生发展的影响未见文献报道。本研究发现浓度低于200 μmol/L 的HDCA 对正常肝细胞及脂肪变性肝细胞活性无明显影响,300 μmol/L 及以上浓度的HDCA 处理的L02 肝细胞和L02 脂肪变性肝细胞活性明显下降,同时PCNA、Cyclin D1 的mRNA 表达降低,表明较高浓度的HDCA 对脂肪变性肝细胞增殖活性具有抑制作用。
FXR 由Forman 等[16]于1995 年在大鼠中发现。FXR是胆汁酸代谢的重要受体,通过调节胆汁酸在肝脏和肠道的合成、结合、摄取和转运以维持胆汁酸的动态平衡。疏水性胆汁酸鹅去氧胆酸对FXR的激活作用最强[17],其次是脱氧胆酸和石胆酸,而亲水性胆汁酸熊去氧胆酸是最弱的FXR激动剂[18]。GW4064、奥贝胆酸和Fexaramine等人工合成的FXR激动剂对FXR的激活作用更强[19-20]。牛磺-β-鼠胆酸和甘氨熊脱氧胆酸是FXR的拮抗剂[21-22]。本研究发现300 μmol/L 的HDCA 处理24 h 后,脂肪变性肝细胞FXR 蛋白表达明显增加,提示HDCA 对FXR 具有激活作用,能够上调肝细胞FXR的表达。
FXR 在各种代谢过程中发挥调节作用,包括脂肪代谢、胆汁酸平衡、葡萄糖平衡和细胞活性[23]。在肝脏中,FXR 通过激活FXR 信号通路,促进脂肪酸的β 氧化和胆汁酸的合成,减少脂肪酸的合成和蓄积,改善肝脂肪代谢异常[24-25]。FXR 还与肝细胞的生长、凋亡以及炎症等生物学过程密切相关[26-27]。此外,FXR 通过调节肠道菌群的组成和代谢产物的生成,参与肥胖、糖尿病等代谢性疾病的发生和发展[28-29]。FXR 发挥各种代谢调节作用与PI3K/AKT信号通路有关。Xu等[30]研究发现激活FXR活性,能够抑制PI3K/AKT信号通路的活化,降低脂肪分解,增加脂肪生成,进而增加鱼体内的脂质积累。本研究结果显示,干扰FXR 表达后,脂肪变性肝细胞PI3K/AKT 信号通路关键分子,如PI3K、p-PI3K、AKT 和p-AKT 的蛋白表达明显增加,提示FXR对PI3K/AKT信号通路关键分子表达具有抑制作用;同时还发现,干扰脂肪变性肝细胞FXR表达后,反映细胞增殖活性的PCNA蛋白表达增加,提示FXR对脂肪变性肝细胞增殖具有抑制作用。以上结果表明HDCA通过上调FXR表达抑制PI3K/AKT信号通路,从而造成脂肪变性肝细胞活性下降。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:汪远远负责实验设计和实施,撰写论文;邹艳负责数据收集与分析;刘朝霞负责图表制作;阳学风指导撰写文章并最后定稿。
