荷叶山楂杜仲叶复配提取物对大鼠脂质代谢的协同调控作用
2024-02-26任思敏徐维佳陈昭闻王详侯欢葛建
任思敏,徐维佳,陈昭闻,王详,侯欢,葛建*
(1.中国计量大学生命科学学院,浙江杭州 310018;2.浙江山屿海康养产业发展有限公司,浙江杭州 310011)
脂质代谢紊乱是当今社会一类普遍发生的机体脂质代谢综合征,是动脉粥样硬化、脂肪肝等疾病最主要病因[1]。目前,临床上主要以化学药物干预为主[2],但效果并不理想而且具有一定的毒副作用[3]。因此,从日常膳食角度进行干预是调控机体脂质代谢紊乱的重要途径。目前有大量研究表明植物源提取物对脂质代谢紊乱具有显著调控功能[4-7],其主要功能成分包括黄酮[8]、类黄酮[9]、皂苷[10]以及生物碱类[11-12],研究主要采用单一组分或单一植物提取物进行研究。而单一植物往往功能有限,很难达到理想效果,张月月等[13]研究结果表明雷公藤甲素配伍槲皮素对肺癌和食管癌细胞均有抗癌增效作用,并均呈现出良好的量效关系。因此通过多个药食同源类成分复配来实现功能上的协同作用成为近年来关注的热点,也与当今“全食品”[14-15]和“复配食品”[16-17]理念一致。
荷叶(Nelumbinisfolium)、山楂(CrataeguspinnatifidaBunge)和杜仲叶(EucommiaulmoidesOliv)都属我国重要的药食同源类新食品资源[18]。荷叶味苦、性平,归肝、脾、胃、心经,具有清暑化湿、升发清阳、凉血止血等功效,荷叶中含丰富的黄酮和生物碱类化合物,其中荷叶碱是荷叶中富含的一种异喹啉类生物碱,不仅是荷叶中的指征成分,也是产生药理作用的重要成分,荷叶碱通过激活肝脏PGC1α,引起PPARα上升,下游脂肪酸氧化基因上调表达,促进氧化代谢,改善脂质分布,起到降脂作用[19-20]。山楂味酸、甘,性微温,归肝、脾、胃经,具有消食健胃、行气散瘀、化浊降脂功效,含有大量有机酸和黄酮化合物等,山楂及山楂黄酮可能通过增强低密度脂蛋白受体活性和提高抗氧化能力预防脂质代谢紊乱[21]。杜仲叶性温、味甘,归肝、肾经,作为一种新资源食品具有调控高血压、高血脂和高血糖等功能,其中杜仲叶总黄酮通过调节血脂参数,降低总胆固醇、甘油三酯、载体脂蛋白B 和低密度脂蛋白胆固醇的水平,并显著提高高密度脂蛋白胆固醇和载脂蛋白A 的含量,从而发挥降脂作用[22]。因此,综合荷叶、山楂和杜仲叶的食品性味归经优势,研究其复配物协同调控脂质代谢功能及其机理,为荷叶、山楂和杜仲叶等药食同源类功能食品功效机制以及新产品开发提供参考。
1 材料与方法
1.1 材料与试剂
荷叶、山楂、杜仲叶:市售,经中国计量大学现代科技学院孙骏威副教授鉴定,为药食同源类荷叶、山楂和杜仲叶。乙醇(95%,分析纯)、石蜡、二甲苯(98.5%,分析纯)、苏木精染液(99%)、伊红染液(5%):杭州米克化工仪器有限公司;甘油三酯(triglyceride,TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒:南京建成生物工程有限公司;TRIzol®Plus RNA Purification 试剂盒、SuperScript™III First-Strand Synthesis SuperMix 试剂盒:美国Thermo Fisher 公司;雄性Wistar 大鼠[(200±20)g]:上海斯莱克实验动物有限责任公司,许可证编号为SCXK(沪)2017-0005。
1.2 仪器与设备
SpectraMax M5 多功能酶标仪:美国Molecular Devices 公司;HWS-24 恒温水浴锅:上海常思工贸有限公司;DTH-2050R 离心机:上海德洋意邦仪器有限公司;OLYMPUS BX60 型荧光显微镜摄像机:日本OLYMPUS 公司;Leica HI120 型摊片机、TP1020 全自组织脱水机:德国Leica 公司;CFX384 多重实时荧光定量PCR 仪:美国Bio-Rad 公司;MV-10 全自动超临界萃取仪/Waters XevoG2-XSQTof 高分辨液质联用系统:美国Waters 公司;Eclipse Ci-E/L/S 光学显微镜:日本Nikon公司。
1.3 方法
1.3.1 复配提取物制备及化学成分表征
准确称取一定质量的荷叶、杜仲叶和山楂(去核),粉碎后过60 目筛,然后称取单一粉末各100 g 加入超临界萃取仪的萃取罐中,同时加入100 mL 乙醇溶液(体积分数70%)作为夹带剂,在室温条件下浸泡过夜,萃取压力控制在25~30 MPa,萃取剂二氧化碳流速保持10 L/h,分离釜I 和II 温度分别控制在70 ℃和75 ℃,萃取压力均为6.0 MPa。将萃取物浓缩成50 g 生药/mL的复配提取液。取25 mL 复配提取液蒸干,残渣加25 mL 甲醇溶解,离心(12 000 r/min,10 min)取上清液,过0.22 μm 滤膜,即得供试品溶液。
1.3.2 色谱与质谱条件
色谱条件:采用Waters XevoG2-XSQTof 高分辨液质联用系统,色谱柱为ODS C18 HSS T3 系列(1.8 μm,100 mm×2.1 mm);保护柱为XBridge C18(1.8 μm,20 mm×2.1 mm);流动相A 为水(含0.1% 甲酸)、流动相B 为甲醇;流速0.3 mL/min ;进样体积5 μL,梯度洗脱条件见表1。

表1 荷叶山楂杜仲叶复配提取物色谱梯度洗脱条件Table 1 Chromatographic gradient elution conditions for the compound extracts of lotus leaf,hawthorn,and Eucommia ulmoides leaf
质谱条件:采用电喷雾离子源,正、负离子模式检测;扫描范围m/z100~900 Da;毛细管电压2 kV;碎裂电压130 V;碰撞电压30 V;脱溶剂温度320 ℃;脱溶剂气体流速600 L/h。数据工作站为Waters MassLynxV4.1。
1.3.3 动物实验
首先将实验大鼠于实验动物中心无特定病原体(specific pathogen free,SPF)动物房中适应性饲养7 d,实验室相对湿度(60±5)%,白天/夜晚设置为12 h/12 h。实验方案由中国计量大学实验动物伦理委员会批准(2022-005)。适应性养殖后,将36 只大鼠随机分为6 组,每组6 只,分别为空白对照组、高脂模型组、荷叶组、山楂组、杜仲叶组以及复配干预组,空白对照组和高脂模型组大鼠分别饲喂正常饲料和高脂饲料,每天定期口灌生理盐水,干预组为饲喂高脂饲料,每天定期口灌提取物,单一提取物剂量均为100 g 生药/kg,复配提取物剂量为16 g 荷叶+80 g 山楂+4 g 杜仲叶生药/kg。大鼠正常饲料营养指标如表2所示,高脂饲料配方为10% 猪油、10% 蛋黄粉、2% 胆固醇、0.1% 胆酸盐、6%酪蛋白、1.2%预混料、3%麦芽糊精,其余基础日粮。

表2 大鼠正常饲料配方Table 2 Normal diet of rats
1.3.3.1 血清生化检测
不同处理组大鼠于8 周后,眼静脉丛采血,离心(4 ℃,3 500 r/min,15 min)分离血清。根据试剂盒说明书,检测不同处理组大鼠血清中TG、TC、LDL-C 和HDL-C 浓度变化。
1.3.3.2 肝脏病理组织学检查
切除大鼠肝脏左侧叶部分,于10%福尔马林溶液中固定,于自动脱水机内脱水后,进行透明和浸蜡及石蜡包埋,然后石蜡切片机切片,制备厚度3~4 μm 切片,烘箱烘干后用于苏木精-伊红染色法(hematoxylineosin staining,HE)染色。染色前对切片进行二甲苯脱蜡、梯度乙醇脱水,苏木精和伊红染色,中性树胶封片,于普通光学显微镜下观察细胞结构变化。
1.3.3.3 脂质代谢相关基因表达
采用TRIzol®Plus RNA Purification 试剂盒和SuperScript™III First-Strand Synthesis SuperMix 试剂盒对不同处理组大鼠肝脏和小肠组织分别进行总RNA 提取以及第一链cDNA 合成,具体步骤参照试剂盒说明书。实验选取GAPDH为内参基因,采用Primer Premier 6.0 软件设计引物,由生工生物工程(上海)股份有限公司负责合成,引物见表3。后采用PowerUpTMSYBRTM Green Master Mix 进行荧光定量PCR(quantitative real-time PCR,qPCR),反应体系:Power SYBR®Green Master Mix 10 μL,上下游引物各0.2 μL,cDNA 模板1.0 μL,补充ddH2O 至20 μL。反应条件为95 ℃预变性1 min;95 ℃变性10 s,60 ℃退火延伸25 s,进行40 个循环。采用2-ΔΔCt法计算不同组织中基因的相对表达量。

表3 大鼠肝脏和小肠组织相关基因引物序列Table 3 Primer sequences of related genes in rat liver and small intestine
1.4 数据统计
所有检测数据均用平均值±标准差表示,差异性分析采用SPSS18.0 软件进行统计分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 复配提取物化学成分分析
在拟定的检测条件下,取供试品溶液进样分析,正负离子模式下的总提取离子流图见图1。
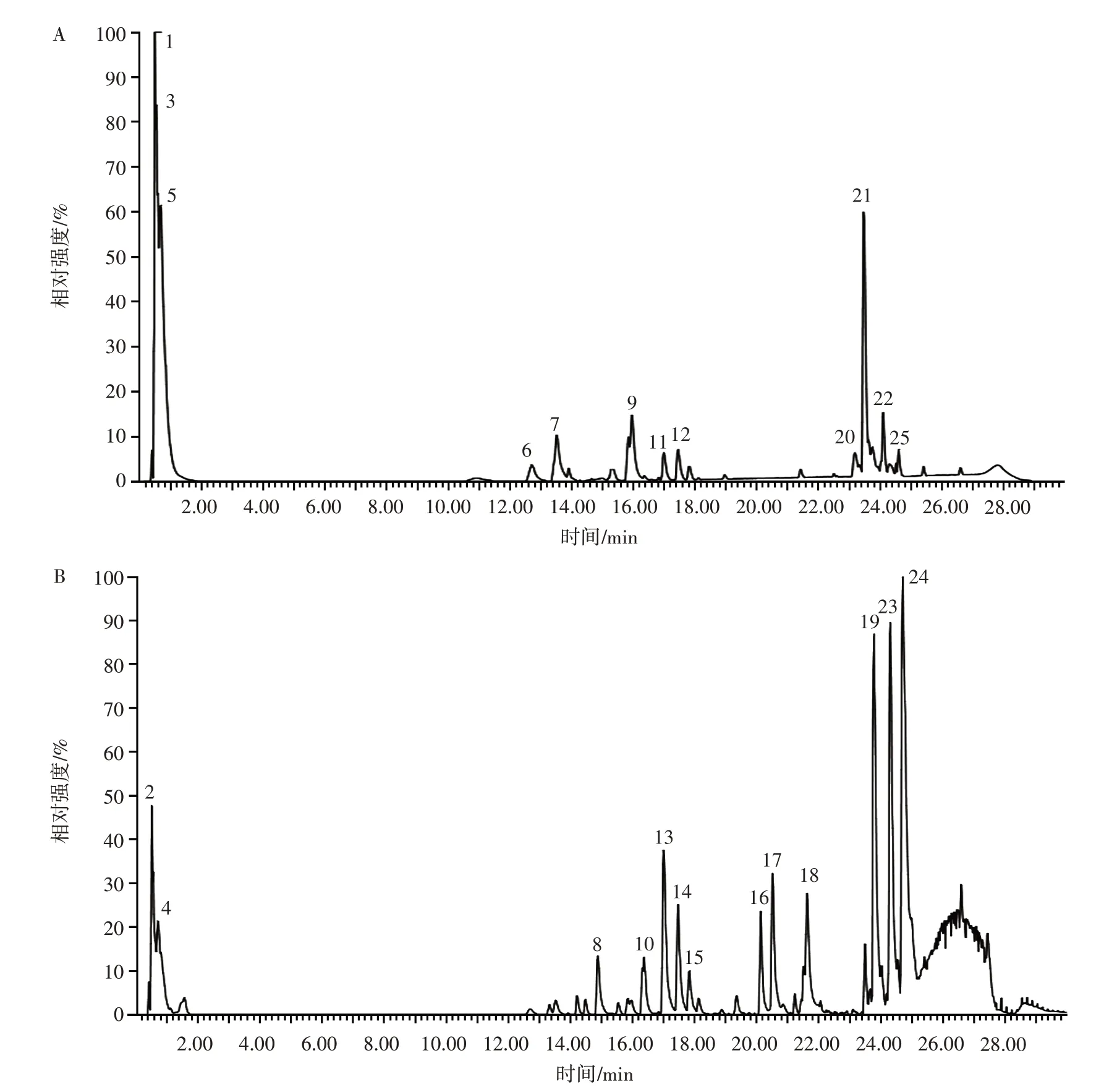
图1 复配提取物负离子模式和正离子模式下的总离子流图Fig.1 Total ion chromatograms of the compound extracts in negative and positive ion modes
通过Waters MassLynxV4.1 软件分析一级质谱提供的化学成分的保留时间、精确准分子离子峰和碎片离子峰等信息并利用Elemental Composition 工具计算化合物元素组成和可能分子式,对各色谱峰进行初步鉴定,再结合数据库及文献数据、裂解规律等信息进行比对,进一步确认化学成分及结构,具体见表4。

表4 复配提取物的化合物鉴定Table 4 Compounds in the compound extracts
2.2 复配提取物对大鼠体质量的影响
不同处理组大鼠体质量变化结果见图2。

图2 不同处理组大鼠体质量变化Fig.2 Changes in body mass of rats in different treatment groups
由图2 可知,不同处理组大鼠干预8 周后,与空白对照组相比,高脂模型组大鼠体质量极显著升高(P<0.01),而与高脂模型组相比,单一提取物组和复配干预组大鼠体质量均极显著下降(P<0.01),与单一提取物组相比,复配干预组大鼠体质量也有所下降,但差异不明显。说明与高脂模型组相比,复配提取物能够明显降低大鼠体质量。
2.3 复配提取物对大鼠血脂水平的影响
复配提取物对脂质代谢基因表达的影响如图3所示。
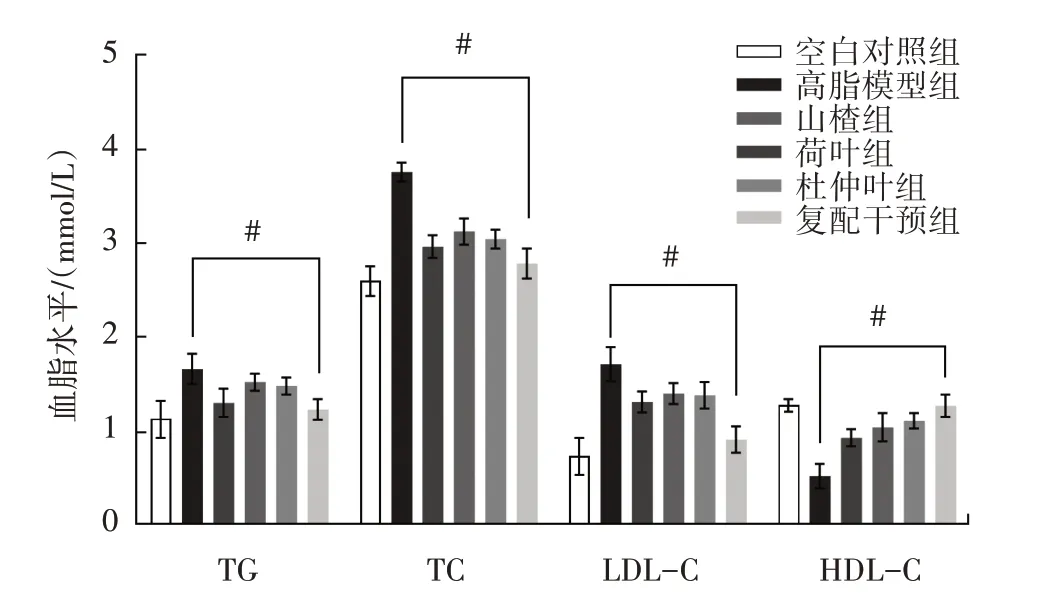
图3 不同处理组大鼠血脂水平变化Fig.3 Changes in serum lipid levels in rats of different treatment groups
由图3 可知,不同处理组大鼠血脂水平与高脂模型组相比存在显著差异,与空白对照组相比,高脂模型组大鼠血脂TG、TC 和LDL-C 浓度升高,而HDL-C 浓度降低。给予不同单一提取物和复配提取物干预8 周后,与高脂模型组大鼠相比,复配干预组大鼠血脂TG、TC 和LDL-C 浓度均显著降低(P<0.05),同时HDL-C浓度显著提高(P<0.05),说明复配提取物均能够显著改善大鼠血脂TG、TC、LDL-C 和HDL-C 水平。
2.4 复配提取物对大鼠肝脏脂肪的影响
不同处理组大鼠肝脏HE 染色结果见图4。

图4 不同处理组大鼠肝脏HE 染色结果(100×)Fig.4 HE staining results of rat livers in different treatment groups(100×)
由图4 可知,高脂模型组大鼠肝脏脂肪空泡明显多于空白对照组和荷叶组、山楂组、杜仲叶组以及复配干预组,且高脂模型组部分细胞内存在气球样变、肝细胞变大,肝细胞核质收缩变形,肝小叶结构被破坏。与高脂模型组相比,复配干预组肝组织中脂滴空泡显著减少,而与单一提取物组相比,复配干预组大鼠肝脏组织中细胞结构更为清晰,而且细胞核界限更明显,同时细胞质与细胞核结构更完整,表明复配提取物较单一提取物具有更明显的调节脂质代谢作用。
2.5 复配提取物对脂质代谢基因表达的影响
复配提取物对脂质代谢基因表达的影响结果见图5。
本实验选取了肝脏和小肠中5 个脂质代谢关键基因,图5 结果显示与空白对照组组相比,高脂模型组肝脏中CYP7A1和PPARα显著下降,HMGCR表达水平显著升高;小肠中NPC1L1表达显著升高,而ABCG5表达显著降低。与高脂模型组相比,复配干预组大鼠肝脏中CYP7A1和PPARα均显著升高,HMGCR表达水平显著降低;小肠中NPC1L1表达显著降低,而ABCG5表达显著升高。结果显示复配提取物可通过上调PPARα/CYP7A1基因表达,同时在小肠层面降低NPC1L1和升高ABCG5表达,达到降低血脂的作用。
3 讨论
荷叶和山楂近年来一直作为药食同源类新食品资源在功能食品领域广泛应用。荷叶中主要活性成分为荷叶生物碱和黄酮类,研究表明生物碱类为主要降脂减肥功效成分,荷叶生物碱为有机弱碱类阿朴菲生物碱,水溶性极差(溶解度为16 mg/L)[23],从而使得荷叶生物碱在胃肠道分散性较差,生物利用度较低。山楂性味酸,其主要含有有机酸类和黄酮类成分。因此,荷叶与山楂等酸性食品复配使用,能够显著达到协同增效的功能,这与本研究结果一致。
杜仲叶作为新食品资源已被收入药食同源类新食品资源目录,具有补肝肾、强筋骨功效,有研究显示杜仲叶提取物能显著降低高脂饮食诱导肥胖小鼠血脂水平,改善肝脏脂肪变性,对非酒精性脂肪肝有明显防治作用[24]。同时,荷叶、山楂和杜仲叶都归肝经,均具有降脂功效,从食物性味归经和功能活性角度,均显示荷叶、山楂和杜仲叶复配能够显著调控脂质代谢紊乱。因此,本文以荷叶、山楂、杜仲叶及其复配提取物为主要研究对象,深入探究荷叶、山楂、杜仲叶单一及其复配物的调节脂质代谢功能,为药食同源类植物复配机制研究提供借鉴。
CYP7A1为肝细胞内胆固醇向胆汁酸合成的限速酶,高脂饮食能够显著抑制酶表达,而提取物通过明显诱导该酶表达水平,从胆固醇排泄途径加速了消除,从而达到降低胆固醇功能[25]。PPARα为肝细胞内一种重要转录因子,本研究发现提取物显著诱导PPAR-α基因表达,从而进一步调控脂质代谢基因表达,这与文献相关报道一致[26-27]。NPC1L1和ABCG5分别为小肠黏膜细胞中胆固醇摄取和外排的重要蛋白[28]。因此本研究结果表明,荷叶、山楂、杜仲叶单一提取物以及复配提取物均能调控脂质代谢,其中复配提取物具有更显著调控高脂所致血脂水平能力,保护肝脏脂肪变性,且其调节机制与脂质代谢相关基因HMGCR、CYP7A1、PPARα、NPC1L1和ABCG5表达水平改变有关。
近年来,大量研究表明肠道菌群可通过影响参与脂质代谢相关基因调节宿主的物质与和能量代谢。已有研究表明若肠道微生物稳态失衡,将导致肥胖症、糖尿病、脂肪肝等代谢性疾病的发生与发展[29]。宋晶晶[30]的研究表明枸杞甘草配制酒能够影响免疫低下的小鼠肠道菌群,提高有益菌的数量,抑制致病菌的生长繁殖。然而本实验虽明确了荷叶、山楂和杜仲叶复配提取物具有协同增效作用,后续可从肠道菌群角度进行进行机制探究。
4 结论
本研究以与单一植物提取物相比,探究荷叶、山楂、杜仲叶复配提取物协同血脂调节作用。采用超临界萃取技术得到荷叶、山楂、杜仲叶以及复配提取物,对高脂饲养的Wistar 大鼠进行灌胃,并进行肝脏形态学观察和脂质代谢基因表达水平检测。结果表明,荷叶、山楂和杜仲叶提取物均能够显著调控肝脏和小肠中脂质代谢相关基因表达,其调节机制通过上调PPARα/CYP7A1基因表达,同时在小肠层面降低NPC1L1和升高ABCG5,进而调节脂质代谢。同时与单一提取物相比,复配提取物又显著增强了脂质代谢调控功能。综上所述,将荷叶、山楂和杜仲叶复配提取后,可进一步增强调节脂质代谢,且具有协同增效特点。
