米糠球蛋白的糖基化改性及其与两种多酚的非共价作用
2024-02-26孙靖宇张风姣唐彩云郑霄刘金光曲亚男陈义伦刘玉茜
孙靖宇,张风姣,唐彩云,郑霄,刘金光,曲亚男,陈义伦,刘玉茜
(山东农业大学食品科学与工程学院,山东泰安 271018)
米糠是稻谷经过砻谷、碾磨等工序后所得的副产物,含有丰富的谷维素、植物甾醇、维生素E 和角鲨烯等生物活性物质,对预防心血管疾病、调节血糖、控制肥胖、预防肿瘤、抗疲劳等均有显著的效果[1]。然而大部分米糠被用作饲料及焚烧处理,造成了资源浪费。米糠中蛋白质含量丰富,与其他谷物蛋白相比,米糠蛋白的营养价值更高,其生物效价为2.0~2.5,与牛奶中酪蛋白相近,优于小麦蛋白、玉米蛋白和大豆蛋白等植物蛋白[2]。米糠蛋白主要由球蛋白、清蛋白、谷蛋白及醇溶蛋白组成,且米糠球蛋白为生理活性蛋白,由单链组成,氨基酸组成更加合理[3],但米糠球蛋白作为米糠蛋白中的盐溶性成分,水溶性较差,限制了其在食品工业中的应用。研究表明,蛋白质糖基化可以改善蛋白的功能性质,且美拉德反应是一种典型的常用的非酶糖基化方法,其原理为蛋白质、肽或氨基酸侧链上的游离氨基与还原糖分子末端的羰基缩合发生反应,形成席夫碱并重排为Amadori 或Heyns 产物,通过增加蛋白质表面羟基数量,改变了蛋白质构象及组分,改善了蛋白稳定性、溶解性等功能性质[4-6],并且美拉德反应温和有效,常被用于蛋白质糖基化改性当中。通过美拉德反应进行糖基化改性有干热法和湿热法两种。与湿热法相比,干热法反应条件较为温和,温度适度可控,且糖基化产物颜色较浅,因此在蛋白的糖基化修饰中应用较为广泛[7]。壳寡糖作为壳聚糖的降解产物,具有分子量低、黏度小、水溶性好等特点,有抗菌、抗氧化、抗炎、免疫调节等多种功能特性,且比壳聚糖更易发生美拉德反应[8]。许多研究发现壳寡糖通过美拉德反应接枝到蛋白上改善了蛋白质的溶解度、热稳定性和乳化性能[9]。因此,壳寡糖因其无毒、可生物降解等特点,在通过美拉德反应修饰蛋白方面的应用越来越受到人们的关注。
研究表明,植物多酚可以与蛋白质相互作用,从而改变蛋白质的结构及构象,如儿茶素与大豆分离蛋白相互作用后,分子无序性增加,二级结构中α-螺旋和β-折叠相对含量下降,β-转角和无规卷曲相对含量增加[10]。绿原酸能与重组大豆种子铁蛋白(rH-2)发生相互作用,引起铁蛋白三级/四级结构的变化,而对其一级/二级结构无影响[11]。蛋白与多酚相互作用也能改善蛋白质的功能特性。阿魏酸与亚麻籽分离蛋白相互作用后,改善其热稳定性及抗氧化活性[12]。因此蛋白质和多酚广泛运用于食品加工中,并且它们之间的相互作用是影响蛋白质稳定性和多酚抗氧化活性主要因素。在相互作用过程中,共价结合和非共价结合是相互作用的两种主要机制,且非共价相互作用因反应条件温和在食品体系中更为常见,主要包括疏水相互作用、范德华力、氢键和静电吸引力等[10]。通过美拉德反应进行糖基化或与多酚非共价结合是改善蛋白质性质的有效方法。之前的研究报道了更多关于二元和三元复合物对蛋白质修饰的研究,而对同时与两种多酚非共价结合的研究较少,且同时利用糖基化和与两种多酚非共价结合对蛋白进行修饰的应用也鲜有研究。因此,本研究使用壳寡糖通过干法美拉德反应对米糠球蛋白进行糖基化修饰,并研究糖基化蛋白与两种多酚(槲皮素、白藜芦醇)的非共价作用,通过荧光光谱、红外、粒径和抗氧化性等进行表征和分析,以期为糖基化蛋白-多酚复合物的制备及扩大米糠蛋白在食品的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
脱脂米糠:江西清河油脂有限公司;壳寡糖(chitosan oligosaccharide,COS):陕西凤栖梧生物科技有限公司;槲皮素(quercetin,QR)、白藜芦醇(resveratrol,RES)、胃蛋白酶(350 NFU/mg)、胰蛋白酶(250 NFU/mg):上海阿拉丁生化科技股份有限公司;蛋白电泳分子量Marker、甘氨酸(glycine,Gly)、福林酚、溴酚蓝(bromophenol blue,BPB)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、考马斯亮蓝R-250:北京索莱宝生物科技有限公司;1-苯胺基萘-8-磺酸(1-aminonaphthalene-8-sulfonic acid,1,8-ANS):赛默飞世尔生物制品有限公司;2,2-二苯基-1-基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH):东京化成工业株式会社;所用试剂均为分析纯。
1.2 仪器与设备
TGL16M 台式高速冷冻离心机:长沙英泰仪器有限公司;Thermo Scientific Lumina 荧光磷光分光光度计、Nicoletis5 傅立叶变换红外光谱仪:赛默飞世尔科技公司;SpectraMax M5 酶标仪:上海美谷分子仪器;JY300 垂直电泳槽:上海天能科技有限公司;200PC 差示扫描量热仪:德国耐驰仪器制造有限公司;Zetasizer-Nano-ZS 激光纳米粒度分析仪:英国Malvern 公司;Universal Hood lll 凝胶成像仪:美国Bio-Rad 公司;JEM-1200EX 扫描电子显微镜:日本日立公司。
1.3 试验方法
1.3.1 米糠球蛋白制备及表征
采用Osborne 分级提取蛋白质的方法提取米糠球蛋白[3],向脱脂米糠中加入10 倍体积的2% 氯化钠溶液,室温条件下搅拌8 h 后,在4 ℃条件下6 000 r/min离心15 min 取上清液,调节等电点至4.0。离心15 min(4 ℃,6 000 r/min)后取沉淀,并用蒸馏水洗涤3 次,所得的沉淀即为米糠球蛋白。
采用聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)表征所提取的米糠球蛋白[13]。将冻干的蛋白样品溶于1 mg/mL磷酸盐缓冲液中(0.05 mol/L,pH7)。电泳的浓缩胶和分离胶凝胶浓度分别为5%和15%。上样缓冲液与样品以1∶1(体积比)稀释,充分混匀后沸水浴5 min,冷却后上样。以蛋白标准品Marker 作为参照,以120 V恒压进行电泳试验。待电泳结束后使用考马斯亮蓝R-250 染色,并用蛋白质凝胶成像仪进行拍照。
1.3.2 米糠球蛋白-壳寡糖糖基化蛋白的制备及表征
按照文献[7]的方法,将一定质量的米糠球蛋白溶解于0.05 mol/L、pH7 的磷酸盐缓冲溶液(phosphatebuffered saline,PBS)中,微调蛋白溶液至pH7,配制得到10 mg/mL 的蛋白液。将米糠球蛋白溶液与壳寡糖以质量比2∶1 混合,磁力搅拌20 min 使其充分混匀,倒入培养皿中置于-80 ℃预冻。将预冻好的米糠球蛋白-壳寡糖混合液放入真空冷冻干燥机中冷冻干燥,制备好的样品放入干燥器中恢复至室温。取制备好的米糠球蛋白-壳寡糖混合物置于密闭容器中,将干燥好的样品放置在康威皿(用饱和KBr 溶液维持容器中相对湿度79% 左右)中,在45 ℃的条件下反应2 h 得到米糠球蛋白-壳寡糖糖基化蛋白。最后将制备好的糖基化蛋白粉末置于-20 ℃中备用。
SDS-PAGE 表征方法同1.3.1。
1.3.3 扫描电镜
将冻干的米糠球蛋白及糖基化蛋白粘贴在扫描电镜观察台上,并用离子溅射镀膜仪对蛋白进行喷金处理。采用加速电压为20 kV,放大1 500 倍的扫描电子显微镜放大观察米糠球蛋白和糖基化蛋白的微观结构形态[13]。
1.3.4 抗消化性
模拟胃液的制备:用5 mL 盐酸溶液(pH2.0)溶解16 mg 胃蛋白酶,得到模拟胃液。然后分别将40 μL 的2 mg/mL 米糠球蛋白和糖基化蛋白样品与200 μL 模拟胃液混合,在37 ℃下反应2 h,模拟胃消化。反应结束后,加入60 μL 的0.001 mol/L 氢氧化钠溶液终止反应。同时模拟肠道消化,向5 mL 的PBS 缓冲液(0.05 mol/L,pH7.0)中加入50 mg 胰蛋白酶制备得到模拟肠液。然后将40 μL 蛋白质样品和200 μL 模拟肠液混合,在37 ℃水浴下孵育2 h,沸水浴中加热5 min 终止反应。最后,通过SDS-PAGE 分析研究蛋白质对胃蛋白酶和胰蛋白酶消化的稳定性。以未进行消化的米糠球蛋白作为对照样品进行分析[14]。
1.3.5 荧光光谱分析
将米糠球蛋白、米糠球蛋白+壳寡糖混合物及糖基化蛋白稀释到相同的蛋白质浓度,使用荧光磷光分光光度计测量荧光强度,激发波长设置为290 nm,在激发和发射狭缝宽度为5 nm 的情况下,在300~500 nm处测量荧光强度。
1.3.6 糖基化蛋白与槲皮素、白藜芦醇的非共价作用
参照Zheng 等[15]的方法,用荧光磷光分光光度计检测由槲皮素和白藜芦醇引起的糖基化蛋白的荧光强度变化。向3 mL 的糖基化蛋白溶液(溶于0.05 mol/L,pH7.0 PBS 中,蛋白浓度1 mg/mL)中分别添加槲皮素(5 mg/mL)和白藜芦醇(5 mg/mL)及同时添加槲皮素白藜芦醇(5 mg/mL 槲皮素与白藜芦醇,质量比为1∶1)[蛋白质与槲皮素(或与白藜芦醇,或与槲皮素白藜芦醇)=1∶0.005、1∶0.01、1∶0.02、1∶0.03、1∶0.04、1∶0.05,质量比]反应10 min 后测定荧光强度。激发和发射狭缝宽度均为5 nm。激发波长为290 nm,在300~500 nm范围内扫描。将数据根据以下方程式进行拟合,获得化学计量位点数n和结合常数K。
式中:n为结合位点数;K 为结合常数;[P]0为蛋白浓度;[PN]0为多酚浓度;I0和I∞分别为蛋白独立结合位点完全饱和时无多酚和有多酚存在时的相对荧光强度。
1.3.7 傅立叶红外光谱分析
参照Zhao 等[6]的测定方法,将样品(米糠球蛋白、糖基化蛋白、糖基化蛋白中分别添加槲皮素、白藜芦醇以及同时添加槲皮素和白藜芦醇,糖基化蛋白与多酚质量比为1∶0.02)进行冻干处理。处理后的样品采用KBr 法压片进行傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)扫描,测定波数为4 000~400 cm-1,扫描次数为32 次,分辨率为4 cm-1,以KBr作为空白参照。
1.3.8 热稳定性分析
参照Zhao 等[6]的测定方法,取5 mg 样品(米糠球蛋白、糖基化蛋白、糖基化蛋白中分别添加槲皮素、白藜芦醇以及同时添加槲皮素和白藜芦醇,糖基化蛋白与多酚质量比为1∶0.02)放入铝制品盒中,用空铝制样品盒作为空白参比,加盖压紧后置于样品池中,样品扫描温度为30~150 ℃,加热升温速率为5 ℃/min,控制氮气流速为10 mL/min,用差示扫描热量仪测定其变性温度及热焓值变化。
1.3.9 粒径分析
参考Zhao 等[6]的测定方法,采用激光纳米粒度分析仪测定样品的粒径分布。将样品(0.2 mg/mL 米糠球蛋白溶液、0.2 mg/mL 糖基化蛋白溶液中,分别添加槲皮素、白藜芦醇以及同时添加槲皮素白藜芦醇,质量比均为1∶0.02,溶于0.05 mol/L,pH7.0 PBS 溶液中)过0.45 μm 微孔滤膜,于室温条件下测量。
1.3.10 体外抗氧化性表征
1.3.10.1 ABTS+·清除能力测定
将ABTS 溶于蒸馏水配成0.007 mol/L 溶液并和浓度为0.002 45 mol/L 的过硫酸钾溶液按体积比1∶1混合,制成ABTS+·溶液,避光放置12~16 h 后用蒸馏水稀释至A734=0.70±0.02,避光备用。
精确量取500 μL 浓度为2 mg/mL 的样品溶液(米糠球蛋白、糖基化蛋白、糖基化蛋白中分别添加槲皮素、白藜芦醇以及同时添加槲皮素和白藜芦醇,糖基化蛋白与多酚质量比为1∶0.02)于试管中,加入3.5 mL ABTS+·溶液混匀,室温避光保存30 min 后测定734 nm处吸光值A;以500 μL 蒸馏水作为空白溶液与3.5 mL ABTS+·溶液混合室温避光静置30 min,734 nm 下测定吸光值A0。ABTS+·清除能力用清除率(X,%)表示,按照下式计算[6]。
1.3.10.2 DPPH·清除能力测定
精确量取2 mL 浓度为2 mg/mL 的样品溶液(米糠球蛋白、糖基化蛋白、糖基化蛋白中分别添加槲皮素、白藜芦醇以及同时添加槲皮素和白藜芦醇,糖基化蛋白与多酚质量比为1∶0.02)于试管中,加入2 mL 的0.000 1 mol/L DPPH 乙醇溶液混匀,室温避光保存30 min 后测定517 nm 处吸光值A;以2 mL 样品与2 mL 乙醇混合溶液作为样品对照组测得吸光值Ax0;以2 mL 蒸馏水与2 mL 的0.000 1 mol/L DPPH 乙醇混合溶液作为空白溶液测得517 nm 吸光值A0。DPPH·清除能力用清除率(Y,%)表示,按照下式计算[6]。
1.3.10.3 超氧阴离子自由基清除能力测定
精确量取1 mL 样品溶液(2 mg/mL)(米糠球蛋白、糖基化蛋白、糖基化蛋白中分别添加槲皮素、白藜芦醇以及同时添加槲皮素和白藜芦醇,糖基化蛋白与多酚质量比为1∶0.02)于试管中,加入3 mL Tris-HCl(0.05 mol/L,pH8.2)混匀,放入水浴锅25 ℃恒温反应20 min 后加入3 mL 焦性没食子酸溶液(0.007 mol/L,25 ℃),反应时间为5 min,最后加入1 mL 浓盐酸终止反应,于325 nm 处测定吸光值A。以样品溶液不加焦性没食子酸于325 nm 处测定吸光值Ax0;用蒸馏水代替样品溶液于325 nm 测定吸光值A0。超氧阴离子自由基清除能力用清除率(P,%)表示,按照下式计算[16-17]。
1.4 数据处理及统计分析
所有检测均进行3 次平行试验,所得结果采用平均值±标准差表示。采用单因素分析法分析组间显著性差异,数据处理软件为SPSS 19.0 和Origin 8.0,显著性水平P<0.05。
2 结果与分析
2.1 电泳表征
2.1.1 米糠球蛋白的电泳表征
米糠球蛋白电泳见图1。
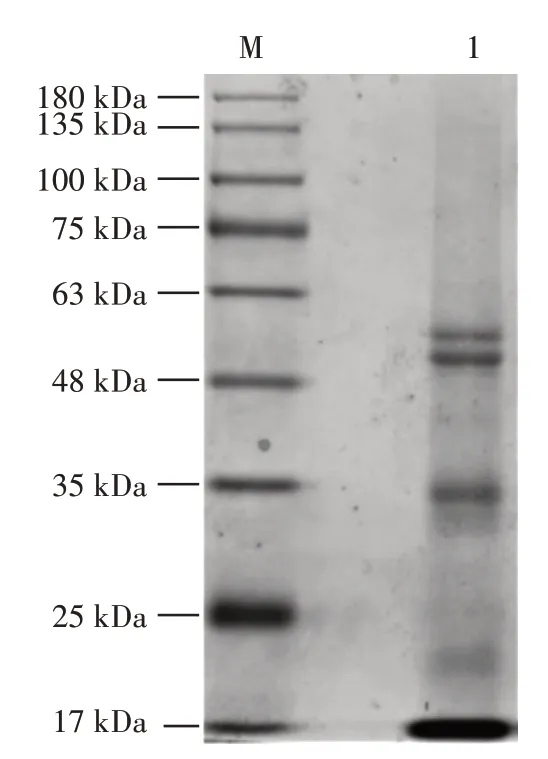
图1 米糠球蛋白电泳Fig.1 Electrophoretogram of rice bran globulin
如图1所示,通过与标准蛋白相比,所提取的米糠球蛋(条带1)白亚基分别在57、53、35 kDa 左右,与已有研究结果一致[18],说明米糠蛋白的制备提取成功。提取的蛋白质中杂质条带较少,提取的球蛋白纯度符合后续试验要求。
2.1.2 糖基化蛋白的SDS-PAGE 表征
米糠球蛋白及糖基化蛋白电泳见图2。
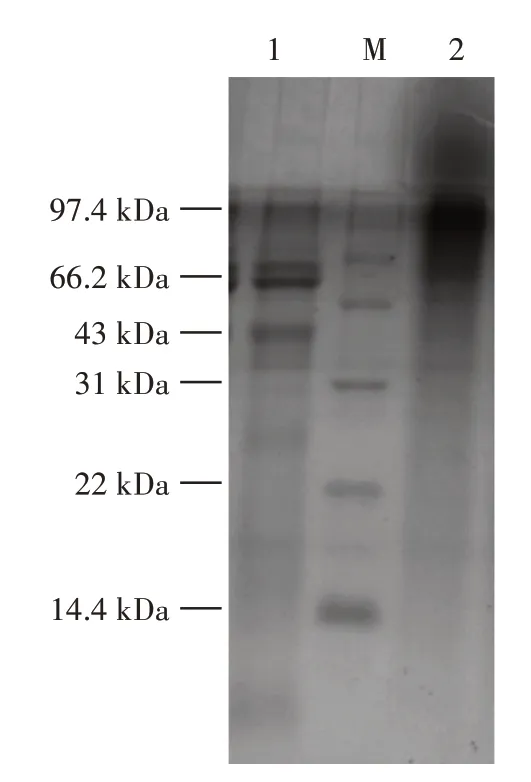
图2 米糠球蛋白及糖基化蛋白电泳Fig.2 Electrophoretogram of rice bran globulin and glycosylated protein
如图2所示,采用壳寡糖将米糠球蛋白通过美拉德反应糖基化后,米糠球蛋白的分离胶顶部形成分子量较高的多分散带(条带2),糖基化蛋白的特征条带变弱,表明壳寡糖成功与米糠球蛋白共价结合,形成二元共轭糖基化蛋白,即生成了更大分子量的化合物,证明糖基化修饰成功。
2.1.3 米糠球蛋白和糖基化蛋白的微观形态
采用扫描电镜观察米糠球蛋白糖基化前后微观结构的变化,结果如图3所示。

图3 米糠球蛋白和糖基化蛋白的电镜Fig.3 Electron micrograph of rice bran globulin and glycosylated protein
如图3所示,米糠球蛋白呈现片状结构,结构紧密。当米糠球蛋白与壳寡糖发生美拉德反应后,糖基化蛋白表面变得褶皱,不规则结构增多,表面变得更加松散。这是由于糖分子的引入在一定程度上改变了原蛋白结构,减少了蛋白质的聚集,使蛋白肽链呈伸展状态,分子扩散[19]。
2.1.4 糖基化蛋白的抗消化性表征
蛋白质在胃肠道中的降解耐受性反映了蛋白质的消化稳定性,因此对米糠球蛋白及糖基化蛋白在模拟胃肠道消化环境下的抗消化性进行了电泳表征,结果如图4所示。
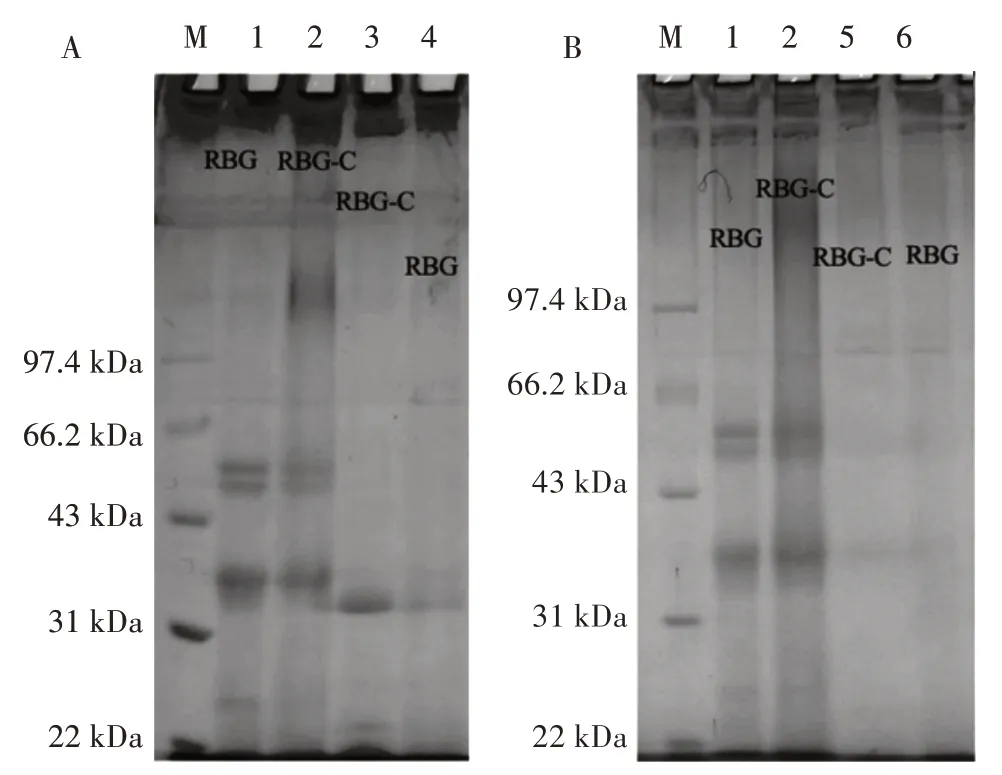
图4 米糠球蛋白及糖基化蛋白胃消化、肠消化蛋白电泳Fig.4 Electrophoresis of rice bran globulin and glycosylated protein after gastric and intestinal digestion
如图4所示,在模拟胃消化中,米糠球蛋白(条带4)及糖基化蛋白(条带3)在50~60 kDa 之间的特征条带几乎都被水解,但糖基化蛋白30 kDa 的条带仍部分保留,其原因可能是糖基化过后,壳寡糖覆盖了球蛋白与胃蛋白酶的结合位点,降低了消化率。在肠消化过程中,米糠球蛋白(条带6)和糖基化蛋白条带(条带5)的变化无明显差别,可能是在肠道吸收中胰蛋白酶的结合位点不受壳寡糖影响,证明糖基化蛋白在胃液里具有一定的抗消化特征,在肠道中可被完全消化。
2.1.5 糖基化蛋白的荧光光谱分析
通过测定米糠球蛋白、米糠球蛋白+壳寡糖混合物及米糠球蛋白-壳寡糖糖基化蛋白的荧光光谱来评估蛋白质的三级结构的变化,结果如图5所示。
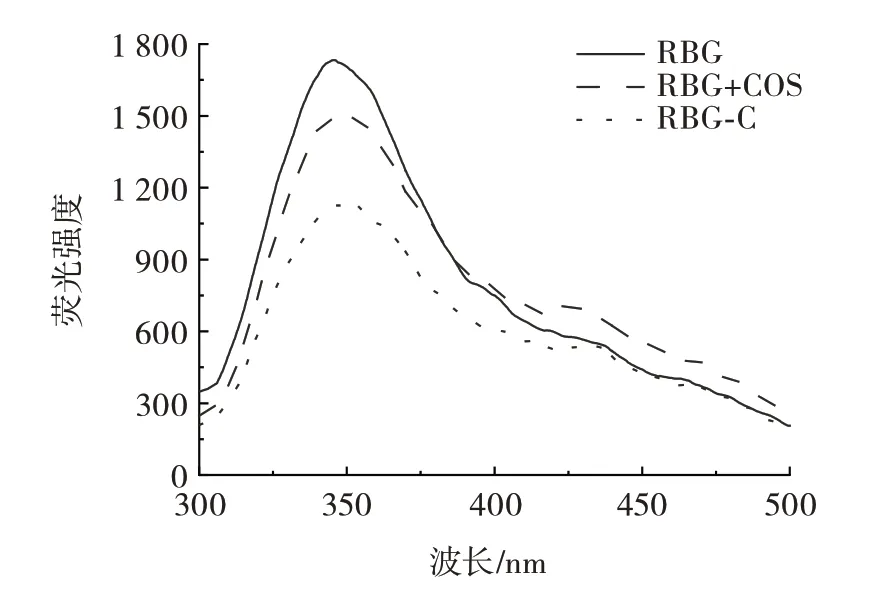
图5 米糠球蛋白、米糠球蛋白+壳寡糖混合物及糖基化蛋白荧光光谱Fig.5 Fluorescence spectra of rice bran globulin,mixture of rice bran globulin and chitooligosaccharide,and glycosylated protein
由图5 可知,米糠球蛋白+壳寡糖混合物及糖基化蛋白均未改变米糠球蛋白所在350 nm 处的最大吸收峰,最大荧光强度为1 712,与米糠球蛋白相比,米糠球蛋白+壳寡糖混合物及糖基化产物的荧光强度均明显降低,荧光强度分别降至1 495 和1 134,说明壳寡糖的混入或键入均未改变蛋白的一、二级结构,但引起了三、四级结构的改变。此外,糖基化蛋白的荧光强度降幅大于混合物,这可能是美拉德反应引起的共价相互作用导致蛋白的色氨酸微环境和蛋白构象发生了改变,壳寡糖中基团的引入遮蔽了蛋白中的部分色氨酸,进而导致荧光淬灭。这与之前的文献报道一致,即美拉德反应引起蛋白结构的变化,发生荧光淬灭现象[15]。
2.2 糖基化蛋白与多酚的相互作用
2.2.1 荧光淬灭现象
糖基化蛋白与多酚结合情况见图6。
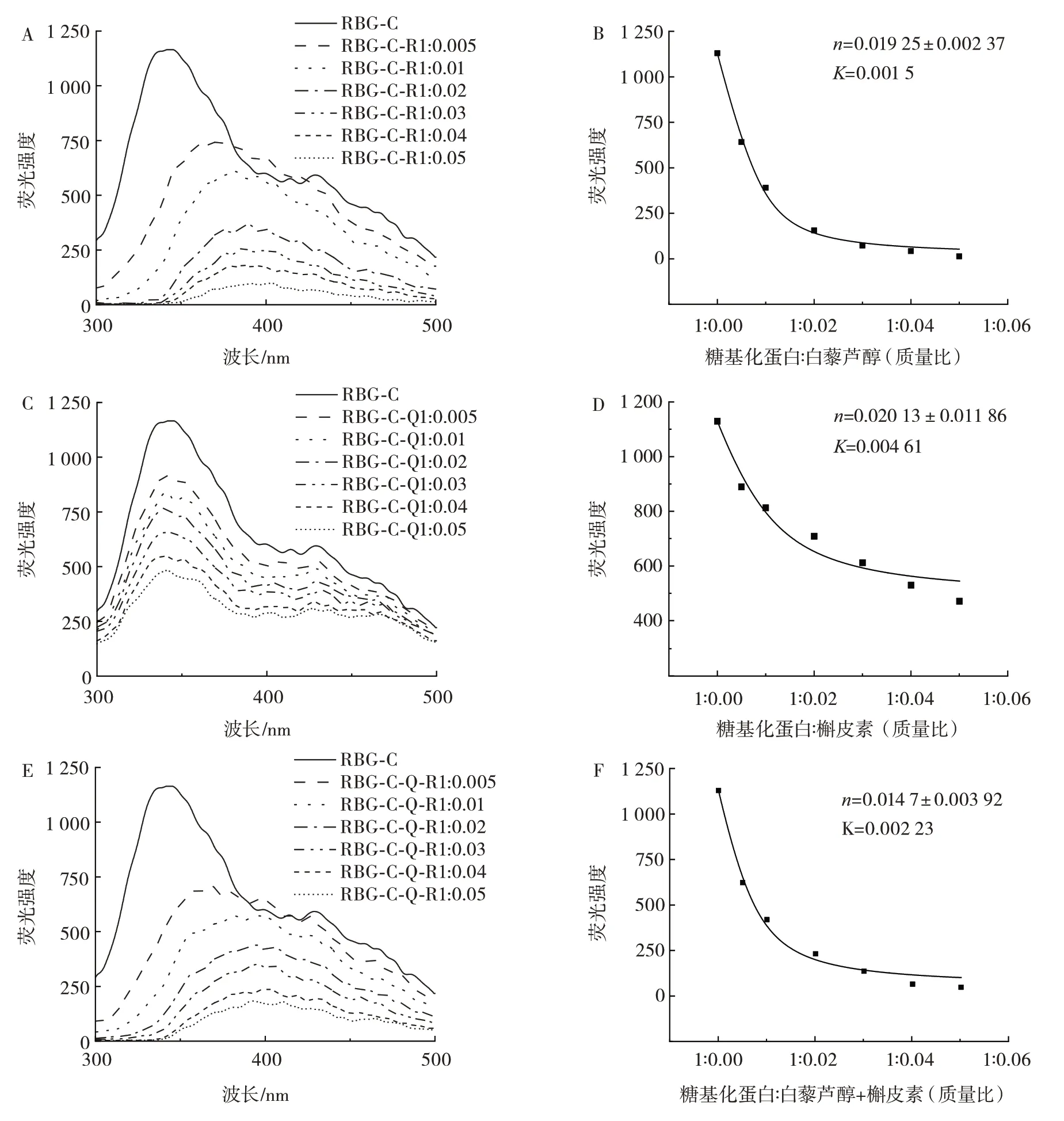
图6 糖基化蛋白分别与白藜芦醇和槲皮素以及同时添加白藜芦醇和槲皮素的结合情况Fig.6 Binding of glycosylated protein with resveratrol or quercetin and simultaneous addition of resveratrol and quercetin
如图6A、图6C 和图6E所示,糖基化蛋白最大吸收峰出现在350 nm 处,其荧光强度随多酚(槲皮素、白藜芦醇)质量的增加而降低,表明糖基化蛋白与多酚之间存在相互作用,导致静态荧光淬灭现象的产生[20]。图6B、图6D 和图6F 分别对单独添加白藜芦醇、槲皮素以及同时添加两种多酚时糖基化蛋白荧光强度变化进行了荧光拟合,结果显示两种多酚分别单独添加时,一个糖基化蛋白分子可结合0.019 25 个白藜芦醇分子,结合常数为0.001 5(图6B),且白藜芦醇的添加使得蛋白的荧光光谱发生了明显的红移(图6A),表明糖基化蛋白与多元醇白藜芦醇的非共价结合使得蛋白质的色氨酸残基暴露于更为极性的环境中。随着白藜芦醇浓度增加,糖基化蛋白红移越明显,证实了白藜芦醇的加入使得糖基化蛋白色氨酸残基微环境极性增加[21]。
如图6D所示,一个糖基化蛋白分子可以结合0.020 13 个槲皮素分子,结合常数为0.004 61。槲皮素对蛋白质的结合较强。同时添加两种多酚时,其结合位点数为0.014 7,结合常数为0.002 23。其结合能力小于单独的白藜芦醇和槲皮素分子,这可能与两种多酚之间的空间位阻有关。同时与蛋白结合时两种多酚之间的相互影响尚且需进一步研究。
2.2.2 糖基化蛋白-多酚非共价复合物的傅立叶-红外光谱分析
不同复合物的红外光谱见图7。
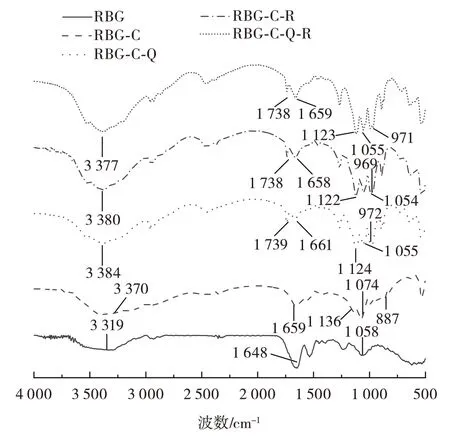
图7 不同复合物的红外光谱Fig.7 Infrared spectra of different compounds
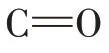
如图7所示,与米糠球蛋白相比,糖基化蛋白在—OH 的伸缩振动区间3 700~3 200 cm-1内出现了更宽的吸收峰,糖分子与蛋白共价作用时,壳寡糖引入了更多的羟基接入米糠球蛋白中。此外,糖基化蛋白在糖的特征吸收峰887 cm-1(糖环中C—H 键的弯曲振动)处有新的振动,说明壳寡糖成功键合在蛋白上,糖分子与米糠球蛋白发生了糖基化反应[23]。
糖基化蛋白与多酚结合后酰胺Ⅰ带峰的位置从1 659 cm-1变成了1 661、1 658 cm-1和1 659 cm-1。可以看出,与多酚结合之后,蛋白的酰胺Ⅰ带发生位移,移动了3~1 cm-1,说明多酚引起了蛋白的构象变化[22]。在3 600~3 200 cm-1的范围内出现较强的吸收峰,表明糖基化蛋白与多酚相互作用改变了已有的羟基环境和氢键网络,多酚中的羟基可以与氨基酸残基通过氢键作用。进一步说明多酚与糖基化蛋白主要是疏水作用及氢键等非共价相互作用[15]。
2.2.3 糖基化蛋白-多酚非共价复合物的热稳定性分析
糖基化蛋白-多酚非共价复合物的热稳定性分析见图8 及表1。
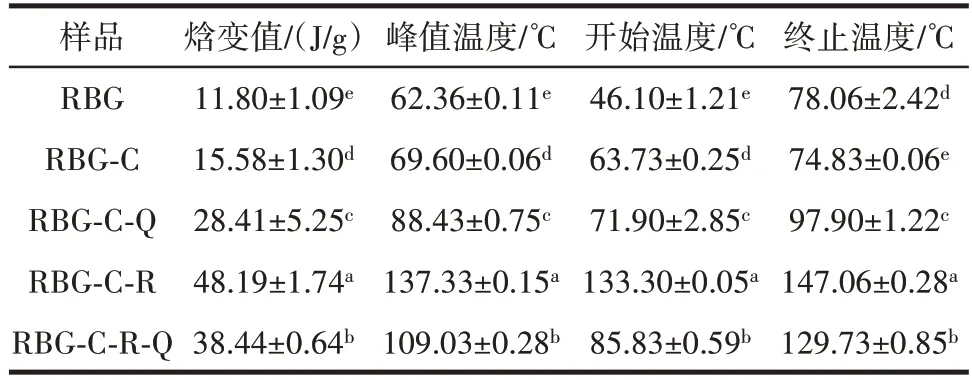
表1 不同复合物的热性质分析Table 1 Thermal property analysis of different compounds
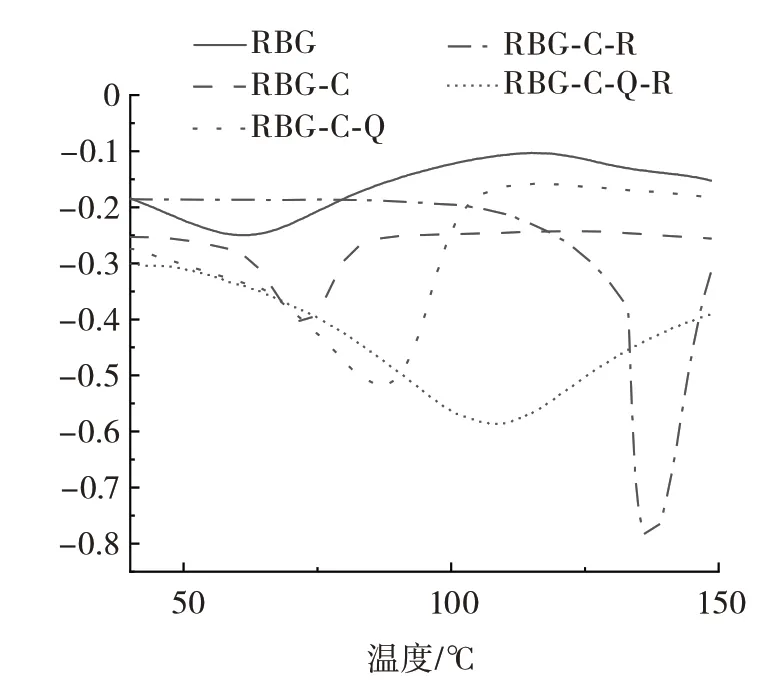
图8 不同复合物的DSC 图谱Fig.8 DSC spectra of different compounds
如图8 及表1所示,米糠球蛋白经过糖基化修饰后,糖基化蛋白的变性温度由原球蛋白的62.36 ℃增加至69.60 ℃,焓变值由11.80 J/g 增加至15.58 J/g,表明米糠球蛋白与壳寡糖共价键合提高了米糠球蛋白的热稳定性。这与Liu 等[24]的报道一致,美拉德反应提高了蛋白质的热稳定性。当加入多酚后,蛋白质与多酚相互作用后进一步提高了蛋白质的热稳定性[25-26]。具体表现为分别单独或共同与两种多酚槲皮素和白藜芦醇结合后糖基化蛋白的变性温度和焓变值显著升高。其中,与白藜芦醇单独结合后糖基化蛋白热稳定性最好,变性温度和焓变值分别为137.33 ℃和48.19 J/g。而同时与两种多酚非共价结合次之。可能是白藜芦醇的加入显著增加了糖基化蛋白的极性,通过非共价键形成了更紧密、热稳定性更高结构。
2.2.4 糖基化蛋白-多酚非共价复合物的粒径变化
米糠球蛋白、糖基化蛋白及糖基化蛋白-多酚非共价复合物的粒径如图9所示。
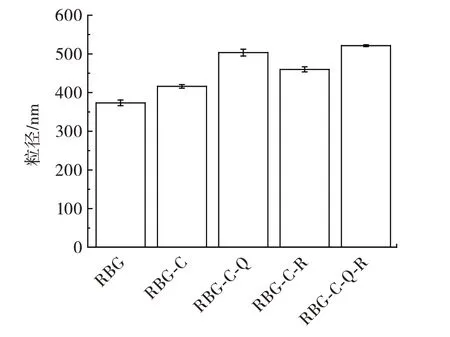
图9 不同复合物的粒径Fig.9 Particle size of different compounds
如图9所示,平均粒径由小到大顺序为RBG(373 nm)<RBG-C(416 nm)<RBG-C-R(459 nm)<RBGC-Q(503 nm)<RBG-C-Q-R(521 nm),米糠球蛋白的粒径小于糖基化蛋白以及糖基化蛋白-多酚非共价复合物,原因可能是美拉德反应主导的糖基化以及蛋白与多酚之间的相互作用力如氢键、范德华力等增强了蛋白质分子之间的聚集,从而使得粒径增大[27]。当同时与两种多酚结合时,粒径最大,可能是两种多酚与糖基化蛋白结合位点的不同导致蛋白分子之间的聚集更强,其机理有待进一步研究。
2.2.5 糖基化蛋白-多酚非共价复合物的体外抗氧化性分析
米糠球蛋白、糖基化蛋白、糖基化蛋白-多酚非共价复合物的体外抗氧化能力如图10所示。
如图10所示,所有糖基化复合物自由基清除能力均高于米糠球蛋白,这与之前的研究结果一致,即糖基化可以提高蛋白的抗氧化活性,这与美拉德反应中糖基化蛋白的氢和/或电子贡献有关[28]。与多酚结合后,发现与白藜芦醇结合后抗氧化能力最强,原因可能是白藜芦醇本身抗氧化性强于槲皮素[29-30]。当与两种多酚结合时,其抗氧化能力介于糖基化蛋白单独结合槲皮素和单独结合白藜芦醇之间。
3 结论
本研究通过美拉德反应对米糠球蛋白进行了糖基化修饰,提高了其抗消化性和抗氧化性。糖基化蛋白可同时与两种多酚发生非共价结合,其结合能力介于糖基化蛋白分别单独结合槲皮素和单独结合白藜芦醇之间。糖基化蛋白同时与两种多酚非共价结合后其粒径最大,其热稳定性及抗氧化能力介于糖基化蛋白单独结合槲皮素和单独结合白藜芦醇之间。本研究为扩大糖基化蛋白与两种及以上多酚的非共价复合物的研究及应用提供了一定的理论支持。
