脂肪因子Chemerin调节结肠癌细胞系迁移及侵袭能力的机制研究*
2024-02-26曹登义王远鹏李乃树崔皖晋
王 彬,曹登义,王远鹏,李乃树,崔皖晋
(蚌埠医学院第二附属医院,安徽蚌埠 233030)
结直肠癌(colorectal cancer,CRC)是常见的消化道恶性肿瘤。2020年IARC发布的对全球185个国家/地区估计数据显示,CRC新发例数与死亡例数分别居第3位与第2位,结肠癌与直肠癌新发例数分别占6.0%与3.8%[1]。明确发病机制、开发敏感的标志物辅助早期诊断与治疗是近年恶性肿瘤研究的重要方向。高脂饮食、肥胖是CRC的重要危险因素[2-3]。脂肪组织是人体最大的内分泌器官,可通过分泌多种蛋白质参与代谢调控,这类蛋白质即为脂肪因子。近年研究显示,脂肪因子及其受体异常可能是肥胖诱导CRC发生、进展的关联因子[4-5]。Chemerin是近年脂肪因子研究的热点之一,主要由肝脏与脂肪组织合成,在凝血与炎症相关丝氨酸蛋白酶将C末端裂解后被激活,与其受体趋化素样受体1(chemokine-like receptor 1,CMLKR-1)结合后发挥生物学效应[6]。近年有研究显示,Chemerin在CRC中可能扮演着重要角色,CRC患者循环系统中Chemerin表达水平显著上升,且与临床病理特征、预后相关[7-8]。但Chemerin对CRC发生与进展作用机制尚不明确。本研究通过细胞学实验,探讨Chemerin对结肠癌细胞系HCT116、SW480迁移与侵袭能力的影响,初步分析其可能的作用机制,现将结果总结如下。
1 材料与方法
1.1细胞来源与培养 人结肠癌细胞系HCT116、SW480购自Gibco公司,采用含10%胎牛血清的DMEM培养基进行培养,置于37 ℃、含5% CO2的细胞培养箱中。细胞融合度达到80%~90%时采用0.25%胰蛋白酶消化传代,采用对数生长期的CRC细胞系进行后续实验。
1.2主要仪器与试剂 脂肪因子Chemerin购自R&D Systems公司,FBS缓冲液、RPMI 1640培养基购自美国Gibco, Trizol试剂盒与Lipofectamine2000试剂购自美国Invitrogen。反转录试剂盒、qRT-PCR试剂盒购自美国Thermo Scientific,胰蛋白酶-EDTA消化液购自美国Thermo Fisher,上皮细胞钙黏蛋白(E-cadherin,E-cad)、神经钙黏附蛋白(N-cadherin,N-cad)和波形蛋白(vimentin)与GAPDH一抗与二抗购自美国Abcam,Matrigel基质胶购自北京尼康。Transwell小室购自美国Corning公司。PCR仪(美国Bio-Rad),细胞培养箱(美国Sim International),倒置荧光显微镜(日本Olympus)。
1.3方法
1.3.1细胞处理 取对数生长期细胞,采用不同浓度的Chemerin溶液处理,即0、100、200、300、400、500 ng/mL,培养24 h后进行细胞迁移实验,48 h后进行细胞侵袭实验。
1.3.2细胞转染 人工合成Chemerin全长cDNA插入pEGFP-N1载体,构建Chemerin高表达细胞,采用si-Chemerin构建低表达Chemerin细胞。每种细胞设置以下4组:pEGFP-N1阴性对照组(vector control)、si-Chemerin阴性对照(si-NC)、pEGFP-N1-Chemerin组与si-Chemerin组。取对数生长期细胞,采用Lipofectamine 2000试剂进行转染,转染浓度为100 nmol/L。培养24 h后进行细胞迁移实验,48 h后进行细胞侵袭实验。
1.3.3细胞迁移实验 将转染后24 h的细胞制成细胞悬液,将细胞密度调整为106/mL,于Transwell小室下层加入600 μL含有10% PBS的RPMI 1640培养基,于上层每孔加入100 μL细胞悬液。将Transwell板置入培养箱中(37 ℃、含5% CO2)培养24 h,95%甲醛固定,风干小室,0.2%结晶紫染色,显微镜观察,选择5个200倍视野进行拍照并计数,计算平均数。实验重复3次。
1.3.4细胞侵袭实验 将Matrigel胶于4 ℃静置24~48 h使其变为液态,采用不含血清的预冷培养基按1∶8比例稀释Matrigel胶,取100 μL均匀涂抹于Transwell小室上室的聚碳酸酯膜表面,室温下静置3~5 h后聚合为凝胶。取各组细胞制成密度为2×105/mL的细胞悬液。于24孔板加入含10%FBS的培养基,将小室置于24孔板,于上室加入100 μL细胞悬液,置于培养箱培养(37 ℃、含5% CO2)24 h。取出小室,湿棉签擦拭上层细胞与Matrigel。95%甲醛固定,0.2%结晶紫染色,PBS洗3次。选择5个200倍视野进行拍照并计数,计算平均值。侵袭率=(实验组侵袭细胞数/对照组侵袭细胞数)×100%。对照组为0 ng/mL组或vector control组。实验重复3次。
1.3.5实时荧光定量PCR检测 采用qRT-PCR法检测结肠癌细胞系E-cadherin(E-cad)、N-cadherin(N-cad)和vimentin mRNA水平。用PBS清洗处理后的细胞,重复2次,完成后置于冰上。加入Trizol裂解液,于冰上静置,依据试剂盒说明书进行总RNA提取,通过反转录试剂盒反转录为cDNA,以后者为模板进行qRT-PCR。反应体系20μL:2×SYBR Mix 10 μL,10×cDNA 1μL,上游引物0.5 μL,下游引物0.5 μL。内参为β-actin(上游引物:ATGCATCTGCTGATGCGTACTG,下游引物:GCTGATGCTGTAGCTGTAGCTC)。E-cad上游引物:TAGCTGTAGTCGTGATCGTAGT,下游引物GTCATGCTGTAGTGCTGATGCG;Vimentin上游引物:CTAGCTGTAGCTGTAGTGCTGTC,下游引物GCTGATGCTGTAGCTGTAGCTC;N-cad上游引物:GTGCCATTAGCCAAGGGAATTCAGC;下游引物:GCGTTCCTGTTCCACTCATAGGAGG。采用相对定量法(2-ΔΔCt)计算相对表达量。重复3次。
1.3.6Western blot实验 通过Western blot法检测E-cadherin、N-cadherin和vimentin蛋白水平。收集转染后48 h细胞,用含蛋白酶抑制剂的RIPA裂解液进行蛋白提取,于SDS-PAGE凝胶上分离各组细胞蛋白质,完成后转移至PVDF膜。采用5%脱脂牛奶进行封闭,行一抗与二抗孵育,采用ECL化学发光试剂盒进行发光信号检测。
1.4统计分析方法 采用IBM SPSS 25.0与GraphPad Prism 8软件进行数据处理。定量指标采用均数±标准差进行描述,结果服从正态分布。两组之间比较采用t检验,三组及以上之间比较采用单因素方差分析进行组间比较,两两比较采用SNK法。P<0.05为差异有统计学意义。
2 结果
2.1不同浓度Chemerin溶液对结肠癌细胞迁移的影响 与0 ng/mL组相比,Chemerin显著增加了HTC116与SW480细胞迁移数(P<0.05),且随Chemerin浓度上升呈增加趋势,但300、400、500 ng/mL组两两比较差异无统计学意义(P>0.05),其余两两比较差异有统计学意义(P<0.05)。见图1。
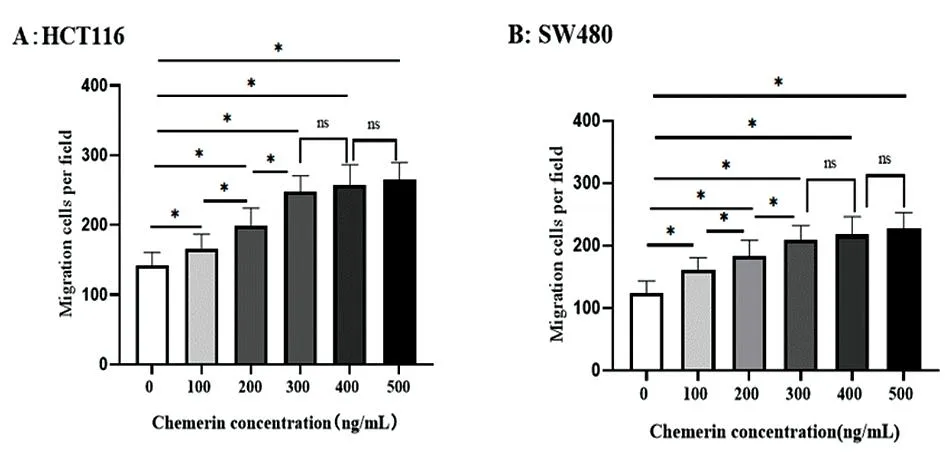
图1 不同Chemerin浓度处理HCT116细胞
2.2不同浓度Chemerin溶液对结肠癌细胞侵袭的影响 与0 ng/mL组相比,Chemerin显著增加了HTC116与SW480细胞侵袭率(P<0.05),且随Chemerin浓度上升呈升高趋势,而HTC116细胞300、400、500 ng/mL组侵袭率两两比较差异无统计学意义(P>0.05),其余两两比较差异有统计学意义(P<0.05);SW480细胞400、500 ng/mL组侵袭率差异无统计学意义(P>0.05),其余两两比较差异有统计学意义(P<0.05)。见图2。
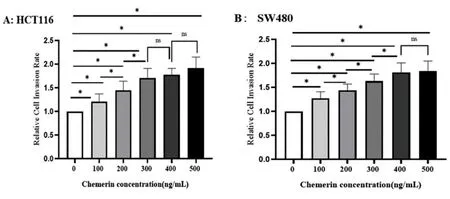
图2 不同Chemerin浓度处理HCT116细胞
2.3Chemerin表达对结肠癌细胞迁移与侵袭的影响 Chemerin过表达的HTC116与SW480细胞迁移与侵袭能力显著上升,高于vector control组(P<0.05);Si-Chemerin组细胞迁移与侵袭能力显著下降,低于si-NC组(P<0.05)。见图3。
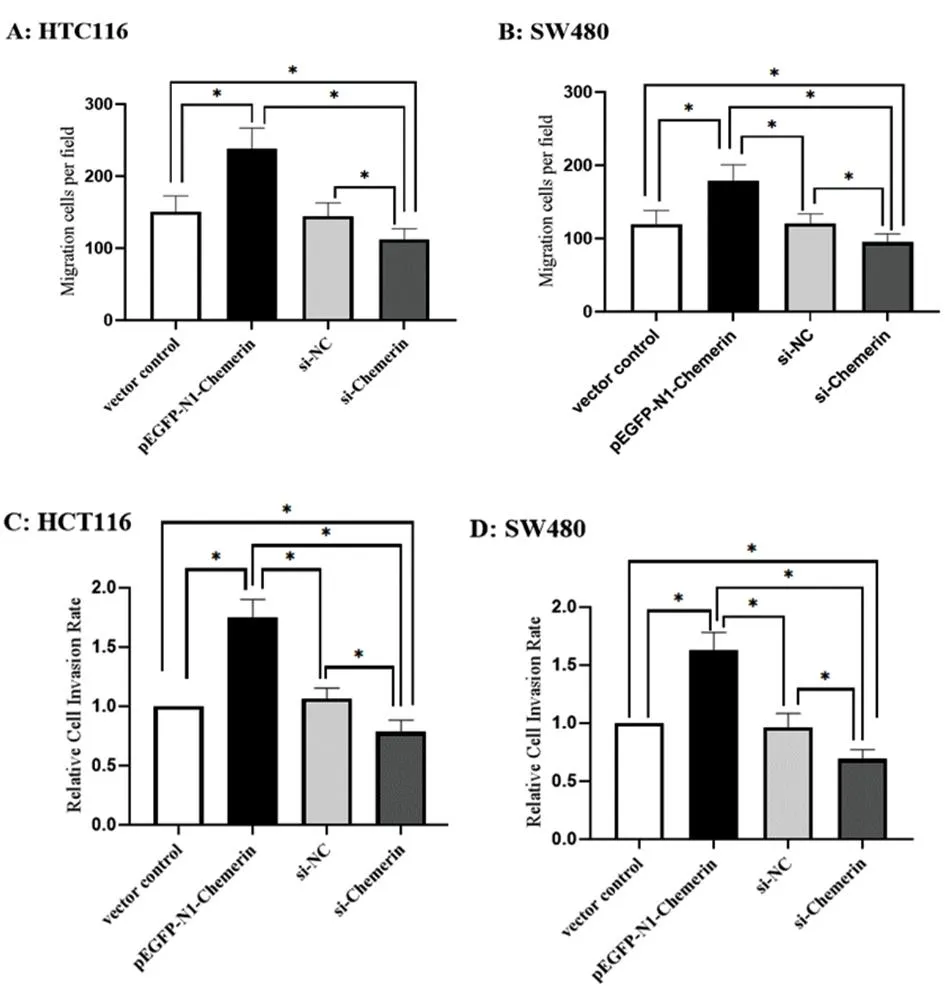
图3 Chemerin表达对HCT116细胞与SW480
2.4Chemerin表达对上皮-间质转化(epithelial-mesenchymaltransition,EMT)标志物表达的影响 qRT-PCR和Western blot检测结果显示,与vector control组相比,Chemerin过表达的HTC116与SW480细胞,E-cad mRNA和蛋白表达水平显著下降(P<0.05),N-cad与vimentin mRNA和蛋白表达水平显著上升(P<0.05);与si-NC组相比,si-Chemerin组E-cad mRNA和蛋白表达水平增加(P<0.05),N-cad与vimentin mRNA和蛋白表达下降(P<0.05),见图4、图5。
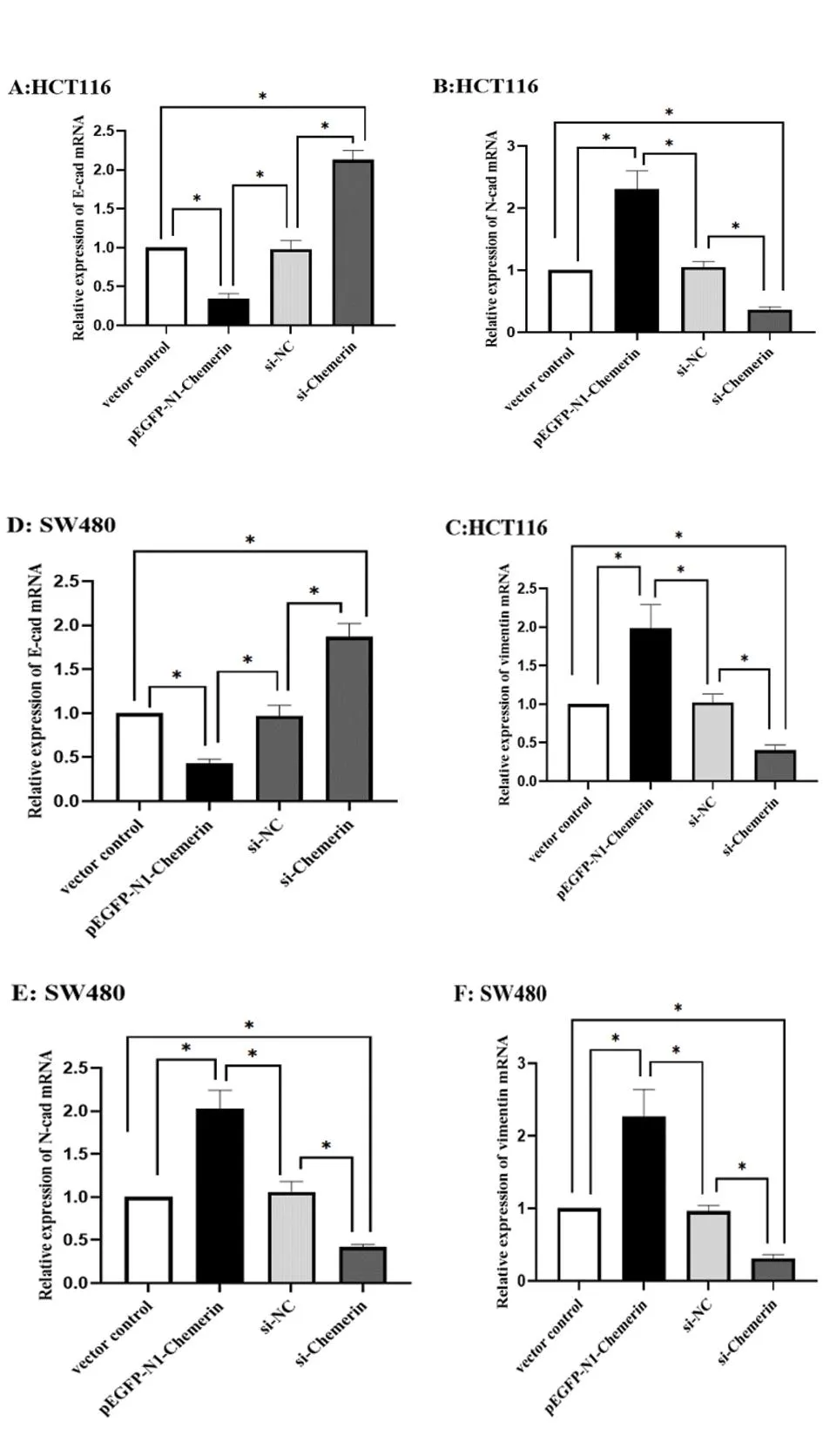
图4 Chemerin对E-cad、N-cad和vimentin基因表达的影响
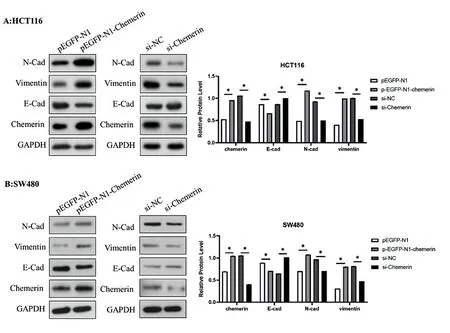
图5 Western blot实验检测E-cad、N-cad
3 讨论
脂肪因子Chemerin编码基因定位在人染色体的7q36.1,包括163个氨基酸序列。Chemerin与CMKLR1在早期脂肪细胞的扩增中发挥着重要作用,可通过与PPARγ的相互作用调节成熟脂肪细胞生长与代谢[9]。Chemerin在肥胖、胰岛素抵抗(insulin resistance,IR)人群中表达水平显著上升,在肥胖相关疾病的病理生理过程中发挥着重要作用[10]。近年研究显示,Chemerin不仅参与脂肪生成、胰岛素代谢与炎症反应等生理过程,也可作用于某些信号通路调控肿瘤的发生与进展,已被证实与肝癌、CRC、乳腺癌等恶性肿瘤相关。
El-Sagheer等[11]对117例乳腺癌患者的研究显示,患者血清Chemerin水平显著高于健康对照,免疫组化检测结果显示乳腺癌组织中Chemerin呈高表达,受体CCRL2表达水平上升,且Chemerin表达水平与ER表达、PR表达、淋巴结转移、远处转移、临床预后相关。近期针对CRC的相关研究也得出了类似的结果。Erdogan等[12]的研究显示,CRC患者血清中Chemerin水平显著高于健康对照,且Chemerin水平与炎症标志物如血沉、C-反应蛋白(C-reactive protein,CRP)相关。Alkady等[13]的研究进一步验证了上述结果,CRC患者循环中Chemerin水平与肿瘤临床病理参数相关,随着肿瘤恶性程度上升,循环中Chemerin表达水平升高。Eichelmann等[14]通过一项大样本前瞻性队列研究发现,循环中Chemerin水平是CRC的独立危险因素,其与CRC的发病风险呈线性相关,Chemerin最高四分位数者较最低四分位数者罹患CRC风险显著上升(HR=1.81,95%CI:1.08-3.05)。上述研究提示循环中Chemerin可作为CRC肿瘤标志物,用以辅助早期诊断与预后预测。本研究从细胞学层面探讨了Chemerin对结肠癌细胞系生物学行为的影响,结果显示外源性给予Chemerin处理可提升结肠癌细胞侵袭与迁移活性,促进恶性生物学行为,Chemerin高表达的细胞侵袭与迁移活性也显著提升,而抑制Chemerin表达可降低迁移与侵袭水平。上述结果提示Chemerin在CRC中表现为促癌效应,可促进肿瘤发展,可作为CRC的肿瘤标志物。
目前认为Chemerin可通过多种机制调控肿瘤的生长。Chemerin表达改变可促进代谢异常,引发肿瘤发生并促进其进展[15]。Chemerin具备促血管生成效应,而新生血管大量形成是肿瘤进展的基础。近期一项针对人脐静脉内皮细胞的研究显示,Chemerin可通过与该类细胞CMKLR1结合诱导AKT、p42/44 ERK磷酸化提升其增殖活性,促进其向毛细血管样结构分化[16]。提示Chemerin可通过诱导新生血管形成来促进肿瘤的发展。Kiczmer等[8]针对CRC的研究进一步证实了这个观点,Chemerin可通过刺激MMP-9表达促进肿瘤向正常组织浸润,促进血管生成并介导肿瘤微环境形成,从而加快肿瘤进展。此外,Chemerin具备较强的促炎效应,可加强肿瘤相关炎症反应,从而影响细胞增殖、侵袭与迁移活性,进一步提升新生血管形成活性[6]。
上皮-间质转化(epithelial-mesenchymaltransition,EMT)是肿瘤发展的重要生物学过程。EMT过程中上皮细胞黏附能力下降,并获得侵袭与迁移表型[17]。Wu等[18]对多形性胶质母细胞瘤(glioblastoma multiforme,GBM)的研究显示,Chemerin可增强肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)间充质表型,并通过CMKLR1/NF-κB轴促进M2极化,进一步加强GBM的间充质特征。上述结果提示Chemerin可促进并维持细胞的间充质特征。但肝癌相关研究得出了否定的结论。Feder等[19]对肝细胞癌的研究显示,EMT标志物E-cad等与Chemerin水平不存在统计学相关,Chemerin可能并不通过EMT影响肝细胞癌的进展。本研究探讨了Chemerin对结肠癌细胞系EMT的影响,结果显示,Chemerin表达水平与EMT相关,Chemerin过表达可抑制上皮标志物上皮细胞钙黏蛋白(E-cadherin)表达,并提升神经钙黏附蛋白(N-cadherin)与波形蛋白(vimentin)表达,抑制Chemerin则可出现相反的效果。上述结果提示,Chemerin可能通过诱导EMT的进展与细胞间充质特征维持促进CRC发展,但具体调控机制还有待进一步研究。
综上所述,Chemerin可提升CRC细胞侵袭与迁移活性,作用机制可能与EMT调控相关。Chemerin可能是CRC诊断、预后评估潜在标志物,可通过进一步研究探讨其对CRC细胞的调控机制。
