细菌外膜囊泡应用于肿瘤治疗*
2024-02-26王云锋庄婉茹马宪彬聂伟东谢海燕
王云锋 庄婉茹 马宪彬 聂伟东 谢海燕
(北京理工大学生命学院,北京 100081)
细菌外膜囊泡(outer membrane vesicles,OMVs)是一种由细菌分泌的脂质纳米囊泡。不同于最初认为的细菌裂解产物,OMVs现今更多被看作一种独特的细菌分泌物,细菌可通过分泌OMVs的方式维持其外膜稳定性或排出有害物质。不同细菌间能对OMVs进行识别与招募以获取遗传信息和营养物质[1-2],此外,细菌通过分泌OMVs甚至能调节宿主免疫反应以逃逸免疫监测[3-6]。作为细菌分泌产物,OMVs表面富含细菌抗原,这使其可作为疫苗用于防治细菌感染[7-8]。除了激起针对细菌的适应性免疫反应外,OMVs还可激活广泛的先天性免疫或作为佐剂增强机体对其他抗原的免疫反应,特别是促进抗肿瘤免疫反应的发生。
癌症是现今死亡率最高的疾病之一,攻克癌症将极大促进人类平均寿命的延长。由于肿瘤异质性高且易于复发与转移,其治疗问题一直是医疗领域的难点。目前临床上已应用多种手段治疗肿瘤,如手术切除、放射治疗、化学治疗、光动力治疗(photodynamic therapy,PDT)与免疫治疗等,它们各有优劣,适用患者类型也各不相同。尽管每年全球都会进行大量的基础研究、药物开发与临床试验以期攻克肿瘤治疗,然而抗肿瘤药物对非肿瘤组织的毒性始终是一个难以回避的问题。为此,开发具有肿瘤靶向性质的纳米体系用于递送抗肿瘤药物具有很高的研究价值。通过纳米体系对肿瘤组织的主动或被动靶向蓄积使药物富集于肿瘤组织,提高了药物的利用率并降低了药物副作用。而细菌衍生的OMVs不仅具有一定肿瘤靶向性,可用于抗肿瘤药物的递送,其丰富的病原体相关分子模式(pathogen associated molecular patterns,PAMPs)还可增强免疫反应以协同治疗肿瘤。
1 OMVs的生物发生机理
与革兰氏阳性菌不同,革兰氏阴性菌有两层结构高度异质的膜:细菌质膜与细菌外膜。两层膜间为细菌周质空间,细菌细胞壁位于其中。位于细胞壁外层的外膜是革兰氏阴性菌的标志性结构。与典型的生物膜不同,虽然同样是脂质双分子层结构,但细菌外膜具有极大不对称性:其内叶主要由磷脂组成,而外叶则含有大量的脂多糖(lipopolysaccharide,LPS)。此外,外膜中含有两大类蛋白质:跨膜的桶状外膜蛋白(outer membrane proteins,OMP)与氨基端嵌入膜内的脂蛋白。细菌外膜的存在不仅为革兰氏阴性菌提供了一个化学屏障,还为细菌提供了一部分机械支撑。革兰氏阴性菌对洗涤剂和其他疏水毒素的抵抗力主要得益于外膜上LPS分子间的强横向作用力及其饱和酰基链,它们在维持细菌外膜结构稳定的同时极大阻碍了疏水分子的通过[9]。同时,外膜中部分脂蛋白通过与肽聚糖层的共价结合将细菌外膜与细胞壁连接,例如大肠杆菌外膜中最丰富的脂蛋白布劳恩脂蛋白(Braun’s lipoprotein,Lpp)的羧基端可与肽聚糖共价结合,这使得细菌外膜能承担一部分机械力以弥补革兰氏阴性菌肽聚糖层较薄的缺点[10-11]。
作为直径在20~250 nm之间的天然脂质纳米囊泡,OMVs始于细菌外膜凸起,因此其膜成分和细菌外膜类似,主要由磷脂、LPS和OMP组成,而其囊腔则富含细菌周质与胞质成分,如肽聚糖、蛋白质、核酸等。OMVs最早发现于1966年,研究人员观察到在没有发生细胞裂解的情况下,赖氨酸依赖的突变大肠杆菌(E. coli)12408产生了膜包被的“小球”[12]。次年,Chatterjee等[13]通过电镜观察到霍乱弧菌(Vibrio cholerae)的外膜出现不同程度的膨大现象,随着膨大明显隆起,其颈部被掐断形成小泡释放。1976年,Hoekstra等[14]发现E. coliJC411产生的囊泡含有脂质与蛋白质;1982年,Katsui等[15]发现E. coliW3110在55℃加热下细胞表面释放含有脂质、蛋白质和LPS的膜囊泡,成分类似于细菌外膜。近年来,随着对OMVs的研究日益增多,虽尚不明确OMVs产生的分子机制,但一些已发现的遗传和生化证据可以帮助人们探索这一过程。
1.1 蛋白质与OMVs的产生
作为OMVs的重要组成成分,蛋白质的缺乏或功能异常可能促进OMVs的分泌。在一种OMVs产生模型中,脂蛋白连接的缺失导致细菌外膜与肽聚糖层局部分离,分离区域的外膜持续生长致使外膜向外凸起并最终以OMVs的形式释放[16]。这种模型的提出基于早期的观察结果:外膜囊泡中脂蛋白较少且大部分不与肽聚糖共价结合[14,17]。1976年,Weigand等[18]揭示了OMVs生物发生的第一个分子证据:缺乏Lpp的LkyD缺陷型鼠伤寒沙门氏菌外膜鼓起大囊泡,这表明连接肽聚糖层与外膜的脂蛋白缺乏直接导致细菌外膜凸起(图1a)。其后在1978年Suzuki等[19]在大肠杆菌lpo突变体上也观察到了类似现象。与Lpp类似,细菌外膜蛋白OmpA也能连接肽聚糖层与外膜,因此多种OmpA突变型细菌表现出OMVs产量提升[20-24]。近年来,研究人员发现,细菌外膜结构重要的基因突变均会导致OMVs产量的提升,这些基因有的与外膜组成有关,有的与肽聚糖的生长交联有关,有的则负责在外膜与肽聚糖间形成桥梁[25]。这些证据都证明了细菌外膜与肽聚糖层的分离有利于细菌OMVs的释放。
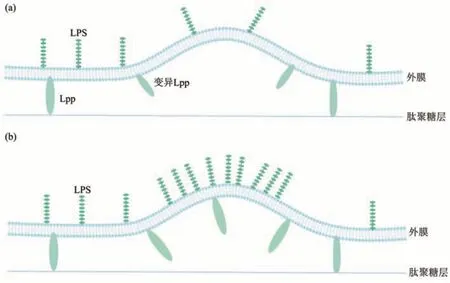
Fig.1 OMVs biogenesis model图1 OMVs生物发生模型
1.2 LPS与OMVs的产生
细菌LPS通常由疏水的类脂A、核心寡糖与O抗原组成[26]。作为细菌外膜主要成分之一,LPS不仅在细菌外膜屏障功能中发挥核心作用[27-28],还是细菌表面最丰富的抗原。但由于带负电的LPS间具有静电排斥力,因此外膜中负电LPS的含量上升也会导致细菌外膜的凸起最终致使OMVs的释放(图1b)[29-31],类似的,基因突变导致的LPS电负性增强也会导致细菌外膜膜曲率失衡,随后致使外膜凸出并产生OMVs[32]。同时,由于OMVs中LPS组成的不同会导致与LPS相互作用的特定蛋白质发生含量变化,因此LPS电负性的改变不仅会影响OMVs的产生还会影响OMVs中蛋白质的包装,已有研究表明,O抗原和核心寡糖的变化均会对OMVs产生影响[25,31]。
1.3 磷脂与OMVs的产生
同为细菌OMVs主要成分磷脂也会影响OMVs分泌。大肠杆菌外膜中磷脂含量从高到低依次为磷脂酰乙醇胺、磷脂酰甘油和心磷脂[33],而大肠杆菌OMVs具有与外膜相似的磷脂组成[34]。革兰氏阴性菌的磷脂在质膜与外膜内叶间进行转运,其中磷脂从外膜内叶到质膜的易位被称为逆行转运[35]。在逆行运输中,脂质不对称维持系统(maintenance of lipid asymmetry,Mla)将外膜外叶中的错位磷脂运输到质膜以维持外膜不对称性。其中,MlaA脂蛋白与外膜OmpC蛋白的相互作用将错位磷脂转给MlaC蛋白,然后递送到位于质膜中的MlaFEDB复合物,并最终整合到质膜上[36-37]。因此,Mla途径蛋白质表达减少或缺失会导致细菌外膜外叶产生磷脂积累,由此带来的外叶不对称扩张会引发细菌外膜向外凸起,进一步的磷脂富集导致细菌外膜萌芽,最终夹断形成OMVs(图2)。在这种OMV产生模型中,细菌通过释放OMVs维持其外膜不对称性,进而维持外膜屏障功能[38-40]。
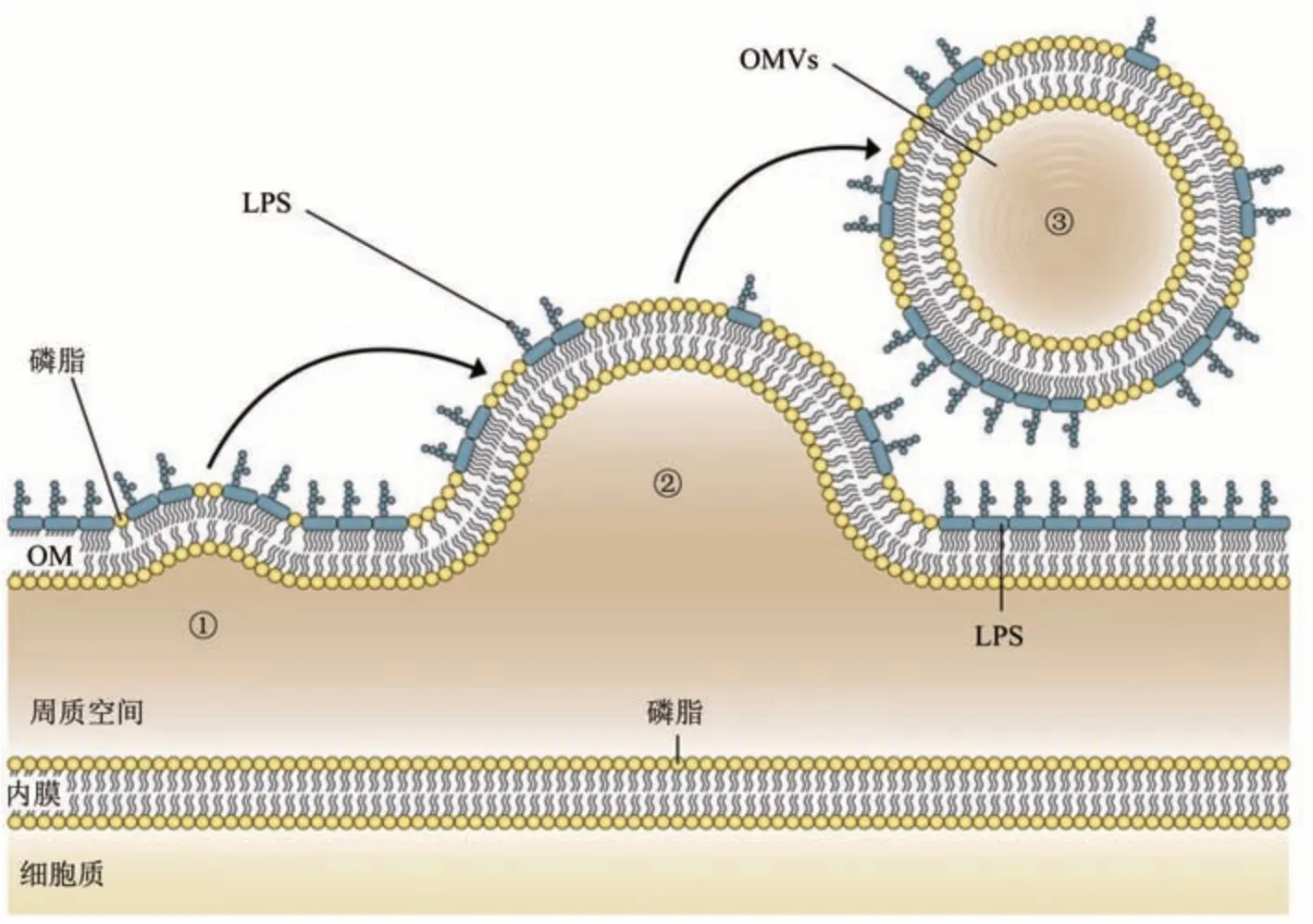
Fig.2 The wrong accumulation of phospholipids in bacterial outer membrane leads to the production of OMVs[39]图2 细菌外膜中磷脂错误累积导致OMVs产生[39]
因此,OMVs的生物发生是一个复杂的过程,对这一过程的机制解析有利于对细菌分泌OMVs这一行为进行调控,包括提高产量、调整组分构成甚至控制OMVs粒径大小,这将极大推动OMVs的实际应用。
2 OMVs对免疫系统的调节作用
作为一种独特的细菌分泌物,OMVs在体液中的出现往往意味着细菌感染的发生,因此宿主模式识别受体(pattern recognition receptor,PRR)识别OMVs上PAMPs后会激发一系列下游免疫应答,导致促炎细胞因子白介素(interleukin,IL)-1β、IL-6、IL-8和抗菌肽的产生,最终清除入侵机体的病原微生物[41-44]。本节通过OMVs对不同免疫细胞的调节来综述OMVs对机体免疫系统的调节作用。
2.1 中性粒细胞
作为先天免疫系统的重要组成成分,中性粒细胞是抵御细菌感染的第一道防线,其能够迅速识别、攻击并消除大多数病原微生物[45-47]。其中,已有研究表明中性粒细胞在OMVs引发的免疫反应中发挥重要作用。在OMVs的刺激下,血管内皮细胞能以Toll样受体4(Toll-like receptors,TLR4)和NF-κB依赖的方式释放IL-8/CXCL1招募中性粒细胞[48],中性粒细胞受OMVs刺激释放促炎细胞因子(如TNF-α、IL-1β)与趋化因子导致炎症的发生(图3a)[49]。但值得注意的是,有研究表明低浓度LPS会诱导中性粒细胞在上调其趋化因子受体CXCR4表达的同时释放中性粒细胞胞外陷阱(neutrophil extracellular traps,NET),这可能与过敏性哮喘的发生有关[50];而由细菌外膜衍生的OMVs富含LPS,因此极大可能和LPS有着类似的效果。此外,部分OMVs可以抑制中性粒细胞的功能以帮助其亲本细菌逃避中性粒细胞的攻击[5]。例如,泌尿致病型大肠杆菌产生的OMVs可以将具有生物活性的1型细胞毒性坏死因子(cytotoxic necrotizing factor 1,CNF1)递送到中性粒细胞内以抑制其趋化性和吞噬功能,最终降低中性粒细胞的抗菌活性。总之,已有研究表明,携带大量PAMPs的OMVs可以招募并激活中性粒细胞从而诱导抗菌免疫的发生,但OMVs携带的毒力因子也可能会抑制中性粒细胞的免疫活性以使亲本细菌逃逸免疫监测。

Fig.3 Regulatory effects of OMVs on immune cells图3 OMVs对免疫细胞的调节作用
2.2 巨噬细胞
与中性粒细胞类似,OMVs可以通过激活巨噬细胞受体来调节免疫反应。一方面OMVs可以激活巨噬细胞表面的TLR2以诱导有效的促炎反应,促进巨噬细胞分泌IL-6、IL-8、TNF-α和IL-1β(图3b)[42-43,51]。另一方面,被巨噬细胞吞噬后,OMVs可以激活巨噬细胞胞内PRR受体引发炎性反应。研究发现,不同来源的细菌OMVs均可以激活巨噬细胞中的炎性小体信号转导途径诱导炎症因子的释放[52-54]。其中,牙周病原体OMVs可诱导强烈的NF-κB活化并刺激促炎细胞因子反应[53],而鞭毛细菌OMVs则可以将细菌鞭毛蛋白递送到巨噬细胞胞质中触发NLRC4介导的典型炎症小体活化[54]。通过将LPS递送至巨噬细胞胞质,OMVs还可引发小鼠胱天蛋白酶(Caspase)-11介导的非典型炎症小体反应[55-58]。其具体作用机制为,OMVs首先通过LPS激活TLR4与IFN-I信号通路,进而诱导鸟苷酸结合蛋白(guanylate-binding protein,GBPs)的产生,产生的GBPs与胞质中OMVs表面LPS结合促进LPS与炎性Caspase-11的相互作用[56,58],活化的Caspase-11裂解GSDMD得到的氨基端片段促进Caspase-1依赖的细胞焦亡与NLRP3依赖的非典型炎症小体的激活[56,58-59]。而在人源细胞中,研究发现,OMVs上LPS主要通过Caspase-5(Caspase-11的人类同系物)激活炎症小体通路[60]。
2.3 树突状细胞(DC)
作为已知功能最强且惟一能活化初始T细胞的专职抗原提呈细胞,树突状细胞(dendritic cells,DC)是启动、调控和维持免疫应答的中心细胞。DC可通过经典的主要组织相容性复合物(MHC I和MHC II)呈递蛋白质类抗原、通过非经典的CD1分子呈递脂类抗原。由DC呈递的抗原可激活抗原特异性T淋巴细胞,包括CD8 T细胞、CD4 T细胞与NK T细胞,其诱导激活抗原特异性T细胞的能力远超其他抗原提呈细胞[61]。早在2007年,研究人员就发现,OMVs能诱导DC分泌促炎因子TNF-α和IL-12,同时促进DC表达更高的抗原呈递分子MHC-II与共刺激分子CD86(图3c);此外,OMVs可以作为佐剂,通过激活DC增强抗原特异性的B细胞与T细胞免疫反应[62]。OMVs对DC的激活主要依赖于DC TLR4通路的激活[63]。
同时,由于DC是适应性免疫反应的中心细胞,疫苗接种后需要DC将抗原提呈给T细胞或B细胞才能顺利激活抗原特异性免疫反应,而OMVs即可作为佐剂激活DC又携带亲本细菌的特异性抗原,因此以OMVs作为疫苗诱发适应性免疫抵抗细菌感染的研究由来已久。早在1987年,第一种基于OMVs的疫苗就在古巴获准用于血清型脑膜炎奈瑟菌的治疗[8];随后OMVs疫苗在挪威、新西兰等地被成功用于预防B族脑膜炎球菌感染[7,64-66];OMVs疫苗对多种病原体都可产生预防效果,包括霍乱弧菌、肺炎克雷伯菌等[67-70]。同时,多项动物实验证明,以OMVs作为佐剂的疫苗能诱导比传统疫苗制剂更强的免疫反应[71-75]。
3 OMVs的修饰改造策略
作为细菌分泌的纳米囊泡,OMVs具有易于修饰改造的特性,这使其在抗肿瘤研究中有着巨大的应用前景。对OMVs进行修饰改造不仅可以加强其肿瘤靶向性、减弱其全身毒性还能根据需要赋予其特定功能。对OMVs的修饰改造根据修饰时间可初步分为分泌前修饰与分泌后修饰。
3.1 OMVs的分泌前修饰
与人工合成的脂质体等纳米载体相比,OMVs制备简单,且通过对其亲本细菌进行功能化改造即可改变其分泌的OMVs功能。可考虑以基因工程、代谢工程或亲本细菌膜工程的方法对亲本细菌进行功能化以实现OMVs的分泌前修饰。
OMVs的基因工程策略大多基于蛋白质或融合蛋白在细菌中的转基因表达,这些蛋白质或融合蛋白往往跨膜结构域以保证目标蛋白在OMVs中的富集。早在2004年,研究人员就已成功利用基因工程向OMVs中掺入了外源蛋白[76]。其中,直接向大肠杆菌导入的异源外膜蛋白Ail(一种来自小肠结肠炎耶尔森菌(Yersinia enterocolitica)的外膜黏附素/侵入素)成功掺入大肠杆菌外膜,且在不影响大小的情况下增加了OMVs产量。对于不能定位于细菌外膜的蛋白质,可通过双精氨酸蛋白转运系统(twin arginine transporter system,Tat)将加有Tat信号序列的蛋白质转入周质空间,且Tat信号序列可在周质空间被切除,研究人员利用这种方法成功将GFP蛋白和其他周质蛋白一起装进了OMVs中。基因工程的应用使OMVs在递送蛋白质类分子方面相比于人工合成的纳米载体或动物细胞的胞外囊泡(extracellular vesicles,EVs)极具优势。这些异源蛋白或作为周质蛋白包裹在OMVs中,或通过与外膜蛋白(ClyA、OmpC等)连接表达在OMVs外膜上。其中,表达在OMVs腔体内的蛋白质要么本就是细菌周质蛋白[77-78],要么就需要利用细菌转运体系将目标蛋白从胞质转运至周质空间[72,76,79];对于表达在OMVs膜表面的蛋白质,根据需求的不同可使目标蛋白处于OMVs膜外叶[80-85]或内叶[86-87]。对OMVs的基因工程化改造可使其获得多种功能。例如:通过基因工程敲除lpxL1基因在保留OMVs免疫活性的同时减轻了LPS毒性[88-90];表面表达ClyA-Ag-Fc(Ag为肿瘤抗原)的OMVs作为肿瘤疫苗具有显著的抗肿瘤效果[83];表面表达靶向多肽LyP1提高了OMVs的肿瘤靶向能力,使其肿瘤内化率提升了10%[80];腔内携带重组人肿瘤坏死因子相关细胞凋亡诱导配体(recombinant human tumor necrosis factor related apoptosis-inducing ligand,TRAIL)的OMVs则具有诱导黑色素瘤凋亡的能力[91];表面表达捕获因子SpC和SnC的OMVs可即时捕获用SnT或SnP标签标记的肿瘤新抗原,从而快速构建个性化抗肿瘤纳米疫苗[85]。
通过干扰内源性代谢途径对亲本细菌进行代谢工程改造,也能赋予OMVs新的成分与功能。早在20世纪50年代,研究人员就通过将硒代甲硫氨酸加入到无甲硫氨酸的培养基中使大肠杆菌合成了含硒的蛋白质[92]。通过这种方法,研究人员向细菌或动物细胞蛋白质中掺入了各种生物正交基团,例如以甲硫氨酸替代物高丙炔基甘氨酸、高烯丙基甘氨酸和叠氮高丙氨酸向蛋白质中高效引入了炔烃、烯烃和叠氮化物[93-94]。包括肿瘤细胞在内的大量细胞会用唾液酸化聚糖修饰细胞表面,且在肿瘤外泌体中检测出特定的含唾液酸的糖蛋白[95],基于此,研究人员将肿瘤细胞与可以代谢为唾液酸的四酰化N-叠氮乙酰甘露糖胺(N-azidoacetylmannosaminetetraacylated,ManNAz)共培养,获得了ManNAz修饰的EVs[96]。类似的,将四酰化N-叠氮乙酰半乳糖胺加入细菌培养基中,可通过糖缀合将叠氮基团(N3)引入细菌外膜,进而得到N3修饰的OMVs,N3与二苯并环辛炔基团(dibenzylcyclooctyne,DBCO)间的点击化学反应可使连接在DBCO上的聚乙二醇(polyethylene glycol,PEG)包覆于OMVs表面以掩蔽其免疫原性[82]。此外,细菌可通过OMVs的分泌缓解环境毒性,基于此,研究人员通过向大肠杆菌培养基中添加其无法代谢的磁性氧化铁纳米颗粒(magnetic iron-oxide nanoparticles,MNPs),最终得到了包裹着MNPs的OMVs,这不仅可以利用磁性吸附显著提高OMVs的收货量,还可以得到具有磁靶向能力的磁性OMVs[97]。相比于基因工程,代谢工程操作简单,但同时代谢工程很难控制偶联位点的特异性与效率。
除上述两种策略,直接对亲本细菌进行膜工程化也可能对OMVs膜进行修饰。研究人员发现,使用叠氮修饰的脂质体与亲本细胞进行膜融合,能得到叠氮修饰的EVs以便利用点击化学对其进行功能化[98]。与此策略相似,膜工程技术也被应用于细菌膜的改造。早在2000年,研究人员就通过脂质体与细菌膜融合的方式将妥布霉素递送进细菌胞内克服了细菌耐药性[99],此后膜工程化技术广泛应用于抗菌研究[100-102]。因此,类似于细胞衍生EVs的修饰策略,将脂质体与细菌进行膜融合可将脂质体上携带的功能性脂质或其他膜相关分子转移到细菌膜上,最终得到功能修饰的OMVs。
3.2 OMVs的分泌后修饰
与分泌前修饰相比,分泌后修饰虽然需要更长的时间与进一步的纯化步骤,但其适用面更广,可用于各种分子与配体的修饰。另外,由于细菌菌株与菌种间差异较大,对其膜表面蛋白的研究远不如哺乳动物细胞清晰[103],这不可避免地给基因工程或代谢工程修饰带来了一定阻碍,而分泌后修饰则避开了这个问题。OMVs的分泌后修饰多基于物理相互作用或化学改性的方法,部分修饰还会与分泌前修饰结合。
OMVs的物理修饰主要分为膜融合与脂质插入两种方法。其中膜融合的对象可分为人工合成的脂质体与生物膜囊泡两类。虽然有一些问题需要克服(包括如何提高脂质体与OMVs的融合效率以及如何分离纯化融合产物),但是,与能够大批量定制生产的脂质体融合来对OMVs进行表面改性是一种颇有前景的方法。荧光共振能量转移(fluorescence resonance energy transfer,FRET)常被用于检测膜融合是否成功,若成功,则脂质体膜中含有的互补配对亲脂性荧光分子将被稀释导致供体荧光可被检测[104]。研究人员通过反复冻融法实现了脂质体与EVs的融合,并通过FRET实验进行了验证[105];而PEG 8000诱导的膜融合则使超过60%的膜成分与可溶性内容物成功从脂质体转移到EVs中且保留了EVs原有的内容物[106]。与脂质体融合既不影响OMVs完整性,又可根据需要对脂质体进行定制以对OMVs进行个性化表面修饰。除了脂质体,膜融合技术还可整合两种或多种生物膜以获得具有所需特性的杂化膜囊泡[107]。基于OMVs优秀的佐剂性,已证明在OMVs表面修饰肿瘤抗原以诱导抗肿瘤免疫反应是一种行之有效的策略,而通过膜融合技术将肿瘤细胞膜与OMVs融合得到的具有肿瘤全抗原的疫苗可引发比单一抗原更强的免疫反应。例如,通过超声和挤压将黑色素瘤膜囊泡与大肠杆菌或沙门氏菌的OMVs融合,得到的杂合囊泡继承并整合了两种母体成分的免疫功能,不仅有效激活了DC免疫反应,还诱导了基于细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的强大抗肿瘤特异性免疫,表现出出色的肿瘤预防与治疗效果[108-110]。类似的,与植物类囊体膜融合的OMVs不仅继承了类囊体膜的光动力效果以有效杀伤肿瘤细胞,还表现出增强的免疫刺激与免疫重编程能力,PDT释放的肿瘤抗原与具有佐剂性质的融合囊泡一起诱导了全身性抗肿瘤免疫反应,这不仅进一步对原位肿瘤产生了杀伤还有效抑制了肿瘤转移的发生[111]。
脂质插入是通过与PEG-脂质胶束共孵育将PEG化的脂质插入囊泡中,这项技术最初被用于对脂质体进行表面功能化。其中PEG-脂质胶束中的脂质多指磷脂和胆固醇,二者区别在于插入条件与插入后稳定性不同。而由于相变温度较高,磷脂插入需要更高的活化能,胆固醇插入温度更适用于生物囊泡,但其插入稳定性较差[112]。尽管如此,脂质插入已被用于对生物囊泡进行功能化修饰,因为比起与脂质体膜融合,脂质插入可以使功能分子不必暴露于常规脂质体合成的有机溶剂中。研究人员在EVs表面插入了表皮生长因子受体(epidermal growth factor receptor,EGFR)抗体-PEG-磷脂,其中EGFR抗体的修饰增强了过表达EGFR的肿瘤细胞对EVs的摄取,而PEG的修饰则延长了EVs的血液循环时间[113]。在这项研究中,40℃是平衡插入效率与稳定性后的最佳温度,虽然60℃能获得更高的插入效率,但会对EVs造成损伤。类似的,37℃条件下共孵育3 h将甘露糖-PEG-磷脂插入EVs表面,基于DC表面甘露糖受体对EVs表面的甘露糖的特异性识别成功增加了DC对EVs的摄取,这增强了EVs在小鼠引流淋巴结处的蓄积[114]。与磷脂类似,用胆固醇修饰siRNA能使其插入EVs中,进而利用EVs的药物递送能力实现了对特定基因(如亨廷顿基因、CD45基因或RNA结合蛋白HuR基因等)的沉默[115-117]。与EVs类似,OMVs同样能用脂质插入技术进行修饰。例如,与二硬脂酰基磷脂酰乙醇胺(1,2-dioctadecanoyl-sn-glycero-3-phosphoethanolamine,DSPE)-PEG-生物素或DSPE-PEG-叶酸胶束的共孵育成功实现了对OMVs的表面修饰。但值得注意的是,区别于动物细胞,脂质插入技术仅能对OMVs进行修饰,并不能修饰细菌外膜[118]。可能的原因是细菌外膜大量糖基化的脂质屏蔽了细胞表面,而高曲率的OMVs往往有着脂质堆积缺陷便于插入[119]。脂质插入技术虽然可以避免功能分子暴露于脂质体合成过程中的有机试剂,但稳定性不足与插入效率低等问题仍需解决。
对OMVs的化学改性主要通过功能基团与OMVs膜组分间形成化学键来实现。例如,OMVs表面的酸性残基可与Ca2+发生螯合反应,并作为成核位点促进磷酸钙成核矿化,最终磷酸钙晶体覆盖OMVs表面,矿化的OMVs生物毒性显著降低,克服了血液循环中OMVs的抗体依赖性清除,并且酸敏感的磷酸钙壳可以在肿瘤酸性微环境中溶解释放OMVs抑制肿瘤生长[120]。此外,研究人员利用OMVs表面蛋白上的氨基与活性酯(NHS)的反应抗原将马来酰亚胺(maleimide,Mal)-PEG4-NHS接枝到OMVs表面得到OMV-Mal,OMV-Mal能利用Mal与蛋白质形成稳定的硫醚键(图6a),这使OMVs具备了抗原捕获的功能[121]。在肿瘤原位捕获抗原的OMVs能作为肿瘤原位疫苗激活DC,诱导强效的抗肿瘤免疫反应。类似的,Peng等[91]利用棕榈酸将αVβ3整合素特异性肽RGP与OMVs进行偶联,实现了对表达αVβ3的侵袭性黑色素瘤的特异性靶向。除了OMVs表面自带的可结合位点,还可利用分泌前修饰向OMVs添加结合位点。例如,研究人员利用基因工程技术构建了一种基于OMVs的多功能疫苗平台,该平台通过由标签/捕获蛋白对构成的即插即显示系统来快速在OMVs表面展示多种肿瘤抗原[85]。通过基因工程技术在OMVs表面表达了捕获蛋白SpC/SnC,捕获蛋白可与抗原上连接的标签蛋白SpT/SnT形成共价连接,从而将抗原展示在OMVs表面(图4)。此外,也有研究利用代谢工程向OMVs表面引入可与DBCO发生点击化学反应的N3,然后通过化学修饰将DBCOPEG/Se接到OMVs表面,PEG对OMVs免疫原性的掩蔽增加了其静脉注射的安全剂量[82]。

Fig.4 Schematic illustration of OMVs system for antigen display[85]图4 用于抗原展示的OMVs平台[85]
基于上述对OMVs的修饰改造方法已得到广泛验证,目前的修饰方法中基因工程、膜融合与化学修饰是最具潜力的3种方法。基因工程修饰成本低、稳定性高、无需额外的分离提纯步骤有利于大规模生产,但基因工程局限于蛋白质或多肽,不适用于小分子或脂类的修饰;膜融合效率高、能兼顾表面修饰与载药,然而由于膜结构的差异,与OMVs的膜融合较难;化学修饰主要作用于OMVs表面蛋白质的氨基,适用面广,且通过基因工程等方法在分泌前修饰上化学结合位点较EVs更易操作,另外化学修饰的共价键连接可以避免目标分子与OMVs的轻易分离。总的来说,通过修饰改造赋予OMVs特定功能有利于其实际应用与临床转化。
4 OMVs应用于肿瘤治疗
目前,临床试验中OMVs主要作为疫苗应用于细菌感染的防治,且已进入临床应用阶段[7-8,64-66]。在抗肿瘤研究中,OMVs既能作为载体用于抗肿瘤药物的递送,也能作为免疫调节剂重塑肿瘤免疫微环境、激活机体自身免疫反应以协同化疗/PDT等疗法抑制肿瘤生长;而在肿瘤疫苗领域,OMVs可同时作为疫苗纳米载体和佐剂以激起强效的肿瘤特异性免疫反应。更重要的是,仅OMVs自身就能通过诱导肿瘤细胞死亡、调节免疫等手段起到一定抑制肿瘤生长的作用。因此,本节将对OMVs的载体优势,OMVs对肿瘤的杀伤作用,OMVs作为载体、免疫调节剂、佐剂等在肿瘤治疗中的应用进行综述。
4.1 OMVs的载体优势
易于修饰的特点及自身性质使OMVs被广泛作为抗肿瘤药物递送载体研究。首先,尺寸效应使OMVs本身就具有一定肿瘤靶向能力;其次,靶向修饰可进一步的增加OMVs对特定细胞的靶向性;最后,表面PAMPs分子与纳米级的粒径使得OMVs兼具佐剂性与淋巴滞留能力,这可以极大地协同抗原增强抗肿瘤免疫反应。
与表面修饰类似,对OMVs进行药物装载同样可分为分泌前装载与分泌后装载两类方法。分泌前加载是对细菌进行处理以得到封装有药物的OMVs,这种方法主要用于易变性的生物分子。例如,研究人员在细菌培养过程加入庆大霉素,利用细菌会通过OMVs排出有害物质的性质,得到了封装有庆大霉素的OMVs[122],而利用基因工程则可使OMVs高效加载蛋白质类药物[91]。分泌后加载是将药物封装入已分离提纯的OMVs中,脂双层结构使OMVs既可封装疏水药物又可封装亲水药物。通过与药物共孵育,疏水性小分子药物可封装在OMVs膜内,同时带正电的小分子药物可利用静电吸附作用封装在OMVs膜上;而通过电穿孔、超声处理、物理挤出或渗透处理等方法可使OMVs封装亲水性药物分子[80-81,123]。
作为载体,OMVs可靶向肿瘤部位(图5):OMVs表面富集的PAMPs使其易被血液循环中的中性粒细胞吞噬,而由于中性粒细胞具有炎性靶向能力,因此OMVs可利用中性粒细胞靶向炎性肿瘤组织。值得注意的是,到达炎性肿瘤后,OMVs可通过中性粒细胞胞外陷阱(neutrophil extracellular traps,NETs)形成过程中被释放出来且不影响活性,这使得OMVs具有天然的肿瘤靶向能力[124]。同时,20~250 nm的粒径使OMVs可以自由循环至淋巴结,表面富集的PAMPs使其易于被DC摄取滞留淋巴,并诱导Th1型免疫反应[125-126]。基于此,研究表明随插随显示的OMVs抗原展示平台在小鼠体内有明显的淋巴蓄积现象,激活了有效的抗肿瘤免疫反应[85]。此外,OMVs可以通过毛囊途径和表皮渗透两种途径穿过角质层到达真皮层,这赋予了其独特的优势作为透皮药物递送载体[127-130]。基于此,研究人员利用OMVs将光敏剂吲哚菁绿(indocyanine Green,ICG)与TRAIL以经皮给药的方式递送至黑色素瘤,成功抑制了肿瘤的生长[91]。

Fig.5 Schematic illustration showing the chemotaxis-driven delivery of NPNs for complete eradication of tumors post-phototherapy[124]图5 炎症趋向的中性粒细胞递送纳米颗粒,用于PTT治疗后肿瘤的根除[124]
综上所述,OMVs的佐剂性与淋巴蓄积能力有利于其在肿瘤免疫治疗中作为药物或抗原的载体,而其肿瘤靶向能力与角质层穿透能力使得OMVs也可用于递送化疗药、光敏剂等药物进行肿瘤治疗。
4.2 OMVs对肿瘤的直接杀伤
在抗肿瘤研究中,OMVs自身就对肿瘤具有一定的杀伤效果。PAMPs的富集使OMVs可通过受体激活的死亡途径在细胞层面可诱导细胞发生焦亡或凋亡。首先,有研究表明,OMVs通过内吞途径进入宿主细胞后可在早期内体阶段将LPS释放到胞质中,继而在GBPs的帮助下激活Caspase-11,引起细胞焦亡并释放炎性因子IL-1β,修饰后的LPS则不具有激活Caspase-11的能力[55,57-58,60]。其次,细菌OMVs可诱导细胞线粒体膜电位降低,引发线粒体功能障碍,进而导致线粒体凋亡、炎症小体激活,最终触发细胞凋亡[131]。最后,致病菌OMVs可递送毒力因子诱导细胞死亡,例如:致病型大肠杆菌OMVs上携带的细胞质酶HlyF可通过阻断细胞自噬体与溶酶体的融合阻断自噬,激活非经典炎症小体途径,诱导细胞死亡[132]。值得注意的是,细胞可通过多种途径抑制由OMVs诱导的细胞死亡[133-135]。因此,OMVs诱导的细胞死亡受多种因素影响,包括OMVs的组分构成、PAMPs分子的相对浓度以及宿主细胞敏感度等。
此外,OMVs在活体层面也有一定的肿瘤抑制效果,这主要归功于OMVs对机体免疫系统的激活。首先,OMVs可以诱导肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)向促炎M1型巨噬细胞极化[82,120];其次,OMVs可招募包括NK细胞、T细胞在内的多种免疫细胞,这既能逆转肿瘤区域免疫抑制性的微环境也能在肿瘤区域诱导γ干扰素(IFN-γ)的产生以介导肿瘤凋亡[136]。然而,IFN-γ在介导肿瘤细胞凋亡的同时会上调肿瘤细胞程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)的表达,这抑制了T细胞活性并最终降低了抗肿瘤效果[137-140]。针对这个问题,研究人员通过基因工程化修饰得到了程序性死亡受体1(programmed cell death protein 1,PD-1)修饰的OMVs,在保留OMVs肿瘤杀伤能力的同时通过对肿瘤细胞表面PD-L1的封闭解除了肿瘤细胞对T细胞的功能抑制,显著提高了肿瘤抑制效果[80,84]。类似的,通过基因工程得到的表面表达CD47抗体的OMVs不仅能封闭肿瘤表面CD47分子以解除其对巨噬细胞的吞噬抑制,还能作为桥梁连接巨噬细胞与肿瘤细胞以增强吞噬,该工程化的OMVCD47nb在小鼠体内重塑了肿瘤微环境且激活了肿瘤特异性免疫反应,在有效抑制肿瘤生长的同时诱导了对肿瘤的长期免疫记忆[82]。
总之,OMVs对机体免疫系统的激活使其具有一定抗肿瘤效果,当OMVs作为载体时,这种效果能很好地增强其他肿瘤治疗方法的疗效。
4.3 OMVs激活免疫协助增强抗肿瘤效果
OMVs对机体免疫系统的调节作用使其在抗肿瘤研究中大有可为。首先,OMVs对免疫细胞的强烈刺激可对免疫抑制性的肿瘤微环境进行重编程,这可增强化疗、光动力等对肿瘤的抑制效果。其次,OMVs的佐剂性及淋巴靶向性使其在肿瘤疫苗的应用中有着广泛应用前景。因此,OMVs主要作为递送载体、免疫调节剂、佐剂等应用于临床前抗肿瘤研究(表1)。

Table 1 Application of OMVs in tumor treatment表1 OMVs应用于肿瘤治疗
在肿瘤治疗中,OMVs不仅可作为纳米递送载体增加抗肿瘤药物的利用率并降低药物副作用,还可以作为免疫调节剂激活机体免疫反应以协同增强化疗、PDT等抗肿瘤疗法的疗效。早在2014年,研究人员利用基因工程化的接有肿瘤靶向肽的减毒OMVs向肿瘤部位递送了小干扰RNA(small interfering RNA,siRNA),有效抑制了肿瘤生长[141]。此后,OMVs被广泛用于抗肿瘤药物的递送。例如,载有光敏剂二氢卟吩e6(chlorin e6,Ce6)和化疗药阿霉素(doxorubicin,DOX)的OMVs作为治疗平台,通过光动力、化疗与免疫疗法的有机协同实现了对小鼠三阴性乳腺肿瘤的完全抑制,并成功防止了肿瘤转移的发生[142]。负载黑色素的OMVs有着良好的光热转换效率,其不仅可在近红外激光的照射下对肿瘤进行局部加热以杀死肿瘤,还可利用多光谱光声断层扫描技术(multispectral optoacoustic tomography,MSOT)对肿瘤组织进行光声成像[143]。总之,OMVs不仅能作为载体将光敏剂、化疗药等抗肿瘤药物递送至肿瘤部位,还能激活免疫反应以增强抗肿瘤效果[144-147]。
在肿瘤疫苗研究中,OMVs同时作为疫苗纳米载体与免疫佐剂来增强由针对肿瘤抗原的特异性免疫反应。作为载体,工程化的OMVs既可以快速捕获多种肿瘤抗原,又可以靶向淋巴结并增强DC对抗原的摄取,同时OMVs能作为佐剂进一步增强肿瘤特异性免疫反应,强效的免疫反应消除了小鼠皮下肿瘤并抑制了肿瘤的转移[85,148]。类似的,利用OMVs向DC递送抗原mRNA能引起有效的抗肿瘤免疫反应,成功实现了对肿瘤的抑制并诱导了长期免疫记忆的产生[149]。然而由佐剂诱导的DC快速成熟会导致其摄取能力降低,这种现象被称为成熟诱导的摄取阻塞(maturation-induced uptake obstruction,MUO)。对此,研究人员通过在OMVs修饰上葡萄球菌蛋白A的结构域B(domain B of staphylococcal protein A)以结合αDEC205抗体的Fc端,而αDEC205抗体的Fab端与DC表面DEC205(CD205,一种具有抗原呈递功能的内吞受体)的结合使OMV-DEC能通过异位摄取途径突破MUO的限制。因此,DC对OMV-DEC表现出比OMVs更强的摄取能力,这增强了OMV-DEC对抗原的呈递能力,激活了更强的抗肿瘤免疫反应,成功抑制了黑色素瘤的生长与转移[150]。作为细菌分泌物,OMVs可由肠道细菌原位产生,因此,研究人员开发了一种阿拉伯糖诱导型基因工程化大肠杆菌作为口服型肿瘤疫苗。大肠杆菌在小鼠肠道原位产生负载肿瘤抗原的OMVs,其可穿过肠上皮细胞屏障,刺激DC成熟,并进一步激活肿瘤特异性免疫反应以杀伤肿瘤细胞。在小鼠模型中,该疫苗不仅实现了对肿瘤的抑制,原位产生的方式还使其避免了分离提纯的繁琐步骤,有效降低了生产成本[83]。而为了实现个性化治疗,可将OMVs与肿瘤细胞膜或肿瘤外泌体融合,得到的杂化囊泡作为个性化肿瘤疫苗能诱导强烈的适应性免疫反应,提高小鼠生存率并提供对肿瘤的长期防护[109-110,146,148,151-152]。进一步的,OMV-Mal可在肿瘤原位捕获PTT后释放的肿瘤抗原,并将之递送至DC以引发肿瘤特异性免疫反应(图6b)。这种策略不仅通过增强抗原摄取、刺激DC成熟等手段增强了免疫反应,还实现了免疫疗法与PDT、PTT、化疗等治疗方法的协同[121]。综上所述,在肿瘤疫苗研究中,OMVs作为具有内在免疫佐剂性质的纳米载体被广泛用于递送肿瘤抗原,引发强效的抗肿瘤特异性免疫反应。
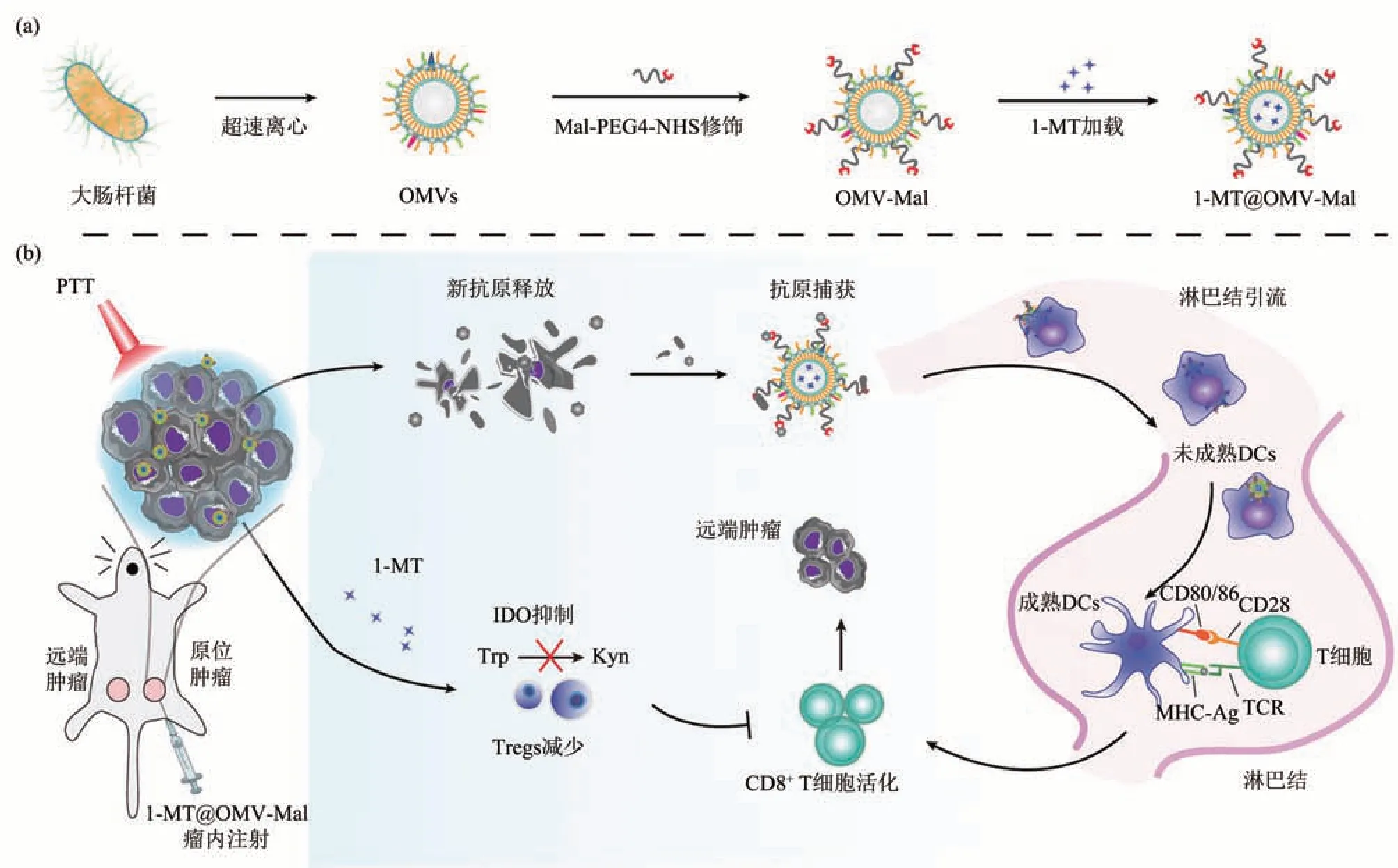
Fig.6 Schematic illustration of preparation of 1-MT@OMV-Mal and in situ vaccine after PTT[121]图6 1-MT@OMV-Mal的制备与光热治疗后原位疫苗作用示意图[121]
5 总结与展望
综上所述,易于修饰、强佐剂性的细菌OMVs在肿瘤治疗中有着广大前景。作为载体,OMVs在提升药物肿瘤蓄积的同时还能通过激活免疫反应对肿瘤进行一定杀伤;作为疫苗组分,OMVs不仅可作为佐剂激活DC还能增强DC对抗原的摄取。并且,OMVs易于修饰改造的特性也有助于构建多功能OMVs体系以更好地抑制肿瘤生长。
尽管OMVs在肿瘤治疗领域有着许多优势,但仍有一些临床应用上的困难需要克服。首先,OMVs的具体成分难以控制且产量较低。其次,OMVs本身具有一定生物毒性,这限制了其使用剂量。最后,在肿瘤疫苗研究中,肿瘤抗原表达量较低以及针对OMVs自身产生的免疫反应可能会影响肿瘤疫苗的效力。
虽然如此,目前,研究人员已通过多种手段对OMVs产量及毒性问题进行了优化,比如,通过敲除Lpp基因可以有效提高OMVs产量,而敲除msbB基因或者对OMVs进行表面修饰则可以得到低毒性的OMVs。未来,随着对OMVs生物发生机理、OMVs与免疫系统的相互作用等研究的不断深入,将有望解决机体产生OMVs特异性免疫反应干扰抗肿瘤效果的问题。同时,细菌易于基因修饰的特性使得人们能通过基因工程的手段同时克服上述问题。因此,未来OMVs将很可能作为具有免疫调节作用的药物载体或者具有佐剂作用的抗原载体应用于肿瘤的临床治疗。