血清色氨酸、酪氨酸与阿尔茨海默病之间的关系
2024-02-26任蜀江敬小钧张华
任蜀江 敬小钧 张华
(重庆医科大学附属第一医院神经内科,重庆 400016)
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的神经退行性疾病,也是老年性痴呆最主要的原因,其发生及进展机制目前尚不明确。越来越多的研究表明,代谢物紊乱与AD的发生、发展密切相关[1-4]。在AD的疾病进展过程中,许多代谢途径受到影响,包括能量代谢、脂质代谢、神经递质等[5]。脑葡萄糖代谢受损发生在AD认知功能障碍发作前数十年[6-7]。越来越多的证据支持胰岛素抵抗可促进AD发病机制的概念,因此,AD可被视为部分由脑胰岛素和胰岛素样生长因子抵抗介导的代谢性疾病[5]。为研究代谢物与疾病发生和进展之间的关系,AD代谢组学联盟(Alzheimer’s Disease Metabolomics Consortium,ADMC)与AD神经成像倡议(Alzheimer’s Disease Neuroimaging Initiative,ADNI)合作,正在为ADNI-1队列中的患者创建一个全面的生化数据库[8]。
皮质下单胺能系统结构和功能的异常与AD的病理生理学之间有着令人信服的联系。研究发现,改善单胺能系统,既可以恢复认知功能,又可以减少神经退行性动物模型中与AD相关的病理改变[9-10]。而色氨酸(tryptophan,Trp)、酪氨酸(tyrosine,Tyr)均为单胺类神经递质(多巴胺、去甲肾上腺素、5-羟色胺(5-HT))的前体物质。动物实验表明,大鼠大脑中单胺能神经元合成神经递质的速度取决于氨基酸前体色氨酸(用于5-HT)和酪氨酸(用于多巴胺和去甲肾上腺素)的可用性[11]。
色氨酸、酪氨酸均可通过特定的主动转运系统通过血脑屏障进入大脑[12]。越来越多的研究表明,体外补充色氨酸、酪氨酸有利于认知功能的改善[12-15]。AD的小鼠模型中,摄入Trp-Tyr肽还抑制了小胶质细胞炎症和β淀粉样蛋白(Aβ)的累积,从而改善认知能力下降[16]。目前,AD患者血清色氨酸、酪氨酸减少已得到充分证明[17]。
然而,血清色氨酸、酪氨酸是否能作为AD外周生物标志物仍需进一步探讨。本研究利用来自ADNI数据库的实验数据分析了在认知正常(cognitive normal,CN)组、稳定性轻度认知功能障碍(stable mild cognitive impairments,sMCI)组、进行性认知功能障碍(progressive mild cognitive impairments,pMCI)组和AD所致痴呆组血清色氨酸、酪氨酸水平差异,检验了血清色氨酸、酪氨酸对AD是否具有诊断价值,通过简易精神状态检查(mini-mental state examination,MMSE)、阿尔茨海默病评估量表认知分量表(Alzheimer’s disease assessment scale cognitive subscale,ADAS-cog 13)、磁共振成像(magnetic resonance imaging,MRI)和18F-氟脱氧葡萄糖正电子发射断层扫描(18F-fluorodeoxyglucose positron emission tomography,FDG-PET)等数据,分析了血清色氨酸、酪氨酸与脑脊液(cerebrospinal fluid,CSF)核心标志物、认知、脑结构和脑代谢之间的关系。
1 数据来源与分析方法
1.1 数据来源
本文所用数据来自ADNI数据库(http://adni.loni.usc.edu)。ADNI是一项持续的纵向研究,于2003年启动,作为公私合作伙伴关系推出,由首席研究员Michael W. Weiner领导。ADNI的主要目标是测试序列MRI、正电子发射断层显像(positron emission tomography,PET)、其他生物标记以及临床和神经心理学评估是否可以结合起来,以测量轻度认知功能障碍(mild cognitive impairment,MCI)和早期AD的进展。ADNI的参与者是从美国和加拿大的59个地点招募。这项研究得到了所有参与机构/研究网站的机构审查委员会的批准。获得了每个站点所有参与者的知情书面同意。如需更多信息,请访问http://www.adni-info.org。
在这项研究中,参与者由55~90岁的AD、MCI和健康对照者组成,他们完成了腰椎穿刺、MMSE、ADAS-cog13、临床痴呆评分(clinical dementia rating,CDR)和MRI。根据ADNI提供的临床和行为测量,本文选取其中一个队列(ADNI-1),除了数据库对CN(n=207)、MCI、AD(n=186)的分类外,本文根据随访期间病程是否进展将MCI分为sMCI(n=201)、pMCI(n=171)。
1.2 ADNI数据库使用的实验方法
1.2.1 分类标准
CN、MCI或AD痴呆症的诊断是根据认知评估进行的,具体的纳入和排除标准在既往的报告中已有详细描述[18]。CN受试者没有记忆力缺陷,而MCI和AD痴呆症受试者确实有记忆力缺陷。CN的标准包括MMSE评分介于24和30之间,CDR评分为0[19]。MCI的标准包括存在主观记忆缺陷,MMSE评分在24至30之间,CDR为0.5,日常生活活动保持,无痴呆[20]。除了可能AD的NINCD/ADRDA标准外,AD痴呆患者的MMSE评分在20和26之间,CDR为0.5或1.0[21-22]。本文将sMCI定义为在至少2年的随访期间未进展为AD的MCI受试者,将pMCI定义为在随访期间的任何时间进展为AD的MCI受试者。排除了在基线时被诊断为MCI但在随访期间恢复为CN的受试者,以及在基线时被诊断为AD但在随访期间恢复为MCI 的受试者。
1.2.2 血清色氨酸、酪氨酸测定
在隔夜禁食后,在CSF采集前的上午8点采集血液标本,立即放在干冰上,并于同一天运送到宾夕法尼亚大学的ADNI生物标志物核心进行处理。使用Absolute IDQ-p180试剂盒(BIOCRA TES Life Science AG,Innsbruck,Austria)和超高效液相色谱(UPLC)/MS/MS系统,采用靶向代谢组学方法定量测量血清代谢物。AbsoluteIDQ-p180试剂盒已根据欧洲医药机构生物分析方法验证指南进行了充分验证。氨基酸使用苯基异硫氰酸酯衍生化,并使用AB SCIEX 4000 QTrap质谱仪(AB SCIEX,Darmstadt,Germany)通过液相色谱串联质谱(HPLC-MS/MS)进行电喷雾电离分析[23-24]。以μmol/L为单位测量每种代谢物的浓度。
1.2.3 CSF中t-tau、p-tau181测定
使用多重xMAP-Luminex平台(Luminex Corp,Austin,TX,USA)和Innogenetics INNOBIA AlzBio3免疫分析试剂定量测定CSF磷酸化tau蛋白(phosphorylated-tau at threonine,p-tau)和总tau蛋白(total-tau,t-tau)。有关CSF采集和测量的ADNI方法以及质量控制程序的更多详细信息,请访问http://www.adni-info.org。
1.2.4 认知功能评估
受试者的认知功能由MMSE和ADAS-cog13评分评估。所有受试者都进行了5次评分:基线、12、24、36和48个月。
1.2.5 神经影像学方法
MRI协议,包括扫描仪规格、图像采集和图像处理,详见www.adni-info.org。简而言之,协议包括T1加权MR图像,包括1.25 mm×1.25 mm平面空间分辨率的矢状体积3D MPRAGE,1.2 mm厚的矢状切片,8°翻转角度,目标TR约为8.9 mm,TE约为3.9 ms[25]。本文使用海马和脑室体积来表示神经系统退行性病变。选择了5个时间点的成像数据:基线、12个月、24个月、36个月和48个月。
1.2.6 脑代谢
利用FDG-PET研究脑葡萄糖代谢。ADNI中PET成像数据的获取和处理参照Lovelace等[26]的描述。注射后30~60 min采集FDG图像数据,并在预处理后从ADNI网站下载图像。使用外侧和内侧前额叶、前扣带和后扣带区域以及外侧顶叶和外侧颞叶的平均计数来估计每个参与者的FDG标准化吸收值比值(standardized uptake value ratio,SUVR)。FDG-PET图像数据是在基线和12个月、24个月、36个月和48个月时获得的。
1.3 统计方法
利用方差分析和卡方检验分析组间基线人口统计学显著差异。采用LSD检验分别分析色氨酸、酪氨酸各组间差异。Spearman相关性用于分析色氨酸、酪氨酸与其他AD核心标志物之间的关系。使用ROC曲线分析获得每个生物标记物的总体诊断准确率(曲线下面积,AUC)。使用bootstrap方法分析来自所有两对不同变量的两个AUC之间的潜在差异。色氨酸、酪氨酸与AD发病率之间的相关性通过使用调整年龄和性别的比例风险回归分析计算95%置信区间(CIs)的风险比(HRs)来评估。在进行Cox比例风险回归分析时,根据每个生物标志物的中位数将血清色氨酸、酪氨酸分为两组。用线性混合效应模型分别分析血清色氨酸、酪氨酸水平与纵向脑代谢、脑结构和认知的关系。然后将截距(基线值)和斜率(变化率)用作线性回归模型中的结果,其中分别将色氨酸、酪氨酸作为预测因子(分析血清色氨酸、酪氨酸与脑代谢之间关系时调整年龄、性别;分析血清色氨酸、酪氨酸与脑室容积之间关系时调整年龄、性别、颅内容积;分析血清色氨酸、酪氨酸与海马体积之间关系时调整年龄、性别、脑室容积及颅内容积;分析血清色氨酸、酪氨酸与认知之间的关系时调整年龄、性别、受教育程度)在诊断组内。所有统计数据均使用SPSS 22版进行。所有分析的统计显著性定义为P<0.05。
2 结果
2.1 人口统计学结果
本文研究对象的基线人口统计学、生物标志物的差异如表1所示。各组间年龄无明显差异。各组间性别、受教育年限、APOEε4基因型个体百分比、生物标志物水平、平均MMSE、平均ADAS-cog13、脑室体积、海马体积和全脑体积均具有显著差异(表1)。

Table 1 Demographics of subjects at baseline
2.2 血清色氨酸、酪氨酸各组间差异
与CN组相比,AD组(71.03±14.54 )μmol/L(P<0.01)、pMCI组(69.97±15.66)μmol/L(P<0.001)和sMCI组(72.55±15.72)μmol/L(P<0.05)血清色氨酸水平均显著低于CN组(74.88±13.7)μmol/L。然而,sMCI组与pMCI组之间以及sMCI组与AD组之间血清色氨酸水平无显著差异。pMCI组和AD组之间血清色氨酸水平亦无显著差异。AD组(81.12±18.43)μmol/L(P<0.01)和pMCI组(82.69±17.78)μmol/L(P<0.05)血清酪氨酸水平均明显低于CN组(86.48±21.19)μmol/L。然而AD组与sMCI组、pMCI组之间,sMCI组与CN组、pMCI组之间无显著差异(图1)。
2.3 血清色氨酸、酪氨酸分别与Tau的关系
在CN组(Try,r=0.146,P=0.148;Tyr,r=-0.056,P=0.583)、sMCI组(Try,r=-0.082,P=0.433;Tyr,r=0.049,P=0.644)、pMCI组(Try,r=-0.134,P=0.220;Tyr,r=-0.113,P=0.301)、AD组(Try,r=-0.113,P=0.275;Tyr,r=0.018,P=0.860)中,血清色氨酸和酪氨酸与脑脊液t-tau之间均无显著相关性(图2a,c,e,g)。不同诊断组血清色氨酸和酪氨酸与脑脊液P-Tau之间亦无显著相关性(CN:Try,r=0.149,P=0.140;Tyr,r=-0.066,P=0.514;sMCI:Try,r=-0.092,P=0.378;Tyr,r=0.036,P=0.731;pMCI:Try,r=-0.129,P=0.239;Tyr,r=-0.114,P=0.297;AD:Try,r=-0.123,P=0.234;Tyr,r=-0.020,P=0.844),(图2b,d,f,h)。
2.4 血清色氨酸、酪氨酸和脑脊液核心标志物对MCI及AD诊断的准确性
进行ROC分析,检测血清色氨酸、酪氨酸、CSF t-tau和CSF p-tau与sMCI、pMCI和AD临床诊断的相关性。与CN相比,CSF t-tau和p-tau对sMCI(表2和图3a)、pMCI(表2和图3b)和AD(表2和图3c)有显著的诊断准确性。血清色氨酸对pMCI(表2和图3b)、AD(表2和图3c)有显著的诊断准确性,而对sMCI(表2和图3a)无显著诊断准确性。血清酪氨酸仅对AD(表2和图3c)具有显著诊断的准确性,而对sMCI(表2和图3a)、pMCI(表2和图3b)均无诊断价值。与单独的CSF t-tau、CSF p-tau相比,血清色氨酸、酪氨酸分别与CSF t-tau或CSF p-tau的组合能提高对sMCI、AD诊断的准确性(表2和图3a,c),但没有统计学差异。与单独的CSF t-tau相比,血清色氨酸、酪氨酸分别与CSF t-tau的组合能提高对pMCI诊断的准确性(表2和图3b)。与CSF p-tau相比,血清色氨酸、酪氨酸分别与CSF p-tau的组合并不能提高对pMCI诊断的准确性(表2和图3b)。

Fig.2 Serum tryptophan and tyrosine in relation to CSF tau
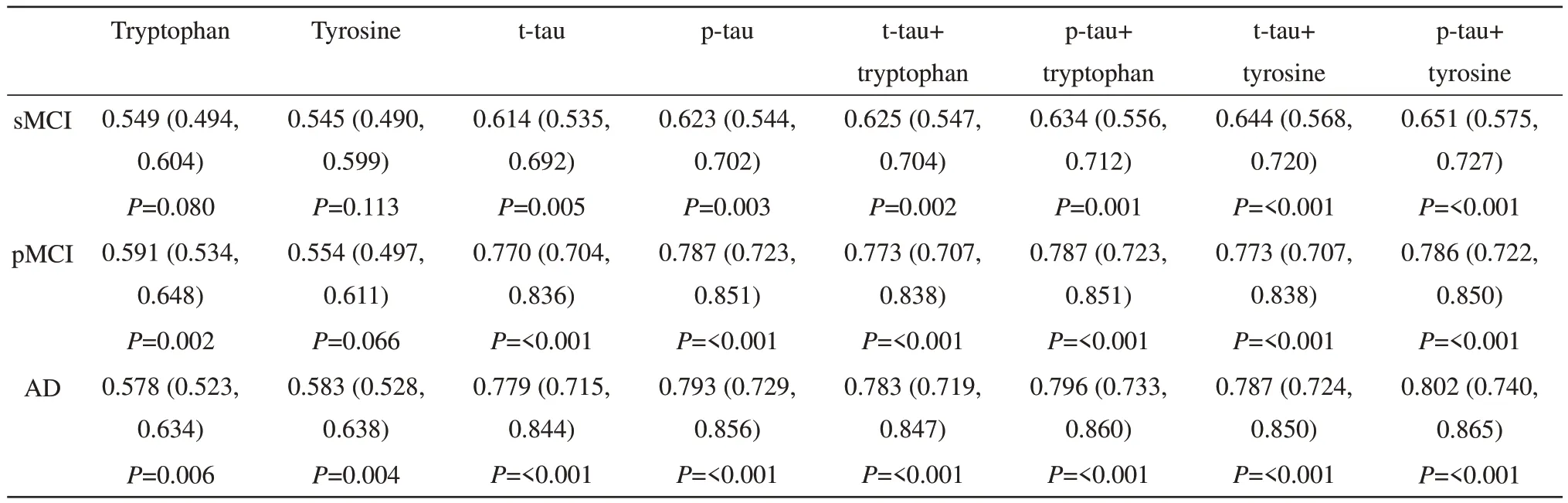
Table 2 AUC of biomarkers
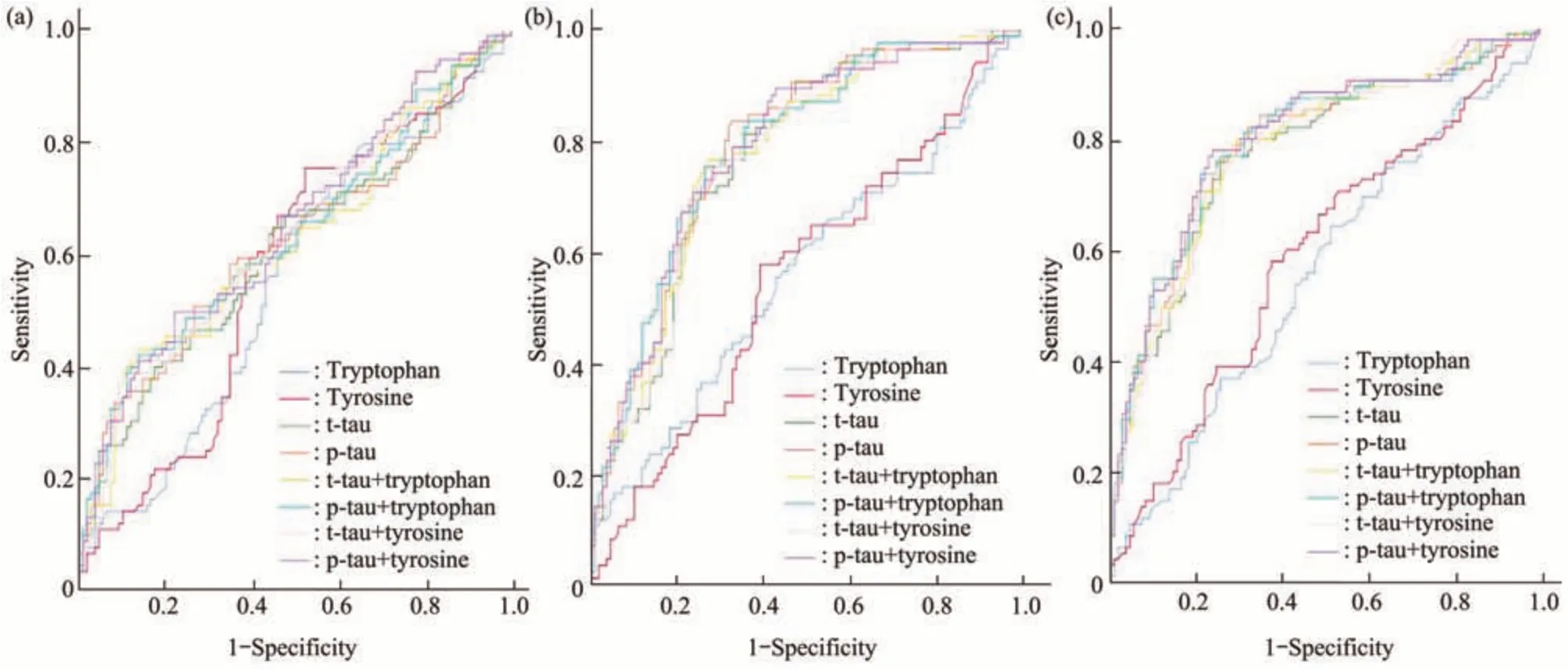
Fig.3 ROC analyses
2.5 血清色氨酸、酪氨酸是否能预测MCI向AD转化
本文研究了血清色氨酸、酪氨酸是否能预测MCI到AD的转化。校正性别、年龄和受教育年限后,对作为连续变量的血清色氨酸、酪氨酸进行Cox比例风险回归。使用血清色氨酸、酪氨酸的中位值作为阈值,计算血清色氨酸、酪氨酸的HRs作为二分变量。结果表明,血清色氨酸、酪氨酸均不能预测MCI向AD的转化(图4a,b)。

Fig.4 Baseline serum measures of tryptophan and tyrosine as a predictor of conversion from MCI to AD
2.6 血清色氨酸、酪氨酸与认知功能之间的关系
在各诊断组中,血清色氨酸与基线时的MMSE、ADAS-cog13评分或随访期间MMSE、ADAS-cog13的变化率无关(图5a,b,e,f)。同样的,血清酪氨酸与基线时的MMSE、ADAS-cog13评分或随访期间MMSE、ADAS-cog13的变化率亦无关(图5c,d,g,h)。

Fig.5 Serum tryptophan and tyrosine in relation to cognition and future cognitive change
2.7 血清色氨酸、酪氨酸与脑结构、脑代谢之间的关系
最后,本文探索了血清色氨酸、酪氨酸与通过MRI测得的脑室容积、海马体积和通过FDG-PET测得的脑代谢之间的关系。在各诊断组中,血清色氨酸、酪氨酸与基线时的脑室容积、海马体积没有相关性(图6a,c,e,g),与随访期间脑室容积、海马体积的变化率亦没有相关性(图6b,d,f,h)。同样的,血清色氨酸、酪氨酸与基线时的FDG-PET、随访期间FDG-PET的变化率均没有相关性(图6i,j-l)。
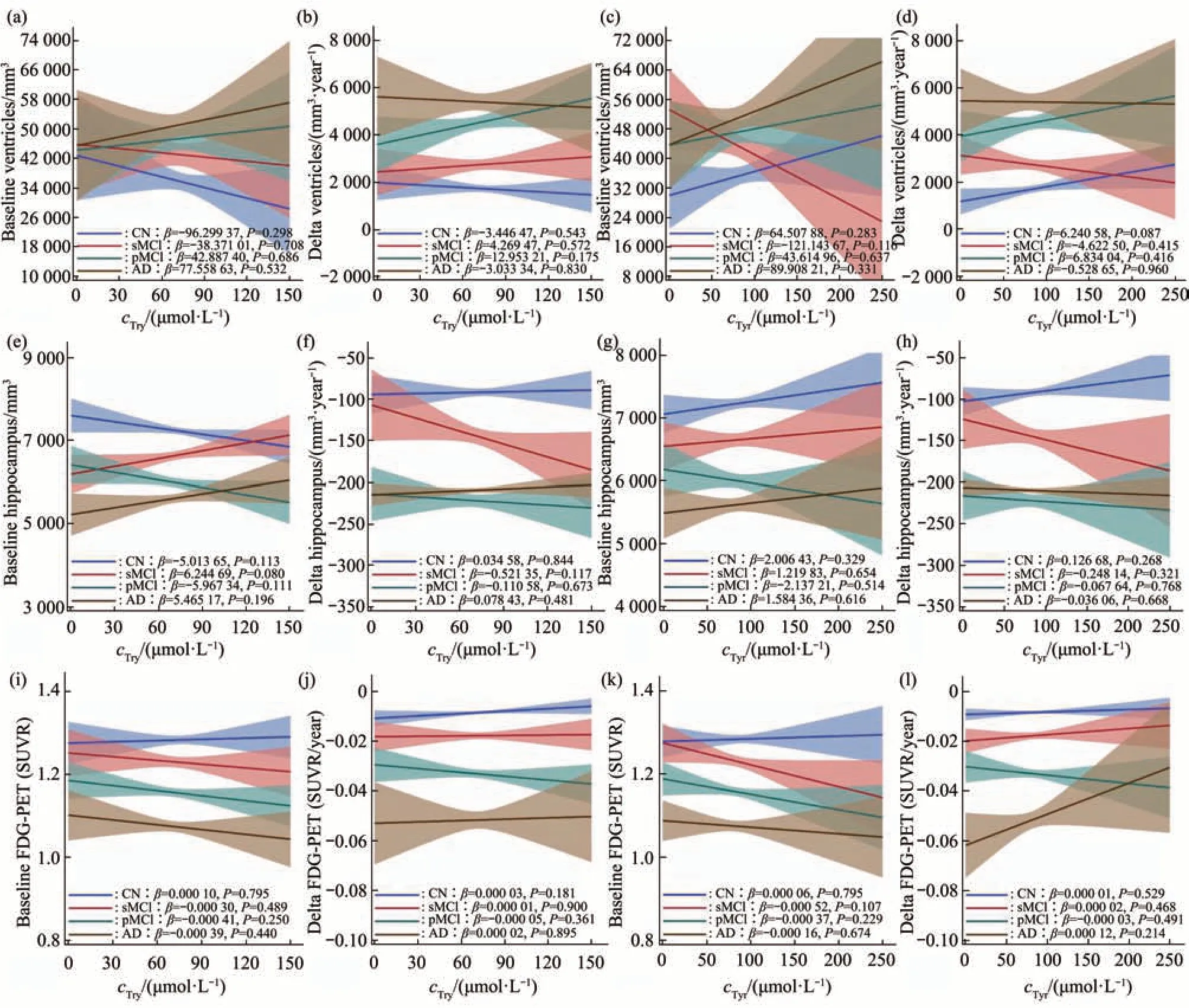
Fig.6 Serum tryptophan and tyrosine in relation to brain structure and FDG-PET
3 讨论
本文分析了ADNI-1队列中血清色氨酸、酪氨酸与AD的诊断、核心生物标志物、脑结构、认知功能及脑代谢之间的关系。分析结果表明:与CN组相比,AD组、pMCI组和sMCI组血清色氨酸水平明显偏低;与CN组相比,AD组和pMCI组血清酪氨酸水平明显偏低。在各诊断组中,血清色氨酸、酪氨酸与tau蛋白无相关性。血清色氨酸对pMCI、AD均具有诊断准确性;血清酪氨酸对AD具有诊断准确性。血清色氨酸、酪氨酸均不能预测MCI向AD的转化。血清色氨酸、酪氨酸与认知功能、脑结构、脑代谢均无明显关系。
越来越多研究表明,AD是一种代谢性疾病,受影响的代谢途径包括能量代谢、脂质代谢、氨基酸代谢、神经递质代谢、激素代谢等[23,27]。色氨酸是必须由饮食供给的必需氨基酸,是5-HT、褪黑素及犬尿氨酸(KYN)的前体物质[10,26-27]。色氨酸主要通过5-HT途径和犬尿氨酸途径(KP)分解代谢成多种生物活性代谢物[28]。色氨酸被色氨酸羟化酶(TPH)催化为5-羟基色氨酸(5-HTP),5-HTP经芳香脱羧酶催化产生5-HT。5-HT最终可转化为褪黑素。KP是色氨酸代谢的主要分解代谢途径。在吲哚胺2,3-双加氧酶(IDO-1)或色氨酸2,3-双加氧酶(TDO)作用下将色氨酸转化为N-甲酰基犬尿氨酸,然后产生KYN、犬尿酸(KYNA)、喹啉酸(QUIN)、烟酰胺腺嘌呤二核苷酸(NAD+)等。5-HT能神经元的缺失与AD的严重程度、记忆功能障碍和精神症状相关[29]。褪黑素在AD的动物模型中可以防止β淀粉样蛋白肽的毒性聚集[30-31]。补充褪黑素,可以改善睡眠质量[32]。研究表明,睡眠障碍会导致中老年人AD的患病风险增加[33]。KP的过分激活会导致包括KYNA在内的神经毒性产物在神经胶质细胞中的累积[10]。NAD+在线粒体能量代谢中起着重要的作用[1]。在神经免疫反应期间能量需求大幅增加,故KP是大脑免疫系统的关键调节器[34]。色氨酸代谢物还具有影响小胶质细胞和相关细胞因子的能力,以调节引发AD促炎细胞毒性的神经炎症和神经免疫因子[28]。急性色氨酸耗竭通过降低其前体L-色氨酸的可用性,导致大脑中5-HT合成暂时整体减少[35]。有研究表明,在AD和帕金森病(PD)的色氨酸耗竭实验期间,整体认知状态会降低[36]。
酪氨酸是去甲肾上腺素和多巴胺的前体物质。酪氨酸被限速酶酪氨酸羟化酶转化为l-3,4-二羟基苯丙氨酸,然后催化成多巴胺。在β羟化酶将多巴胺转化为去甲肾上腺素。由于酪氨酸羟化酶仅约75%被酪氨酸饱和,酪氨酸的膳食补充可以增加多巴胺和去甲肾上腺素的合成和传递[37]。多巴胺和去甲肾上腺素均为儿茶酚胺类神经递质。去甲肾上腺素可以通过β肾上腺素能依赖性诱导生长因子和p-tau去除直接预防Aβ诱导的毒性作用。在动物模型中,产生去甲肾上腺素和多巴胺的蓝斑损伤诱导淀粉样斑块周围的星形胶质细胞增生和小胶质细胞增生以及细胞因子和促炎因子的释放。总之,AD中的儿茶酚胺能损伤在神经退行性和神经炎症过程中起着关键作用[38]。实验表明,补充酪氨酸可逆转应激或认知需求下的认知能力下降[13-15]。小鼠实验表明含Trp-Tyr的肽可穿透大脑,抑制单胺氧化酶B(MAO-B)活性并增加大脑中的多巴胺(DA)水平,从而预防与年龄相关的认知能力下降[39]。早在1989年,一项针对血浆氨基酸的研究表明,AD患者血浆色氨酸、酪氨酸浓度均低于正常对照组[40]。
本文的分析结果表明,与CN组相比,AD组、pMCI组、sMCI组的血清色氨酸显著降低,但pMCI与sMCI组、pMCI组与AD组之间无显著差异。与CN组相比,AD组、pMCI组的血清酪氨酸显著降低,但CN组与sMCI组之间,sMCI组与pMCI组、AD组之间,pMCI组与AD组之间均无明显差异。上述结果提示在AD的疾病进展过程中,血清色氨酸、酪氨酸的浓度变化缓慢。目前已有研究结果表明,与正常对照组相比,MCI组及AD组血清色氨酸浓度明显偏低[41],AD组血清酪氨酸浓度明显偏低[17]。本文的分析与之前的研究结果一致,表明血清色氨酸、酪氨酸测定有助于AD的早期诊断。
p-tau和t-tau是公认的生物标志物,广泛用于AD的早期诊断[42-43]。目前已有大量关于色氨酸、酪氨酸及其代谢产物与AD发病机制之间的联系的相关研究,但尚无血清色氨酸、酪氨酸对于MCI、AD的诊断价值的相关研究。本文的分析结果表明,血清色氨酸对pMCI、AD具有显著的诊断准确性,血清酪氨酸对AD具有显著的诊断准确性。虽然色氨酸、酪氨酸对AD的诊断敏感性明显弱于p-tau、t-tau。与单独使用t-tau、p-tau相比,血清色氨酸、酪氨酸分别联合t-tau或p-tau对AD的诊断准确性提高,提示血清色氨酸、酪氨酸可与AD的核心诊断标志物联合使用以提高AD的诊断准确性。
多尺度代谢物共表达网络显示,色氨酸和酪氨酸与AD的严重程度和认知特征显著相关[44]。AD的代谢网络分析提示,MCI和AD与色氨酸、酪氨酸、甲硫氨酸和嘌呤途径的重叠扰动模式相关,并表明深刻的生化改变与异常的Aβ42和tau蛋白代谢有关[9]。目前已知在MCI和AD患者中,CSF tau蛋白含量升高,认知功能明显减退,脑室体积增大,海马及大脑体积缩小,脑代谢率降低。单胺能神经系统退行性病变与认知功能障碍密切相关[10]。已知色氨酸代谢产物NAD+在线粒体能量代谢中起着重要的作用[1],因此推测血清色氨酸含量与脑代谢相关,但目前尚无相关研究证明其相关性。在本研究中,血清色氨酸、酪氨酸与tau、认知功能、脑结构、脑代谢之间均无相关性。可能原因如下:血清色氨酸、酪氨酸受多种代谢途径影响;本文未纠正饮食、药物和APOE4等混杂因素影响。因此,色氨酸、酪氨酸是否能作为AD患者早期诊断生物标志物仍需进一步探讨。
4 研究的局限性
首先,ADNI数据库参与者均为受过高等教育的白人,这可能会导致选择上的偏差。其次,目前仍不能确定血清色氨酸、酪氨酸水平是否能反映颅内色氨酸、酪氨酸的水平。最后,只有基线是血清色氨酸、酪氨酸水平测定,无纵向比较,不能直接反映疾病发展过程中血清色氨酸、酪氨酸水平的变化。因此,未来还需要在种族、受教育水平多样化的样本中,在疾病发展的不同阶段采集血液样本,验证本文的研究结果,进一步探讨疾病的发病机制。
5 结论
sMCI、pMCI和AD患者血清色氨酸浓度均明显降低,且色氨酸对pMCI和AD具有一定的诊断准确性。pMCI和AD患者血清酪氨酸浓度明显偏低,且血清酪氨酸对AD具有一定的诊断准确性。由于血清色氨酸、酪氨酸与AD核心标志物、认知功能、脑结构、脑代谢之间均无明显相关性,血清色氨酸、酪氨酸可能不能作为AD的外周生物标志物。未来,需要将色氨酸、酪氨酸定位为参与AD发病机制的关键代谢途径,为AD治疗方面提供新的治疗靶点。