鸡血藤ISSR体系优化及引物筛选
2024-02-26李金梅王一婷潘丽梅黄晓东谭勇汝梅刘雯
李金梅 王一婷 潘丽梅 黄晓东 谭勇 汝梅 刘雯


摘要:以鸡血藤的入药部位藤茎为试验材料,采用改良CTAB法进行DNA提取,利用正交试验和单因素试验对ISSR-PCR反应体系进行优化和构建。结果表明,鸡血藤最佳ISSR-PCR反应体系为DNA模板60 ng,Taq酶2.00 U,Mg2+浓度1.75 mmol/L,dNTP浓度 0.25 mmol/L,引物浓度0.20 μmol/L,最佳退火温度44.6 ℃。从100条ISSR引物筛选出20条适合鸡血藤的ISSR引物。
关键词:鸡血藤;ISSR;分子标记;引物筛选;正交设计;体系优化
中图分类号:S567.1 文献标识码:A
文章编号:0439-8114(2024)01-0206-06
DOI:10.14088/j.cnki.issn0439-8114.2024.01.037 开放科学(资源服务)标识码(OSID):
Optimization of the ISSR system and primer screening for caulis spatholobi
LI Jin-mei, WANG Yi-ting, PAN Li-mei, HUANG Xiao-dong, TAN Yong, RU Mei, LIU Wen
(College of Pharmacy/The First Affiliated Hospital, Guangxi University of Chinese Medicine, Nanning 530200,China)
Abstract: The stem of caulis spatholobi was used as the experimental material for DNA extraction using the improved CTAB method. The ISSR-PCR reaction system was optimized and constructed using orthogonal and single factor experiments. The results showed that the optimal ISSR-PCR reaction system for caulis spatholobi was DNA template 60 ng, Taq enzyme 2.00 U, Mg2+ concentration 1.75 mmol/L, dNTP concentration 0.25 mmol/L, primer concentration 0.20 μmol/L, and optimal annealing temperature 44.6 ℃. 20 ISSR primers suitable for caulis spatholobi from were selected 100 ISSR primers.
Key words: caulis spatholobi; ISSR; molecular markers; primer screening; orthogonal design; system optimization
收稿日期:2022-10-19
基金項目:广西中医药大学博士启动基金项目(2017BS029);广西中医药大学青年创新研究团队项目(2018QT001)
作者简介:李金梅(1998-),女,广西灵山人,在读硕士研究生,研究方向为分子生药学,(电话)17878718953(电子信箱)2281953548@qq.com;通信作者,谭 勇(1976-),男,重庆人,教授,主要从事中药资源研究,(电子信箱)xjty321@163.com。
鸡血藤为豆科植物密花豆(Spatholobus suberectus Dunn.)的干燥藤茎,具有活血补血、调经止痛、舒经活络的功能,广泛用于月经不调、痛经、经闭、风湿痹痛、麻木瘫痪、血虚萎黄等症[1]。鸡血藤是多年生木质藤本,野生于灌丛中、山地林间,主要分布于中国广西壮族自治区、云南省及越南、老挝、缅甸等国家[2,3]。现代研究表明,鸡血藤具改善造血系统、免疫调节、降血脂、抗血栓、抗肿瘤等多种作用[4]。目前该药材主要来源于野生资源,因其生长周期长,过度采伐,植被破坏,导致其野生资源逐年减少。
ISSR (Inter-simple sequence repeat)即简单重复序列区间扩增,由Zietkiewicz等[5]于1994年提出,是基于PCR的一种分子标记技术。广泛应用于植物种质资源鉴定、遗传多样性、亲缘关系研究等方面[6,7]。关于优化ISSR-PCR反应体系的研究也越来越多,如淫羊藿[8]、藜芦[9]等。因此,本研究采用L16(45)正交试验和单因素试验对ISSR-PCR体系中的主要成分进行优化,建立鸡血藤最佳ISSR-PCR反应体系,并利用该体系筛选100条ISSR引物,选出扩增条带清晰、稳定,适合鸡血藤的ISSR引物。为鸡血藤的遗传多样性及亲缘关系等方面研究提供科学依据。
1 材料与方法
1.1 材料
试验材料为鸡血藤的入药部位藤茎,采自广西中医药大学仙葫药圃,尽量选择新鲜、幼嫩的藤茎。预处理:用灭菌去离子水冲洗新鲜藤茎,晾干;再用75%乙醇擦拭表面,晾干;若外皮稍厚,可除去外皮。试验材料经广西中医药大学药学院梁子宁教授鉴定为豆科植物密花豆(Spatholobus suberectus Dunn.)。
1.2 试验方法
1.2.1 鸡血藤DNA提取 采用改良的CTAB法提取鸡血藤DNA,具体操作步骤如下:取新鲜鸡血藤藤茎,剪碎,置研钵(-20 ℃预冷),加入液氮快速研磨成细粉状,迅速移至50 mL离心管,加入12 mL 65 ℃预热2% CTAB缓冲液,65 ℃水浴30 min,每8 min摇匀1次。取出,12 000 r/min离心10 min,取上清液800 μL,加入等体积苯酚抽提2次,12 000 r/min离心10 min,取上清液450 μL。加入氯仿抽提,10 000 r/min离心2 min,取上清液300 μL,加异丙醇(-20 ℃预冷),置-20 ℃沉淀过夜。取出,10 000 r/min离心10 min,弃上清液,75%乙醇洗涤2次,10 000 r/min离心 5 min,弃上清液,无水乙醇洗涤1次,10 000 r/min离心5 min,弃上清液,晾干。加入100 μL TE缓冲液和0.5 μL RNA酶,37 ℃水浴1 h溶解DNA,-20 ℃存放备用。
提取的DNA样品用1.0%琼脂糖凝胶100 V电泳45 min,观察条带的情况(有无拖尾现象、片段是否完整)。紫外分光光度计测定DNA的OD260/280、OD260/230和浓度。
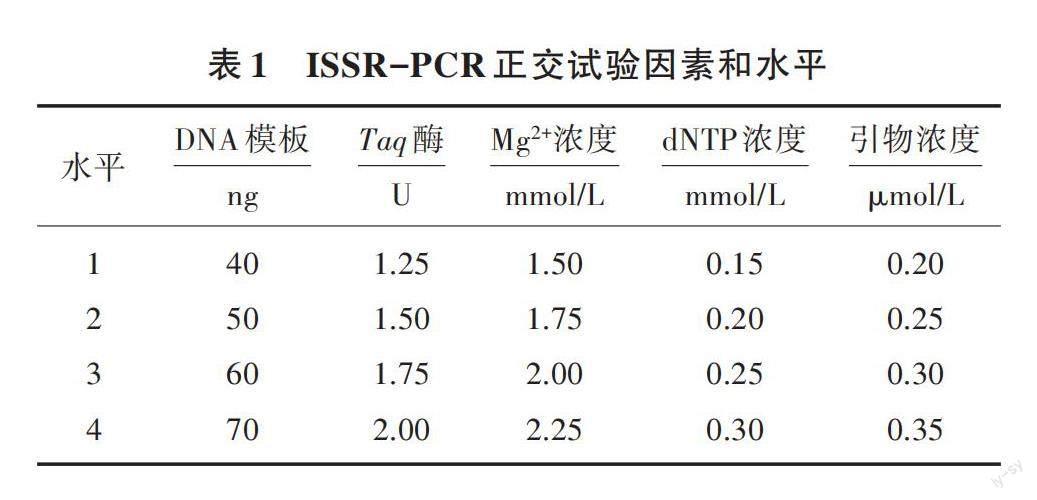
1.2.2 ISSR-PCR反应体系的正交试验 对ISSR-PCR反应体系中的主要成分进行正交设计,引物为UBC811。因素和水平见表1,L16(45)正交设计见表2,共16个处理,试验重复2次。扩增反应体系及程序见表3。扩增产物用2.0%琼脂糖凝胶100 V电泳40 min。成像系统观察,拍照,并分析各组条带。
1.2.3 退火温度的优化 初始退火温度为45.0 ℃,在此基础上设定试验范围为43.0~47.0 ℃,即得8个温度梯度(43.0、43.3、43.7、44.6、45.5、46.2、46.7、47.0 ℃)。通过直观观察对条带进行分析,选择扩增效果好的退火温度。
1.2.4 引物筛选 利用最佳反应体系和退火温度进行扩增,筛选100条ISSR引物。观察电泳图,以条带清晰、多态性好为标准,对每条引物出现的条带进行直观分析,选出条带清晰、多态性较好的ISSR引物。
2 结果与分析
2.1 总DNA质量检测
同一批次提取的DNA样品检测结果如图1所示,紫外分光光度计测定结果如表4所示。总DNA浓度在134.800~170.650 ng/μL。DNA OD260/280在1.90~2.10,OD260/230在1.80~2.00。可以看出雞血藤总DNA条带清晰、没有拖尾、完整性较好,表明提取的总DNA没有断裂、质量较好。且浓度和OD的数据相对稳定,较理想。说明此次提取的总DNA比较成功,可用于后续PCR扩增,将样品保存在-20 ℃冰箱。
2.2 ISSR-PCR反应体系的正交试验
该正交试验重复2次,结果如图2所示,通过直观观察,8号处理多态性较差,2、10号处理条带暗淡、不好分辨;13、16号处理扩增条带背景模糊、分离度不好,表明上述处理的体系不稳定或各因素浓度配比不合适。7、15号处理扩增出的条带较清晰明亮、重复性好、多态性较好,2次重复性试验均表现稳定,故确定为最佳处理。根据电泳检测结果,参照何正文等[10]的评分方法,以特异性条带强弱、丰富程度及背景清晰度对16个处理的2次重复试验进行直观分析,并依次评分,以条带是否清晰稳定、重复性好、多态性好为评分标准,最佳计16分,最差计1分。2次正交试验评分结果见表5,分数越高,表示条带特异性越好。通过SPSS 20.0软件得出均值(K)和极差(R),结果如表6所示,从K可以看出,DNA模板水平3、Taq酶水平4、Mg2+浓度水平2、dNTP浓度水平3、引物浓度水平1的K最大;K越大,表示该反应水平扩增效果越好。根据K算出R,R越大,表示影响因素对反应体系的影响越大。本试验各因素影响由大到小依次为dNTP浓度、引物浓度、Mg2+浓度、Taq酶、DNA模板。
2.3 退火温度优化结果
以UBC811为引物,设置8个退火温度,扩增结果如图3所示。对不同温度的条带进行分析,选择最佳退火温度。引物UBC811在43.0~44.6 ℃时条带清晰、亮度好,且条带完整性较好,其中退火温度为44.6 ℃时获得的条带最优。可见,合适的退火温度能使扩增出的条带更稳定、明亮清晰。
2.4 引物筛选结果
利用最佳ISSR-PCR反应体系进行PCR扩增,结果如图4所示,因引物UBC809扩增出的条带暗淡、不清晰,因此去除。从100条ISSR引物中共选出20条扩增效果较好的引物。20条ISSR引物及其序列如表7所示,可用于鸡血藤的ISSR-PCR扩增。结果表明,20条ISSR引物在该反应体系中均能获得较好的扩增效果。说明该扩增体系较稳定,适用于鸡血藤ISSR分子标记的研究。
2.5 单因素水平对ISSR-PCR反应的影响
2.5.1 DNA模板添加量对ISSR-PCR反应的影响 DNA模板添加量是ISSR-PCR反应的重要因素,为获得较稳定、扩增效果较好的反应体系,要选择合适的DNA模板添加量。由图5可知,DNA模板添加量为30 ng时条带不明显且暗;DNA模板添加量为50、70 ng时扩增的条带多且清晰;DNA模板添加量为90 ng时条带开始出现模糊现象。结合上述正交试验(DNA模板添加量分别为40、50、60、70 ng)结果,DNA模板添加量为60 ng时获得的条带最优。
2.5.2 Taq酶添加量对ISSR-PCR反应的影响 由图6可知,Taq酶添加量为1.00~2.00 U时条带分离度较好,且亮度高;Taq酶添加量为2.50 U时条带较暗淡且模糊。Taq酶添加量过低时不能扩增出特异性条带或扩增效率下降,Taq酶添加量较高时会增加特异性条带,Taq酶添加量过高时易产生非特异性条带,且酶的价格高,用量过大会增加成本,造成不必要的浪费。因此正交试验选用的Taq酶添加量为1.25~2.00 U,结合上述试验结果及经济角度考虑,Taq酶最适添加量为2.00 U。
2.5.3 Mg2+浓度对ISSR-PCR反应的影响 Mg2+浓度对Taq酶活性、引物与模板的结合率都有一定影响。由图7可知,Mg2+浓度为1.50~2.50 mmol/L时条带较清晰。Mg2+浓度为3.00 mmol/L时条带较暗,分离度较差,不易分辨。正交试验选用的Mg2+浓度为1.50~2.25 mmol/L。综上,Mg2+最适浓度为1.75 mmol/L,能保证条带特异性,且条带清晰度较好。
2.5.4 dNTP浓度对ISSR-PCR反应的影响 dNTP是扩增合成新核苷酸的原料,对扩增结果有一定影响。由图8可知,dNTP浓度为0.10 mmol/L时扩增条带较少,而在0.20~0.40 mmol/L时条带增多且更清晰。说明dNTP浓度过低时会降低产物合成效率,浓度过高时非特异性条带增多,碱基错配率增大。因此正交试验选用的dNTP浓度为0.15~0.30 mmol/L。综上,dNTP最适浓度为0.25 mmol/L,扩增条带清晰,稳定性好。
2.5.5 引物浓度对ISSR-PCR反应的影响 由图9可知,引物浓度为0.20~0.40 μmol/L时扩增条带清晰明亮,引物浓度为0.50 μmol/L时条带开始出现模糊、亮度减弱的现象。引物浓度过低会影响正常扩增,过高时非特异性条带增加,条带模糊不清,分辨率降低。适宜的引物浓度能够使扩增产物的特异性得到提高,因此正交试验选用的引物浓度为0.20~0.35 μmol/L。综上,引物最适浓度为0.20 μmol/L。
3 讨论
本研究在对鸡血藤藤茎DNA的提取过程中发现,不同时期采摘的鸡血藤藤茎所提取出的DNA样品质量、浓度有一定的差异。因采摘时期的不同,鸡血藤藤茎中的蛋白质、多糖、多酚等代谢产物含量也不相同,新鲜幼嫩的藤茎代谢产物含量可能较低,但DNA含量较高,结合预试验的结果,在提取鸡血藤藤茎DNA时尽可能选择新鲜、幼嫩的藤茎。传统的DNA提取方法较通用,适用于多糖、多酚类植物DNA的提取[11]。但也有其局限性,可根据具体情况适当改进。本研究对传统的DNA提取方法进行改进,因藤类药材鸡血藤富含纤维和代谢产物,植物细胞壁较厚,DNA含量较少,在提取过程中需要足够的样品量来保证DNA浓度[12]。本研究的材料为鸡血藤藤茎,在研磨时可能会比较费力(若外皮偏厚,可去除),需要在加入液氮研磨之前把研钵置于冰箱-20 ℃预冷3 h或更长时间,保证在研磨过程中DNA裂解一直处于低温状态下,使之得到充分裂解,同时可减少DNA的降解,降低损失。结果表明,提取的DNA条带清晰稳定、完整性好,满足后续PCR扩增试验,该方法适用于鸡血藤藤茎DNA的提取。
ISSR分子标记结合了SSR和RAPD 2种标记方法的优点,操作简单、多态性好,具有较高的可重复性和稳定性[13]。近年来,已广泛用于温莪术[14]、重楼[15]、铁线莲[16]、广藿香[17]等种质资源遗传多样性的分析研究。PCR扩增结果受反应体系各组分和退火温度的影响,为确保试验结果的准确性,需要优化固定PCR反应体系中的各种条件。通过单因素试验可直观看出单个因素对结果的影响,并根据结果选定试验条件区间。何天友等[18]采用单因素试验优化泽泻ISSR反应体系。由于未考虑因素间交互作用,对试验结果的准确性有一定影响。而正交试验能快速准确地得到ISSR-PCR的最佳优化条件,丁雯等[19]通过正交设计试验,建立酸枣仁ISSR-PCR最佳反应体系。但结果以直观分析得出,带有主观意识,存在一定试验误差。上述2种方法分别有其局限性,因此基于2种试验方法来建立ISSR-PCR最佳反应体系,并已在中国兰[20]、大叶铁线莲[21]、中国沙棘[22]等植物中建立了ISSR-PCR最佳体系。本试验也是采用2种试验方法结合来优化鸡血藤ISSR-PCR反应体系。结果表明,2种方法结合可以有效地减少试验误差,克服单一方法存在的局限性,同时保证试验的科学性、严谨性和稳定性。
参考文献:
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2020.202.
[2] 刘 静,王晓静,戴 忠,等.鸡血藤研究进展[J].中国药事,2019,33(2):188-194.
[3] 陈乾平,谷筱玉,龙海荣,等.不同产地鸡血藤药材中芒柄花素及总黄酮的含量测定[J].当代化工,2016,45(7):1549-1552.
[4] 秦双双,朱艳霞,韦坤华,等.鸡血藤的本草沿革与黄酮类成分及其药理学研究进展[J].中国中药杂志,2018,43(11):2216-2223.
[5] ZIETKIEWICZ E, RAFALSKI A, LABUDA D. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994, 20(2):176-83.
[6] 王 刚,曹 佩,韦学敏,等.分子标记技术在药用植物种质资源研究中的应用[J].中国现代中药,2019,21(11):1435-1444.
[7] 时圣明,潘明佳,王 洁,等.分子鑒定技术在中药中的应用[J].中草药,2016,47(17):3121-3126.
[8] 段媛媛,罗孝荣,周武先,等.淫羊藿ISSR-PCR反应体系的建立与优化[J].分子植物育种,2020,18(2):482-487.
[9] 唐雨晨,岳 鑫,张 屏,等.藜芦ISSR-PCR反应体系的建立与优化[J].分子植物育种,2020,18(15):5054-5062.
[10] 何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998(4):76-77.
[11] 段中岗,黄琼林,杨锦芬,等.适合中药材DNA条形码分析的DNA提取方法的研究[J].中药新药与临床药理,2009,20(5):480-484.
[12] 陈士林,姚 辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志,2013,38(2):141-148.
[13] 任梦云,陈彦君,张 盾,等.ISSR标记技术在药用植物资源中的研究进展及应用[J].生物技术通报,2017,33(4):63-69.
[14] 张玉秀,刘 杨,刘培卫,等.不同产地温莪术遗传多样性及亲缘关系的ISSR分析[J].世界科学技术—中医药现代化,2020,22(8):2845-2850.
[15] 刘胜坤,胡剑民,朱红军,等.基于ISSR的重楼种质资源遗传多样性研究[J].湖北林业科技,2020,49(5):20-23.
[16] 余伟军,姚 红,孙瑞琦,等.铁线莲属植物ISSR-PCR反应体系优化及遗传多样性分析[J].植物资源与环境学报,2019, 28(2):42-48.
[17] 胡 珊,陈洪毅,邬龙怡,等.DNA条形码及ISSR技术对广藿香种质资源的分析[J].现代中药研究与实践,2019,33(1):8-11.
[18] 何天友,瞿印权,徐 雯,等.泽泻ISSR反应体系的建立与优化[J].安徽农学通报,2017,23(7):23-26,100.
[19] 丁 雯,李 泽,杜晨晖,等.酸枣仁ISSR-PCR反应体系优化及引物筛选[J].分子植物育种,2020,18(23):7834-7839.
[20] 黄晓慧,巫伟峰,陈 春,等.中国兰ISSR-PCR反应体系优化及引物筛选[J].南方农业学报,2018,49(7):1282-1288.
[21] 任夏萌,李欣怡,丁群英.大叶铁线莲ISSR反应体系的建立与优化[J].山西农业科学,2019,47(12):2083-2087.
[22] 周 武,王 驰,胡 娜,等.中国沙棘ISSR-PCR反应体系的建立和优化[J].分子植物育种,2019,17(16):5357-5367.
