IHC、FISH、qRT-PCR检测NSCLC ALK融合基因的对比分析
2024-02-24朱宇凝屈顺林曹晓卉杨志慧孙桂凤殷正进刘仕琦张缨
朱宇凝, 屈顺林, 曹晓卉, 杨志慧, 孙桂凤, 殷正进, 刘仕琦, 张缨
1.东部战区总医院秦淮医疗区病理科,江苏南京210002;2.南华大学衡阳医学院心血管疾病研究所,湖南衡阳421001
肺癌是恶性肿瘤的主要死亡原因,且在早期不易被发现[1]。根据组织学、临床和神经内分泌特征,肺癌分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)[2]。研究表明,肺癌中存在ALK融合基因变异现象[3-4]。ALK作为胰岛素受体亚家族的受体酪氨酸激酶已被证实在各种癌症中发挥重要作用,特别是间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)、NSCLC和神经母细胞瘤[1]。随后,临床实验表明,针对ALK基因靶点的药物克唑替尼,对于晚期ALK阳性的NSCLC患者治疗疗效显著[5]。因此,寻找稳定、准确、经济、快速的ALK基因融合状态检测手段迫在眉睫。本文对比分析免疫组化(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in situ hybridization,FISH)、实时荧光定量PCR(real-time quantitative-PCR,qRT-PCR)检测NSCLC ALK融合基因的情况。
1 材料和方法
1.1 标本来源
收集本院2018年12月—2022年12月通过HE染色法和IHC共同确诊的453例NSCLC标本。标本来源包括细胞块样本(来自胸水)和组织样本(经皮肺穿刺、纤支镜活检获取的小标本以及肺叶切除、转移病灶切除获取的手术切除大标本)。随机选取IHC确诊的ALK(-)、(+)、(2+)、(3+)标本各10例进行FISH、qRT-PCR验证。
1.2 IHC法
1.2.1 组织标本制备 10%中性福尔马林固定,自动脱水仪常规标准脱水,经58~60 ℃熔点石蜡包埋后3 μm 厚切片备用。
1.2.2 细胞块制备 新鲜胸水4 ℃冰箱静置过夜后弃上清液,取底部沉淀于50 mL离心管2 500 r/min离心5 min;3%冰乙酸乙醇去红细胞,30%乙醇去黏液;加入10%福尔马林,振荡均匀,2 500 r/min离心3 min,弃上清液;再加入95%乙醇10 mL,振荡均匀,2 500 r/min离心3 min;弃上清液,收集底部沉淀转移到擦镜纸上,包好,和常规组织一起脱水,最后经58~60 ℃熔点石蜡包埋。
1.2.3 IHC制片 从HE法中选取453例NSCLC标本,4 μm厚石蜡切片65 ℃烘箱烤片1 h,然后使用Ventana BenchMark GX全自动免疫组化染色仪进行检测。所用试剂为罗氏抗ALK一抗(D5F3)和OptiView DAB免疫组化试剂盒以及增强扩增试剂盒。
1.2.4 IHC结果判定 ALK根据文献[6]判定:>5%的肿瘤细胞呈现颗粒状细胞质强着色为(3+);>5%的肿瘤细胞呈现中度细胞质着色为(2+);>5%的肿瘤细胞呈现微弱或模糊的细胞质着色或≤5%的肿瘤细胞有任何程度的着色为(+);肿瘤细胞无着色为(-)。
1.3 FISH法
从IHC样本中随机选取ALK(-)、(+)、(2+)、(3+)各10例。所有标本用10%中性福尔马林缓冲液固定,常规脱水、石蜡包埋,4 μm厚切片。常规脱蜡,75 ℃热处理12 min,37 ℃预热蛋白酶K消化15 min,缓冲液清洗,暗室内滴加探针10 μL(美国Abbott公司),封片后放入杂交仪,75 ℃ 5 min变性,37 ℃过夜杂交。去除封片胶,将切片置于预加热72 ℃洗液内2 min,滴加10 μL DAPI、封片。选取单个视野50个肿瘤细胞,要求肿瘤细胞核轮廓及信号清晰,每个细胞核内至少有一组红、绿信号,如果红绿信号分离(距离≥两个信号直径)或额外出现单独的红色信号数≥25个,或者不同视野的100个细胞内合计≥15个存在分离信号或者绿色信号缺失视为阳性标本[6]。
1.4 qRT-PCR法
同1.3方法选取样本共40例。组织样本选用10%中性福尔马林缓冲液固定,石蜡包埋样本切片后立即检测。手术标本切片厚度5 μm,5片;穿刺标本切片厚度5 μm,10片。样品进行RAN和DNA分离,提取RNA和DNA,RNA经反转录形成单链cDNA,然后使用ALK融合基因检测试剂盒进行qRT-PCR检测。检测流程严格按照说明书操作,操作中避免污染;最后使用SLAN全自动医用PCR分析系统进行qRT-PCR检测。根据试剂盒说明书判定结果:阳性对照曲线升起Ct值<24;若样本融合基因FAM信号曲线升起Ct值<30,则为阳性;若样本融合基因FAM信号无曲线升起或者Ct值≥30,则为阴性。
1.5 统计学分析
采用SPSS 26.0统计软件。计数资料以例(%)表示,一致性检验采用Kappa检验或者Spearman相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 ALK融合基因的IHC检测结果
453例经HE和IHC共同确诊为NSCLC标本。IHC样本中379例ALK阴性、74例ALK阳性,其中(1+)12例、(2+)30例及(3+)32例。IHC ALK阳性率为16.3%(图1)。NSCLC IHC ALK阳性细胞染色定位为细胞质。

图1 IHC法检测NSCLC中ALK蛋白的表达(200×)A为ALK(-);B为ALK(+);C为ALK(2+);D为ALK(3+)。
2.2 ALK融合基因的FISH检测结果
选取IHC样本ALK(-)、(+)、(2+)、(3+)各10例,进行ALK荧光探针检测,12例阳性,28例阴性(图2)。
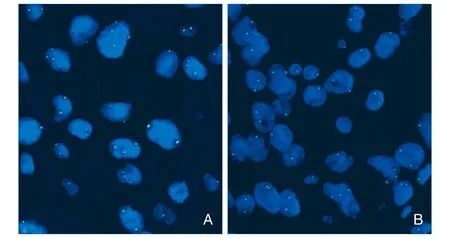
图2 FISH法检测NSCLC中ALK融合基因的表达(1 000×)A为ALK(-),红绿信号融合;B为ALK(+),红绿信号分离大于2个信号点。
2.3 ALK融合基因的qRT-PCR检测结果
选取IHC样本ALK(-)、(+)、(2+)、(3+)各10例,进行qRT-PCR检测,13例阳性,27例阴性(图3)。
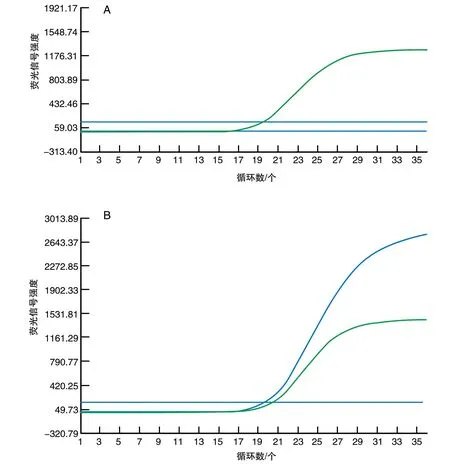
图3 qRT-PCR法检测NSCLC中ALK融合基因的表达A为ALK(-),绿色曲线为阳性质控,蓝色样本曲线无升起;B为ALK(+),绿色曲线为阳性质控,蓝色曲线样本有明显扩增。
2.4 IHC与FISH的一致性比较
Kappa检验结果显示,在IHC判定为ALK(-)/(3+)的20例标本中,与FISH检测结果一致率均为100%,具有高度一致性(P<0.05);在IHC判定为ALK(1+)/(2+)的20例标本中,与FISH检测结果一致率分别为0%和20%,两种方法AILK(1+)/(2+)标本检测结果无一致性(χ2=0.474,P>0.05;表1)。Spearman相关性分析结果显示,IHC和FISH检测ALK具有一致性(r=0.781,P<0.05)。
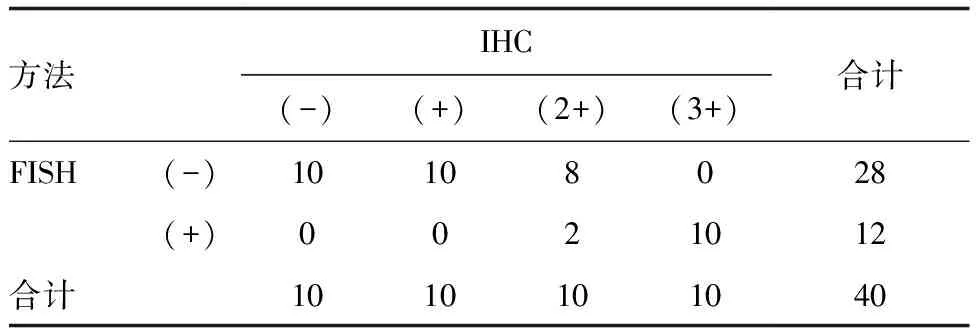
表1 IHC和FISH检测ALK结果的一致性(n=40) 例
2.5 IHC与qRT-PCR的一致性比较
Kappa检验结果显示,在IHC判定为ALK(-)/(3+)的20例标本中,IHC与qRT-PCR检测结果一致率均为100%,具有高度一致性(P<0.05);在IHC判定为ALK(1+)/(2+)的20例标本中,与qRT-PCR检测结果一致率分别为10%和20%,两种方法检测结果无一致性(χ2=1,P>0.05;表2)。Spearman相关性分析结果显示,IHC和qRT-PCR检测ALK具有一致性(r=0.740,P<0.05)。
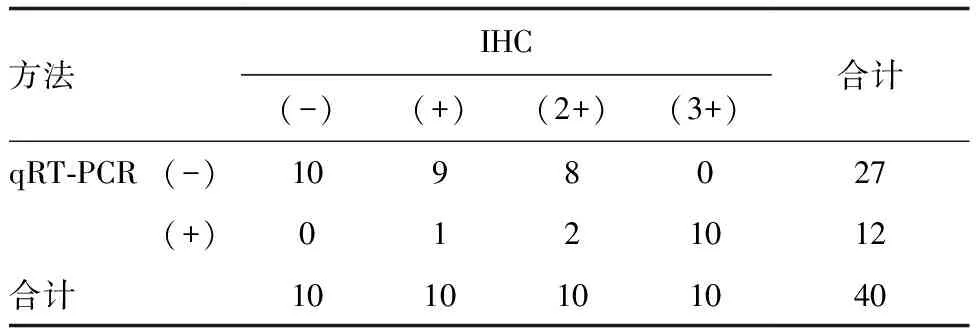
表2 IHC和qRT-PCR检测ALK结果的一致性(n=40) 例
2.6 qRT-PCR与FISH的一致性比较
在40例已做IHC检测样本中,qRT-PCR与FISH检测结果一致率为97.5%,两种检测方法结果具有高度一致性(r=0.943,P<0.05;表3)。
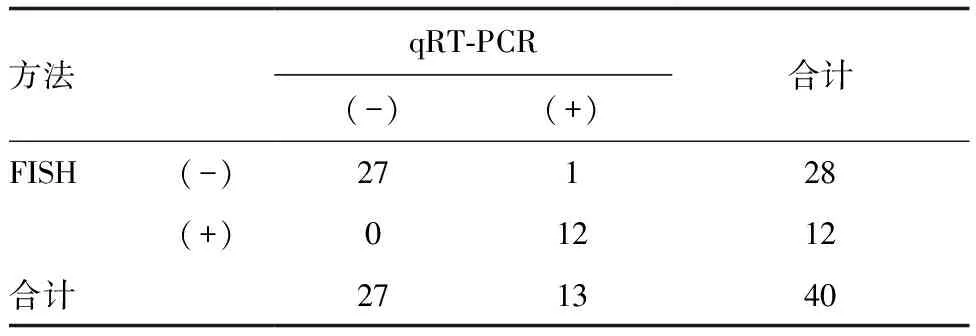
表3 qRT-PCR和FISH检测ALK结果的一致性(n=40) 例
3 讨 论
随着精准医疗的不断发展,个体化靶向药物治疗备受关注。研究表明,ALK融合基因的突变在肺癌的发生发展中起着关键作用;其基因靶向药物克唑替尼对ALK阳性的肺癌患者治疗效果显著[7]。
ALK是肺癌较为常见的驱动基因[8]。目前,ALK融合基因的检测方法主要有qRT-PCR、FISH、IHC法。qRT-PCR、FISH是经典检测方法,但费用较高;IHC法检测ALK敏感性和染色强度较高,且费用相对较低。研究证明,检测ALK所用的IHC、FISH、qRT-PCR法各有利弊[9]。
本文通过3种检测方法比较,IHC作为初筛方法相对经济且便捷。因IHC人为因素影响较大,所以为确保实验准确性,对实验的每例标本均设置阳性对照,阑尾中的神经节组织为已知阳性;另外,IHC可以检测ALK的蛋白表达,但无法观察到其基因变异和融合伴侣情况。FISH法检测时间短,相对标准化,可以检测到ALK的缺失、断裂[10],但不能识别融合伴侣,可能会错过罕见复杂的重排[11];并且判定者之间结果解释会有较大区别[12]。qRT-PCR法检测灵敏,特异性强,但在使用福尔马林固定石蜡包埋的组织样本时,需要多个引物集来检测所有的ALK变异[13];qRT-PCR诊断的准确性在很大程度上取决于样本RNA质量,对样本要求比较高[14],特别是交叉污染会出现假阳性结果。
综上所述,IHC与FISH法判定相对主观,结果可能存在较大差异,qRT-PCR法较客观且更加灵敏。根据研究对比,qRT-PCR、FISH法在ALK融合基因的检测结果与IHC法的一致性存在差别,IHC对于ALK融合基因表达的灵敏度更高。IHC检测法经济且便捷,对病理科来说实验过程可控,结果稳定,重复性较好。因此,IHC可以作为ALK融合基因的初筛检测方法,存疑样本使用FISH、qRT-PCR检测方法验证,能够检测更全面的基因突变信息,为临床病理诊断提供有效检测辅助手段。
