副干酪乳杆菌发酵液中抗菌肽的筛选及对副溶血性弧菌的抑菌作用
2024-02-23邢宇凡白淑锦金日天翁武银丁能水张志刚
邢宇凡,白淑锦,金日天,3,翁武银,3,丁能水,张志刚,杨 燊,3*
(1 集美大学海洋食品与生物工程学院 福建厦门361021 2 厦门银祥集团有限公司 肉食品安全生产技术国家重点实验室 福建厦门361100 3 海洋食品精深加工关键技术省部共建协同创新中心 大连工业大学 辽宁大连116034 4 福建傲农生物科技集团股份有限公司 福建省生猪营养与饲料重点实验室 福建漳州 363000)
副溶血性弧菌是一种革兰氏阴性嗜盐细菌,主要存在于鱼、虾、贝类等水产动物以及腌菜、咸肉和咸鸭蛋等高盐食品中[1]。它是一种常见的食源性病原体,可引发腹泻、呕吐、头痛、腹部痉挛等病症[2]。此外,它还可以形成保护宿主的生物膜,从而对抗生素产生耐药性[1,3]。发掘更安全、有效的抑菌剂至关重要。
抗菌肽是一种具有广泛抑菌活性的阳离子多肽,可对病原体进行多靶点破坏,如通过静电作用破坏细胞膜,作用于核酸,从而影响DNA、RNA 以及蛋白质的合成等[4],且不易产生耐药性,被认为是抗生素的一种良好替代品[5-6]。副干酪乳杆菌作为乳酸菌的一种,具有抗肿瘤、抗炎、改善和调节肠道菌群等生物活性[7]。其在发酵过程中产生的细菌素,能有效抑制食源性致病菌,可应用于热敏性食品的冷链运输保鲜[8-9]。如从副干酪乳杆菌FX-6中分离出细菌素F1,其对细菌和真菌均具有较好的抑菌活性,可以通过增加细菌膜的通透性,促进细胞内物质的渗漏,干扰细胞中基因组DNA,从而完成杀菌作用[10]。
本研究采用超高效液相色谱-质谱联用技术鉴定副干酪乳杆菌发酵液小分子多肽序列,通过生物信息学筛选出可能具有抑菌活性的氨基酸序列,合成后研究其对副溶血性弧菌的抑菌活性及机理,以期为副溶血性弧菌的防治提供理论依据。
1 材料与方法
1.1 材料与试剂
副干酪乳杆菌(Lacticaseibacillus paracasei)、副溶血性弧菌(Vibrio parahaemolyticus)、蜡样芽孢杆菌(Bacillus cereus)、金黄色葡萄球菌(Staphylococcus aureus)由福建省微生物与酶工程重点实验室提供,MRS 培养基、营养肉汤培养基、LB 培养基,广东环凯微生物科技有限公司;琼脂,厦门兰博利德生物技术有限公司;TIANamp Bacteria DNA Kit 细菌基因组DNA 提取试剂盒(DP302),北京天根生化科技有限公司。
核酸染料10×DNA 上样缓冲液,北京索莱宝(Solarbio)科技有限公司;十二烷基硫酸钠(SDS),厦门泰京生物技术有限公司;邻硝基苯-β-D-吡喃半乳糖苷,上海麦克林生化科技有限公司;三羟甲基氨基甲烷,上海科雅生物技术有限公司;Na2HPO4·7H2O、NaH2PO4·2H2O、KH2PO4、NaCl、NH4Cl、MgSO4、乳糖、CaCl2、冰醋酸、乙二胺四乙酸、NaOH、戊二醛溶液,西陇化工股份有限公司。
M9 培养基:200 mL M9 盐溶液(5×)(64 g Na2HPO4·7H2O+15 g KH2PO4+2.5 g NaCl+5.0 g NH4Cl,用去离子水定容至1 000 mL),2 mL 1 mol/L MgSO4,20 mL 乳糖(20%),0.1 mL 1 mol/L CaCl2,用去离子水定容至1 000 mL。
50×TAE:24.2 g Tris,5.71 mL 冰醋酸,10 mL 0.5 mol/L EDTA,用NaOH 调至pH=8.0,加水定容至100 mL。
0.01mol/L 磷酸盐缓冲液(PBS,pH 7.2):61 mL 0.01 mol/L Na2HPO4·7H2O+39 mL 0.01 mol/L NaH2PO4·2H2O。
1.2 仪器与设备
湘仪H1650-W 高速台式离心机,湖南湘仪离心机有限公司;H-7650 透射电镜,日本日立有限公司;Nanodrop 1000 超微量分光光度计,美国Nanodrop 公司;C400 凝胶成像系统,美国Azure Biosystems 有限公司;Synergy HIMF 多功能酶标仪,美国伯腾仪器有限公司;Nano Acquity UPLC system、Thermo Scientific Q-Exactive,美国Waters公司;Chirascan V100 圆二色谱仪,美国Applied Photophysice Ltd 公司。
1.3 方法
1.3.1 副干酪乳杆菌发酵液的质谱分析 -20 ℃保存的副干酪乳杆菌按照1%的接种量接种于20 mL MRS 培养基中,37 ℃静置厌氧培养2 d 后煮沸10 min 置于离心管中,3 000 r/min 离心5 min进行固液分离,上清液用超滤膜截留分子质量为3 000 u 以下的多肽,于-20 ℃保存。利用超高效液相色谱-质谱联用技术对多肽的氨基酸序列进行鉴定,色谱采用长度25 cm,内径75 μm 的分析色谱柱,流动相A 为0.1%的甲醇水溶液,流动相B为乙腈,进样5 μL 在超高效液相色谱进行梯度洗脱,洗脱条件如表1 所示。采用翘气速率:40 mL/min,辅助气速率:10 mL/min,喷雾电压:3.0 kV,毛细管温度:300 ℃,S-lens:50%的条件下用高分辨质谱仪进行质谱分析。其中一级扫描分辨率为70 000,扫描范围为350~1 600 m/z;二级扫描分辨率为17 500,动态消除10.0 s。最后将质谱结果用搜库软件(MAXQUANT v1.6.5.0)搜乳酸菌库,蛋白质对比后得到副干酪乳杆菌肽段序列。

表1 液相色谱的梯度洗脱条件Table 1 Gradient elution procedure of liquid chromatography
1.3.2 抗菌肽的筛选 得到的肽段序列利用在线软件APD3(https://aps.unmc.edu/)计算多肽的电荷数和疏水率,使用Swiss-Model(https://swissmodel.expasy.org/interactive)预测多肽的三维结构,随后用软件Pymol 2.0 对抗菌肽的三维结构进行编辑。多肽由北京中科亚光生物科技有限公司采用固相法合成,使用Agela C18 柱进行高效液相色谱(HPLC)纯化,利用液相色谱-质谱联用仪(LC-MS/ESI)测定多肽的纯度和分子质量。
1.3.3 最低杀菌质量浓度的测定(MBC)副溶血性弧菌、蜡样芽孢杆菌、金黄色葡萄球菌分别接种于20 mL 营养肉汤培养基中,37 ℃,200 r/min 培养8 h 后,用无菌的0.01 mol/L PBS(pH 7.2)分别将其稀释至4.82~4.96 lg CFU/mL。将肽分别稀释至1 000,500,250,125,62.5 μg/mL 后,取等量的肽与菌液混和于37 ℃孵育2 h 后,取20 μL 均匀涂布于平板中,37 ℃培养24 h 后进行菌落计数。设置等量的PBS 与菌液混合作为对照组,试验重复3 次取平均值。
1.3.4 时间-杀菌曲线分析 培养至对数期的副溶血性弧菌用0.01 mol/L PBS(pH 7.2)稀释至4.82~4.96 lg CFU/mL,将等量多肽和菌液混合至最终质量浓度为125 μg/mL(1×MBC)。在0,0.5,1.0,1.5,2.0,2.5,3.0 h 分别取20 μL 菌悬液,在营养肉汤固体培养基中均匀涂布,37 ℃培养24 h 后进行菌落计数。以等量的PBS 和菌液混合为对照,试验重复3 次取平均值。
1.3.5 膜通透性的测定 通过测量副溶血性弧菌细胞质β-半乳糖苷酶产生的邻硝基苯酚水平,来确定细菌的膜通透性变化。首先,在LB 培养基中将细菌培养至对数期,再将菌液离心(10 000 r/min,1 min)后重悬至20 mL M9 培养基中,摇床(200 r/min)培养直到OD600nm>0.4。最后,在96 孔板中加入菌液100 μL,0.5 mg/mL 邻硝基苯β-D-半乳吡喃糖苷(ONPG)10 μL 以及不同质量浓度的 肽100 μL(0,0.5×MBC,1×MBC,2×MBC,4×MBC),每隔1 h 用酶标仪测量其在波长420 nm下的吸光度。
1.3.6 透射电镜 将副溶血性弧菌培养至对数期,取菌液5 mL 和1 mg/mL 的肽1 mL 于已灭菌的试管中,37 ℃恒温培养2 h 后,将混合液在离心机中离心(10 000 r/min,1 min),倒掉上清液。用PBS 冲洗沉淀3 次,加入1 mL 2.5%的戊二醛溶液,4 ℃固定12 h 后用酒精脱水,并用白色树脂渗透。最后,样品包埋后70 ℃焙烧24 h,在铜网格上制备70 nm 薄玻片,并用柠檬酸铅和醋酸铀酰染色,通过透射电镜观察细菌的超微结构。
1.3.7 凝胶阻滞分析 用细菌基因组DNA 试剂盒提取副溶血性弧菌的基因组DNA,所得DNA采用超微量分光光度计测定浓度,并用260 nm 和280 nm 光密度比(OD260nm/OD280nm≥1.90)测定提取的DNA 的纯度,然后将DNA 定量至20 ng/μL。在微量离心管中加入10 μL 上述DNA,并加入不同浓度的抗菌肽,使肽/DNA 分别为100/1,50/1,25/1,12.5/1,6.25/1,3.125/1,0,混匀后置于37 ℃孵育1.5 h。每个样品取8 μL 加入1 μL 的10×DNA 上样缓冲液,在1%的琼脂糖凝胶上进行电泳,利用凝胶成像仪在波长320 nm 的紫外灯下曝光60 s成像来检测DNA 的迁移情况。
1.3.8 圆二色谱 用圆二色谱仪(Circular dichroism spectrum,CD)测定抗菌肽二级结构及副溶血性弧菌DNA 对其结构的影响。将肽分别溶解在25 mmol/L 十二烷基硫酸钠(SDS)溶液和0.01 mol/L PBS 中,使肽的最终质量浓度为0.2 mg/mL,然后将其置于直径为1 mm 的石英比色皿中进行CD 扫描,扫描范围为180~280 nm,狭缝为2 mm,扫描速度为10 nm/min,每个样品连续扫描3 次,结果取平均值。然后在抗菌肽中加入副溶血性弧菌基因组DNA,孵育2 h 后,再用相同的方法检测肽的二级结构,观察DNA 对肽二级结构的影响。
1.3.9 数据分析 采用SPSS 22.0 分析软件对试验结果进行分析,采用单因素分析法(ANOVA)检验其差异显著性,P <0.05 表明差异显著。
2 结果与分析
2.1 副干酪乳杆菌发酵液中潜在抗菌序列的筛选与鉴定
从副干酪乳杆菌发酵液中共鉴定出6 个潜在的抗菌序列(表2),利用在线数据库APD3 计算了它们的带电荷数、疏水性。它们的平均氨基酸数为12,分子质量范围是1 036~1 587 u,疏水率范围是25%~60%,净电荷数从-2 到+3。
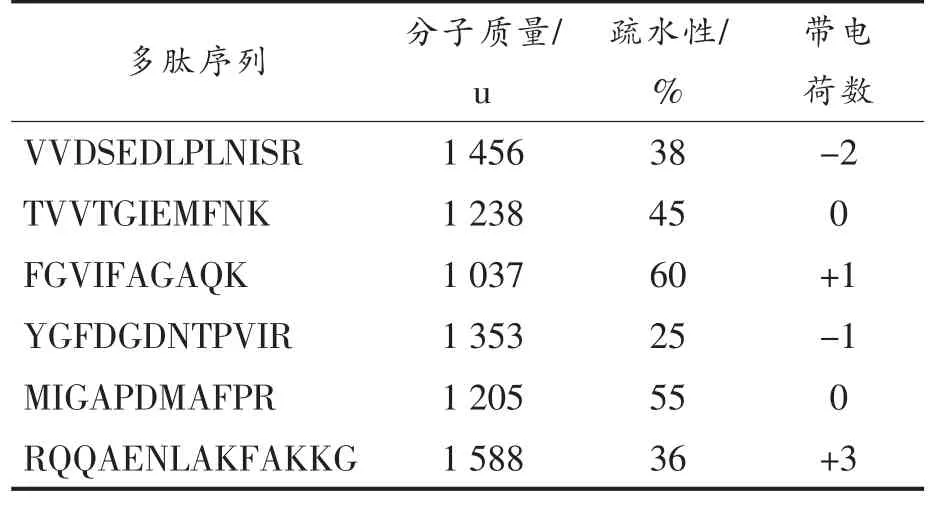
表2 副干酪乳杆菌发酵液中抗菌肽的预测Table 2 Prediction of antimicrobial peptides in fermentation broth of Lactobacillus paracasei
抗菌肽的正电荷有助于其通过静电作用与富含阴离子的磷脂膜表面初始结合,从而改变细菌细胞膜上的电位,导致细胞膜损伤和蛋白质等大分子的渗透使其死亡,一般净电荷范围在+2 到+9之间[4]。同时,抗菌肽中的疏水残基与亲水残基可以形成两亲结构,进而插入细菌细胞膜中的疏水区域,破坏生物膜使细胞死亡[4,11]。此外,其抑菌效果还与肽的长度、分子质量和空间结构的螺旋性等理化性质有关[12],抗菌肽通常由10~50 个氨基酸组成,较短的抗菌肽可能会通过胶束作用降解膜,而较长的抗菌肽可能会在较长的范围内弯曲,从而稳定地跨越膜[13-14]。在二级结构方面,α-螺旋是抗菌肽最常见的结构,该结构有利于在细菌表面诱导形成跨膜孔洞,从而帮助抗菌肽穿透细菌细胞膜或让脂质体和细胞中的大分子泄漏[15]。在已鉴定的6 个抗菌肽中,Yt9z(RQQAENLAKFAKKG)由14 个氨基酸组成,其总电荷为+3,疏水氨基酸百分比为36%,其分子质量为1 588 u,且三维结构预测显示其具有α-螺旋结构(见图1 和图2)。
图1 抗菌肽Yt9z 质谱分析图Fig.1 Mass spectrometry analysis of antimicrobial peptide Yt9z

图2 抗菌肽Yt9z 的三维结构预测Fig.2 3D structure prediction of antimicrobial peptide Yt9z
2.2 肽Yt9z 对副溶血性弧菌的抑菌活性
2.2.1 最低杀菌浓度(MBC)为探究多肽Yt9z的抑菌活性,测定了其对金黄色葡萄球菌、蜡样芽孢杆菌和副溶血性弧菌的最低杀菌浓度。当抗菌肽Yt9z 质量浓度为500 μg/mL 时,金黄色葡萄球菌和蜡样芽孢杆菌仍然不能被完全抑制,说明其对金黄色葡萄球菌和蜡样芽孢杆菌无抑菌作用。而在抗菌肽Yt9z 质量浓度为125 μg/mL 时,仍对副溶血性弧菌有很好的杀菌效果,低于这个质量浓度时,副溶血性弧菌的数量随着抗菌肽Yt9z 质量浓度的减小而增加,如图3 所示。因此,抗菌肽Yt9z 对副溶血性弧菌的MBC 为125 μg/mL。

图3 抗菌肽Yt9z 对副溶血性弧菌的最低杀菌浓度Fig.3 Minimum bactericidal concentration(MBC)of antimicrobial peptide Yt9z against V.parahaemolyticus
由此可以看出,抗菌肽Yt9z 对革兰氏阴性菌(副溶血性弧菌)的抑制效果优于革兰氏阳性菌(金黄色葡萄球菌、蜡样芽孢杆菌),这可能是由于革兰氏阳性细菌细胞壁中存在更厚的肽聚糖层使抗菌肽难以穿透其细胞壁[16-17]。而抗菌肽可以直接结合革兰氏阴性细菌的脂多糖(LPS)从而破坏细胞膜[18]。乳酸链球菌可以产生一系列小分子抗菌多肽,其中大多数针对革兰氏阳性菌,尤其是孢子形成菌,如乳酸链球菌素(Nisin)等[19]。因此,抗菌肽Yt9z 的发现可与Nisin 形成互补,进一步完善乳酸链球菌抗菌肽的抗菌谱。
2.2.2 时间-杀菌曲线 从图4 可以看出没有加入抗菌肽的副溶血性弧菌在3 h 内只有少量的衰亡,而加入抗菌肽Yt9z 后的副溶血性弧菌生长迅速被抑制,3 h 细菌被完全杀死,这表明抗菌肽Yt9z 对副溶血性弧菌有较高的杀菌效率。

图4 抗菌肽Yt9z 对副溶血性弧菌的时间-杀灭曲线Fig.4 Time-kill curve of antimicrobial peptide Yt9z against V.parahaemolyticus
已有一些研究从乳酸菌中分离出具有抑菌活性的物质,例如,从乳酸杆菌FGC-12 中分离出的细菌素对副溶血性弧菌的MBC 为6.0 mg/mL,且12 h 才能杀死大部分细菌[20]。相比之下,抗菌肽Yt9z 对副溶血性弧菌的MBC 更低且杀灭时间更短,说明其抑菌活性更强,杀菌效率更高。
2.3 抗菌肽Yt9z 对副溶血性弧菌的抑菌机制研究
2.3.1 细胞膜通透性 通过测定产生的邻硝基苯酚的含量,来验证经抗菌肽Yt9z 处理后副溶血性弧菌细胞膜通透性的变化。当膜通透性增加时,邻硝基苯β-D-半乳吡喃糖苷(ONPG)进入细胞质被细胞内的β-半乳糖苷酶降解,产生黄色产物邻硝基苯酚,其OD420nm值可以反映出膜透性增加的程度[21]。由图5 可知,对照组的副溶血性弧菌在2~5 h 内,膜通透有轻微的下降,而后膜通透性略微上升。相比于对照组,经过抗菌肽Yt9z 处理的副溶血性弧菌细胞膜通透性,随着肽的作用时间延长而逐渐升高,且肽的浓度越高,细胞膜通透性越大,表明该菌细胞膜通透性与抗菌肽Yt9z 具有明显的时间-浓度依赖性。
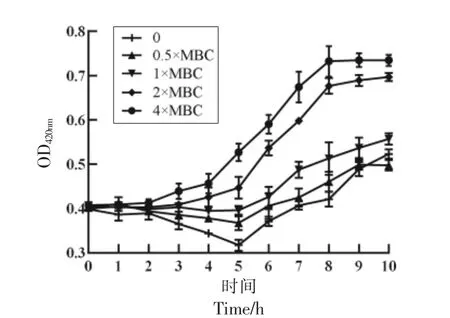
图5 抗菌肽Yt9z 对副溶血性弧菌内膜通透性的影响Fig.5 Effect of antimicrobial peptide Yt9z on inner membrane permeability of V.parahaemolyticus
抗菌肽杀灭细菌的能力通常取决于它们与细菌膜相互作用的能力,细胞膜在维持电化学梯度和电子传递中起着至关重要的作用,因此,大多数抗菌肽通过破坏细胞膜来杀灭细菌[22-23]。然而,其对细胞膜的渗透作用并不一定导致细胞膜的完全崩塌而破坏,多数情况下带正电荷的抗菌肽能够与革兰氏阴性菌外膜中的脂多糖(LPS)等带负电部分相互作用,穿透细菌的外膜并在其上产生孔隙,导致离子和代谢物泄漏、去极化和膜耦合呼吸丧失,从而加速细胞死亡[13,24]。例如,CGA-N12 在不干扰膜完整性的情况下,消散了热带假丝酵母的膜电位,增加了膜流动性和钾离子的流出,诱导非选择性离子通道的形成来发挥抑菌活性[25]。
2.3.2 抗菌肽Yt9z 二级结构分析 圆二色谱是一种广泛应用于表征蛋白质二级结构的方法[26]。抗菌肽的抑菌活性与其二级结构的变化密切相关,其中最常见的抗菌肽二级结构有α-螺旋、β-折叠和无规则卷曲[27]。本试验利用圆二色谱对抗菌肽Yt9z 在PBS 和SDS 疏水环境下的二级结构进行研究。如图6 所示,在PBS 环境下,抗菌肽Yt9z 在波长200 nm 处出现负峰,在波长210 nm处出现正峰,这说明抗菌肽Yt9z 在PBS 环境下,其主要结构为无规则卷曲[28]。在SDS 环境下,抗菌肽Yt9z 在波长193 nm 左右出现正峰,在波长208 nm 左右出现负峰,表明抗菌肽Yt9z 具有α-螺旋结构[29],且其在接触细菌细胞膜时可能存在二级结构转换。

图6 不同环境下抗菌肽Yt9z 的二级结构变化Fig.6 Secondary structure of Yt9z in different environments
SDS 是一种阴离子洗涤剂,用于模拟细菌膜的环境,抗菌肽Yt9z 在SDS 环境下结构发生改变说明抗菌肽Yt9z 在接触细菌细胞膜时自身结构发生了改变,这可能是其展现抑菌活性的重要因素之一[30]。已有相关研究发现,抗菌肽对细菌细胞膜的破坏很大程度上依赖其二级结构,α-螺旋的两亲性有助于其疏水结构域插入细菌膜中引起膜变形,或通过静电相互作用附着在带负电荷的细菌膜上,从而实现与膜的相互作用[31]。
2.3.3 透射电镜 用抗菌肽Yt9z 处理副溶血性弧菌,并通过透射电镜(Transmission electron microscope,TEM)观察细菌超微结构。结果发现,未经处理的对照组细菌(副溶血性弧菌)具有组织均匀分布的完整细胞膜,且表面光滑平整,无内容物流出(图7a),而用抗菌肽Yt9z 处理后的副溶血性弧菌,仍存在完整的细胞膜结构,然而其发生了收缩和变形,且细胞内物质明显减少(图7b)。这表明抗菌肽Yt9z 能够与细胞膜相互作用,增强细胞膜的通透性进而杀死细菌,而这一过程并未破坏细胞膜的完整性。

图7 副溶血性弧菌在抗菌肽Yt9z 处理前、后的透射电镜图像Fig.7 TEM images of V.parahaemolyticus before and after antimicrobial peptide Yt9z treatment
相关研究显示,一些多肽能够穿透且不破坏细胞膜,进入细胞内与胞内物质相互作用,表现出很强的抑菌活性[32]。它们的抑菌作用包括插入细胞质膜,形成孔隙,破坏脂质不对称性,从而导致胞内物质的流出,或进入细胞与胞内物质结合。例如,从南美角蛙皮中分离出α-螺旋抗菌肽pseudin-2,它在革兰氏阴性菌中不能中和脂多糖(LPS),然而能与LPS 相互作用在细胞膜上形成孔洞,通过孔洞进入细胞质并与RNA 紧密结合[33]。然而,抗菌肽Yt9z 的胞内作用靶点暂不清楚,因此,要进一步探究其胞内作用靶点。
2.3.4 抗菌肽Yt9z 对副溶血性弧菌基因组DNA的相互作用 除了作用于细胞膜之外,抗菌肽还可以将胞内物质作为靶点,展现其抑菌活性[34],因此,通过DNA 凝胶试验来研究抗菌肽与副溶血性弧菌基因组DNA 之间的相互作用。在抗菌肽Yt9z/副溶血性弧菌DNA 为100/1 时,无法观察到DNA 条带,当比例分别为50/1,25/1,25/2,25/4,25/8 时,条带清晰度和亮度明显上升;对照组DNA 的凝胶电泳图谱则显示出完整清晰且最明亮的条带(图8)。可以看出抗菌肽Yt9z 以浓度依赖的方式与副溶血性弧菌DNA 相互作用。

图8 凝胶阻滞分析抗菌肽Yt9z 与副溶血性弧菌DNA 的相互作用Fig.8 Gel retardation analysis of interaction between antimicrobial Yt9z and the DNA of V.parahaemolyticus
抗菌肽与细菌的DNA 相互作用是一种常见的抑菌机制,抗菌肽可以与细菌基因组DNA 结合,导致基因组DNA 直接损伤,或阻断细胞DNA的复制和转录使细胞失去生命活力[35-36]。本研究中,抗菌肽Yt9z 不仅增加了副溶血性弧菌细胞膜通透性,还能与其DNA 相互作用来实现抑菌作用。这与小麦胚乳蛋白中的肽PuroB 作用机制相似,它能够与带负电的磷脂相互作用,在不破坏细胞膜脂质双层完整性的同时,与细胞内靶点(DNA)结合,从而阻断体内大分子合成来实现抑菌活性[37]。从鲶鱼表皮黏液中分离出抗菌肽CF-14,通过增加腐败希瓦氏菌的细胞膜通透性,从而穿透其细胞膜与DNA 结合完成杀菌过程[38]。
2.3.5 副溶血性弧菌DNA 对抗菌肽Yt9z 二级结构的影响 通过圆二色谱测定抗菌肽Yt9z 与副溶血性弧菌DNA 结合后的二级结构变化,进一步证实二者之间存在相互作用关系。图9 显示,加入DNA 后,193 nm 的正峰和208 nm 的负峰仍然存在,而抗菌肽Yt9z 的谱图整体上移,表明抗菌肽Yt9z 与副溶血性弧菌基因组DNA 存在相互作用关系。抗菌肽与DNA 结合后,能够抑制DNA 的复制,从而阻碍蛋白质正常合成和表达,也对相关酶造成影响。例如,LP5 能结合金黄色葡萄球菌的DNA,抑制大分子生物合成和拓扑异构酶IV 和DNA 回旋酶的功能,诱导SOS 反应,从而抑制该菌生长[39]。含有色氨酸的多肽与多重耐药铜绿假单胞菌DNA 通过沟槽结合而相互作用,干扰DNA 复制,从而影响相关基因的表达,致使细菌快速死亡[40]。

图9 副溶血性弧菌DNA 对抗菌肽Yt9z 二级结构的影响Fig.9 Secondary structure changes of Yt9z binding to DNA in SDS
3 结论
本研究从副干酪乳杆菌发酵液中筛选出1 种对副溶血性弧菌具有强抑菌活性的抗菌肽Yt9z,其序列为RQQAENLAKFAKKG。研究显示其最低杀菌质量浓度为125 μg/mL,且3 h 内能杀死全部细菌,它是通过与细胞膜作用来增加细菌细胞膜通透性,从而穿透细胞膜与DNA 结合使其死亡。这些发现为抗菌肽Yt9z 作为生物防腐剂的应用提供了理论基础。
