肿瘤生长率对经导管动脉化疗栓塞治疗巨大肝细胞癌患者的预后评估价值
2024-02-23陈宗杰彭新建王瑜林胡添松
陈宗杰 彭新建 王瑜林 胡添松
直径>10 cm的肝细胞癌(hepatocellular carcinoma,HCC)一直是临床治疗的难题,极少患者有手术根治性机会[1,2]。经导管动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)是巨大HCC的有效治疗方法之一[3,4]。肿瘤生长率是一种反映肿瘤体积随时间变化的指标。近年来已用于评估非小细胞肺癌、肾细胞癌和神经内分泌肿瘤等多种肿瘤进展、介入治疗效果[5-7]。研究发现,肿瘤生长率对预测接受纳武单抗治疗的晚期HCC患者进展具有意义[8]。本研究探讨TACE治疗初期肿瘤生长率变化与HCC患者预后关系。
资料与方法
一、一般资料
回顾性分析2016年1月至2020年3月在联勤保障部队第909医院接受TACE治疗的98例巨大HCC患者临床资料,患者中男90例,女8例。纳入标准:①首次接受TACE,治疗根据《中国肝细胞癌经动脉化疗栓塞治疗临床实践指南(2021年版)》[3]进行;②年龄≥18岁;③HCC经过病理诊断确认,肿瘤为非浸润型;④肿瘤直径>10 cm;⑤预期生存时间≥60 d;⑥治疗前行增强CT或增强MRI检查,术后1~3个月复查。排除标准:①TACE治疗前28 d内接受肝癌的其他治疗;②严重心力衰竭;③无法控制的糖尿病、严重感染;④妊娠或哺乳期患者;⑤存在治疗药物过敏。所有患者均签署书面知情同意。
二、TACE治疗
动脉穿刺入路采用Seldinger法,导管通过右腹股沟股动脉穿刺插入肝总动脉或肝固有动脉。进行Splanchic血管造影术评估肿瘤大小、位置和动脉供应。导管尖端进入肿瘤供应动脉。根据患者个体选择化疗药物,并以碘化油栓塞肿瘤血液供应。
三、资料收集及肿瘤生长率计算
收集患者的年龄、性别、既往肝硬化、糖尿病、高血压病史,HBV感染情况,东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体能状态评分。TACE治疗前的基线肿瘤学特征包括:最大肿瘤直径、门静脉癌栓(portal vein tumor thrombus, PVTT)、血管或胆管侵犯、远处转移、肿瘤数量。血清学指标:AFP、总胆红素、白蛋白、ALT、AST、INR、C-反应蛋白。
肿瘤生长率(%)=100×[Exp(TG)-1];TG(肿瘤生长)=3×[ln(D2/D1)]/时间(月)[8]。其中D1为TACE治疗前增强CT或增强MRI测量肿瘤最大径;D2为TACE后第一次影像学检查时肿瘤最大径;时间(月)=(D2时间-D1时间)/30.4。总生存期(overall survival, OS)为首次TACE开始到死亡时间[9]。
四、统计分析
结 果
一、肿瘤生长率的最佳诊断值确定
使用耶鲁大学开发的X-tile软件分析肿瘤生长率与巨大HCC患者TACE治疗后生存时间关系,经计算得到患者3年生存时间的最佳预测诊断切点为-11.7%/月,见图1。根据最佳预测诊断切点将患者分为高肿瘤生长率组(≥-11.7%/月)46例和低肿瘤生长率组(<-11.7%/月)52例。
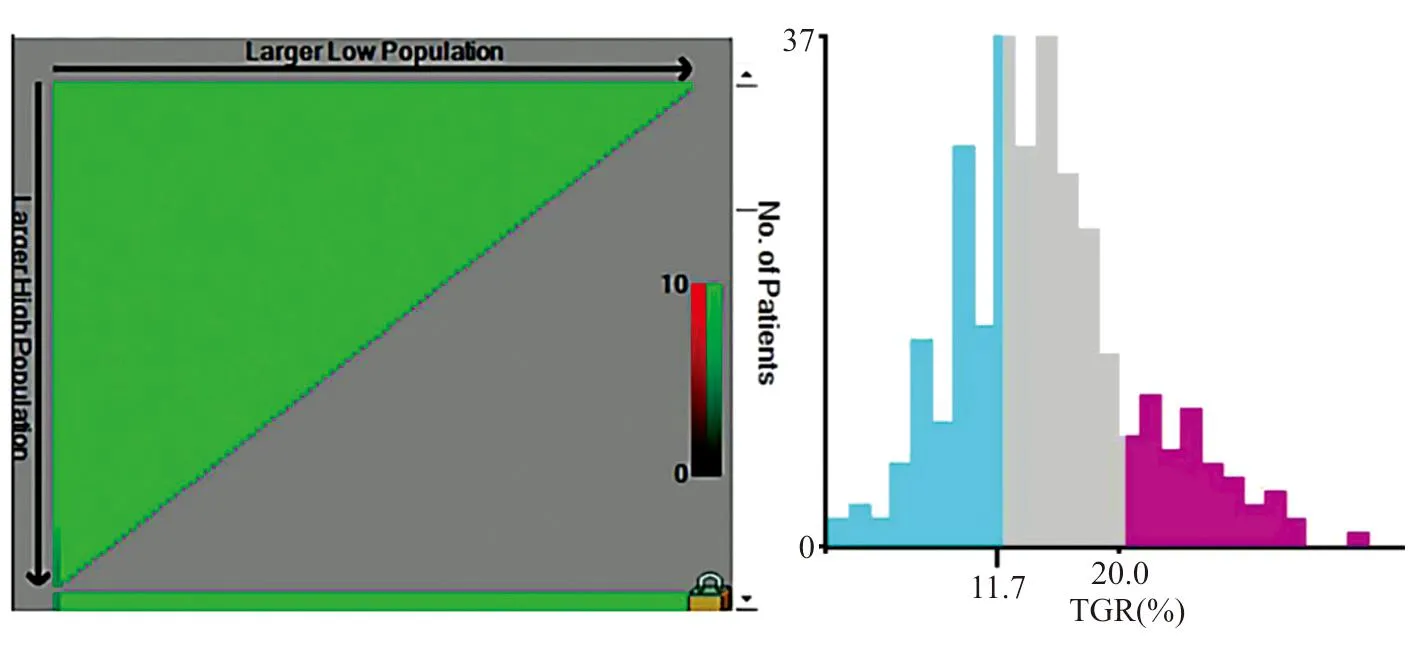
图1 X-tile分析肿瘤生长率与TACE治疗后巨大HCC患者3年生存率
二、纳入患者特征
全部患者的肿瘤生长率为(13.52 ± 19.186)%。根据肿瘤生长率截断值,52例为低肿瘤生长率组,46例为高肿瘤生长率组。比较2组患者资料可见,低肿瘤生长率组患者的PVTT比例较高、远处转移比例较高、后续联合治疗比例较高、基线白蛋白水平更低,见表1。

表1 不同肿瘤生长率HCC患者特征比较
三、不同肿瘤生长率组患者生存情况比较
全部患者中位随访时间为27.6个月,中位生存期为14.8个月。低肿瘤生长率组的mOS优于高肿瘤生长率组(χ2=7.120,P=0.008),见图2。
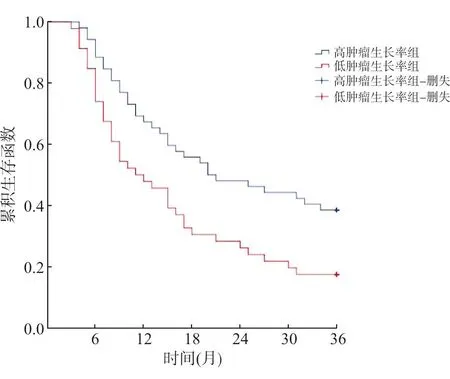
图2 不同肿瘤生长率组患者36个月生存情况比较
四、Cox回归分析HCC患者TACE治疗预后的影响因素
单因素Cox回归分析结果可见高肿瘤生长率、存在PVTT、存在远处转移是影响巨大HCC患者TACE治疗后OS的危险因素,而高白蛋白水平和无后续联合治疗是保护因素,见表2。
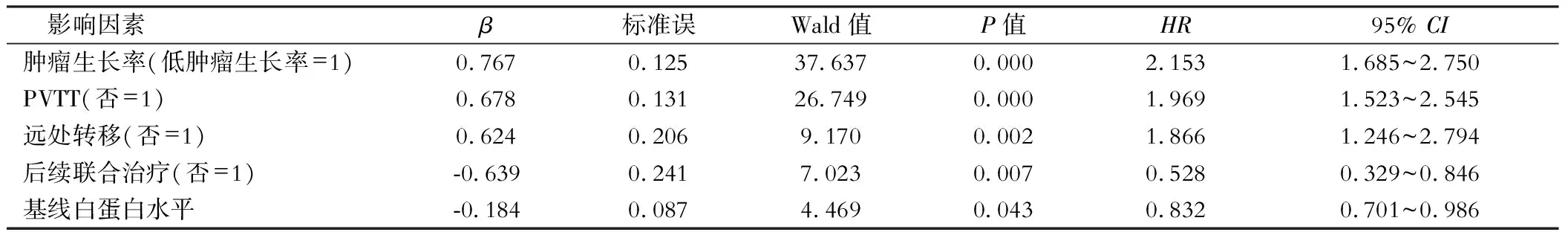
表2 单因素Cox回归分析HCC患者TACE治疗OS的影响因素
多因素Cox回归分析可见,高肿瘤生长率、存在PVTT是影响巨大HCC患者TACE治疗后OS的独立危险因素。而后续联合治疗是接受首次TACE的HCC患者OS的保护因素,见表3。
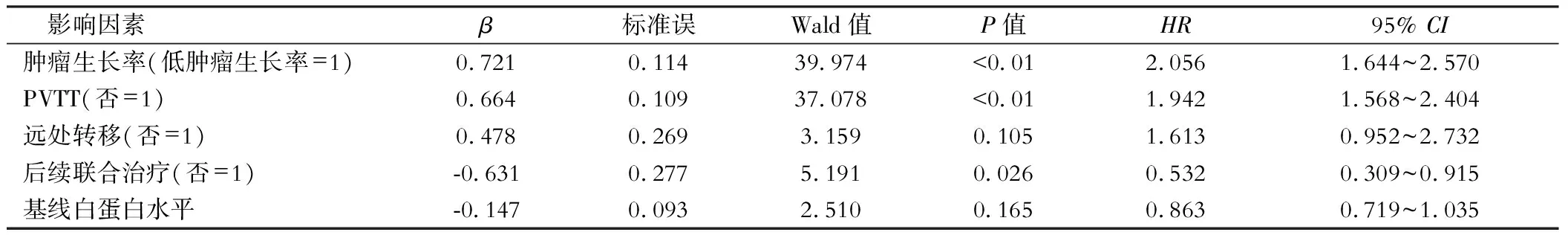
表3 多因素Cox回归分析HCC患者TACE治疗OS的影响因素
五、不同肿瘤生长率患者后续联合治疗的亚组分析
患者中有57例(58.16%)进行了后续治疗,其中接受靶向治疗44例、免疫治疗10例、消融治疗4例、放疗1例、手术治疗6例,部分患者接受了多种治疗。
比较不同肿瘤生长率HCC患者TACE后的联合治疗情况可见,对于低肿瘤生长率组是否接受联合治疗对HCC患者的OS无显著影响(P=0.477)。而对于高肿瘤生长率组,初始TACE后,后续联合治疗者的OS优于未联合治疗者(χ2=4.312,P=0.038),见表4。

表4 肿瘤生长率患者后续联合治疗的亚组分析
讨 论
目前对于巨大HCC的治疗策略仍然存在争议,这些患者通常存在血管侵犯、肿瘤直径较大和多个肿瘤结节,预后相对更差[10]。研究显示,对于单个巨大(>10 cm)HCC以TACE作为一线治疗后患者的mOS为28个月,但该研究排除了大血管侵犯和肝外转移的患者[11]。本研究的纳入标准更宽泛。引入了肿瘤生长率来评估TACE治疗患者的预后。国外已有肿瘤生长率用于分析TACE治疗HCC效果的报道[12]。本研究使用X-tile软件确定了以肿瘤生长率判断患者预后的最佳诊断切点。相较于传统的ROC曲线方法,X-tile软件增加了时间因素,得出的诊断界值更为准确[13]。根据诊断界值分组后发现,高肿瘤生长率组的OS明显长于低肿瘤生长率组。
本研究中,TACE治疗后高肿瘤生长率、PVTT和后续联合治疗是患者OS的影响因素,与既往报道PVTT是影响HCC患者生存的关键因素一致[14,15]。多数巨大HCC患者在首次确诊时失去手术的机会,而TACE治疗可以阻塞肿瘤供应血管,但对巨大HCC的治疗效果有限,因为很难在动脉造影上区分患者肿瘤供体[16]。已经证实,TACE治疗后续联合靶向治疗、免疫治疗、放化疗等联合治疗是改善中晚期HCC患者预后的有效方法[17-19]。本研究中,高肿瘤生长率组TACE后接受联合治疗的巨大HCC患者的OS更长,提示可以根据TACE后肿瘤生长率识别出可从后续联合治疗中受益的患者,以实现精准治疗,减轻患者经济负担。
本研究的局限性主要包括以下几个方面:①为回顾性研究,患者数量有限;②纳入HCC患者绝大多数为HBV导致,其他病因导致的HCC患者比例较小;③TACE治疗时使用的化疗药物和栓塞材料不同可能造成一定治疗效果差异。
综上所述,肿瘤生长率对接受TACE作为初始治疗的巨大HCC患者预后具有一定预测价值,高肿瘤生长率患者预后相对较差,此外高肿瘤生长率在TACE后的联合治疗中获益更多。未来值得进行更大样本量的研究进一步验证本结论,并开发基于肿瘤生长率的更多模型。
利益冲突声明:所有作者均声明不存在利益冲突。
